 Иммунная система держит круговую оборону организма от бактерий, вирусов и других патогенов.
Иммунная система держит круговую оборону организма от бактерий, вирусов и других патогенов.
Этой статьей мы начинаем цикл по аутоиммунным заболеваниям – болезням, при которых организм начинает бороться сам с собой, вырабатывая аутоантитела и/или аутоагрессивные клоны лимфоцитов. Мы расскажем о том, как работает иммунитет и почему иногда он начинает «стрелять по своим». Некоторым самым распространенным заболеваниям будут посвящены отдельные публикации. Для соблюдения объективности мы пригласили стать куратором спецпроекта доктора биологических наук, чл.-корр. РАН, профессора кафедры иммунологии МГУ Дмитрия Владимировича Купраша. К тому же у каждой статьи есть свой рецензент, более детально вникающий во все нюансы. Рецензентом этой – вводной – статьи стал Евгений Сергеевич Шилов, кандидат биологических наук, научный сотрудник этой же кафедры.
Около 5% населения Земли страдают аутоиммунными заболеваниями – состоянием, при котором собственные клетки иммунной системы организма вместо того, чтобы бороться с патогенами, уничтожают нормальные клетки органов и тканей. В этой статье, предваряющей спецпроект по аутоиммунным заболеваниям, мы рассмотрим основные принципы работы иммунной системы и покажем, почему возможна такая диверсия с ее стороны.
Иммунитет — система реакций, призванная защитить организм от вторжения бактерий, вирусов, грибов, простейших и других вредоносных агентов — так называемых патогенов. Если представить, что наше тело — это страна, то иммунную систему можно сравнить с ее вооруженными силами. Чем более слаженным и адекватным будет их ответ на интервенцию патогенов, тем надежнее окажется защита организма.
В мире существует великое множество патогенов, и для того чтобы эффективно бороться со всеми ними, в результате длительной эволюции сформировалась замысловатая система из иммунных клеток, каждая из которых имеет свою стратегию борьбы. Клетки иммунной системы взаимно дополняют друг друга: применяют разные способы уничтожения патогена, могут усиливать или ослаблять действие других клеток, а также привлекать всё новых бойцов на поле битвы, если сами не справляются.
Нападая на организм, патогены оставляют молекулярные «улики», которые «подбирают» иммунные клетки. Такие улики называются антигенами.
Антигены — любые вещества, которые организм воспринимает как чужеродные и, соответственно, отвечает на их появление активацией иммунитета. Самыми важными для иммунной системы антигенами являются кусочки молекул, расположенных на внешней поверхности патогена. По этим кусочкам можно определить, какой именно агрессор напал на организм, и обеспечить борьбу с ним.
Цитокины – азбука Морзе организма
Для того чтобы иммунные клетки могли скоординировать свои действия в борьбе с врагом, им необходима система сигналов, сообщающих, кому и когда вступать в бой, или заканчивать битву, или, наоборот, возобновлять ее, и многое-многое другое. Для этих целей клетками вырабатываются небольшие белковые молекулы — цитокины, например, различные интерлейкины (IL-1, 2, 3 и т.д.) [1]. Многим цитокинам сложно приписать однозначную функцию, однако с некоторой степенью условности их можно разделить на пять групп: хемокины, факторы роста, провоспалительные, противовоспалительные и иммунорегуляторные цитокины.
- Хемокины подают клетке сигнал, который говорит, куда ей нужно двигаться. Это может быть инфицированное место, куда необходимо стянуть все боевые подразделения нашей армии, или же определенный орган иммунной системы, где клетка будет дальше проходить обучение военной грамоте.
- Факторы роста помогают клетке определиться, какую «воинскую специальность» для себя выбрать*. По названиям этих молекул, как правило, легко понять, за развитие каких клеток они отвечают. Так, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, GM-CSF) способствует появлению гранулоцитов и макрофагов, а фактор роста эндотелия сосудов (VEGF), как следует из названия, отвечает за образование новых сосудов кровеносной системы.
* — О том, как клетка выбирает свою судьбу, можно почитать в статье «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [2].
- О провоспалительных, противовоспалительных и иммунорегуляторных цитокинах говорят, что они «модулируют» иммунный ответ. Именно эти молекулы клетки используют для «разговора» между собой, ведь любое совместное дело должно строго регулироваться, чтобы ключевые игроки не запутались в том, что им делать, и не мешали друг другу, а эффективно выполняли свои функции. Провоспалительные цитокины, как следует из названия, способствуют поддержанию воспаления, которое необходимо для эффективной иммунной реакции в борьбе с патогенами, тогда как противовоспалительные цитокины помогают организму остановить войну и привести поле боя в мирное состояние. Сигналы иммунорегуляторных цитокинов могут быть расшифрованы клетками по-разному в зависимости от того, что это за клетки и какие другие сигналы они к этому времени получат.
Упомянутая выше условность классификации означает, что цитокин, входящий в одну из перечисленных групп, при определенных условиях в организме может сыграть диаметрально противоположную роль — например, из провоспалительного превратиться в противовоспалительный.
Без налаженной связи между видами войск любая хитроумная военная операция обречена на провал, поэтому клеткам иммунной системы очень важно, принимая и отдавая приказы в виде цитокинов, правильно их интерпретировать и слаженно действовать. Если цитокиновые сигналы начинают вырабатываться в очень большом количестве, то в клеточных рядах наступает паника, что может привести к повреждению собственного организма. Это называется цитокиновым штормом: в ответ на поступающие цитокиновые сигналы клетки иммунной системы начинают продуцировать всё больше и больше собственных цитокинов, которые, в свою очередь, действуют на клетки и усиливают секрецию самих себя. Формируется замкнутый круг, который приводит к разрушению окружающих клеток, а позже и соседних тканей.
По порядку рассчитайсь! Иммунные клетки
Как в вооруженных силах существуют разные рода войск, так и клетки иммунной системы можно разделить на две большие ветви — врожденного и приобретенного иммунитета, за изучение которых в 2011 году была вручена Нобелевская премия [3, 4, 5]. Врожденный иммунитет — та часть иммунной системы, что готова защищать организм немедленно, как только совершилось нападение патогена. Приобретенный же (или адаптивный) иммунный ответ при первом контакте с врагом разворачивается дольше, так как требует хитроумной подготовки, но зато после может осуществлять более сложный сценарий защиты организма. Врожденный иммунитет очень эффективен в борьбе с единичными диверсантами: он обезвреживает их, не беспокоя специализированные элитные воинские подразделения — адаптивный иммунитет. Если же угроза оказалась более существенной и есть риск проникновения патогена всё глубже в организм, клетки врожденного иммунитета немедленно сигнализируют об этом, и в бой вступают клетки иммунитета приобретенного.
Все иммунные клетки организма образуются в костном мозге от кроветворной стволовой клетки, которая дает начало двум клеткам — общему миелоидному и общему лимфоидному предшественникам [2, 6]. Клетки приобретенного иммунитета происходят от общего лимфоидного предшественника и, соответственно, называются лимфоцитами, тогда как клетки врожденного иммунитета могут брать начало от обоих предшественников. Схема дифференцировки клеток иммунной системы изображена на рисунке 1.
Схема дифференцировки клеток иммунной системы
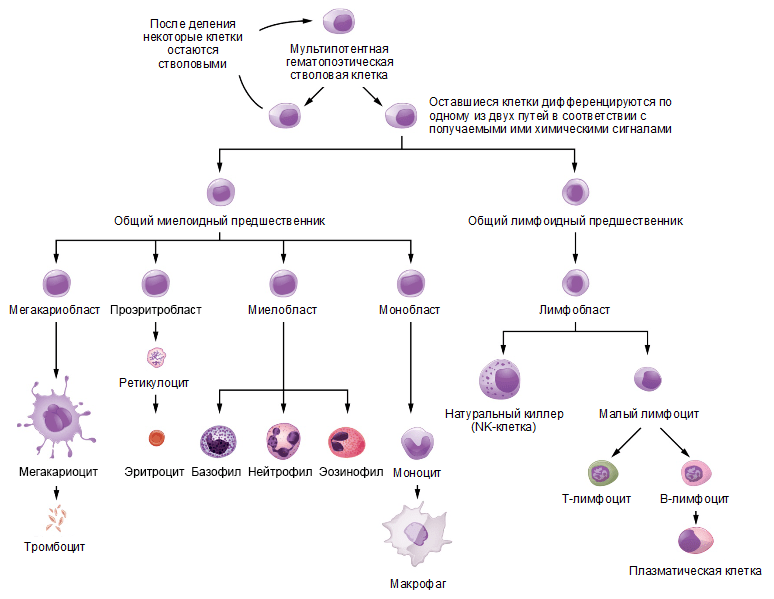
Рисунок 1. Схема дифференцировки клеток иммунной системы. Кроветворная стволовая клетка дает начало клеткам – предшественницам миелоидной и лимфоидной линий дифференцировки, из которых дальше образуются все типы клеток крови. Рисунок с сайта opentextbc.ca, адаптирован.
Врожденный иммунитет – регулярная армия
Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркерам — так называемым образам патогенности [7]. Эти маркеры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с чужаками. Для нашего организма подобными маркерами могут служить фрагменты клеточной стенки и жгутиков бактерий, двухцепочечная РНК и одноцепочечная ДНК вирусов, и т.д. При помощи специальных рецепторов врожденного иммунитета, таких как TLR (Toll-like receptors, Толл-подобные рецепторы) и NLR (Nod-like receptors, Nod-подобные рецепторы), клетки взаимодействуют с образами патогенности и приступают к реализации своей защитной стратегии.
Теперь подробнее рассмотрим некоторые клетки врожденного иммунитета.
Макрофаги и дендритные клетки поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Такой способ уничтожения врага очень удобен: осуществившая его клетка не только может и дальше активно функционировать, но и получает возможность сохранить в себе фрагменты патогена — антигены, которые при необходимости послужат сигналом активации для клеток адаптивного иммунитета. Лучше всего с этим справляются дендритные клетки — именно они работают связистами между двумя ветвями иммунной системы, что необходимо для успешного подавления инфекции.
Нейтрофилы — самые многочисленные иммунные клетки в крови человека — бόльшую часть своей жизни путешествуют по организму. При встрече с патогеном они поглощают и переваривают его, но после «сытного обеда» обычно погибают. Нейтрофилы — клетки-камикадзе, и смерть — основной механизм их действия. В момент гибели нейтрофилов высвобождается содержимое находящихся в них гранул — вещества, обладающие антибиотическим действием, — а кроме того, разбрасывается сеть из собственной ДНК клетки (NETs, neutrophil extracellular tracts), в которую попадают находящиеся поблизости бактерии — теперь они становятся еще более заметными для макрофагов.
|
|
Видео 1. Нейтрофилы (обозначены зеленым) приходят в очаг повреждения ткани. Видео снято при помощи прижизненной двухфотонной микроскопии.
Эозинофилы, базофилы и тучные клетки выделяют в окружающую ткань содержимое своих гранул — химическую защиту против крупных патогенов, например, паразитических червей. Однако, как это часто бывает, химикатами может отравиться и мирное население, и эти клетки широко известны не столько своей прямой физиологической ролью, сколько вовлеченностью в развитие аллергической реакции.
Помимо вышеупомянутых миелоидных клеток, во врожденном иммунитете работают и клетки лимфоидного ряда, которые так и называются — лимфоидные клетки врожденного иммунитета. Они продуцируют цитокины и, соответственно, регулируют поведение других клеток организма.
Один из типов этих клеток — так называемые натуральные киллеры (natural killers, или NK-клетки). Они — пехота в вооруженных силах организма: борются с зараженными клетками один на один, вступая с ними в рукопашный бой. NK-клетки выделяют белки перфорин и гранзим В. Первый, как следует из названия, перфорирует клеточную мембрану мишени, встраиваясь в нее, а второй, подобно картечи, проникает через эти бреши и запускает гибель клетки, расщепляя белки, ее образующие.
Удивительно, но на разных стадиях своего развития некоторые клетки иммунной системы могут выполнять функции, противоположные друг другу. Так, выделяют гетерогенную группу предшественников различных иммунных клеток врожденного иммунитета, которые в таком незрелом виде подавляют иммунный ответ. Их так и назвали: миелоидные супрессорные клетки. Их количество увеличивается в организме в ответ на появление хронической инфекции или рака. Роль таких клеток очень важна, ведь они не позволяют другим бойцам армии иммунитета слишком сильно бороться с врагом, повреждая тем самым мирное население — ни в чем не повинные клетки, находящиеся поблизости.
Адаптивный иммунитет — спецподразделения вооруженных сил организма
Клетки адаптивного иммунитета — Т- и В-лимфоциты — можно сравнить с отрядами специального назначения. Дело в том, что они способны распознавать множество индивидуальных антигенов патогенов благодаря специализированным рецепторам на своей поверхности. Эти рецепторы называются Т-клеточным (TCR, T-cell receptor) и В-клеточным (BCR, B-cell receptor) соответственно. Благодаря хитроумному процессу образования TCR и BCR, каждый В- или Т-лимфоцит несет свой собственный уникальный рецептор к конкретному, уникальному антигену*.
* — Об этом подробно рассказывает статья «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [8].
Для того чтобы понять, как работает Т-клеточный рецептор, надо вначале немного обсудить еще одно важное семейство белков — главный комплекс гистосовместимости (MHC, major histocompatibility complex) [9]. Эти белки — молекулярные «пароли» организма, позволяющие клеткам иммунной системы отличать своих соотечественников от неприятеля. В любой клетке постоянно идет процесс деградации белков. Специальная молекулярная машина — иммунопротеасома — расщепляет белки на короткие пептиды, которые могут быть встроены в MHC и, как яблочко на тарелочке, преподнесены Т-лимфоциту. Тот при помощи TCR «видит» пептид и распознает, принадлежит ли он собственным белкам организма или является чужеродным. Одновременно TCR проверяет, знакома ли ему молекула MHC, — это позволяет отличать собственные клетки от «соседских», то есть клеток того же вида, но другой особи. Именно совпадение молекул MHC необходимо для приживления пересаженных тканей и органов, отсюда и такое мудреное название: histos по-гречески означает «ткань». У человека молекулы MHC также называются HLA (human leukocyte antigen — человеческий лейкоцитарный антиген).
|
|
Видео 2. Кратковременные взаимодействия Т-клеток с дендритной клеткой (обозначена зеленым). Видео снято при помощи прижизненной двухфотонной микроскопии.
T-лимфоциты
Существует два типа молекул главного комплекса гистосовместимости: MHC-I и MHC-II. Первый присутствует на всех клетках организма и несет на себе пептиды клеточных белков или же белков заразившего ее вируса. Специальный подтип Т-клеток — Т-киллеры (их еще называют CD8+ Т-лимфоциты) — своим рецептором взаимодействует с комплексом «MHC-I—пептид». Если это взаимодействие достаточно сильное, значит, пептид, который видит Т-клетка, не характерен для организма и, соответственно, может принадлежать внедрившемуся в клетку врагу — вирусу. Необходимо срочно обезвредить нарушителя границ, и Т-киллер отлично справляется с этой задачей. Он, подобно NK-клетке, выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени.
Т-клеточный рецептор другого подтипа Т-лимфоцитов — Т-хелперов (Th-клетки, CD4+ T-лимфоциты) — взаимодействует с комплексом «MHC-II—пептид». Это комплекс есть не на всех клетках организма, а в основном на иммунных, и пептиды, которые могут презентироваться молекулой MHC-II, являются фрагментами патогенов, захваченных из внеклеточного пространства. Если Т-клеточный рецептор взаимодействует с комплексом «MHC-II—пептид», то Т-клетка начинает продуцировать хемокины и цитокины, помогающие другим клеткам эффективно осуществлять свою функцию — борьбу с врагом. Потому-то эти лимфоциты и называются хелперами — от английского helper (помощник). Среди них выделяют множество подтипов, которые различаются спектром вырабатываемых цитокинов и, следовательно, ролью в иммунном процессе. Например, существуют Th1-лимфоциты, эффективные в борьбе с внутриклеточными бактериями и простейшими, Th2-лимфоциты, помогающие В-клеткам в работе и потому важные для противостояния внеклеточным бактериям (о чём мы скоро поговорим), Th17-клетки и многие другие.
|
|
Видео 3. Движение Т-хелперов (красные) и Т-киллеров (зеленые) в лимфоузле. Видео снято при помощи прижизненной двухфотонной микроскопии.
Среди CD4+ T-клеток существует особый подтип клеток — регуляторные Т-лимфоциты. Их можно сравнить с военной прокуратурой, сдерживающей фанатизм рвущихся в бой солдат и не дающей им причинить вред мирному населению. Эти клетки продуцируют цитокины, подавляющие иммунный ответ, и таким образом ослабляют иммунную реакцию, когда враг повержен.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием хитроумного процесса, называемого селекцией. Она происходит в специально созданном для этого органе — тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид. Селекция в тимусе — механизм так называемой центральной иммунологической толерантности.
Существует также периферическая иммунологическая толерантность. При развитии инфекции на дендритную клетку, как и на любую клетку врожденного иммунитета, действуют образы патогенности. Только после этого она может созреть, начать экспрессировать на своей поверхности дополнительные молекулы для активации лимфоцита и эффективно представлять антигены Т-лимфоцитам. Если же Т-лимфоцит встречается с незрелой дендритной клеткой, то он не активируется, а самоуничтожается или же супрессируется. Это неактивное состояние Т-клетки называется анергией. Таким способом в организме предотвращается патогенное действие аутореактивных Т-лимфоцитов, которые по тем или иным причинам выжили в ходе селекции в тимусе*.
* — О жизненном цикле Т-клеток можно прочитать в статье «Т-лимфоциты: путешественники и домоседы» [10].
Всё вышесказанное относится к αβ-Т-лимфоцитам, однако существует еще один тип Т-клеток — γδ-T-лимфоциты (название определяет состав белковых молекул, образующих TCR) [11]. Они относительно малочисленны и в основном заселяют слизистую оболочку кишечника и другие барьерные ткани, играя важнейшую роль в регуляции состава обитающих там микробов. У γδ-T-клеток механизм распознавания антигенов отличается от αβ-Т-лимфоцитарного и не зависит от TCR [12].
B-лимфоциты
В-лимфоциты несут на своей поверхности В-клеточный рецептор [13]. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип — плазматические клетки, обладающие уникальной способностью секретировать свой B-клеточный рецептор в окружающую среду — именно эти молекулы мы называем антителами. Таким образом, как BCR, так и антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Для эффективной встречи клеток адаптивного иммунитета с дендритными клетками, несущими в составе MHC чужеродные антигены и поэтому работающими «связными», в организме существуют специальные иммунные органы — лимфоузлы. Распределение их по организму неоднородно и зависит от того, насколько уязвимой является та или иная граница. Бόльшая их часть находится вблизи пищеварительного и дыхательного трактов, ведь проникновение патогена с пищей или вдыхаемым воздухом — наиболее вероятный способ заражения.
|
|
Видео 4. Перемещение Т-клеток (обозначены красным) по лимфоузлу. Клетки, образующие структурную основу лимфоузла и стенки сосудов, помечены зеленым флуоресцентным белком. Видео снято при помощи прижизненной двухфотонной микроскопии.
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ.
Логика иммунного ответа
Когда организм атакуют патогены, в бой в первую очередь вступают клетки врожденного иммунитета — нейтрофилы, базофилы и эозинофилы. Они выделяют вовне содержимое своих гранул, способное повредить клеточную стенку бактерий, а также, например, усилить кровоток, чтобы как можно больше клеток поспешило в очаг инфекции.
Одновременно с этим дендритная клетка, поглотившая патоген, спешит в ближайший лимфоузел, где передает информацию о нём находящимся там Т- и В-лимфоцитам. Те активируются и путешествуют до местонахождения патогена (рис. 2). Битва разгорается: Т-киллеры при контакте с зараженной клеткой убивают ее, Т-хелперы помогают макрофагам и В-лимфоцитам осуществлять их механизмы защиты. В итоге патоген гибнет, а победившие клетки отправляются на покой. Бόльшая их часть погибает, но некоторые становятся клетками памяти, которые поселяются в костном мозге и ждут, когда их помощь снова понадобится организму.
Схема иммунного ответа
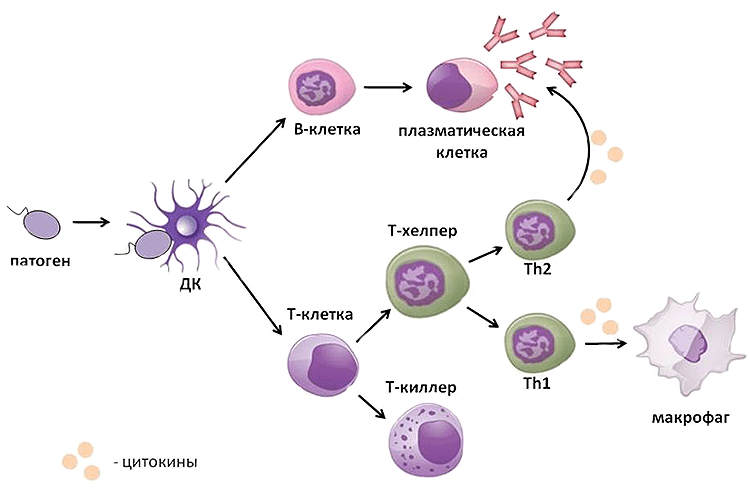
Рисунок 2. Схема иммунного ответа. Проникший в организм патоген обнаруживается дендритной клеткой, которая движется в лимфоузел и там передает информацию о враге Т- и В-клеткам. Те активируются и выходят в ткани, где реализуют свою защитную функцию: В-лимфоциты продуцируют антитела, Т-киллеры при помощи перфорина и гранзима В осуществляют контактный киллинг патогена, а Т-хелперы продуцируют цитокины, помогающие другим клеткам иммунной системы в борьбе с ним. Схема составлена автором статьи.
Так выглядит схема любого иммунного ответа, однако она может заметно видоизменяться в зависимости от того, какой именно патоген проник в организм. Если мы имеем дело с внеклеточными бактериями, грибами или, скажем, глистами, то основными вооруженными силами в этом случае будут эозинофилы, В-клетки, продуцирующие антитела, и Th2-лимфоциты, помогающие им в этом. Если же в организме поселились внутриклеточные бактерии, то на помощь в первую очередь спешат макрофаги, которые могут поглотить инфицированную клетку, и Th1-лимфоциты, помогающие им в этом. Ну а в случае вирусной инфекции в бой вступают NK-клетки и Т-киллеры, которые уничтожают зараженные клетки методом контактного киллинга.
Как мы видим, многообразие типов иммунный клеток и механизмов их действия неслучайно: на каждую разновидность патогена у организма припасен свой эффективный способ борьбы (рис. 3).
Основные типы патогенов и уничтожающие их клетки
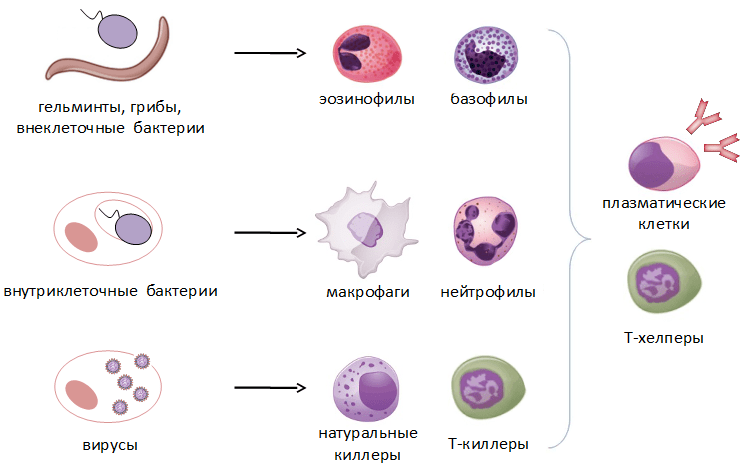
Рисунок 3. Основные типы патогенов и клетки, принимающие участие в их уничтожении. Схема составлена автором статьи.
Громыхает гражданская война...
К сожалению, ни одна война не обходится без потерь среди гражданского населения. Долгая и интенсивная защита может дорого стоить организму, если агрессивные высокоспециализированные войска выйдут из-под контроля. Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом [3]. Заболеваниями этого типа страдает около 5% человечества.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани в соответствии со своей специфичностью.
За аутоиммунные поражения организма могут быть ответственны как Т-, так и В-клетки. Первые осуществляют непосредственное убийство безвинных клеток, несущих на себе соответствующий антиген, а также помогают аутореактивным В-клеткам в продукции антител. Т-клеточный аутоиммунитет хорошо изучен при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
В-лимфоциты действуют куда более изощренно. Во-первых, аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги. Во-вторых, мишенями для антител могут стать рецепторы на поверхности клетки. При связывании такого антитела с рецептором тот может или блокироваться, или же активироваться без реального гормонального сигнала. Так происходит при болезни Грейвса: В-лимфоциты производят антитела против рецептора к ТТГ (тиреотропному гормону), мимикрируя действие гормона и, соответственно, усиливая продукцию тиреоидных гормонов [14]. При миастении гравис антитела против рецептора к ацетилхолину блокируют его действие, что приводит к нарушению нейромышечной проводимости. В-третьих, аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность — наличие определенного варианта какого-либо гена.
Предрасположенность к тому или иному аутоиммунному заболеванию часто ассоциирована с определенными аллелями генов MHC, о которых мы уже много говорили. Так, наличие аллеля HLA-B27 может служить маркером предрасположенности к развитию болезни Бехтерева, ювенильного ревматоидного артрита, псориатического артрита и других заболеваний. Интересно, что присутствие в геноме того же самого HLA-B27 коррелирует с эффективной защитой от вирусов: например, носители этого аллеля имеют пониженные шансы заразиться ВИЧ или гепатитом С [15, 16]. Это еще одно напоминание о том, что чем агрессивнее воюет армия, тем вероятнее потери среди гражданского населения.
Кроме того, на развитие болезни может влиять уровень экспрессии аутоантигена в тимусе. Например, продукция инсулина и, соответственно, частота презентации его антигенов Т-клеткам различается от человека к человеку. Чем она выше, тем ниже риск развития сахарного диабета первого типа, так как это позволяет удалить специфичные к инсулину Т-лимфоциты.
Все аутоиммунные заболевания можно разделить на органоспецифические и системные. При органоспецифических болезнях поражаются отдельные органы или ткани. Например, при рассеянном склерозе — миелиновая оболочка нейронов, при ревматоидном артрите — суставы, а при сахарном диабете первого типа — островки Лангерганса в поджелудочной железе. Системные аутоиммунные заболевания характеризуются поражением многих органов и тканей. К таким болезням относятся, например, системная красная волчанка и первичный синдром Шегрена, поражающие соединительную ткань. Более подробно об этих заболеваниях будет рассказано в других статьях спецпроекта.
Заключение
Как мы уже убедились, иммунитет — это сложнейшая сеть взаимодействий как на клеточном, так и на молекулярном уровнях. Создать идеальную систему, надежно защищающую организм от атак патогенов и одновременно ни при каких условиях не повреждающую собственные органы, не смогла даже природа. Аутоиммунные заболевания — побочный эффект высокой специфичности работы системы адаптивного иммунитета, те издержки, которыми нам приходится платить за возможность успешно существовать в мире, кишащем бактериями, вирусами и другими патогенами.
Медицина — творение рук человека — не может в полной мере исправить то, что было создано природой, поэтому на сегодняшний день ни одно из аутоиммунных заболеваний полностью не излечивается. Поэтому цели, которых стремится достичь современная медицина, — это своевременная диагностика заболевания и эффективное купирование его симптомов, от которого напрямую зависит качество жизни пациентов. Однако для того чтобы это было возможно, необходимо повысить информированность населения об аутоиммунных заболеваниях и способах их лечения. «Предупрежден — значит вооружен!» — вот девиз общественных организаций, созданных для этого по всему миру.
Ссылки на источники в оригинале статьи
26.01.2017 Источник: biomolecula.ru








































































