Выйти на плато «жизнь»
О том, что в ходе клинических исследований препарата для иммунотерапии рака получены обнадеживающие результаты, наш журнал писал два года назад (см.
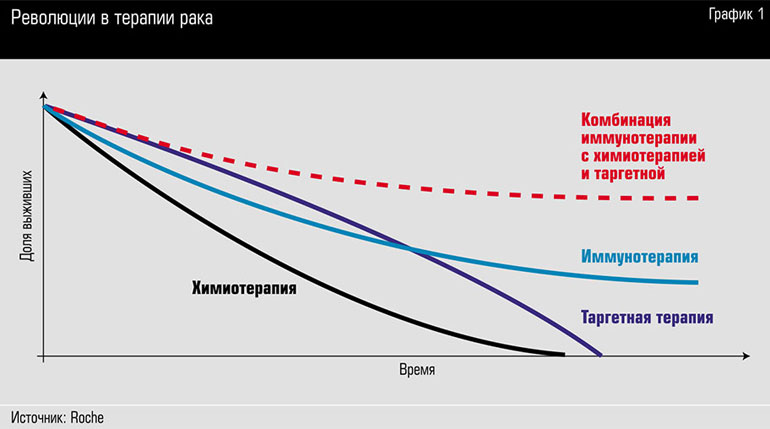
«Очнись, иммунитет», № 43 за 2013 год). На недавнем европейском онкологическом конгрессе, прошедшем в Вене в конце сентября, тема иммунной терапии в онкологии была главной. Несколько препаратов уже вышли на рынок, еще несколько находятся на последних стадиях исследований, а в портфелях фармкомпаний – сотни разработок. Компании, сфокусированные на теме иммунотерапии в онкологии, значительно расширяют свои подразделения, поскольку даже создание одного препарата, призванного активировать иммунитет против опухоли, дает веер возможностей его комбинации с уже имеющимися средствами, в том числе с химиотерапией или таргетными препаратами. Условная диаграмма, которую онкологи охотно демонстрировали на конгрессе (см. график 1), позволяет представить, как новые методы борьбы с опухолью могут вывести пациентов на плато под названием «жизнь».
Потеря равновесия
Обычно в организме человека постоянно появляется небольшое количество перерожденных клеток. Поскольку они «неправильные», иммунная система, призванная следить за порядком, распознает их и уничтожает. Но в какой-то момент здоровое равновесное состояние нарушается. Возможно, в мутации, накопившиеся в клетке, была добавлена последняя «ложка дегтя», и начался неконтролируемый рост. До недавнего времени ученые не очень хорошо понимали, что происходит, почему и в каких ситуациях иммунная система перестает бороться с опухолевыми клетками.
А ведь о том, что она может эффективно бороться, было известно еще в конце XIX века. В американском госпитале хирург Вильям Коли столкнулся со случаем, когда пациент излечился о рака после того, как заболел рожистой инфекцией. И Коли стал собирать свидетельства о подобных случаях. Увидев, что инфекция способна каким-то образом побороть рак, в 1891 году он отважился сделать инъекцию живых стрептококковых бактерий тридцатилетнему итальянцу с последней стадией неоперабельной саркомы кости. Больной пошел на поправку. У двух следующих пациентов тоже уменьшились опухоли, но они умерли от самой инфекции. Модифицировав свою вакцину, чтобы она не заражала пациентов, Коли в 1893 году стал вводить ее больным с саркомами кости. В 1935 году он докладывал о блестящих результатах пятилетней выживаемости пациентов с неоперабельными формами рака. Его пациенты жили. А его вакцину называли «токсинами Коли».
Не все с восторгом относились к токсинам Коли, к тому же в середине века началось бурное развитие других методов лечения рака – химио- и лучевой терапии. Несмотря на усилия дочери Коли, пытавшейся возродить интерес к методам отца, ученые и врачи были увлечены другими направлениями исследований, тогда казавшимися куда более перспективными.
Теперь многие жалеют, что на долгие годы направление иммунотерапии было практически забыто, ведь, развивайся оно более интенсивно, возможно, мы уже имели бы более впечатляющие результаты борьбы с раком. Впрочем, то, что эта область стала активно развиваться в XXI веке, тоже дает серьезное основание для оптимизма. Конечно, за сто с лишним лет ученые получили огромное количество информации, которая теперь позволяет им больше знать о том, что происходит с клетками, как они ведут «диалог» друг с другом. «Мы, конечно, далеко не все знаем о природе рака и о тонкостях работы иммунной системы, – говорит старший вице-президент подразделения клинических разработок компании MSD (подразделение Merck & Co. в США и Канаде) доктор Рой Бэйнс. – Но постепенно открывая новые детали, мы стараемся как можно быстрее использовать их сначала для разработок, а потом для лечения больных раком».
Еще совсем недавно ученые, по словам руководителя группы по разработкам в области иммунотерапии рака компании Genentech (подразделение в составе компании Roche) Дэниела Чена, не понимали, почему опухоли удается избежать атак иммунной системы. Это понимание начало появляться лишь лет пятнадцать назад в связи с исследованиями ВИЧ-инфекции. Выяснилось, что пораженная вирусом клетка выставляет на своей поверхности белок-антиген, который при встрече с клеткой иммунной системы связывается с ней и блокирует ее активность. Белок-антиген назвали PD-L1. А новость чрезвычайно заинтересовала онкологов: может, таким же образом и раковая клетка разоружает иммунную? И, действительно, исследования показали, что опухолевая клетка действует точно так же: выставляет на своей поверхности антиген PD-L1. Если представить, что это рука опухолевой клетки, то она хватает за руку (его назвали PD-1) иммунную клетку – Т-лимфоцит и тем самым запускает сигнал о прекращении боевых намерений иммунной клетки.
Развязать лимфоциту руки
Эти первые результаты стали очень хорошим драйвером для начала разработки новых препаратов. Теперь у фармакологов появилась мишень, или точка приложения. Сейчас эти точки приложения называют чекпойнтами. Стало ясно, что нужно воспрепятствовать «рукопожатию» PD-L1 и PD-1, и сделать это можно с помощью антител, блокирующих эти белки (см. схему). Тогда Т-лимфоцит, у которого уже не будут связаны руки, может свободно заняться своей функцией: выбросом активных веществ, разрушающих опухолевую клетку. Фармкомпании начали разрабатывать такие антитела. Занятие не быстрое: известно, что от идеи до лекарства проходит от десяти до пятнадцати лет.

Дэниел Чен, ученый, разработчик и онколог в одном лице, два года назад рассказывал о поразительных случаях эффекта от препарата, находящегося на стадии клинических исследований. Как врач, он особенно хорошо понимает, каково пациенту с метастатической формой рака: ведь он уже почти смирился со скорым уходом. Но надежда оживает, когда ему предлагают попробовать совсем новое средство. И он оживает сам уже после нескольких инъекций препарата. В компании Genentech разработали не просто антитело к опухолевому белку-антигену PD-L1, его сделали таким, чтобы оно не мешало работать другим клеткам и было максимально щадящим для организма. Дэниел Чен отметил, что препарат практически готов к регистрации, которую должен пройти в начале 2016 года. «Несколько лет назад мы пробовали подходы только к двум видам рака – меланоме и раку легкого, – рассказывает Чен, – а сейчас проводим исследования на очень многих видах рака. И мы невероятно рады тому, что многие пациенты, которых мы в рамках исследований стали лечить нашим атезолизумабом, живут три-четыре года, хотя им, больным с распространенными метастазами, оставались лишь месяцы».
Genentech – не единственная компания, нацелившаяся на этот чекпойнт. Антитело для блокировки PD-L1 разрабатывают и в AstraZeneca. Сейчас препарат этой компании дурвалумаб находится в третьей фазе клинических исследований, то есть тоже вот-вот будет готов к регистрации. В компаниях MSD и Bristol-Myers Squibb созданы антитела против другой молекулы – PD-1, находящейся на поверхности Т-лимфоцита, и эти лекарства тоже препятствуют обезоруживающей силе опухолевой клетки. Профессор Национального тайваньского медицинского университета и руководитель онкологического подразделения университетского госпиталя доктор Чун Хсю весьма впечатлен эффектом применения препарата пембролизумаб: «Мои исследования касались так называемого назофарингиального рака, распространенного в нашей стране. У пациентов был рак в тяжелой форме, они уже не по первому разу получали курсы химиотерапии, но рак после этого все равно прогрессировал. Обычно в таких случаях больным остается максимум десять-одиннадцать месяцев с продолжающей развиваться болезнью и ужасным состоянием. Терапия с иммунным препаратом прерывала прогрессирование болезни пока что на восемь месяцев, но исследования продолжаются. Нам очень важно видеть, что безнадежные пациенты продолжают жить».

Четыре крупные компании словно участвуют в конкурентной гонке. «На самом деле это вдохновляет, поскольку видов рака очень много и компании исследуют препараты во многих направлениях. Пациенты с меланомой или раком легкого, раком почки или мочевого пузыря и другими видами в исследованиях получают уникальный шанс, а сами разработчики расширяют спектр применения препаратов», – говорит Дэниел Чен. К тому же, чем больше похожих препаратов появится на рынке, тем больше пациентов смогут их получить, тем быстрее будут выравниваться цены на них, комментирует Рой Бэйнс из MSD.
Веерное наступление
Онкологи уже назвали революцией разработку первых антител для иммунной терапии. Однако сейчас еще больше надежд они связывают с разработкой новых препаратов, действующих на другие точки приложения, и комбинаций иммунных препаратов с другими методами. «Если мы посмотрим на иммунный цикл, то увидим, как много открывается возможностей для воздействия на активацию иммунной системы против опухоли, – говорит руководитель фармподразделения компании Roche Дэниел О’Дэй. – Сегодня мы разрабатываем более двадцати препаратов, воздействующих на различные чекпойнты иммунотерапевтического цикла. Семь из них уже на стадии клинических исследований».
Иммунный цикл начинается с того, что к опухоли приближается один из стражей иммунной системы – дендритная клетка. Она «считывает» информацию с белка-антигена опухоли и тащит эту новость в средоточие армии иммунной системы – в лимфоузлы. Там дендритная клетка может передавать эту информацию, обучая и науськивая Т-лимфоциты на опухолевые антигены. Т-лимфоциты по кровяному руслу отправляются к опухоли и просачиваются в ее окружение (см. схему). На всем этом пути уже отмечены точки, на которые можно воздействовать. «К примеру, мы нацелились на этап, который происходит в лимфоузлах. Мы разрабатываем антитело к одному из рецепторов на Т-лимфоците с целью еще больше активировать его на борьбу с опухолью», – рассказывает Дэниел Чен.
Над этой же точкой приложения под названием OX40 работают и в компании AstraZeneca. Здесь же на стадии поздних клинических исследований находится еще одна новая молекула – антитело к еще одному рецептору Т-лимфоцита – CTLA-4. В обычное время через этот рецептор проходит сигнал, который тормозит активность иммунной клетки. Это физиологический механизм, поскольку любой иммунный ответ в какой-то момент должен быть остановлен. В компании исследуют комбинацию двух антител – дурвалумаба (анти-PD-L1) и тремелимумаба (анти-CTLA- 4). Дело в том, что прием только первого препарата в виде монотерапии весьма эффективен в лечении примерно 25% пациентов. Второй же препарат усиливает активность иммунного ответа. «Эта комбинация представляет собой один из первых опытов применения двух молекул, позволяющих использовать иммунные механизмы в лечении онкологических заболеваний. При немелкоклеточном раке легкого она продемонстрировала весьма впечатляющую клиническую активность», – говорит исполнительный директор AstraZeneca Паскаль Сорио. Важно, что эта комбинация эффективна и для тех пациентов, которые неохотно откликались на терапию только дурвалумабом. В портфеле подразделения AstraZeneca, компании Medimmune, еще ряд разработок, в том числе анти-PD-1 и другие препараты, которые призваны воздействовать на те или иные рецепторы, по сути усиливающие или восстанавливающие противоопухолевой иммунный ответ. Помимо того что исследования ведутся в самой компании, она заключает партнерские соглашения с разработчиками, реализующими интересные проекты в этом направлении.
«В ходе исследований мы видим, как можем усилить иммунный ответ, – рассказывает глава глобального направления онкологии в фармподразделении Roche Вильям Пао. – Сейчас у нас на стадии клинических исследований находится несколько таких препаратов. К примеру, мишень для одного из них – макрофаг, который уменьшает активацию Т-лимфоцита. Наша цель – избавить лимфоцит от излишней опеки макрофага. При определенных опухолях в суставах, где велико количество опухоль-ассоциированных макрофагов, применение нашего нового препарата эмактузумаб дало фантастический результат: уровень ответа составил 86 процентов». Еще один препарат, по словам доктора Пао, действует на активацию дендритной клетки, чтобы она в свою очередь возбудила на борьбу как можно больше Т-лимфоцитов. Большие надежды в Roche связывают с разработкой так называемых биспецифических Т-клеток: «Это антитела, которые направлены на один из рецепторов опухолевой клетки, обеспечивающий связывание с Т-клетками и их активацией. После чего Т-клетки разрушают опухолевые».
В компаниях не только разрабатываются инновационные препараты для иммунной терапии, но и ведутся веерные испытания этих препаратов в комбинации с уже известными средствами, например с традиционной химиотерапией или с таргетными лекарствами. Хорошей моделью для опыта является немелкоклеточный рак легкого и его подвиды. Дело в том, что ученым и фармацевтам уже известны многие мутации, связанные с этим раком (до 70%), для многих из этих мутаций уже созданы таргетные препараты. «Для пациентов с конкретными мутациями применяются таргетные препараты и новые иммунные, – рассказывает Рой Бэйнс. – И результаты весьма вдохновляют. Мы в компании разрабатываем более 30 направлений, связанных с комбинациями препаратов, 17 из них – на финальных стадиях исследований».
Усиливает наступление на рак и разработка диагностических тестов. В Roche, где очень сильно связаны друг с другом два мощных подразделения – диагностическое и фармацевтическое, ученые идут рука об руку. Они не только разрабатывают тесты, которые могут давать ответы на вопрос, с каким конкретным препаратом или с какой комбинацией нужно подходить к тому или иному пациенту, но и на стадии лечения берут образцы и исследуют их, чтобы контролировать или изменять схемы лечения. Ведь известно, что опухоль, во-первых, неоднородна, а во-вторых, чрезвычайно изменчива: специалистам важно знать, что происходит там, внутри, на разных этапах, чтобы воздействовать на опухоль еще более эффективно. Компания MSD в партнерстве тоже разрабатывает тесты для иммунной терапии. По словам практических онкологов, они воодушевлены новыми препаратами и разработками, им есть чем обнадежить своих пациентов.
29.10.2015















