|КРОВЕТВОРНАЯ СИСТЕМА| |ИММУННАЯ СИСТЕМА|
|ИНСТРУКЦИЯ ДИАГНОСТИКИ КОСТНОГО МОЗГА| |БОЛЕЗНИ КОСТНОГО МОЗГА| |ВОССТАНОВЛЕНИЕ КОСТНОГО МОЗГА|
КОСТИ Трансплантация костного мозга Стволовые клетки wiki
Костный мозг - общая информация
Костный мозг — важнейший орган кроветворной системы, осуществляющий гемопоэз, или кроветворение — процесс создания новых клеток крови взамен погибающих и отмирающих. Он также является одним из органов иммунопоэза. Для иммунной системы человека костный мозг вместе с периферическими лимфоидными органами является функциональным аналогом так называемой фабрициевой сумки, имеющейся у птиц.
Костный мозг — единственная ткань взрослого организма, в норме содержащая большое количество незрелых, недифференцированных и низкодифференцированных клеток, так называемых стволовых клеток, близких по строению к эмбриональным клеткам. Все другие незрелые клетки, например незрелые клетки кожи, всё же имеют большую степень дифференцировки и зрелости, чем клетки костного мозга, и имеют уже заданную специализацию.
Красный костный мозг
Gray's Anatomy Клетки красного костного мозга.
Красный, или кроветворный, костный мозг у человека находится, в основном, внутри тазовых костей и рёбер, в меньшей степени, внутри эпифизов длинных трубчатых костей и, в ещё меньшей степени, внутри тел позвонков. В норме он защищён барьером иммунологической толерантности с целью недопущения уничтожения незрелых и созревающих клеток собственными лимфоцитами организма. При нарушении иммунологической толерантности лимфоцитов к клеткам костного мозга развиваются аутоиммунные цитопении, в частности аутоиммунные тромбоцитопении, аутоиммунные лейкопении, и даже апластическая анемия.[источник не указан 626 дней]
Красный костный мозг состоит из фиброзной ткани стромы и собственно кроветворной ткани. В кроветворной ткани костного мозга выделяют несколько ростков гемопоэза (так же называемых линиями, англ. cell lines), количество которых увеличивается по мере созревания. Зрелых ростков в красном костном мозге пять: эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный. Каждый из этих ростков даёт, соответственно, следующие клетки и постклеточные элементы: эритроциты; эозинофилы, нейтрофилы и базофилы; лимфоциты; моноциты; тромбоциты.
Развитие ростков гемопоэза представляет собой сложный процесс дифференцировки клеток. Родоначальники всех ростков названы полипотентными клетками за их способность дифференцироваться в клетки всех ростков гемопоэза под действием цитокинов. Также эти клетки называют колониеобразующими элементами (КОЭ) за их локальное расположение в костном мозге. Количество полипотентных стволовых клеток, то есть клеток, которые являются самыми первыми предшественниками в ряду кроветворных клеток, в костном мозге ограничено, и они не могут размножаться, сохраняя полипотентность, и тем самым восстанавливать численность. Дело в том, что при первом же делении полипотентная клетка выбирает путь развития, и её дочерние клетки становятся либо мультипотентными клетками, у которых выбор более ограничен (только в эритроцитарный или лейкоцитарный ростки), либо мегакариобластами и затем мегакариоцитами — клетками, от которых отшнуровываются тромбоциты.
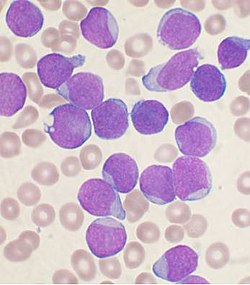
Мазок красного костного мозга у больного лейкемией (препарат окрашен красителем Романовского — Райта).
Под действием цитокинов КОЭ начинают специализироваться, переходя на следующий этап — олигопотентные клетки. Как видно из названия. вариантов дифференцировки у них уже меньше. Второе название этих клеток — колониеобразующие единицы (КОЕ), поскольку они расположены более мелкими группами, чем КОЭ. КОЕ неоднородны между собой: выделяют колониеобразующие единицы гранулоцитарно-эритроцитарно-миелоцитарно-макрофагального (КОЕ-ГЭММ) и колониеобразующие единицы лимфоцитарного (КОЕ-Л) ростков. Дальнейшее развитие КОЕ ещё более специфично.
Под действием цитокинов КОЕ-ГЭММ даёт следующие три типа клеток: колониеобразующая единица гранулоцитов и моноцитов (КОЕ-ГиМ), колониеобразующая единица эритроцитов (КОЕ-Э) и колониеобразующая единица мегакариоцитов (КОЕ-МГЦ). Эти переходы инициируются лейкопоэтином, эритропоэтином и тромбопоэтином соответственно. Эти КОЕ — последние, дальнейшие клетки ростков называются бластами, поскольку они уже становятся на один путь дифференцировки в одну конечную клетку. Так, КОЕ-ГМ развивается либо в промонобласт, либо в програнулобласт; КОЕ-Э развивается в эритробласт; КОЕ-МГЦ развивается в мегакариобласт. Таким образом, вкупе с лимфоидным ростков, получаются 5 вышеперечисленных ростков гемопоэза.
Под действием различные лимфопоэтинов КОЕ-Л начинает экспрессировать разные маркеры дифференцировки и даёт разные типы лимфоцитов. Например, CD4+, CD8+, CD54+, и так далее. Представления о «Т-лимфоцитах» и «В-лимфоцитах» устарели уже к началу 1990-х годов: это деление основано лишь на месте конечного созревания клетки и не учитывает иммунологических особенностей. Например, классический «Т-лимфоцит» и правда отличается от классического «В-лимфоцита»: первый несёт CD3+, а второй CD19+. Однако такое деление не учитывает множество клеток, не являющихся потомками ни Т-, ни В- ростка. Классическим примером для аргументации неточности этой классификации являются естественные киллеры (NK-клетки). Так же такое деление не позволяет объяснять механизмы взаимодействия иммунокомпетентных клеток при различных типах аллергий, что требует искусственно вводить термины «Т-хелперы» и «Т-супрессоры», а в дальнейшем разбивать их на «Т-хелперы 1-го порядка» и «Т-хелперы 2-го порядка». Однако, для простоты термины «Т- и В- лимфоциты» используются до сих пор.
Чувствительность к цитостатикам и излучению
Клетки нормального костного мозга, подобно другим незрелым клеткам — клеткам злокачественных опухолей, а также стволовым клеткам кожи и слизистых, — обладают повышенной по сравнению с другими, более зрелыми, клетками организма чувствительностью к ионизирующим излучениям и цитостатическим противоопухолевым химиопрепаратам. Однако чувствительность клеток костного мозга всё же ниже чувствительности клеток злокачественных опухолей, что и позволяет применять химиотерапию и облучение, уничтожая злокачественные опухоли или тормозя их размножение и метастазирование при сравнительно меньшем (хотя во многих случаях и весьма значительном) повреждении костного мозга.
Особенно высокой, более высокой, чем у клеток нормального костного мозга, чувствительностью к химиотерапии обладают лейкозные клетки.
Те цитотоксические химиопрепараты, которые уничтожают или повреждают полипотентные клетки, обладают кумулятивным, то есть накапливающимся, повреждающим воздействием на костномозговое кроветворение. Дело в том, что они приводят к исчерпанию невозобновимого костномозгового резерва первичных клеток-предшественников. Подобный кумулятивный угнетающий эффект на костномозговое кроветворение характерен, в частности, для бусульфана и производных нитрозомочевины. Передозировка любого из цитостатических агентов, обладающих кумулятивным действием на клетки-предшественники, вызывает необратимую аплазию костного мозга — апластическую анемию.
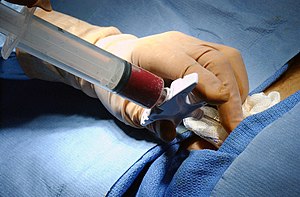
Проведение пункции.
И напротив, химиопрепараты, в основном повреждающие или уничтожающие более поздние промежуточные стадии развития кроветворных клеток, например мультипотентные клетки, почти не обладают кумулятивным угнетающим действием на костномозговое кроветворение — после прекращения химиотерапевтического воздействия численность костномозговых клеточных популяций полностью или почти полностью восстанавливается за счёт костномозгового резерва первичных клеток-предшественников. Таким свойством — относительно мало уничтожать невозобновимую популяцию первичных полипотентных клеток — обладает большинство противоопухолевых препаратов, например, циклофосфамид, цитозин-арабинозид. Именно это позволяет применять эти лекарства при опухолях и лейкозах.
НОВОСТИ КОСТНОГО МОЗГА