Предотвращение старения с помощью регенеративного перепрограммирования

Резюме: все живые существа после онтогенеза подвергаются системному физиологическому спаду, характеризующемуся старением. Современная медицина увеличила продолжительность жизни, но это создало пожилое общество, которое имеет большую предрасположенность к дегенеративным расстройствам. Поэтому, нужен роман вмешательства с целью продления ее качество параллельно продолжительности жизни. Способность живых существ к регенерации поддерживает их биологическую целостность и, таким образом, является основным рычагом против старения. Однако регенерационная способность млекопитающих низка и в дальнейшем снижается во время старения. Следовательно, условия, которые усиливают регенерацию может противодействовать старению. Последние достижения в области регенеративной медицины показали, что старение не является необратимым процессом. Конверсия соматических клеток в эмбрионально - подобные плюрипотентные клетки показала, что дифференцированное состояние и возраст клетки не фиксированы. Идентификация плюрипотенцииндуцирующих факторов впоследствии породила идею о том, что клеточные особенности могут быть перепрограммированы определенными факторами, определяющими желаемый результат. Последнее десятилетие следовательно наблюдало избыток исследований которые дорабатывают клетчатые особенности включая вехи вызревания в дополнение к клетчатым функции и идентичности в разнообразие типах клетки ин витро. Недавно, некоторые из этих перепрограммируя стратегий сразу были использованы в животных моделях в преследовании подмолаживания и замены клетки. Здесь мы рассматриваем эти усилия перепрограммировать vivo и обсудим возможность их использования в целях продления долголетия, дополняя или усиливая регенеративные способности.
Ключевые слова: старение ■ клеточное перепрограммирование ■ долголетие ■ регенерация ■ стволовые клетки
Авторы: Ergin Beyret,* Paloma Martinez Redondo,* Aida Platero Luengo,* Juan Carlos Izpisua Belmonte
Для прочтения информации о последних исследованях в области регенерации с целью омоложения, прочтите по порядку следующие главы:
Эликсир жизни
За последние 2 столетия в развитых странах мира продолжительность жизни уманцев увеличилась более чем в 2 раза, в результате чего резкое увеличение численности пожилого населения.1 преклонный возраст связан с физиологическими спадами, которые в конечном итоге приводят к недееспособности личности и повышенной предрасположенности к заболеваниям.2 среди них сердечно-сосудистые заболевания являются ведущей причиной смерти во всем мире. На первый взгляд, старение можно рассматривать как регулирование жизни возник период в ходе эволюции многоклеточных животных от простейших.3,4 на самом деле, долговечность использована как основные критерии в много биологических моделей вызревания, и, таким образом, многочисленные исследования показывали расширение жизненного периода на изменении специфических сохраненных троп.5-7 однако такое количественное улучшение можно считать менее приоритетным по сравнению с качественным улучшением жизни человека. Поэтому, разрешать немедленное последствие вызревания, физиологопсихологическое ухудшение качества, главная цель вызреваниориентированных изучений в людях. В этом отношении Продолжительность здоровой жизни, называемая healthspan, может быть определена как Продолжительность времени, в течение которого человек физиологически компетентен и способен поддерживать гомеостаз в ответ на внешний стресс, но не обязательно приравнивается к продолжительности жизни.8,9
Тот факт, что наш healthspan не идет в ногу с увеличением ожидаемой продолжительности жизни приводит к большему количеству лет, проведенных в физиологическом дефиците. Таким образом, существует высокий социально-экономический, медицинский и научный интерес для того чтобы найти стратегии которые совещаются оптимальная физиология, таким образом удлиняя healthspan.10 однако, наше понимание биологии старения с целью улучшения физиологической компетентности все еще ограничено; таким образом, чтобы расширить healthspan, нам все еще нужно расшифровать и противодействовать клеточным триггерам старения. На клеточном уровне старение можно рассматривать как нарушение молекулярных механизмов во времени, вызывающее такие аберрации, как эпигенетическая дисрегуляция, истощение теломер и повышенный уровень активных форм кислорода и токсичных белковых агрегатов. Среди них эпигенетические изменения были широко изучены в последние десятилетия.11 исследования на ряде моделей, охватывающих от дрожжей до человека, показали различные эпигенетические изменения во время старения 11, такие как образование связанного с старением гетерохроматина foci12; снижение объемных уровней основных гистонов; и включение noncanonical histones13 в дополнение к изменениям в Post-translational изменениях гистона, картине метилирования дна, и noncoding профиле рибонуклеиновой кислоты.11,14,15 в целом, эти молекулярные аберрации препятствуют клеточным функциям, которые, в свою очередь, проявляются как системный физиологический спад, который мы наблюдаем как старение на организменном уровне.2 физиологические спады в конечном счете приводят к гибели организма, как только они опускаются ниже определенного порога, который поддерживает его жизнь.
Таким образом, старение-это не что иное, как молекулярные аберрации, которые происходят на клеточном уровне, что в свою очередь возмущает состав биологической единицы или как она функционирует.
Молекулярные аберрации, связанные со старением, являются фундаментальным эффектом энтропии, которая повсеместно действует на все вещество, живое и неживое. Подвержена энтропии, вся материя стремится к беспорядку. Тем не менее, живые существа наделены жизненно важным свойством, отделяющим их от неживой материи, способностью активно поддерживать организованное состояние. Регенерация означает восстановление функциональных единиц, утраченных в результате ухудшения или повреждения, и, таким образом, является основным рычагом воздействия живых существ на дегенеративный эффект энтропии. Тем не менее, все живые существа в конечном итоге теряют перетягивание каната с энтропией. Биологический порядок постепенно ухудшается в этой борьбе, проявляется как старение, и в конечном итоге разрушается, характеризуется как смерть. Следовательно, старение характеризуется системной хронической дегенерацией. Кроме того, с возрастом способность к регенерации снижается, что делает организм еще более уязвимым.16 биологические единицы, не обладающие значительной регенерационной способностью, наиболее уязвимы к воздействию энтропии. Учитывая, что целостность биологических единиц определяет возраст человека, ожидается, что меры, которые противодействуют ущербу биологическому порядку, будут способствовать укреплению здоровья и долголетия.
Индуцированные плюрипотентные стволовые клетки (iPSCs) запустили золотую эру регенеративной медицины из-за их способности генерировать любой тип клеток в организме.17,18 это открытие закрепило концепцию, что клеточная идентичность является просто состоянием и может быть изменена индуктивными факторами, которые поддерживают состояние желаемого типа клетки. Последующее выявление целого ряда таких факторов, изменяющих клеточную идентичность, позволило осуществить прямое преобразование клеток в другое дифференцированное состояние без достижения плюрипотентности. Хотя использование этой технологии было впервые направлено на генерацию клеток in vitro для трансплантации, ее применение непосредственно in vivo недавно было изучено в регенеративных целях.19,20 здесь мы рассмотрим последние достижения в области клеточного перепрограммирования и обсудим, как их можно использовать для улучшения здоровья и долголетия, дополняя или увеличивая регенеративную способность.
Эпигенетика и перепрограммирование
Роль эпигенетики в старении в последнее время стала центральной темой. Многочисленные исследования показали, что эпигенетический профиль клетки изменяется во время старения.12,21-25 например, выяснение возрастных изменений в структуре метилирования ДНК привело к использованию термина “часы метилирования ДНК” в качестве точного предиктора возраста на молекулярном уровне.26-28 изменения в структуре хроматина также коррелируют с агингрелатед фенотипами в разнообразном виде выстраивая в ряд от дрожжей к людям.11 на самом деле, роль эпигенетических модификаций в регуляции продолжительности жизни была продемонстрирована у дрожжей давно из-за роли гистоновых деацетилаз III класса, сиртуинов, в замалчивании рибосомной ДНК. 29
Следуя этой линии мысли, можем ли мы улучшить healthspan, сбросив старый эпигеном в более молодое состояние, чтобы клетки восстановили свой молодой фенотип?
Функции каждого типа клеток в организме эпигенетически запрограммировано в ходе ее онтогенеза. Эксперименты по ядерному переносу в лягушке в середине 20-го века впервые показали, что эта программа может быть сброшена цитоплазматическими факторами, присутствующими в яйцеклетке, и аннулировала догму, которая утверждает, что клеточная Спецификация необратима.30,31 2006 было выделено с открытием этих факторов которые преобразовывают мышиные и человеческие соматические клетки к государству iPSC.17,18 При долгосрочном комбинаторном эффекте 4 факторов транскрипции (OCT4, KLF4, SOX2 и c-Myc; также известный как 4F), любой тип соматических клеток дифференциируется и приобретает состояние iPSC, подобное состоянию эмбриональных стволовых клеток млекопитающих.32 Эти исследования показали, что имитация транскрипционной схемы яйцеклетки в соматических клетках была достаточной для придания плюрипотентности и установления существенных доказательств того, что клеточная идентичность может быть изменена путем имитации транскрипционной схемы желаемого типа клетки (рис.1).
В процессе развития пластичность клеток постепенно снижается параллельно их спецификации, и это снижение сопровождается постепенным увеличением уплотнения их хроматина. Наоборот, структура хроматина заново открывает во время наведенный 4F перепрограммировать к Положению iPSC.33 Взаимодействие между транскрипционными факторами и эпигенетическими модификаторами в конечном итоге индуцирует плюрипотентность через основное эпигенетическое ремоделирование33,34, которое включает в себя 2 основные транскрипционные волны.35,36 Первая волна характеризуется повышением регуляции генов, участвующих в пролиферации, и понижением регуляции тех, кто участвует в клеточной адгезии и дифференцировке, тогда как вторая волна характеризуется повышением регуляции основных факторов плюрипотентности, таких как эндогенные OCT4 и SOX2.
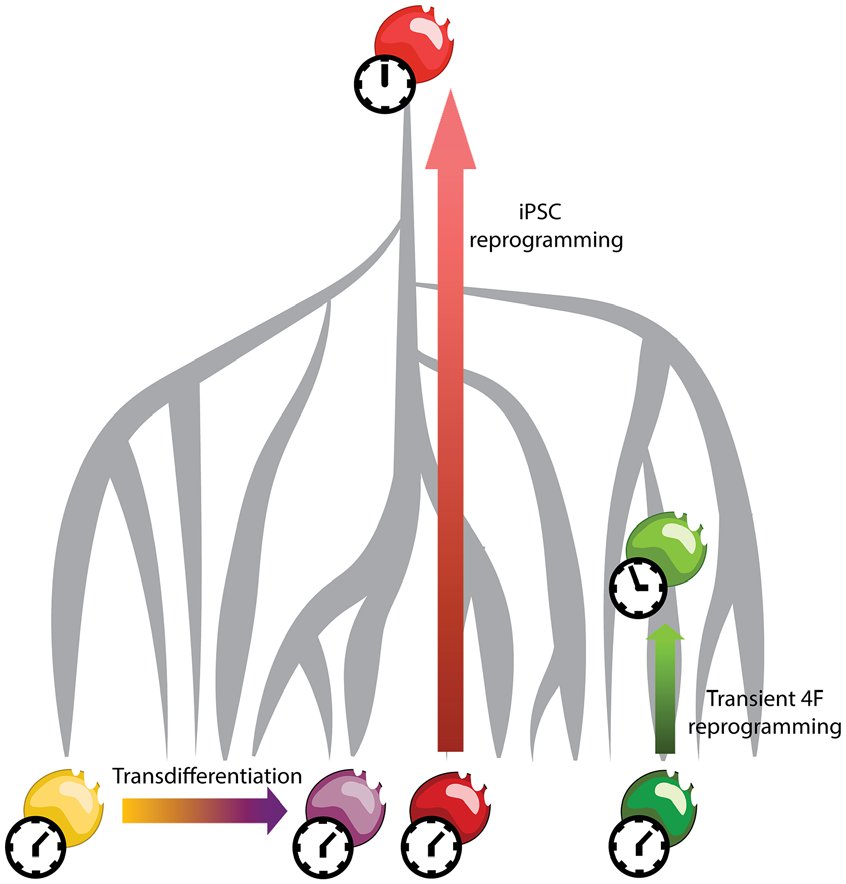 Рис. 1. Клеточное перепрограммирование. Клетку можно индуцировать transdifferentiate в другой тип или dedifferentiate в состояние прародителя по индуктивным факторам. Дедифференциация 4F (OCT4, KLF4, SOX2 и c-Myc) индуцирует эпигенетическое омоложение в отличие от трансдифференцировки. Риск образования тератомы препятствует любой стратегии, которая включает дедифференцировку индуцированного состояния плюрипотентных стволовых клеток (iPSC) in vivo. Однако, временной модуляции 4Ф выражение может использоваться, чтобы вызвать эпигенетическое омоложение без изменений личности или при дифференцировке в пластиковые государств.
Рис. 1. Клеточное перепрограммирование. Клетку можно индуцировать transdifferentiate в другой тип или dedifferentiate в состояние прародителя по индуктивным факторам. Дедифференциация 4F (OCT4, KLF4, SOX2 и c-Myc) индуцирует эпигенетическое омоложение в отличие от трансдифференцировки. Риск образования тератомы препятствует любой стратегии, которая включает дедифференцировку индуцированного состояния плюрипотентных стволовых клеток (iPSC) in vivo. Однако, временной модуляции 4Ф выражение может использоваться, чтобы вызвать эпигенетическое омоложение без изменений личности или при дифференцировке в пластиковые государств.
Ассоциация OCT4 с H3K36me2 demethylases, KDM2A и KDM2B, активирует OCT4 генов-мишеней во время первой волны на снижение уровня H3K36me2 на своих промоутеров.37 аналогичным образом, взаимодействие OCT4, SOX2, KLF4 и с главным членом Trithorax комплекс, WDR5, и H3K27 деметилазы, UТУ, активирует эндогенную ядра сети плюрипотентности во время второй волны.37-39 таким образом, компоненты 4F облегчают эпигенетическое ремоделирование, координируя эпигенетические модификаторы во время обеих транскрипционных волн. Учитывая эту силу 4F в модуляции эпигенетической топографии, можно ли использовать их для сброса старого эпигенома?
Действительно, перепрограммирование соматических клеток в iPSCs не только обращает вспять их развитие clock31,40-42,но и обращает вспять их старение часы, 43-45 свидетельствует об исчезновении клеточных признаков старения (рис.1). Например, старческие клетки человека или клетки, полученные от столетних особей, сбрасывают свой размер теломер, профили экспрессии генов, уровни окислительного стресса и метаболизм митохондрий во время этого процесса до уровней, неотличимых от эмбриональных стволовых клеток человека.43 полученные ипск способны redifferentiate в полностью омолаживаются клетки. Например, пока нейроны сразу перепрограммированные от старых фиброцитов сохраняют их постаретый молекулярный профиль, те выведенные через образование iPSC показывают rejuvenated фенотип.46 эти наблюдения показывают, что клеточная идентичность и возраст являются не необратимыми конечными точками, а просто пластическими клеточными состояниями, продиктованными эпигенетическим кодом в данный момент времени, и этот код можно перепрограммировать. Однако, перепрограммировать к iPSCs и redifferentiation требуют множественных разделений клетки и преобразования клетчатой тождественности через множественные положения неопластического потенциала как образование teratoma iPSCs. Поэтому, поскольку организмы материализуются из гармоничных взаимодействий биологических единиц, было сомнительно, что эта технология может быть фактически применена in vivo.
Замечательно, мы недавно наблюдали что переходное выражение 4F достаточно для того чтобы переустановить часы вызревания клетки без потери своих тождественности или клетчатых разделений, показывая что подмолаживание клетки происходит очень раньше во время своего преобразования к iPSCs (диаграмме 1). Кроме того, мы наблюдали, что повсеместная индукция 4F расширяет продолжительность жизни мышиной модели ускоренного старения (синдром Хатчинсона–Гилфорда) в корреляции с увеличением эпигенетических признаков, связанных с молодостью, тогда как снижение тех, которые связаны со старением.47 для этого исследования мы использовали циклы выражения 4F, которые включали 2 дня выражения, а затем 5 дней отдыха. Этот режим не влиял на экспрессию маркера fi-broblast THY-1 (thymus cell antigen 1) или индуцировал маркер плюрипотентности NANOG in vitro, указывая на то, что дедифференцировка не произошла. Тем не менее, мы наблюдали свидетельства того, что эпигенетический профиль был перепрограммирован в состояние молодой клетки. Например, переходная экспрессия 4F восстановила уровни H3K9me3 и H4K20me3, которые уменьшаются и увеличиваются, соответственно, во время физиологического возраста48,49 и в прогерии.50 это эпигенетическое перепрограммирование сопровождалось уменьшением повреждения ДНК на основе уровней 53bp1 и гистона γ-H2AX. Уменшение в этих отметках повреждения дна не произошло в присутствии к ИУ АБС битор метилтрансферазы H3K9, показывая что эпигенетические изменения необходимы для наведенных 4F предохранения или ремонта дна.
Интересно, что эти результаты подтверждаются более недавней публикацией, которая подтверждает регулирование уровней H3K9me3 в течение первых 48 часов 4F-индуцированного перепрограммирования.51 они также показали увеличение связывания гистоновой деацетилазы 1 в течение 48 часов индукции, связанное с метилированием H3K9, и не наблюдали значительной регуляции генов, связанных с повреждением ДНК, в этот период. Хотя в настоящее время не ясно, может ли этот подход продлить продолжительность жизни физиологически пожилых людей, мы подтвердили эти выводы о позднем прохождении клеток дикого типа человека и мышей, моделирующих физиологическое старение in vitro. В целом, Ключевая концепция, поднятая в этой работе, заключается в том, что старение является проявлением прогрессирующей эпигенетической дисрегуляции, которая может быть сброшена путем переходного in vivo перепрограммирования, индуцированного экспрессией 4F. Оно должен также быть упомянут что работы другими предложили метаболически дисфункцию и сокращение telomere как водители вызревания. Например, удаление пим-киназ у мыши вызывает преждевременное старение сердца в связи с нарушенным биогенезом и функцией митохондрий.52 в частности, принудительная экспрессия киназы Pim 1 в первичных сердечных прародителях человека устраняет клеточные признаки старения in vitro.53 аналогичным образом, гиперэкспрессия теломеразы обратной транскриптазы омолаживает мышиные мезенхимальные стромальные клетки. Кроме того, после трансплантации в ишемический модель задних конечностей, омоложенные клетки способствовали регенерации тканей более эффективно, чем издеваться над контролем.54 интересно, что возмущение эпигенетических регуляторов коррелирует с дисрегуляцией теломера, 55 и истертость теломера, как известно, компрометирует метаболизм и функцию митохондрий через активацию p53.56 поэтому роль эпигенетической, метаболической и теломерной дисрегуляции в старении не обязательно может быть взаимоисключающей.
В дополнение к эпигенетическому омоложению, стратегии перепрограммирования могут быть потенциально использованы непосредственно in vivo для замены клеток, которые ухудшаются или погибают во время старения, тем самым продлевая срок службы (Рис.2). Таким образом, в отличие от эпигенетического омоложения, эта стратегия основана на преобразовании резидентной клетки ткани в другой тип клеток.
Замена клеток In Vivo перепрограммированием
Классически, регенеративная медицина полагалась на трансплантацию для заместительной терапии клеток, чтобы облегчить физиологические дисфункции, которые вытекают из ухудшения или смерти клеточной популяции.57 данный подход успешно переведен в клиники по поводу гемопоэтических нарушений.58 однако в других случаях он не дал удовлетворительных результатов, которые можно было бы рассматривать как обобщенную клиническую процедуру отчасти из-за проблем иммунокомпатибельности.57 потому что iPSCs может дать подъем к любому типу клетки внутри тело, открытие этой технологии натравили понятие поколения в пробирке функционального, омолаживаются клетки для замены терапии аутологичной. Однако трансплантация клеток, полученных из iPSC, сталкивается с проблемами безопасности и функциональности. Например, клетки, полученные из iPSCs, часто демонстрируют неоднородность и незрелую функциональность, что делает их непригодными для трансплантации. Кроме того, in vitro манипуляции с клетками несут в себе риск заражения и накопления мутаций. Кроме того, существуют внутренние технические барьеры для самой процедуры трансплантации, такие как инвазивность процедуры, а также доставка и удержание трансплантата. Поэтому, клиническое применение этой ин витро технологии бросало вызов.59
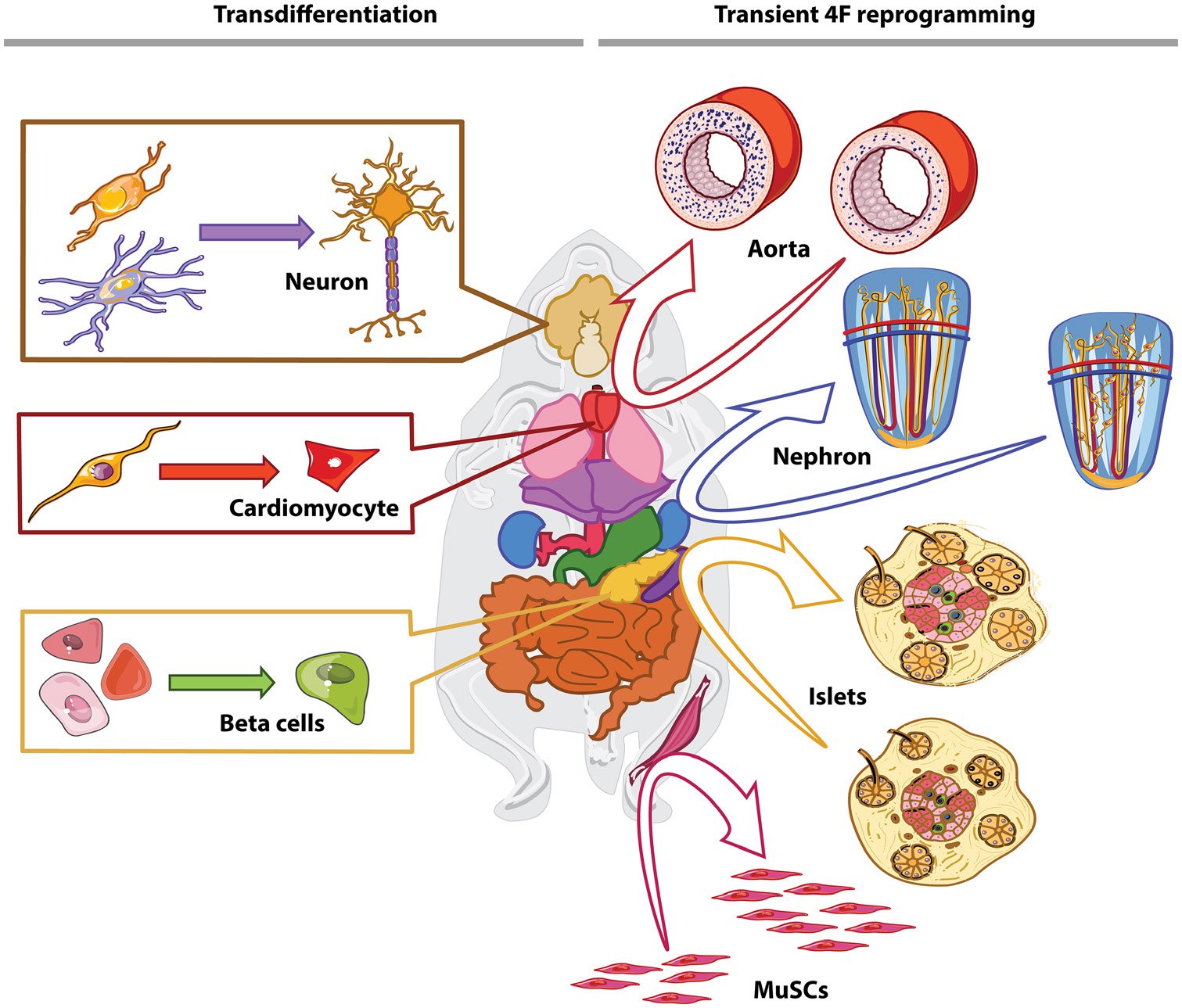
Рис.2. Подходы регенеративного перепрограммирования. В-индукция vivo transdifferentiation можно использовать для того чтобы repopulate клетки потерянный во время вызревания как альтернатива к трансплантации, комплектуя внутреннеприсущую регенеративную емкость. Например, нейроны, потерянные при нейродегенеративных заболеваниях, могут быть заменены трансдифференцирующими резидентными глиями или астроцитами; сердечные фибробласты могут быть источником клеток для индуцированных кардиомиоцитов; α, протоковые и ацинарные клетки могут использоваться для β-клеток. lternatively, транзиторная 4F (OCT4, KLF4, SOX2 и C-Myc) выражение можно использовать для того чтобы rejuvenate клетки. Это в свою очередь может замедлить вырождение биологических единиц, которые имеют низкую регенерации емкость (например, аорта) или увеличить регенерацию потенциала по противодействию стволовых клеток утомления (например, мышц) или за счет повышения пластичности органов, что свойственно проходить клеточные преобразования в процессе регенерации (например, трансдифференцировка в поджелудочной железе и дифференцировке в почках). Мускус указывает на мышечные стволовые клетки.
Альтернативой трансплантации клеток в живом организме перепрограммирования клеток житель ткани для создания функциональных клеток (Рис. 2). С клинической точки зрения, перепрограммировать в плюрипотентные государство имеет риск онкогенеза. Однако, клетки могут быть индуцированы в transdifferentiate без прохождения плюрипотентных государства.60 в ходе этого процесса общепринято, что клетка непосредственно переключает свою идентичность без дедифференцировки или клеточной пролиферации при введении индуктивных факторов. Преобразование является более эффективным между клетками, которые развиваются closer61, 62, но также может происходить между развитыми удаленными клетками, демонстрируя возможность пересечения барьеров развития.63,64 одно из первых наблюдений трансдифференцировки было сделано Дэвисом и др. в 1987,65, который показал in vitro, что мышиные эмбриональные фибробласты превращаются в миобласты при принудительном выражении MyoD (миогенная дифференцировка 1), главного регулятора скелетной мышцы. С тех пор поступили сообщения о различных наблюдениях трансдифференцировки.61 например, нейроны,64,66,67 гепатоцитов,68 кроветворных клеток,62,69 скелетных мышечных клеток,65 и эндотелиальной cells70 были вызваны непосредственно из других дифференцированных клеток, таких как фибробласты. Хотя большинство из этих исследований были выполнены in vitro, некоторые из них перешли к in vivo в моделях животных (Таблица).
В этом разделе мы рассмотрим некоторые из этих примеров in vivo transdifferentiation, как стратегию восстановления поврежденных тканей.
β Клетки
Сахарный диабет является одним из основных заболеваний, связанных со старением. Более 25% американцев >65 лет испытывают его, и распространенность, по оценкам, удвоится в ближайшие 20 лет частично из-за старения населения.71 сахарный диабет характеризуется потерей или дисфункцией инсулинпродуктивных клеток, β-клеток, островков поджелудочной железы. Поэтому стратегии генерации β-клеток были высоко изучены в области регенеративной медицины, включая перепрограммирование in vivo.72 по сравнению с фармакологическими альтернативами эта стратегия имеет то преимущество, что она устанавливает физиологические условия, в которых секреция инсулина и гомеостаз глюкозы внутренне гармонизированы. Поэтому неудивительно, что первый случай прижизненного трансдифференцировка было обращение панкреатических экзокринных клеток ацинарных клеток в β-клетки.73 в этой работе Чжоу и др. использовали аденовирусные векторы для экспрессии 3 β-клеточных спецификаторов Neurog3, Pdx1 и MafA в поджелудочной железе взрослой мыши. Индуцированные β-клетки близко напоминали первичные β-клетки и вырабатывали инсулин. Кроме того, они смогли улучшить гипергликемию в модели диабетической мыши. Впоследствии,
Таблица. Способы трансдифференцировки In Vivo
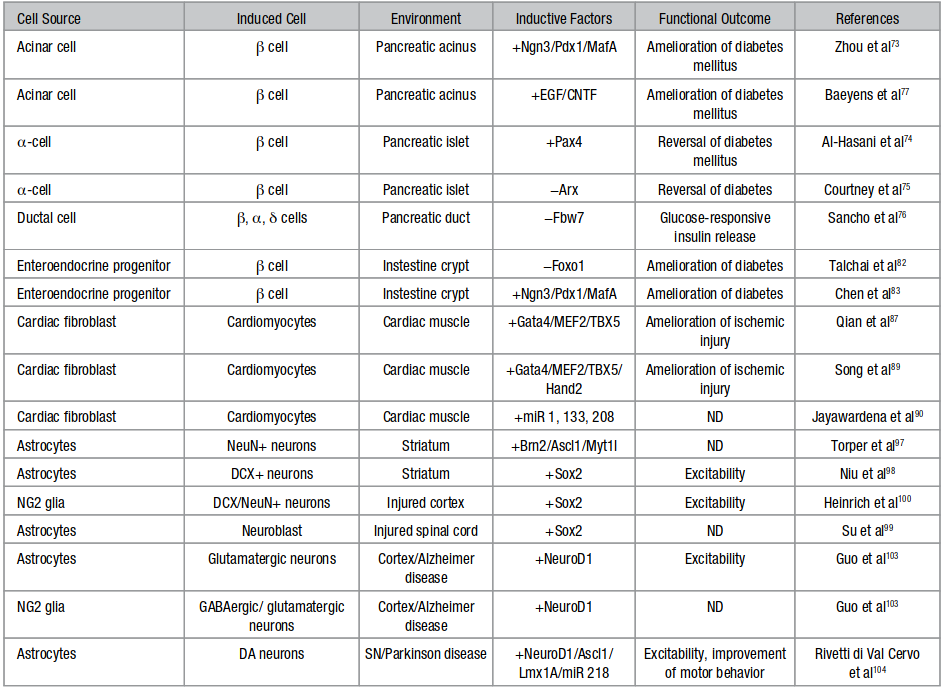
Все исследования проводились in vivo на мышах. DA указывает дофаминергических нейронов; DCX, doublecortin; ND, не определено; NeuN, конкретные нейрональные ядерные маркер; и SN, черной субстанции.
Затем последовала трансдифференцировка других типов не βклеток в β-клетки. Например, Аль-Хасани эт al74 и Кортни эт al75 преобразованы α-клетки, глюкагон-секретирующих клеток островков, в β-клеток у взрослых мышей, экспрессирующих Pax4 или инактивации Аркс, родословная описатели из β и α клеток, соответственно. Дополнительно, панкреатические дуктальные клетки были преобразованы в α, β, и клетки δ (производители соматостатина) в взрослой мыши путем деактивировать Fbw7, компонент опознавания субстрата scf-типа лигазы убиквитина E3.76 эта инактивация включает эндокринную программу путем стабилизации Neurog3, которая необходима для установления эндокринной веры во время развития. Интересно, что недавнее исследование показало преобразование ацинарных клеток в функциональные β-клетки путем транзиторного воздействия цитокинов без какого-либо генетического вмешательства.77 в данном исследовании авторы использовали эпидермальный фактор роста в сочетании с цилиарным нейротрофическим фактором в модели мыши с хронической гипергликемией у взрослых. Де-Ново созданный β клеток epigenetically перепрограммирован с использованием процедуры, предусматривавшей оживление Neurog3. Эта стратегия особенно важна для клинического перевода, потому что она не предполагает использование трансгенов.
Учитывая, что β-клетки сами по себе являются физиологическими единицами для гомеостаза глюкозы в крови, и небольшое их количество является достаточным, экстрапанкреатические области, которые более доступны для манипуляции, чем поджелудочная железа, также были исследованы в качестве источника для индуцирования β-клеток. Например, гепатоциты и эпителиальные клетки кишечника и желчного пузыря были преобразованы в β-клетки in vivo.78-80 эти клетки имеют близкое происхождение развития с β-клетками. Например, энтероэндокринные прародителей, которые находятся в эпителии кишечных крипт уже выражают Neurog3.81 Инактивации транскрипционного фактора Foxo1 в клетках индуцированной экспрессии β-клеточных маркеров, включая инсулин, предполагая, что Foxo1 предотвращает получение β-клеток функции в кишечнике.82 однако индуцированные β-клетки все еще сохраняли некоторые кишечные свойства; таким образом, процесс трансдифференцировки, по-видимому, происходил частично. Тем не менее, более недавнее исследование показало формирование функциональных β-клеточных островков из кишечных энтероэндокринных прародителей in vivo путем принудительной экспрессии факторов транскрипции Pdx1, MafA (и Neurog3).83
Кардиомиоциты
Кардиомиоциты являются функциональными клеточными единицами сердца. Несмотря на жизненно важную роль сердца в поддержании жизни организма, взрослые кардиомиоциты млекопитающих не являются пролиферативными, и, таким образом, сердечная мышца уязвима к травмам.
Хотя предполагаемая популяция сердечных стволовых клеток была зарегистрирована, их значение неуловимо, учитывая, что скорость оборота кардиомиоцитов низка у взрослых млекопитающих.84 поэтому травмы, такие как ишемия, приводят к инфаркту миокарда, характеризующемуся невосполнимой гибелью кардиомиоцитов и дегенерацией сердечной ткани. Фактически, ишемическая болезнь сердца является основной причиной смерти во всем мире, согласно докладу Всемирной организации здравоохранения за январь 2017 года. Вместо регенерации дегенерированная ткань заменяется образованием фиброзной рубцовой ткани, функция которой заключается в запечатывании травмы и предотвращении дальнейшего повреждения оставшейся ткани.85 однако рубцовая ткань не выполняет физиологическую функцию, такую как ритмическое сокращение, и, кроме того, ограничивает функцию остальной функциональной ткани. Поэтому, возможность преобразовывать ткань шрама в функциональную ткань технологиями перепрограммировать широко была последована.
Прямое преобразование сердечных фибробластов в кардиомиоцит-подобные клетки была достигнута первая в vitro86 и позже в vivo87 группы Шривастава через принудительное выражение сердечной линии спецификаторы. Путем выражать Gata4, Mef2, и Tbx5 (GMT), Ieda et al86 сперва показали преобразование ≤20% сердечных фиброцитов в α-mhc (цепь myosin тяжелую)– положительные клетки. Созданный кардиомиоцит-подобные клетки выразил кардиомиоцитов-специфических маркеров и показали сходную экспрессию генов и эпигенетические профили в качестве первичных кардиомиоцитов при продувке соответствующие молекулярные профили фибробластов. Однако, только небольшой процент перепрограммированных фибробластов показал сужение после самопроизвольного созревания ин витро. Тем не менее, клетки, пересаженные на следующий день после трансдукции в инфарктное мышиное сердце, эффективно дифференцируются в кардиомиоциты, указывая на стимулирующую роль физиологической среды в перепрограммировании, возможно, из-за наличия в микроокружении специфических сигналов. Поэтому заманчиво предположить, что перепрограммирование in vivo может быть даже более эффективным, чем in vitro. Действительно, экспрессия GMT непосредственно в инфарктной мыши превращала резидентные фибробласты в функциональные кардиомиоциты.87 индуцированные кардиомиоциты демонстрировали нормальную сборку саркомера и профиль экспрессии генов, сходный с первичными кардиомиоцитами, производили потенциалы действия и реагировали на электрические стимулы сокращением. Примечательно, что перепрограммированные клетки демонстрировали электрическую связь, указывая на то, что они успешно интегрировались в ткань. Анализ временного курса показал, что частично перепрограммированные индуцированные кардиомиоциты созревали во времени. Важно, животные которые прошли сердечный перепрограммировать показали уменьшенное сердечное ≤ дисфункции 3 месяца столб-ушиба. В целом, эти результаты не только показывают, что клетки могут быть перепрограммированы in vivo, но и окружающая среда может увеличить этот процесс и стимулировать тканевую интеграцию клеток de novo.
После этих наблюдений были разработаны различные модификации коктейля GMT для дальнейшего повышения эффективности перепрограммирования. Эти стратегии включены дополнение или изменение в Lineage-специфических транскрипционных факторов,88,89 оптимизации условий культуры,90 или дополнять с мал-молекулы compounds90,91 и miRNAs90, связанных со спецификацией сердца.
Например, Song et al89 обнаружили, что добавление сердечного фактора транскрипции, Hand2, к коктейлю GMT (GHMT) повысило эффективность перепрограммирования in vitro и in vivo. Jayawardena et al90 показали, что in situ введение miRNAs 1, 133, 208 и 499 в ишемический миокард мышей было достаточным для перепрограммирования сердечных фибробластов в кардиомиоциты. Это ободряет для клинического перевода потому что miRNAs может более охотно быть поставлено nonintegrating переходными стратегиями по отношению к факторам транскрипции изза их малого размера, делая ими apt кандидатов для терапевтических целей.
Нейроны
Неврологические расстройства включают в себя широкий круг заболеваний, которые вызывают серьезные отклонения с высокой влияние на ее качество и создают все большую нагрузку, в условиях стареющего общества. Например, болезнь Альцгеймера входит в топ-10 причин смерти во всем мире (Всемирная организация здравоохранения, январь 2017 г.). Исследования по трансплантации фетальных клеток дали чрезвычайно изменчивые и неудовлетворительные результаты у пациентов с нейродегенеративными заболеваниями, требуя альтернативных стратегий для повторного заполнения нейронов, потерянных в этих условиях.92-94 учитывая, что сложный характер центральной нервной системы затрудняет инвазивные процедуры, терапевтические стратегии, основанные на подходах in vivo, очень желательны.
В-виво трансдифференцировка мозг-резидентных не-нейрональных клеток в нейроны была сообщена несколькими групп. Например, перициты и клетки глии, таких как астроциты и глиальные НГ2 были успешно преобразованы в нейроны.95 в отличие от нейронов, эти клетки являются пролиферативными при определенных условиях, и, таким образом, они могут быть заменены гомеостатической пролиферацией, когда тратятся на преобразование.96 например, принудительная экспрессия Brn2, Ascl1 и Myt1l в паренхиматозных астроцитах в стриатуме превратила их в нейроны, идентифицированные нейрональным специфическим ядерным маркером NeuN.97 последующие исследования показали, что даже одиночных факторов транскрипции может быть достаточно, чтобы направить glia в нейрональную судьбу. Например, принудительное выражение только Sox2, а спецификатор нейроэктодермальное происхождение, превратили стриарные астроцитов в пролиферативной doublecortinположительный нейробластов-подобных клеток.98 однако эти нейробласты не могли дифференцироваться без эктопического стимула, который направляет их нейрональную дифференцировку. Аналогичные наблюдения были зарегистрированы в спинном мозге99 и коре головного мозга 100,где Sox2 использовался для индуцирования нейроноподобных клеток из реактивных астроцитов и NG2 glia, соответственно. Это значительно потому что эти неврологические места показывают меньше пластичности чем стриатум и, таким образом, они более уязвимы к повреждению. В частности, большинство неврологических нарушений связано с коры головного мозга. Поэтому существует большой интерес к определению регенеративных стратегий, ориентированных на эти регионы. Интересно, что вызванное Sox2 нейрональное преобразование в коре головного мозга требовало наличия локальной травмы, 100 поддерживая идею о том, что повреждение ткани и связанные с ним воспалительные реакции обеспечивают сигналы, которые повышают клеточное перепрограммирование.101 следовательно, в отличие от in vitro, где условия определены, in vivo клеточное перепрограммирование происходит в сложной среде неповрежденной ткани, что может потребовать кондиционирования или перепрограммирования физиологической ниши.
Хотя описанные выше исследования являются доказательством концепции исследований, выполненных в мыши, первичные перициты, изолированные от коры головного мозга человека, также были преобразованы в нейроны in vitro с помощью Sox2 и Mash1 (нейрональный спецификатор).102 преобразованные клетки обладают потенциалом действия и являются синаптическими мишенями для других нейронов, усиливая возможность использования перицитов в качестве источника клеток в клиниках.
Кроме того, Guo et al103 обнаружили, что одного только фактора транскрипции NeuroD1 было достаточно для перепрограммирования реактивных астроцитов и ng2 glia в функциональные нейроны в модели мыши болезни Альцгеймера. В этом исследовании, в частности астроциты породило глутаматергические нейроны, а НГ2 клетках превращается в глутаматергической и ГАМК-ергических нейронов, указывая на важность происхождения исходной клетки. Однако одной из самых сложных проблем в области перепрограммирования является генерация специфических типов нейронов, погибших из-за нейродегенеративных заболеваний, таких как дофаминергические нейроны, потерянные при болезни Паркинсона. Недавно, эти нейроны также наведенная на месте от стриарные астроцитов.104 важно отметить, что индуцированные дофаминергические нейроны спонтанно созревали и улучшали моторные симптомы в мышиной модели болезни Паркинсона. Кроме того, авторы продемонстрировали, что та же стратегия была успешной в преобразовании астроцитов человека в индуцированные допаминергические нейроны in vitro, предлагая потенциальное терапевтическое использование этой технологии in vivo.
В целом, стратегии трансдифференцировки in vivo являются терапевтическими подходами, которые направлены на отмену возрастной дегенерации и, таким образом, дополняют внутреннюю регенерационную способность. Дополнительно, перепрограммировать можно потенциально использовать для того чтобы увеличить внутреннеприсущую регенеративную емкость индивидуалов (диаграммы 2).
Перепрограммировать регенеративную емкость
Важность регенеративного потенциала можно оценить по тому факту, что регенеративные сбои вызывают снижение целостности тканей, что по сути является гистологическим проявлением старения.105-107 аналогичным образом старение связано со снижением регенерационной способности.16,108,109 таким образом, ключом к увеличению продолжительности жизни может быть повышение способности к регенерации. Хотя все живые существа обладают способностью к регенерации, их способность колеблется в широких пределах.110 у млекопитающих способность к регенерации в значительной степени ограничена уровнем тканей, и биологические единицы более высокого порядка не регенерируют.111 например, кроветворные клетки и мезенхима соединительной ткани, эпителиальная и мышечная часть органов, а также некоторые нервные ткани центральной нервной системы могут повторно заселяться при потере. Однако органы, состоящие из нескольких типов тканей и создающие еще более сложные биологические системы, подвергаются восстановлению только после травмы, чтобы препятствовать дальнейшей функциональной потере и, самое большее, чтобы компенсировать потерю.112 напротив, многие филогенетически низших животных, таких, как планарии, hydractinia, и низших позвоночных наделены большой способностью регенерации, реформируя органы, биологические системы, или даже целые организмы после травмы. Одно из объяснений филогенетических различий в регенерации заключается в том, что регенерационная способность снизилась во время эволюции млекопитающих. Примером этого является регенерация придатков.Сто тринадцать.
Например, fish114 и salamanders115 могут полностью регенерировать свои придатки после ампутации на протяжении всей жизни, тогда как лягушки образуют простой хрящевой выступ, называемый шип, лишенный цифр.116 напротив, рептилии, птицы и млекопитающие не образуют какой-либо части конечности, ампутированной за ногтевым ложем.117-119 таким образом, восстановление утраченных регенеративных механизмов у млекопитающих может наделить их повышенной регенеративной способностью, наблюдаемой у филогенетически низших животных. Что отличает эти организмы от млекопитающих?
Планарии и hydractinia содержать тотипотентные/плюрипотентных стволовых клеток, распределенных по всему телу. Эти высокоемкие стволовые клетки мигрируют к месту повреждения и дают начало всем пропавшим этапам, таким образом восстанавливая биологический заказ.120,121 у земноводных и рыб, дифференцированные клетки рядом с dedifferentiate травмы в смесь из происхождение конкретных прародителей или multipotential стволовых клеток, чтобы сформировать multipotential мезенхимальной ткани называют бластемой.122,123 это травмы, вызванной пластик ткань регенерирует недостающие рисунком структуры, соответственно порождая все ткани в нем, такие как мышцы, хрящи, кости, и сухожилия во время регенерации придатка через процесс, называемый эпиморфозом.124,125 у млекопитающих, плюрипотентные стволовые клетки и blastemas обычно не встречается вне эмбриогенеза или возобновиться после травмы. Они в значительной степени зависят от стволовых/прогениторных клеток с ограниченной способностью к регенерации. Эти специализированные клетки дают начало дифференцированным клеткам только их соответствующей ткани.126 например, гемопоэтические стволовые клетки (ГСК) поддерживают оборот гемопоэтической ткани во время гомеостаза и при острой кровопотере, тогда как кишечные стволовые клетки генерируют эпителий кишечника. Это достигается асимметричным делением стволовой клетки, что приводит к тому, что одна дочерняя клетка совершает дифференцировку, а другая остается стволовой клеткой для поддержания пула стволовых клеток.127 совершенная клетка подвергается последовательным делениям, которые приводят к иерархическому образованию клеток-предшественников линии, которые в конечном итоге образуют типы клеток, образующие соответствующую ткань. Хотя индуцированная травмой дедифференцировка наблюдалась в эпителии нескольких органов, способность к редифференцировке ограничена образованием только эпителиальной ткани органа.128-130 таким образом, обширная регенерационная способность коррелирует с возникновением высокопластичных клеточных состояний, которые отсутствуют у взрослых млекопитающих, и ключом к превосходной регенерации может быть наличие типа пластической клетки и способность индуцировать такую пластичность.
Преобразование дифференцированных клеток в iPSCs предполагает, что пластические состояния теперь могут быть индуцированы у млекопитающих 4F. Действительно, доказательство показывает что 4F наводит dedifferentiation возмужалых клеток последовательно через время водя к stepwise образованию прародителей. Это постепенное dedifferentiation соединено с прогрессивным увеличением в потенциале redifferentiation прежде чем положение pluripotency достигается. Например, преобразование fi-бробластов, производной мезодермы, в iPSCs происходит в течение 3-4 недель in vitro, 131 и в ходе этого процесса сначала теряются соматические признаки, за которыми следует реактивация паттернов развития (например, маркеры мезендодермы) до появления эпибластоподобных плюрипотентных признаков.35,132,133 прерывая этот процесс после 8 дней преобразование фибробластов в промежуточный, мезодерма, как государство, не достигнув плюрипотентности.134,135 также, 4F экспрессия in vivo вызывает образование тканеспецифичных предшественников развития в нескольких органах до появления iPSCs.132
Интересно, что 4F или связанные с ним факторы плюрипотентности естественным образом выражаются в некоторых организмах, которые показывают высокую регенерационную способность, либо в резидентных пластиковых клетках, которые опосредуют регенерацию, либо при дедифференцировании в такое состояние во время регенерации.136-138 учитывая, что 4F индуцирует эпигенетические изменения на молекулярном уровне, которые преобразуют клеточные характеристики в более пластичное состояние, результатом на тканевом уровне может быть усиление регенерации, что в конечном итоге приводит к замедлению старения на организменном уровне. Если это так, это будет означать, что регенерационная способность и долговечность могут быть перепрограммированы путем индуцирования клеточной пластичности посредством эпигенетического перепрограммирования. Действительно, мы наблюдали что способность 4Ф перепрограммировать эпигеном сопоставляет с гистологическими улучшениями в множественных органах в мышах прогерии как кожа, живот, хандра, и почки параллельно к торможению вызревания. В частности, agingrelated сердечно-сосудистая недостаточность, а также ведущей причиной смерти в прогерии,139 частично спасали, о чем свидетельствует увеличение числа ядер в медиальный слой аорты (Рис. 3А против 3Б). Эти наблюдения показывают, что экспрессия 4F улучшает гомеостаз тканей, подавляя дегенерацию или улучшая регенерацию. Однако, учитывая, что прогерия-это системное заболевание, связанное с симптомами старения, а не модель естественного старения, можно утверждать, что наблюдаемые гистологические изменения могут быть косвенный эффект 4Ф выражение на больной мыши (рис. 3). Как таковой, любое улучшение в физиологии биологического блока внутри организм может повлиять на физиологию других блоков. Например, вызванное 4Ф сердечнососудистое улучшение может восстановить внутрирастительный баланс, таким образом вызывающ глобальное физиологопсихологическое улучшение в теле и таким образом расширяющ продолжительность жизни мышей прогерии.
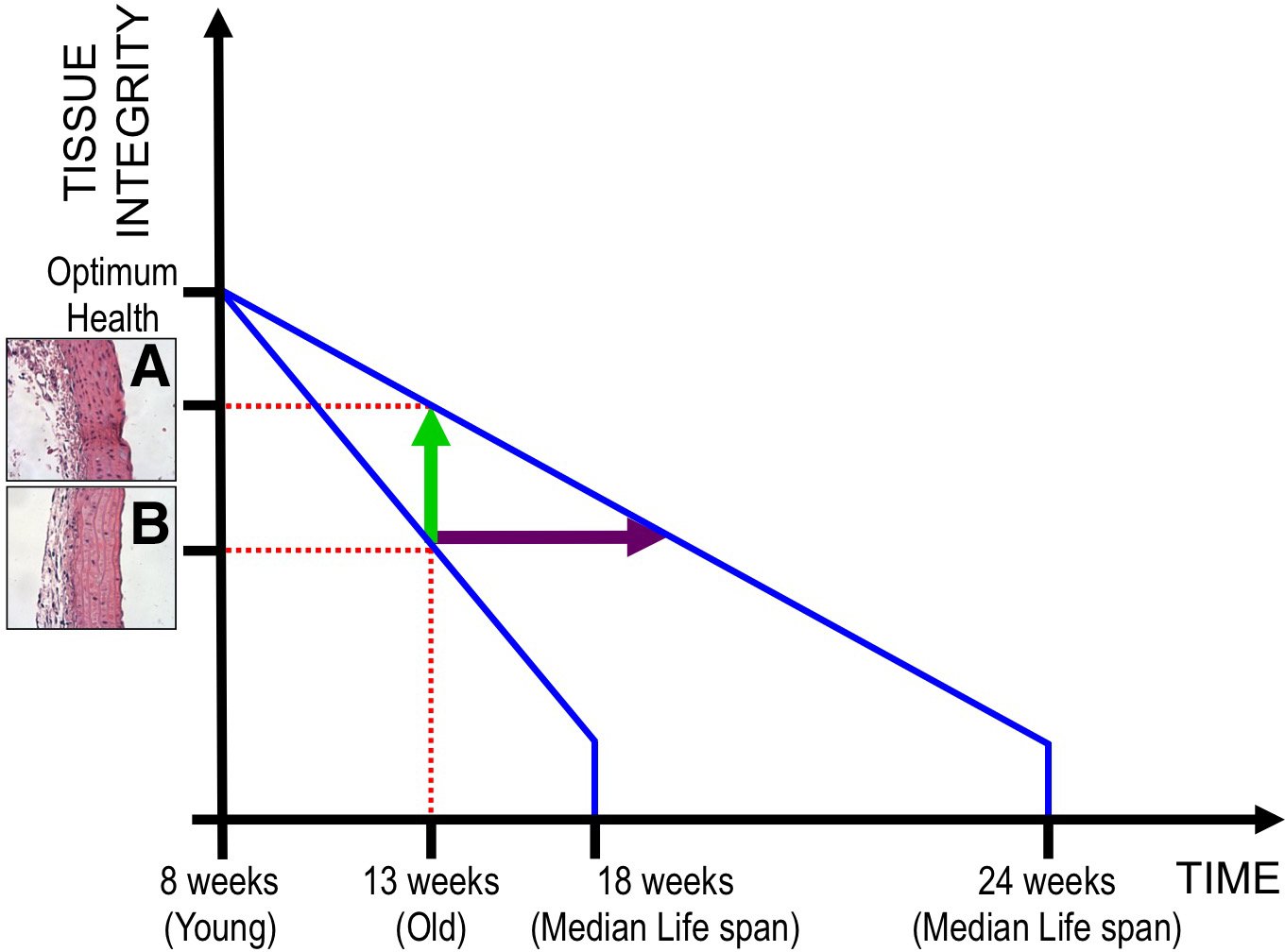 Рис.3. Обратная корреляция между целостностью ткани и возрастом. Прерывистое выражение 4F (OCT4, KLF4, SOX2, и c-Myc) на фоне прогерии от 8 wk и далее увеличивает среднюю продолжительность жизни с 18 до 24 wk. Более здоровая морфология тканей наблюдается при режиме 4F при 13 wk (A), который считается выдержанным для фоновых мышей progeria (B). Улучшения на жизненном периоде и целостности ткани могут иметь 2 объяснения: режим 4Ф улучшает целостность ткани (зеленая стрелка) путем увеличивать регенерацию и таким образом ослабляет вызревание. Альтернативно, оно расширяет жизненный период (пурпуровую стрелку) путем влиять на другие аспекты вызревания как старени-связанные воспалительные реакции, метаболизм, neuroendocrinological ритм, гомеостазирование протеина, свободные радикалы, и повреждение дна и таким образом ослабляет ухудшение качества ткани.
Рис.3. Обратная корреляция между целостностью ткани и возрастом. Прерывистое выражение 4F (OCT4, KLF4, SOX2, и c-Myc) на фоне прогерии от 8 wk и далее увеличивает среднюю продолжительность жизни с 18 до 24 wk. Более здоровая морфология тканей наблюдается при режиме 4F при 13 wk (A), который считается выдержанным для фоновых мышей progeria (B). Улучшения на жизненном периоде и целостности ткани могут иметь 2 объяснения: режим 4Ф улучшает целостность ткани (зеленая стрелка) путем увеличивать регенерацию и таким образом ослабляет вызревание. Альтернативно, оно расширяет жизненный период (пурпуровую стрелку) путем влиять на другие аспекты вызревания как старени-связанные воспалительные реакции, метаболизм, neuroendocrinological ритм, гомеостазирование протеина, свободные радикалы, и повреждение дна и таким образом ослабляет ухудшение качества ткани.
Поэтому, хотя до сих пор не ясно, может ли 4F продлить срок жизни мышей дикого типа, Мы проверили его влияние на восстановление пожилых мышей дикого типа от острых травм.47 мы наблюдали, что лечение 4F коррелировало с лучшим гистологическим ответом в поджелудочной железе и мышцах со скоростью, подобной молодой, предполагая, что их регенеративная способность была омоложена. Заметно, эксперименты по ушиба мышцы были основаны на местной активации, предлагая что влияние 4F сразу.
Как может перепрограммируя влияние 4F на клетчатом уровне материализовать как увеличенная регенерация на уровне ткани? Потому что стволовые клетки главные водители целостности ткани, 4Ф могло противодействовать высасывание бассейна стволовой клетки который происходит во время вызревания.140 истощение стволовых клеток, связанное со старением, может быть вызвано уменьшением количества стволовых клеток, и, таким образом, повторное заполнение пула стволовых клеток может, в свою очередь, омолодить ткань. Например, мышечных стволовых cells141 и нейральные стволовые cells142 уменьшаться при старении в связи с сокращением мышц и когнитивных функций, соответственно. Интригующе, принудительное выражение 4F увеличивает число стволовых клеток мышцы, хотя физиологопсихологический исход этого расширения неуловим.47 подобно количественному снижению, истощение пула стволовых клеток может быть вызвано снижением потенциала стволовых клеток143, и возвращение этого потенциала в молодое состояние может, в свою очередь, вызвать омоложение тканей. Например, старый костный мозг содержит больше задействуя, активированных HSCs, которые показывают функциональные дефекты как неэффективность в самонаводить к hematopoietic niche144 и миелоидн-смещению за счет лимфоидного происхождения.145-147 снижение лимфоидного потенциала пула ГСК является одной из причин, лежащих в основе иммунодефицита, наблюдаемого у пожилых людей. Эти связанные со старением фенотипы коррелируют с различными эпигенетическими изменениями в ГСК. Например, промоутеры ключевых транскрипционных факторов, участвующих в спецификации кроветворной Lineage и мишенью гистон метилтрансферазы PRC2 не hypermethylated при старении параллельно с развитием дисбаланса myelolymphoid.148,149 в корреляции, возмущение регуляторов МЕТИЛИРОВАНИЯ ДНК, таких как DNMTs (ДНК-метилтрансферазы)150 и Tet2 (Ten-eleven translocation-2) 151,152 у мышей вызывает миелоидное смещение, и эти ферменты дифференцированно выражены между молодыми и старыми HSCs.21,25 также, мышечные стволовые клетки теряют обратимое успокоение во время старения параллельно со снижением регенерации мышц.153 этот фенотип частично обусловлен прогрессирующей потерей двухвалентных доменов гистона 3 (H3K4me3 и H3K27me3) в промоторах генов поддержания стволовых клеток.154 интересно, что принудительная экспрессия эпигенетически ассоциированных ферментов, Сиртуинов 3 и 7, в возрасте HSCs уравновешивает их миелолимфоидный потенциал, приводя к сбалансированному составу гемопоэтической ткани, как в молодом.155,156 в дополнение, насыщенности этого Сиртуина кофактора над+ улучшает функцию мышцы стволовые клетки, нейральные стволовые клетки, и меланоцитных стволовых клеток старых мышей параллельно физиологические улучшения и продления жизни.157 эти наблюдения свидетельствуют о том, что эпигенетическая дисрегуляция стволовых клеток, связанная со старением, препятствует тканевому гомеостазу. Таким образом, 4F может оказывать регенеративный эффект путем сброса эпигенетических часов стволовых клеток. Дополнительно, были показаны, что регенерируют некоторые ткани mammalian недавно через преобразования судьбы клетки после акутового ушиба.
Например, почечный эпителий восстанавливается от мелких острых травм через дифференцировке, пролиферации и redifferentiation заполнять нефронов; однако нефронов потерявший из-за ранения не реформа.130,158,159 по крайней повреждение панкреатических β-клеток, α160 и cells161 δ привести к β клеток на мышь. Точно так же паренхиматозные астроциты в стриатуме мозга спонтанно приобретают нейронные стволовые клеточные характеристики после строки162 или колотой раны.163 увеличение таких преобразований клеточной судьбы, которые естественным образом происходят у млекопитающих путем экспрессии 4F, может повысить регенеративную способность соответствующей ткани, тем самым продлевая продолжительность жизни.
Следует также отметить, что факторы, отличные от 4F, также были запрошены для их регенеративного потенциала. Главная стратегия за этими факторами repopulate ткань путем наводить пролиферацию резидентных продифференцированных клеток. Например, Гиппопотам контролирует Размер органов, регулируя пролиферацию клеток и апоптоз, а также участвует в регенерации мухи disc164 и плавника зебрафа.165 сверх того, своя модуляция может повысить mammalian сердечную регенерацию путем наводить проживающие кардиомиоциты для того чтобы reenter митоз.166 также, мы выявили программу, регулируемую микрорнк, которая естественным образом индуцирует дедифференцировку кардиомиоцитов zebrafish при регенерации сердца и показала, что ее принудительная активация в инфарктном мышином сердце индуцирует регенерацию через дедифференцировку кардиомиоцитов.167 подобные филогенетические сравнения показали, что urodele регенерации конечности амфибий определяется homeodomain белка, Msx1 (МШ homeobox 1). Этот миогенный фактор транскрипции не только выражается в почке конечности во время развития, но и активируется во время регенерации конечности168, где это, повидимому, необходимо для дедифференцировки миофиберов.169 следовательно, уродельские амфибии возобновляют свою программу развития после ампутации конечностей. Экспрессия Msx1 ограничена развитием конечностей у млекопитающих, 170 но ее принудительное выражение в мышиных миотубах также индуцирует их дедифференцировку.171 в целом эти примеры подчеркивают важность изучения филогенетически низших организмов, обладающих высокой регенерационной способностью.
Дальнейшая перспектива
Хотя последние три десятилетия показали огромное понимание природы клетки и того, как ею можно манипулировать in vitro, перевод полученных результатов в in vivo перепрограммирование все еще находится на заре. В организме человека насчитывается около 200 типов клеток,172, и мы экспериментировали, чтобы вызвать только несколько из них. Существует множество барьеров, которые необходимо преодолеть, чтобы перевести исследования трансдифференцировки в клиники. Вопервых, источник ячейки, который будет предназначен для перепрограммирования на нужный Тип ячейки, должен быть определен с умом, поскольку он потеряет свою функцию. Клетки соединительной ткани, такие как фибробласты, кажутся лучшими кандидатами. Они многочисленнѕр и общий в каждом органе, и их роль supportive для необходимой физиологии органа. Фибробласты являются пролиферативными и, таким образом, могут пополнять свою популяцию, потерянную для перепрограммирования. Их сократительная форма, миофибробласты, по существу, является причиной образования нефункциональной и неадаптивной рубцовой ткани, когда они не устраняются после восстановления травмы.Сто семьдесят три.
Во-вторых, эффективное функционирование клеток, индуцированных по-прежнему вызывает озабоченность, несмотря на микроокружение в тканях способствует функциональному созреванию клеток индуцированной относительно экстракорпорального перепрограммирования.174 как мы видели, каждое исследование добавляет Предыдущее, и платформа in vitro по-прежнему оказывается лучшей установкой для определения факторов для начала. Поэтому, только вопрос времени и больше скрининга который обеспечит оптимальный коктейль факторов необходимых для каждого типа клетки. В-третьих, интеграция индуцированной клетки в функцию ткани является сложной задачей, особенно в больной обстановке, где состав ткани уже был нарушен из-за неправильного восстановления по умолчанию, что вызывает накопление рубцовой ткани. В таких условиях могут применяться реконструктивные подходы, дополняющие перепрограммирование in vivo. Например, больная область может быть удалена хирургическим путем или обусловлена матричными металлопротеиназами, что позволяет перепрограммированным клеткам заселять иссеченную область. Такие реконструктивные подходы оказались успешными, чтобы сделать целевую область более восприимчивой к клеточной трансплантации studies175-177 и, таким образом, могут также способствовать тканевой интеграции in situ индуцированных клеток. Дополнительно, biodegradable ремонтину которая передразнивает естественную внеклеточную матрицу можно трансплантировать в вырезанную область.178 эшафот ожидается деградировать, как перепрограммировать клетки заложить их естественного внеклеточного матрикса.
Рассмотренные здесь исследования, особенно те, которые относятся к in situ индуцированных клеток в условиях травмы, демонстрируют потенциал in vivo перепрограммирования для повышения healthspan, и, в свою очередь, продолжительность жизни людей. Однако, стенд ктумбочка перевод набор-обратно из видовых отличий. Это было ясно проиллюстрировано на рубеже веков испытаниями генной терапии, святым граалем того времени. Несмотря на многообещающие данные в доклинических исследованиях, в которых участвовали мыши и даже нечеловеческие приматы, клиническое исследование привело к летальному исходу для пациента и значительно изученному полю генной терапии из-за различной реакции, которую человеческие пациенты вызвали к процедуре относительно моделей животных.179,180 возможно ли, что доклинические исследования являются всего лишь шагами в области регенеративной медицины к ее концу в клиниках? Это особенно важно, учитывая, что почти все перепрограммирующие события связаны с генетическими вмешательствами. Технический барьер поставлять индуктивные факторы окончательно будет отжат с выдвижениями в полях генной терапии 181,182 и nanoengineering.183 кроме того, между различными видами могут существовать внутренние клеточные различия. Это хорошо иллюстрируется индукцией кардиомиоцитов из фибробластов. Хотя GHMT индуцирует кардиомиоциты с функциональными свойствами из мышиных фибробластов, 89 эта комбинация была неэффективна для фибробластов человека и требовала дополнительных факторов и дальнейшей модификации.184-187 поэтому индуктивные факторы могут различаться между моделями животных и людьми. Подтверждение или оптимизирование на людских клетках или organoids или в humanized животных моделях могут соединить preclinical изучения к клиническим испытаниям. С другой стороны,перепрограммируя сила 4F или своих производных кажется,что будет всеобща потому что они были показаны,что будут эффективны на клетках лягушек,188 рыб,189 птиц, 189, 190 мух, 189 и ряда млекопитающих.191,192 таким образом, индукция пластического клеточного состояния путем переходной экспрессии 4F или аналогичных индуктивных факторов может быть универсальным подходом среди всех видов для in vivo перепрограммирования каждого типа клеток.
Клеточная пластичность-обоюдоострый меч. Несмотря на то, что высокая пластичность коррелирует с высокой регенерационной способностью, она также повышает вероятность возникновения опухоли. Например, запоздалое содержание плюрипотентных клеток вне беременности вызывает тератомы у млекопитающих.193 трансплантация плюрипотентных клеток или их индукция in vivo длительной экспрессией 4F194 также вызывает образование тератомы у мыши, указывая на то, что неконтролируемая экспрессия перепрограммирующих факторов может быть катастрофической. Тем не менее, темпоральный контроль экспрессии 4F может уточнить индуцированную пластичность и ограничить риск возникновения опухоли. Таким образом, соматическая клетка приобретает пластичность своего развивающегося предшественника, а потенциал этой пластичности пропорционален степени индукции. Например, хотя более 8 дней экспрессии in vivo 4F индуцирует образование тератомы, от 4 до 7 дней экспрессии вызывает тканеспецифические дисплазии, 132 и 2 дней индукции достаточно для эпигенетического омоложения без образования новообразований.47 кроме того, в Lineage спецификаторы могут быть применены на месте, как факторы водителю прямые redifferentiation индуцированной прародителей.
До сих пор не ясно, как влияет молекулярный профиль клетки, включая эпигенетический ландшафт, во время in vivo перепрограммирования. Выяснение молекулярной дорожной карты in vivo 4F-индуцированного перепрограммирования мыши может улучшить наше понимание возможностей и факторов риска использования этой технологии для регенеративной медицины. Например, сравнение молекулярной динамики различных типов клеток, таких как производные различных зародышевых слоев, подвергающихся перепрограммированию, может указывать на молекулярные механизмы, лежащие в основе перепрограммирования in vivo, независимо от типа клетки и того, какие генные схемы могут стимулировать или антагонизировать его. Такая молекулярная сигнатура может быть использована для прогнозирования исхода in vivo перепрограммирования других типов клеток и определения маркеров и времени промежуточных пластических состояний на пути к плюрипотентному состоянию. Оно может также помочь определить любой связанный риск активации онкогена. Идентификация молекулярных путей и их динамики во время in vivo перепрограммирования в конечном итоге позволит нам контролировать эти схемы для более безопасных, надежных и эффективных стратегий перепрограммирования in vivo.
Хотя терапевтическое влияние 4F на мышах progeria и акутовых ушибах обсуженных здесь замечательно, мы не видели самое лучшее его пока. Мы пока не знаем, могут ли 4F или аналогичные факторы перепрограммирования продлить срок жизни диких животных. Кроме того, мы не знаем механистических деталей 4F-индуцированных гистологических улучшений в моделях травмы поджелудочной железы и мышц или 4F может быть эффективным в условиях травмы, кроме поджелудочной железы и мышц. Следующие несколько лет обязательно увидят влияние 4F на продолжительность жизни моделей дикого типа и на параметры травмы, которые включают механизмы регенерации, опосредованные стволовыми клетками или преобразованиями клеток. Учитывая недавний прогресс в выявлении химических веществ, которые могут boost195 или даже replace196,197 4Ф в пробирке, мы предполагаем, что результаты связанные с 4Ф тоже в конечном итоге приводят к безопасной химической основе терапевтической стратегии в регенеративной медицине, которое позволит сместить акцент с инвазивной заместительной терапии для регенерации ориентированным на самовосстановление. Таким образом, победа в перетягивании каната с энтропией имеет значительные клинические последствия для облегчения необходимости трансплантации органов и, таким образом, окажет непосредственное влияние на стареющее общество.
Источники финансирования
E. Beyret была частично поддержана Фондом Катарина. П. М. Редондо был частично поддержан Фондом Альфонсо Мартина Эскудеро. A. P. Luengo была частично поддержана Фондом Хьюитта. Работа в лаборатории J. С. И. Бельмонте поддерживается г. Гарольд и Лейла е. Мэтерс Благотворительный Фонд, Мокси Фонд Леоны М. и Гарри Б. Хелмсли Благотворительный фонд, CIRM-CESCG, национальные институты здоровья (П21 AG055938), католический Университет Сан-Антонио-де-Мурсия, исследовательский Фонд Прогерии, и Гленн Фонда.
Ссылки на литературу
Ссылки на литературу
1.Christensen K, Doblhammer G, Rau R, Vaupel JW. Ageing populations: the challenges ahead. Lancet. 2009;374:1196–1208. doi: 10.1016/ S0140-6736(09)61460-4.
2.Boss GR, Seegmiller JE. Age-related physiological changes and their clinical significance. West J Med. 1981;135:434–440.
3.Ackermann M, Stearns SC, Jenal U. Senescence in a bacterium with asymmetric division. Science. 2003;300:1920. doi: 10.1126/science. 1083532.
4.Stewart EJ, Madden R, Paul G, Taddei F. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS Biol. 2005;3:e45. doi: 10.1371/journal.pbio.0030045.
5.Wood JG, Rogina B, Lavu S, Howitz K, Helfand SL, Tatar M, Sinclair D. Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature. 2004;430:686–689. doi: 10.1038/nature02789.
6.Lin K, Hsin H, Libina N, Kenyon C. Regulation of the Caenorhabditis elegans longevity protein DAF-16 by insulin/IGF-1 and germline signaling. Nat Genet. 2001;28:139–145. doi: 10.1038/88850.
7.Kwon YY, Lee SK, Lee CK. Caloric restriction-induced extension of chronological lifespan requires intact respiration in budding yeast. Mol Cells. 2017;40:307–313. doi: 10.14348/molcells.2017.2279.
8.Melov S. Geroscience approaches to increase healthspan and slow aging. F1000Res;5.
9.Hansen M, Kennedy BK. Does longer lifespan mean longer healthspan? Trends Cell Biol. 2016;26:565–568. doi: 10.1016/j.tcb.2016.05.002.
10.Crimmins EM. Lifespan and healthspan: past, present, and promise. Gerontologist. 2015;55:901–911. doi: 10.1093/geront/gnv130.
11.Booth LN, Brunet A. The aging epigenome. Mol Cell. 2016;62:728–744. doi: 10.1016/j.molcel.2016.05.013.
12.Kreiling JA, Tamamori-Adachi M, Sexton AN, Jeyapalan JC, Munoz- Najar U, Peterson AL, Manivannan J, Rogers ES, Pchelintsev NA, Adams PD, Sedivy JM. Age-associated increase in heterochromatic marks in murine and primate tissues. Aging Cell. 2011;10:292–304. doi:
10.1111/j.1474-9726.2010.00666.x.
13.Feser J, Tyler J. Chromatin structure as a mediator of aging. FEBS Lett.
2011;585:2041–2048. doi: 10.1016/j.febslet.2010.11.016.
14.Kim J, Kim KM, Noh JH, Yoon JH, Abdelmohsen K, Gorospe M. Long noncoding RNAs in diseases of aging. Biochim Biophys Acta. 2016;1859:209–221. doi: 10.1016/j.bbagrm.2015.06.013.
15.Inukai S, de Lencastre A, Turner M, Slack F. Novel microRNAs differentially expressed during aging in the mouse brain. PLoS One. 2012;7:e40028. doi: 10.1371/journal.pone.0040028.
16.Sousounis K, Baddour JA, Tsonis PA. Aging and regeneration in vertebrates. Curr Top Dev Biol. 2014;108:217–246. doi: 10.1016/ B978-0-12-391498-9.00008-5.
17.Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126:663–676. doi: 10.1016/j.cell.2006.07.024.
18.Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007;131:861–872. doi: 10.1016/j. cell.2007.11.019.
19.Robbins RD, Prasain N, Maier BF, Yoder MC, Mirmira RG. Inducible pluripotent stem cells: not quite ready for prime time? Curr Opin Organ Transplant. 2010;15:61–67. doi: 10.1097/MOT.0b013e3283337196.
20.Gourronc FA, Klingelhutz AJ. Therapeutic opportunities: telomere maintenance in inducible pluripotent stem cells. Mutat Res. 2012;730:98–105. doi: 10.1016/j.mrfmmm.2011.05.008.
21.Beerman I, Bock C, Garrison BS, Smith ZD, Gu H, Meissner A, Rossi DJ. Proliferation-dependent alterations of the DNA methylation landscape underlie hematopoietic stem cell aging. Cell Stem Cell. 2013;12:413–425. doi: 10.1016/j.stem.2013.01.017.
22.Fraga MF, Ballestar E, Paz MF, et al. Epigenetic differences arise during the lifetime of monozygotic twins. Proc Natl Acad Sci USA. 2005;102:10604–10609. doi: 10.1073/pnas.0500398102.
23.Heyn H, Li N, Ferreira HJ, et al. Distinct DNA methylomes of newborns and centenarians. Proc Natl Acad Sci USA. 2012;109:10522–10527. doi:
10.1073/pnas.1120658109.
24.Horvath S. DNA methylation age of human tissues and cell types. Genome Biol. 2013;14:R115. doi: 10.1186/gb-2013-14-10-r115.
25.Sun D, Luo M, Jeong M, et al. Epigenomic profiling of young and aged HSCs reveals concerted changes during aging that reinforce self-renewal. Cell Stem Cell. 2014;14:673–688. doi: 10.1016/j.stem.2014.03.002.
26.Petkovich DA, Podolskiy DI, Lobanov AV, Lee SG, Miller RA, Gladyshev VN. Using DNA methylation profiling to evaluate biological age and longevity interventions. Cell Metab. 2017;25:954–960.e6. doi: 10.1016/j. cmet.2017.03.016.
27.Stubbs TM, Bonder MJ, Stark AK, Krueger F, von Meyenn F, Stegle O, Reik W; BI Ageing Clock Team. Multi-tissue DNA methylation age predictor in mouse. Genome Biol. 2017;18:68. doi: 10.1186/s13059-017-1203-5.
28.Thompson MJ, vonHoldt B, Horvath S, Pellegrini M. An epigenetic aging clock for dogs and wolves. Aging (Albany NY). 2017;9:1055–1068. doi:
10.18632/aging.101211.
29.Kennedy BK, Gotta M, Sinclair DA, Mills K, McNabb DS, Murthy M, Pak SM, Laroche T, Gasser SM, Guarente L. Redistribution of silencing proteins from telomeres to the nucleolus is associated with extension of life span in S. cerevisiae. Cell. 1997;89:381–391.
30.GURDON JB, ELSDALE TR, FISCHBERG M. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature. 1958;182:64–65.
31.Gurdon JB, Laskey RA, Reeves OR. The developmental capacity of nuclei transplanted from keratinized skin cells of adult frogs. J Embryol Exp Morphol. 1975;34:93–112.
32.Choi J, Lee S, Mallard W, Clement K, Tagliazucchi GM, Lim H, Choi IY, Ferrari F, Tsankov AM, Pop R, Lee G, Rinn JL, Meissner A, Park PJ, Hochedlinger K. A comparison of genetically matched cell lines reveals the equivalence of human iPSCs and ESCs. Nat Biotechnol. 2015;33:1173–1181. doi: 10.1038/nbt.3388.
33.Gaspar-Maia A, Alajem A, Meshorer E, Ramalho-Santos M. Open chromatin in pluripotency and reprogramming. Nat Rev Mol Cell Biol. 2011;12:36–47. doi: 10.1038/nrm3036.
34.Apostolou E, Hochedlinger K. Chromatin dynamics during cellular reprogramming. Nature. 2013;502:462–471. doi: 10.1038/nature12749.
35.Polo JM, Anderssen E, Walsh RM, et al. A molecular roadmap of reprogramming somatic cells into iPS cells. Cell. 2012;151:1617–1632. doi:
10.1016/j.cell.2012.11.039.
36.Buganim Y, Faddah DA, Cheng AW, Itskovich E, Markoulaki S, Ganz K, Klemm SL, van Oudenaarden A, Jaenisch R. Single-cell expression analyses during cellular reprogramming reveal an early stochastic and a late hierarchic phase. Cell. 2012;150:1209–1222. doi: 10.1016/j. cell.2012.08.023.
37.Liang G, He J, Zhang Y. Kdm2b promotes induced pluripotent stem cell generation by facilitating gene activation early in reprogramming. Nat Cell Biol. 2012;14:457–466. doi: 10.1038/ncb2483.
38.Ang YS, Tsai SY, Lee DF, Monk J, Su J, Ratnakumar K, Ding J, Ge Y, Darr H, Chang B, Wang J, Rendl M, Bernstein E, Schaniel C, Lemischka IR. Wdr5 mediates self-renewal and reprogramming via the embryonic stem cell core transcriptional network. Cell. 2011;145:183–197. doi: 10.1016/j. cell.2011.03.003.
39.Mansour AA, Gafni O, Weinberger L, et al. The H3K27 demethylase Utx regulates somatic and germ cell epigenetic reprogramming. Nature. 2012;488:409–413. doi: 10.1038/nature11272.
40.Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell KH. Viable offspring derived from fetal and adult mammalian cells. Nature. 1997;385:810–813. doi: 10.1038/385810a0.
41.Gurdon JB. Adult frogs derived from the nuclei of single somatic cells. Dev Biol. 1962;4:256–273.
42.Kou Z, Kang L, Yuan Y, Tao Y, Zhang Y, Wu T, He J, Wang J, Liu Z, Gao
S. Mice cloned from induced pluripotent stem cells (iPSCs). Biol Reprod. 2010;83:238–243. doi: 10.1095/biolreprod.110.084731.
43.Lapasset L, Milhavet O, Prieur A, Besnard E, Babled A, Aït-Hamou N, Leschik J, Pellestor F, Ramirez JM, De Vos J, Lehmann S, Lemaitre JM. Rejuvenating senescent and centenarian human cells by reprogramming
through the pluripotent state. Genes Dev. 2011;25:2248–2253. doi:
10.1101/gad.173922.111.
44.Mahmoudi S, Brunet A. Aging and reprogramming: a two-way street. Curr Opin Cell Biol. 2012;24:744–756. doi: 10.1016/j.ceb.2012.10.004.
45.Rando TA, Chang HY. Aging, rejuvenation, and epigenetic reprogramming: resetting the aging clock. Cell. 2012;148:46–57. doi: 10.1016/j. cell.2012.01.003.
46.Mertens J, Paquola AC, Ku M, et al. Directly reprogrammed human neurons retain aging-associated transcriptomic signatures and reveal age-related nucleocytoplasmic defects. Cell Stem Cell. 2015;17:705–718. doi:
10.1016/j.stem.2015.09.001.
47.Ocampo A, Reddy P, Martinez-Redondo P, et al. In vivo amelioration of age-associated hallmarks by partial reprogramming. Cell. 2016;167:1719– 1733.e12. doi: 10.1016/j.cell.2016.11.052.
48.Sarg B, Koutzamani E, Helliger W, Rundquist I, Lindner HH. Postsynthetic trimethylation of histone H4 at lysine 20 in mammalian tissues is associated with aging. J Biol Chem. 2002;277:39195–39201. doi: 10.1074/jbc.M205166200.
49.Djeghloul D, Kuranda K, Kuzniak I, Barbieri D, Naguibneva I, Choisy C, Bories JC, Dosquet C, Pla M, Vanneaux V, Socié G, Porteu F, Garrick D, Goodhardt M. Age-associated decrease of the histone methyltransferase SUV39H1 in HSC perturbs heterochromatin and B lymphoid differentiation. Stem Cell Reports. 2016;6:970–984. doi: 10.1016/j.stemcr.2016.05.007.
50.Shumaker DK, Dechat T, Kohlmaier A, Adam SA, Bozovsky MR, Erdos MR, Eriksson M, Goldman AE, Khuon S, Collins FS, Jenuwein T, Goldman RD. Mutant nuclear lamin A leads to progressive alterations of epigenetic control in premature aging. Proc Natl Acad Sci USA. 2006;103:8703–8708. doi: 10.1073/pnas.0602569103.
51.Chronis C, Fiziev P, Papp B, Butz S, Bonora G, Sabri S, Ernst J, Plath K. Cooperative binding of transcription factors orchestrates reprogramming. Cell. 2017;168:442–459.e20. doi: 10.1016/j.cell.2016.12.016.
52.Din S, Konstandin MH, Johnson B, Emathinger J, Völkers M, Toko H, Collins B, Ormachea L, Samse K, Kubli DA, De La Torre A, Kraft AS, Gustafsson AB, Kelly DP, Sussman MA. Metabolic dysfunction consistent with premature aging results from deletion of Pim kinases. Circ Res. 2014;115:376–387. doi: 10.1161/CIRCRESAHA.115.304441.
53.Mohsin S, Khan M, Nguyen J, Alkatib M, Siddiqi S, Hariharan N, Wallach K, Monsanto M, Gude N, Dembitsky W, Sussman MA. Rejuvenation of human cardiac progenitor cells with Pim-1 kinase. Circ Res. 2013;113:1169– 1179. doi: 10.1161/CIRCRESAHA.113.302302.
54.Madonna R, Taylor DA, Geng YJ, De Caterina R, Shelat H, Perin EC, Willerson JT. Transplantation of mesenchymal cells rejuvenated by the overexpression of telomerase and myocardin promotes revascularization and tissue repair in a murine model of hindlimb ischemia. Circ Res. 2013;113:902–914. doi: 10.1161/CIRCRESAHA.113.301690.
55.Blasco MA. The epigenetic regulation of mammalian telomeres. Nat Rev Genet. 2007;8:299–309. doi: 10.1038/nrg2047.
56.Sahin E, Colla S, Liesa M, et al. Telomere dysfunction induces metabolic and mitochondrial compromise. Nature. 2011;470:359–365. doi: 10.1038/ nature09787.
57.Trounson A, McDonald C. Stem cell therapies in clinical trials: progress and challenges. Cell Stem Cell. 2015;17:11–22. doi: 10.1016/j. stem.2015.06.007.
58.Bryder D, Rossi DJ, Weissman IL. Hematopoietic stem cells: the paradigmatic tissue-specific stem cell. Am J Pathol. 2006;169:338–346. doi:
10.2353/ajpath.2006.060312.
59.Trounson A, DeWitt ND. Pluripotent stem cells progressing to the clinic. Nat Rev Mol Cell Biol. 2016;17:194–200. doi: 10.1038/nrm.2016.10.
60.Sancho-Martinez I, Baek SH, Izpisua Belmonte JC. Lineage conversion methodologies meet the reprogramming toolbox. Nat Cell Biol. 2012;14:892–899. doi: 10.1038/ncb2567.
61.Graf T, Enver T. Forcing cells to change lineages. Nature. 2009;462:587– 594. doi: 10.1038/nature08533.
62.Lis R, Karrasch CC, Poulos MG, et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 2017;545:439–445. doi: 10.1038/nature22326.
63.Sekiya S, Suzuki A. Direct conversion of mouse fibroblasts to hepatocytelike cells by defined factors. Nature. 2011;475:390–393. doi: 10.1038/ nature10263.
64.Vierbuchen T, Ostermeier A, Pang ZP, Kokubu Y, Südhof TC, Wernig M. Direct conversion of fibroblasts to functional neurons by defined factors. Nature. 2010;463:1035–1041. doi: 10.1038/nature08797.
65.Davis RL, Weintraub H, Lassar AB. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 1987;51:987–1000.
66.Son EY, Ichida JK, Wainger BJ, Toma JS, Rafuse VF, Woolf CJ, Eggan K. Conversion of mouse and human fibroblasts into functional
spinal motor neurons. Cell Stem Cell. 2011;9:205–218. doi: 10.1016/j. stem.2011.07.014.
67.Caiazzo M, Dell’Anno MT, Dvoretskova E, et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 2011;476:224–227. doi: 10.1038/nature10284.
68.Huang P, He Z, Ji S, Sun H, Xiang D, Liu C, Hu Y, Wang X, Hui L. Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors. Nature. 2011;475:386–389. doi: 10.1038/nature10116.
69.Batta K, Florkowska M, Kouskoff V, Lacaud G. Direct reprogramming of murine fibroblasts to hematopoietic progenitor cells. Cell Rep. 2014;9:1871–1884. doi: 10.1016/j.celrep.2014.11.002.
70.Han JK, Chang SH, Cho HJ, Choi SB, Ahn HS, Lee J, Jeong H, Youn SW, Lee HJ, Kwon YW, Cho HJ, Oh BH, Oettgen P, Park YB, Kim HS. Direct conversion of adult skin fibroblasts to endothelial cells by defined factors. Circulation. 2014;130:1168–1178. doi: 10.1161/CIRCULATIONAHA.113.007727.
71.Boyle JP, Thompson TJ, Gregg EW, Barker LE, Williamson DF. Projection of the year 2050 burden of diabetes in the US adult population: dynamic modeling of incidence, mortality, and prediabetes prevalence. Popul Health Metr. 2010;8:29. doi: 10.1186/1478-7954-8-29.
72.Wei R, Hong T. Lineage reprogramming: a promising road for pancreatic β cell regeneration. Trends Endocrinol Metab. 2016;27:163–176. doi:
10.1016/j.tem.2016.01.002.
73.Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 2008;455:627–632. doi: 10.1038/nature07314.
74.Al-Hasani K, Pfeifer A, Courtney M, et al. Adult duct-lining cells can reprogram into β-like cells able to counter repeated cycles of toxin-induced diabetes. Dev Cell. 2013;26:86–100. doi: 10.1016/j.devcel.2013.05.018.
75.Courtney M, Gjernes E, Druelle N, et al. The inactivation of Arx in pancreatic α-cells triggers their neogenesis and conversion into functional β-like cells. PLoS Genet. 2013;9:e1003934. doi: 10.1371/journal.pgen.1003934.
76.Sancho R, Gruber R, Gu G, Behrens A. Loss of Fbw7 reprograms adult pancreatic ductal cells into α, δ, and β cells. Cell Stem Cell. 2014;15:139– 153. doi: 10.1016/j.stem.2014.06.019.
77.Baeyens L, Lemper M, Leuckx G, et al. Transient cytokine treatment induces acinar cell reprogramming and regenerates functional beta cell mass in diabetic mice. Nat Biotechnol. 2014;32:76–83. doi: 10.1038/nbt.2747.
78.Zaret KS, Grompe M. Generation and regeneration of cells of the liver and pancreas. Science. 2008;322:1490–1494. doi: 10.1126/science.1161431.
79.Nagaya M, Katsuta H, Kaneto H, Bonner-Weir S, Weir GC. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 2009;201:37–47. doi: 10.1677/JOE-08-0482.
80.Hickey RD, Galivo F, Schug J, Brehm MA, Haft A, Wang Y, Benedetti E, Gu G, Magnuson MA, Shultz LD, Lagasse E, Greiner DL, Kaestner KH, Grompe M. Generation of islet-like cells from mouse gall bladder by direct ex vivo reprogramming. Stem Cell Res. 2013;11:503–515. doi:
10.1016/j.scr.2013.02.005.
81.Schonhoff SE, Giel-Moloney M, Leiter AB. Neurogenin 3-expressing progenitor cells in the gastrointestinal tract differentiate into both endocrine and non-endocrine cell types. Dev Biol. 2004;270:443–454. doi:
10.1016/j.ydbio.2004.03.013.
82.Talchai C, Xuan S, Kitamura T, DePinho RA, Accili D. Generation of functional insulin-producing cells in the gut by Foxo1 ablation. Nat Genet. 2012;44:406–12, S1. doi: 10.1038/ng.2215.
83.Chen YJ, Finkbeiner SR, Weinblatt D, Emmett MJ, Tameire F, Yousefi M, Yang C, Maehr R, Zhou Q, Shemer R, Dor Y, Li C, Spence JR, Stanger BZ. De novo formation of insulin-producing “neo-β cell islets” from intestinal crypts. Cell Rep. 2014;6:1046–1058. doi: 10.1016/j.celrep.2014.02.013.
84.Garbern JC, Lee RT. Cardiac stem cell therapy and the promise of heart regeneration. Cell Stem Cell. 2013;12:689–698. doi: 10.1016/j.stem.2013.05.008.
85.Boudoulas KD, Hatzopoulos AK. Cardiac repair and regeneration: the Rubik’s cube of cell therapy for heart disease. Dis Model Mech. 2009;2:344–358. doi: 10.1242/dmm.000240.
86.Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell. 2010;142:375–386. doi: 10.1016/j. cell.2010.07.002.
87.Qian L, Huang Y, Spencer CI, Foley A, Vedantham V, Liu L, Conway SJ, Fu JD, Srivastava D. In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes. Nature. 2012;485:593–598. doi: 10.1038/nature11044.
88.Addis RC, Ifkovits JL, Pinto F, Kellam LD, Esteso P, Rentschler S, Christoforou N, Epstein JA, Gearhart JD. Optimization of direct fibroblast reprogramming to cardiomyocytes using calcium activity as a functional measure of success. J Mol Cell Cardiol. 2013;60:97–106. doi: 10.1016/j. yjmcc.2013.04.004.
89.Song K, Nam YJ, Luo X, Qi X, Tan W, Huang GN, Acharya A, Smith CL, Tallquist MD, Neilson EG, Hill JA, Bassel-Duby R, Olson EN. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 2012;485:599–604. doi: 10.1038/nature11139.
90.Jayawardena TM, Egemnazarov B, Finch EA, Zhang L, Payne JA, Pandya K, Zhang Z, Rosenberg P, Mirotsou M, Dzau VJ. MicroRNA-mediated in vitro and in vivo direct reprogramming of cardiac fibroblasts to cardiomyocytes. Circ Res. 2012;110:1465–1473. doi: 10.1161/ CIRCRESAHA.112.269035.
91.Ifkovits JL, Addis RC, Epstein JA, Gearhart JD. Inhibition of TGFβ signaling increases direct conversion of fibroblasts to induced cardiomyocytes. PLoS One. 2014;9:e89678. doi: 10.1371/journal.pone.0089678.
92.Björklund A, Lindvall O. Replacing dopamine neurons in Parkinson’s disease: how did it happen? J Parkinsons Dis. 2017;7:S23–S33. doi:
10.3233/JPD-179002.
93.Ishii T, Eto K. Fetal stem cell transplantation: past, present, and future. World J Stem Cells. 2014;6:404–420. doi: 10.4252/wjsc.v6.i4.404.
94.Abbott A. Fetal-cell revival for Parkinson’s. Nature. 2014;510:195–196. doi: 10.1038/510195a.
95.Li H, Chen G. In vivo reprogramming for CNS repair: regenerating neurons from endogenous glial cells. Neuron. 2016;91:728–738. doi:
10.1016/j.neuron.2016.08.004.
96.Robel S, Berninger B, Götz M. The stem cell potential of glia: lessons from reactive gliosis. Nat Rev Neurosci. 2011;12:88–104. doi: 10.1038/ nrn2978.
97.Torper O, Pfisterer U, Wolf DA, Pereira M, Lau S, Jakobsson J, Björklund A, Grealish S, Parmar M. Generation of induced neurons via direct conversion in vivo. Proc Natl Acad Sci USA. 2013;110:7038–7043. doi:
10.1073/pnas.1303829110.
98.Niu W, Zang T, Zou Y, Fang S, Smith DK, Bachoo R, Zhang CL. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nat Cell Biol. 2013;15:1164–1175. doi: 10.1038/ncb2843.
99.Su Z, Niu W, Liu ML, Zou Y, Zhang CL. In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nat Commun. 2014;5:3338. doi: 10.1038/ncomms4338.
100.Heinrich C, Bergami M, Gascón S, Lepier A, Viganò F, Dimou L, Sutor B, Berninger B, Götz M. Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 2014;3:1000–1014. doi: 10.1016/j.stemcr.2014.10.007.
101.Mosteiro L, Pantoja C, Alcazar N, Marion RM, Chondronasiou D, Rovira M, Fernandez-Marcos PJ, Munoz-Martin M, Blanco-Aparicio C, Pastor J, Gomez-Lopez G, De Martino A, Blasco MA, Abad M, Serrano
M. Tissue damage and senescence provide critical signals for cellular reprogramming in vivo. Science;354.
102.Karow M, Sánchez R, Schichor C, Masserdotti G, Ortega F, Heinrich C, Gascón S, Khan MA, Lie DC, Dellavalle A, Cossu G, Goldbrunner R, Götz M, Berninger B. Reprogramming of pericyte-derived cells of the adult human brain into induced neuronal cells. Cell Stem Cell. 2012;11:471–476. doi: 10.1016/j.stem.2012.07.007.
103.Guo Z, Zhang L, Wu Z, Chen Y, Wang F, Chen G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 2014;14:188–202. doi: 10.1016/j.stem.2013.12.001.
104.Rivetti di Val Cervo P, Romanov RA, Spigolon G, Masini D, Martin-Montanez E, Toledo EM, La Manno G, Feyder M, Pifl C, Ng YH, Sanchez SP, Linnarsson S, Wernig M, Harkany T, Fisone G, Arenas E. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson’s disease model. Nat Biotechnol. 2017;35:444–452.
105.Blau HM, Cosgrove BD, Ho AT. The central role of muscle stem cells in regenerative failure with aging. Nat Med. 2015;21:854–862. doi: 10.1038/nm.3918.
106.Navarro S, Driscoll B. Regeneration of the aging lung: a mini-review.
Gerontology. 2017;63:270–280. doi: 10.1159/000451081.
107.Lukjanenko L, Jung MJ, Hegde N, et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nat Med. 2016;22:897–905. doi: 10.1038/nm.4126.
108.Grounds MD. Age-associated changes in the response of skeletal muscle cells to exercise and regeneration. Ann NY Acad Sci. 1998;854:78–91.
109.Geoffroy CG, Hilton BJ, Tetzlaff W, Zheng B. Evidence for an agedependent decline in axon regeneration in the adult mammalian central nervous system. Cell Rep. 2016;15:238–246. doi: 10.1016/j. celrep.2016.03.028.
110.Tsonis PA. Regeneration in vertebrates. Dev Biol. 2000;221:273–284. doi: 10.1006/dbio.2000.9667.
111.Carlson BM. Some principles of regeneration in mammalian systems.
Anat Rec B New Anat. 2005;287:4–13. doi: 10.1002/ar.b.20079.
112.Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology.
2006;43:S45–S53. doi: 10.1002/hep.20969.
113.Han M, Yang X, Taylor G, Burdsal CA, Anderson RA, Muneoka K. Limb regeneration in higher vertebrates: developing a roadmap. Anat Rec B New Anat. 2005;287:14–24. doi: 10.1002/ar.b.20082.
114.Yoshinari N, Kawakami A. Mature and juvenile tissue models of regeneration in small fish species. Biol Bull. 2011;221:62–78. doi: 10.1086/ BBLv221n1p62.
115.Young HE, Bailey CF, Dalley BK. Gross morphological analysis of limb regeneration in postmetamorphic adult Ambystoma. Anat Rec. 1983;206:295–306. doi: 10.1002/ar.1092060308.
116.Endo T, Tamura K, Ide H. Analysis of gene expressions during Xenopus forelimb regeneration. Dev Biol. 2000;220:296–306. doi: 10.1006/ dbio.2000.9641.
117.Seifert AW, Monaghan JR, Smith MD, Pasch B, Stier AC, Michonneau F, Maden M. The influence of fundamental traits on mechanisms controlling appendage regeneration. Biol Rev Camb Philos Soc. 2012;87:330– 345. doi: 10.1111/j.1469-185X.2011.00199.x.
118.McKim LH. Regeneration of the distal phalanx. Can Med Assoc J.
1932;26:549–550.
119.Simkin J, Han M, Yu L, Yan M, Muneoka K. The mouse digit tip: from wound healing to regeneration. Methods Mol Biol. 2013;1037:419–435. doi: 10.1007/978-1-62703-505-7_24.
120.Baguñà J. The planarian neoblast: the rambling history of its origin and some current black boxes. Int J Dev Biol. 2012;56:19–37. doi: 10.1387/ ijdb.113463jb.
121.Müller WA, Teo R, Frank U. Totipotent migratory stem cells in a hydroid.
Dev Biol. 2004;275:215–224. doi: 10.1016/j.ydbio.2004.08.006.
122.Tweedell KS. The urodele limb regeneration blastema: the cell potential.
ScientificWorldJournal. 2010;10:954–971. doi: 10.1100/tsw.2010.115. 123.Morrison JI, Lööf S, He P, Simon A. Salamander limb regeneration in
volves the activation of a multipotent skeletal muscle satellite cell population. J Cell Biol. 2006;172:433–440. doi: 10.1083/jcb.200509011.
124.Gemberling M, Bailey TJ, Hyde DR, Poss KD. The zebrafish as a model for complex tissue regeneration. Trends Genet. 2013;29:611–620. doi: 10.1016/j.tig.2013.07.003.
125.Straube WL, Tanaka EM. Reversibility of the differentiated state: regeneration in amphibians. Artif Organs. 2006;30:743–755. doi:
10.1111/j.1525-1594.2006.00296.x.
126.Lazzeri E, Anna P, Ballerini L, Laura L. Adult stem cells in tissue homeostasis and disease. In: Current Frontiers and Perspectives in Cell Biology. Stevo Najman, Ed; InTech. doi: 10.5772/33941. https://www.intechopen. com/books/current-frontiers-and-perspectives-in-cell-biology/adultstem-cells-in-tissue-homeostasis-and-disease. 2012.
127.Berika M, Elgayyar ME, El-Hashash AH. Asymmetric cell division of stem cells in the lung and other systems. Front Cell Dev Biol. 2014;2:33. doi: 10.3389/fcell.2014.00033.
128.van Es JH, Sato T, van de Wetering M, Lyubimova A, Yee Nee AN, Gregorieff A, Sasaki N, Zeinstra L, van den Born M, Korving J, Martens ACM, Barker N, van Oudenaarden A, Clevers H. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage. Nat Cell Biol. 2012;14:1099–1104. doi: 10.1038/ncb2581.
129.Tata PR, Mou H, Pardo-Saganta A, Zhao R, Prabhu M, Law BM, Vinarsky V, Cho JL, Breton S, Sahay A, Medoff BD, Rajagopal J. Dedifferentiation of committed epithelial cells into stem cells in vivo. Nature. 2013;503:218–223. doi: 10.1038/nature12777.
130.Bonventre JV. Dedifferentiation and proliferation of surviving epithelial cells in acute renal failure. J Am Soc Nephrol. 2003;14(suppl 1):S55–S61.
131.Aasen T, Raya A, Barrero MJ, Garreta E, Consiglio A, Gonzalez F, Vassena R, Bilić J, Pekarik V, Tiscornia G, Edel M, Boué S, Izpisúa Belmonte JC. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnol. 2008;26:1276–1284. doi: 10.1038/nbt.1503.
132.Ohnishi K, Semi K, Yamamoto T, Shimizu M, Tanaka A, Mitsunaga K, Okita K, Osafune K, Arioka Y, Maeda T, Soejima H, Moriwaki H, Yamanaka S, Woltjen K, Yamada Y. Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation. Cell. 2014;156:663–677. doi: 10.1016/j.cell.2014.01.005.
133.Takahashi K, Tanabe K, Ohnuki M, Narita M, Sasaki A, Yamamoto M, Nakamura M, Sutou K, Osafune K, Yamanaka S. Induction of pluripotency in human somatic cells via a transient state resembling primitive streak-like mesendoderm. Nat Commun. 2014;5:3678. doi: 10.1038/ ncomms4678.
134.Kurian L, Sancho-Martinez I, Nivet E, et al. Conversion of human fibroblasts to angioblast-like progenitor cells. Nat Methods. 2013;10:77–83. doi: 10.1038/nmeth.2255.
135.Efe JA, Hilcove S, Kim J, Zhou H, Ouyang K, Wang G, Chen J, Ding S. Conversion of mouse fibroblasts into cardiomyocytes using a direct reprogramming strategy. Nat Cell Biol. 2011;13:215–222. doi: 10.1038/ncb2164.
136.Perry KJ, Thomas AG, Henry JJ. Expression of pluripotency factors in larval epithelia of the frog Xenopus: evidence for the presence of cornea epithelial stem cells. Dev Biol. 2013;374:281–294. doi: 10.1016/j. ydbio.2012.12.005.
137.Maki N, Suetsugu-Maki R, Tarui H, Agata K, Del Rio-Tsonis K, Tsonis PA. Expression of stem cell pluripotency factors during regeneration in newts. Dev Dyn. 2009;238:1613–1616. doi: 10.1002/dvdy.21959.
138.Onal P, Grün D, Adamidi C, Rybak A, Solana J, Mastrobuoni G, Wang Y, Rahn HP, Chen W, Kempa S, Ziebold U, Rajewsky N. Gene expression of pluripotency determinants is conserved between mammalian and planarian stem cells. EMBO J. 2012;31:2755–2769. doi: 10.1038/emboj.2012.110.
139.Hennekam RC. Hutchinson-Gilford progeria syndrome: review of the phenotype. Am J Med Genet A. 2006;140:2603–2624. doi: 10.1002/ ajmg.a.31346.
140.Kamminga LM, van Os R, Ausema A, Noach EJ, Weersing E, Dontje B, Vellenga E, de Haan G. Impaired hematopoietic stem cell functioning after serial transplantation and during normal aging. Stem Cells. 2005;23:82–92. doi: 10.1634/stemcells.2004-0066.
141.Day K, Shefer G, Shearer A, Yablonka-Reuveni Z. The depletion of skeletal muscle satellite cells with age is concomitant with reduced capacity of single progenitors to produce reserve progeny. Dev Biol. 2010;340:330–343. doi: 10.1016/j.ydbio.2010.01.006.
142.Encinas JM, Michurina TV, Peunova N, Park JH, Tordo J, Peterson DA, Fishell G, Koulakov A, Enikolopov G. Division-coupled astrocytic differentiation and age-related depletion of neural stem cells in the adult hippocampus. Cell Stem Cell. 2011;8:566–579. doi: 10.1016/j.stem.2011.03.010.
143.Sharpless NE, DePinho RA. How stem cells age and why this makes us grow old. Nat Rev Mol Cell Biol. 2007;8:703–713. doi: 10.1038/nrm2241.
144.Morrison SJ, Wandycz AM, Akashi K, Globerson A, Weissman IL. The aging of hematopoietic stem cells. Nat Med. 1996;2:1011–1016.
145.Cho RH, Sieburg HB, Muller-Sieburg CE. A new mechanism for the aging of hematopoietic stem cells: aging changes the clonal composition of the stem cell compartment but not individual stem cells. Blood. 2008;111:5553–5561. doi: 10.1182/blood-2007-11-123547.
146.Dykstra B, Olthof S, Schreuder J, Ritsema M, de Haan G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. J Exp Med. 2011;208:2691–2703. doi: 10.1084/jem.20111490.
147.Rundberg Nilsson A, Soneji S, Adolfsson S, Bryder D, Pronk CJ. Human and murine hematopoietic stem cell aging is associated with functional impairments and intrinsic megakaryocytic/erythroid bias. PLoS One. 2016;11:e0158369. doi: 10.1371/journal.pone.0158369.
148.Beerman I, Rossi DJ. Epigenetic regulation of hematopoietic stem cell aging. Exp Cell Res. 2014;329:192–199. doi: 10.1016/j.yexcr.2014.09.013.
149.Xie H, Xu J, Hsu JH, Nguyen M, Fujiwara Y, Peng C, Orkin SH. Polycomb repressive complex 2 regulates normal hematopoietic stem cell function in a developmental-stage-specific manner. Cell Stem Cell. 2014;14:68–80. doi: 10.1016/j.stem.2013.10.001.
150.Bröske AM, Vockentanz L, Kharazi S, Huska MR, Mancini E, Scheller M, Kuhl C, Enns A, Prinz M, Jaenisch R, Nerlov C, Leutz A, Andrade-Navarro MA, Jacobsen SE, Rosenbauer F. DNA methylation protects hematopoietic stem cell multipotency from myeloerythroid restriction. Nat Genet. 2009;41:1207–1215. doi: 10.1038/ng.463.
151.Li Z, Cai X, Cai CL, Wang J, Zhang W, Petersen BE, Yang FC, Xu
M. Deletion of Tet2 in mice leads to dysregulated hematopoietic stem cells and subsequent development of myeloid malignancies. Blood. 2011;118:4509–4518. doi: 10.1182/blood-2010-12-325241.
152.Moran-Crusio K, Reavie L, Shih A, et al. Tet2 loss leads to increased hematopoietic stem cell self-renewal and myeloid transformation. Cancer Cell. 2011;20:11–24. doi: 10.1016/j.ccr.2011.06.001.
153.Sousa-Victor P, Gutarra S, García-Prat L, Rodriguez-Ubreva J, Ortet L, Ruiz-Bonilla V, Jardí M, Ballestar E, González S, Serrano AL, Perdiguero E, Muñoz-Cánoves P. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 2014;506:316–321. doi: 10.1038/nature13013.
154.Woodhouse S, Pugazhendhi D, Brien P, Pell JM. Ezh2 maintains a key phase of muscle satellite cell expansion but does not regulate terminal differentiation. J Cell Sci. 2013;126:565–579. doi: 10.1242/jcs.114843.
155.Brown K, Xie S, Qiu X, Mohrin M, Shin J, Liu Y, Zhang D, Scadden DT, Chen D. SIRT3 reverses aging-associated degeneration. Cell Rep. 2013;3:319–327. doi: 10.1016/j.celrep.2013.01.005.
156.Mohrin M, Shin J, Liu Y, Brown K, Luo H, Xi Y, Haynes CM, Chen D. Stem cell aging. A mitochondrial UPR-mediated metabolic checkpoint regulates hematopoietic stem cell aging. Science. 2015;347:1374–1377. doi: 10.1126/science.aaa2361.
157.Zhang H, Ryu D, Wu Y, Gariani K, Wang X, Luan P, D’Amico D, Ropelle ER, Lutolf MP, Aebersold R, Schoonjans K, Menzies KJ, Auwerx J. NAD⁺ repletion improves mitochondrial and stem cell function and enhances life span in mice. Science. 2016;352:1436–1443. doi: 10.1126/science.aaf2693.
158.Kusaba T, Lalli M, Kramann R, Kobayashi A, Humphreys BD. Differentiated kidney epithelial cells repair injured proximal tubule. Proc Natl Acad Sci USA. 2014;111:1527–1532. doi: 10.1073/pnas.1310653110.
159.Humphreys BD, Czerniak S, DiRocco DP, Hasnain W, Cheema R, Bonventre JV. Repair of injured proximal tubule does not involve specialized progenitors. Proc Natl Acad Sci USA. 2011;108:9226–9231. doi: 10.1073/pnas.1100629108.
160.Thorel F, Népote V, Avril I, Kohno K, Desgraz R, Chera S, Herrera PL. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature. 2010;464:1149–1154. doi: 10.1038/nature08894.
161.Chera S, Baronnier D, Ghila L, Cigliola V, Jensen JN, Gu G, Furuyama K, Thorel F, Gribble FM, Reimann F, Herrera PL. Diabetes recovery by age-dependent conversion of pancreatic δ-cells into insulin producers. Nature. 2014;514:503–507. doi: 10.1038/nature13633.
162.Magnusson JP, Göritz C, Tatarishvili J, Dias DO, Smith EM, Lindvall O, Kokaia Z, Frisén J. A latent neurogenic program in astrocytes regulated by Notch signaling in the mouse. Science. 2014;346:237–241. doi: 10.1126/science.346.6206.237.
163.Buffo A, Rite I, Tripathi P, Lepier A, Colak D, Horn AP, Mori T, Götz
M. Origin and progeny of reactive gliosis: a source of multipotent cells in the injured brain. Proc Natl Acad Sci USA. 2008;105:3581–3586. doi: 10.1073/pnas.0709002105.
164.Meserve JH, Duronio RJ. Scalloped and Yorkie are required for cell cycle re-entry of quiescent cells after tissue damage. Development. 2015;142:2740–2751. doi: 10.1242/dev.119339.
165.Mateus R, Lourenço R, Fang Y, Brito G, Farinho A, Valério F, Jacinto
A. Control of tissue growth by Yap relies on cell density and F-actin in zebrafish fin regeneration. Development. 2015;142:2752–2763. doi: 10.1242/dev.119701.
166.Martin JF, Perin EC, Willerson JT. Direct stimulation of cardiogenesis: a new paradigm for treating heart disease. Circ Res. 2017;121:13–15. doi:
10.1161/CIRCRESAHA.117.311062.
167.Aguirre A, Montserrat N, Zacchigna S, et al. In vivo activation of a conserved microRNA program induces mammalian heart regeneration. Cell Stem Cell. 2014;15:589–604. doi: 10.1016/j.stem.2014.10.003.
168.Simon HG, Nelson C, Goff D, Laufer E, Morgan BA, Tabin C. Differential expression of myogenic regulatory genes and Msx-1 during dedifferentiation and redifferentiation of regenerating amphibian limbs. Dev Dyn. 1995;202:1–12. doi: 10.1002/aja.1002020102.
169.Kumar A, Velloso CP, Imokawa Y, Brockes JP. The regenerative plasticity of isolated urodele myofibers and its dependence on MSX1. PLoS Biol. 2004;2:E218. doi: 10.1371/journal.pbio.0020218.
170.Bensoussan-Trigano V, Lallemand Y, Saint Cloment C, Robert B. Msx1 and Msx2 in limb mesenchyme modulate digit number and identity. Dev Dyn. 2011;240:1190–1202. doi: 10.1002/dvdy.22619.
171.Odelberg SJ, Kollhoff A, Keating MT. Dedifferentiation of mammalian myotubes induced by msx1. Cell. 2000;103:1099–1109.
172.Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Chapter 22: histology: the lives and deaths of cells in tissues. In: Molecular Biology of the Cell. 4th ed. New York: Garland Science. http://www.garlandscience.com/textbooks/0815341059.asp. 2002.
173.Schroer AK, Merryman WD. Mechanobiology of myofibroblast adhesion in fibrotic cardiac disease. J Cell Sci. 2015;128:1865–1875. doi: 10.1242/jcs.162891.
174.Morris SA, Cahan P, Li H, Zhao AM, San Roman AK, Shivdasani RA, Collins JJ, Daley GQ. Dissecting engineered cell types and enhancing cell fate conversion via CellNet. Cell. 2014;158:889–902. doi: 10.1016/j. cell.2014.07.021.
175.Suzuki T, Mandai M, Akimoto M, Yoshimura N, Takahashi M. The simultaneous treatment of MMP-2 stimulants in retinal transplantation enhances grafted cell migration into the host retina. Stem Cells. 2006;24:2406–2411. doi: 10.1634/stemcells.2005-0587.
176.Suzuki T, Akimoto M, Imai H, Ueda Y, Mandai M, Yoshimura N, Swaroop A, Takahashi M. Chondroitinase ABC treatment enhances synaptogenesis between transplant and host neurons in model of retinal degeneration. Cell Transplant. 2007;16:493–503.
177.West EL, Pearson RA, Tschernutter M, Sowden JC, MacLaren RE, Ali RR. Pharmacological disruption of the outer limiting membrane leads
to increased retinal integration of transplanted photoreceptor precursors. Exp Eye Res. 2008;86:601–611. doi: 10.1016/j.exer.2008.01.004.
178.D’Amore A, Yoshizumi T, Luketich SK, Wolf MT, Gu X, Cammarata M, Hoff R, Badylak SF, Wagner WR. Bi-layered polyurethane - extracellular matrix cardiac patch improves ischemic ventricular wall remodeling in a rat model. Biomaterials. 2016;107:1–14. doi: 10.1016/j. biomaterials.2016.07.039.
179.Wilson JM. Lessons learned from the gene therapy trial for ornithine transcarbamylase deficiency. Mol Genet Metab. 2009;96:151–157. doi: 10.1016/j.ymgme.2008.12.016.
180.Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP, Wilson JM, Batshaw ML. Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer. Mol Genet Metab. 2003;80:148–158.
181.Jooss K, Chirmule N. Immunity to adenovirus and adeno-associated viral vectors: implications for gene therapy. Gene Ther. 2003;10:955–963. doi: 10.1038/sj.gt.3302037.
182.Kotterman MA, Schaffer DV. Engineering adeno-associated viruses for clinical gene therapy. Nat Rev Genet. 2014;15:445–451. doi: 10.1038/ nrg3742.
183.Ramamoorth M, Narvekar A. Non viral vectors in gene therapy- an overview. J Clin Diagn Res. 2015;9:GE01–GE06. doi: 10.7860/ JCDR/2015/10443.5394.
184.Fu JD, Stone NR, Liu L, Spencer CI, Qian L, Hayashi Y, Delgado-Olguin P, Ding S, Bruneau BG, Srivastava D. Direct reprogramming of human fibroblasts toward a cardiomyocyte-like state. Stem Cell Reports. 2013;1:235–247. doi: 10.1016/j.stemcr.2013.07.005.
185.Muraoka N, Yamakawa H, Miyamoto K, et al. MiR-133 promotes cardiac reprogramming by directly repressing Snai1 and silencing fibroblast signatures. EMBO J. 2014;33:1565–1581. doi: 10.15252/ embj.201387605.
186.Nam YJ, Song K, Luo X, Daniel E, Lambeth K, West K, Hill JA, DiMaio JM, Baker LA, Bassel-Duby R, Olson EN. Reprogramming of human fi-broblasts toward a cardiac fate. Proc Natl Acad Sci USA. 2013;110:5588– 5593. doi: 10.1073/pnas.1301019110.
187.Wada R, Muraoka N, Inagawa K, et al. Induction of human cardiomyocyte-like cells from fibroblasts by defined factors. Proc Natl Acad Sci USA. 2013;110:12667–12672. doi: 10.1073/pnas.1304053110.
188.Vivien C, Scerbo P, Girardot F, Le Blay K, Demeneix BA, Coen L. Non-viral expression of mouse Oct4, Sox2, and Klf4 transcription factors efficiently reprograms tadpole muscle fibers in vivo. J Biol Chem. 2012;287:7427–7435. doi: 10.1074/jbc.M111.324368.
189.Rossello RA, Chen CC, Dai R, Howard JT, Hochgeschwender U, Jarvis ED. Mammalian genes induce partially reprogrammed pluripotent stem cells in non-mammalian vertebrate and invertebrate species. Elife;2:e00036.
190.Lu Y, West FD, Jordan BJ, Mumaw JL, Jordan ET, Gallegos-Cardenas A, Beckstead RB, Stice SL. Avian-induced pluripotent stem cells derived using human reprogramming factors. Stem Cells Dev. 2012;21:394–403. doi: 10.1089/scd.2011.0499.
191.Ogorevc J, Orehek S, Dovč P. Cellular reprogramming in farm animals: an overview of iPSC generation in the mammalian farm animal species. J Anim Sci Biotechnol. 2016;7:10. doi: 10.1186/s40104-016-0070-3.
192.Ben-Nun IF, Montague SC, Houck ML, Tran HT, Garitaonandia I, Leonardo TR, Wang YC, Charter SJ, Laurent LC, Ryder OA, Loring JF. Induced pluripotent stem cells from highly endangered species. Nat Methods. 2011;8:829–831. doi: 10.1038/nmeth.1706.
193.Heaney JD, Anderson EL, Michelson MV, Zechel JL, Conrad PA, Page DC, Nadeau JH. Germ cell pluripotency, premature differentiation and susceptibility to testicular teratomas in mice. Development. 2012;139:1577–1586. doi: 10.1242/dev.076851.
194.Abad M, Mosteiro L, Pantoja C, Cañamero M, Rayon T, Ors I, Graña O, Megías D, Domínguez O, Martínez D, Manzanares M, Ortega S, Serrano M. Reprogramming in vivo produces teratomas and iPS cells with totipotency features. Nature. 2013;502:340–345. doi: 10.1038/ nature12586.
195.Huangfu D, Maehr R, Guo W, Eijkelenboom A, Snitow M, Chen AE, Melton DA. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nat Biotechnol. 2008;26:795–797. doi: 10.1038/nbt1418.
196.Beyret E, Izpisua Belmonte JC. The XEN of reprogramming. Cell Res.
2016;26:147–148. doi: 10.1038/cr.2016.9.
197.Hou P, Li Y, Zhang X, Liu C, Guan J, Li H, Zhao T, Ye J, Yang W, Liu K, Ge J, Xu J, Zhang Q, Zhao Y, Deng H. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Science. 2013;341:651–654. doi: 10.1126/science.1239278.












