
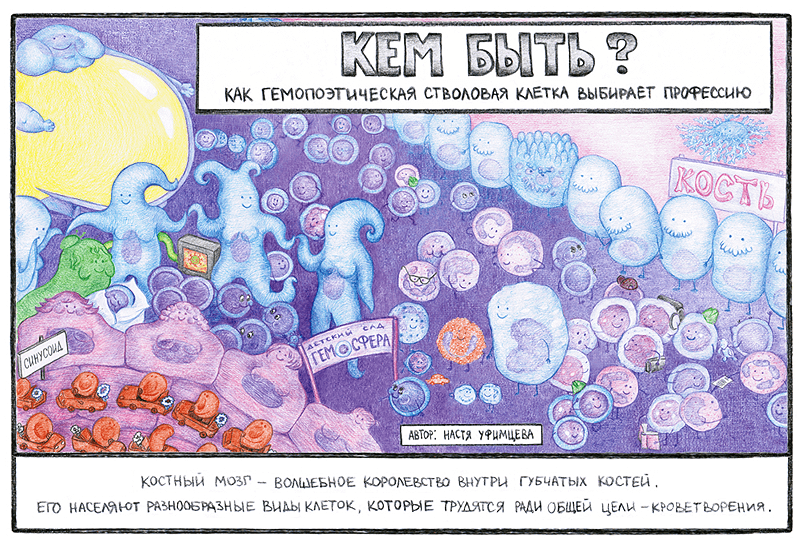
Как в человеческом обществе существует много профессий, в человеческой крови различают разные виды клеток, которые выполняют различные функции во благо организма. Все они когда-то были юными гемопоэтическими стволовыми клетками, жили в сказочном костном мозге и не знали, кем будут, когда вырастут. Как же гемопоэтическая стволовая клетка решает, что пора взрослеть, и как выбирает будущую профессию?
Комикс на конкурс «био/мол/текст»
Быть базофилом хорошо,
а тромбоцитом — лучше,
в тромбоциты б я пошел,
пусть меня научат
Костный мозг — кроветворный орган, расположенный в ячейках губчатых костей и в эпифизах трубчатых. Его населяют различные виды клеток. Если посмотреть на срез костного мозга в микроскоп, в нём можно увидеть участки кости, в которых представлены клетки костной ткани. Также обнаруживаются наполненные кровью синусоиды, образованные эндотелиоцитами, вокруг которых располагаются периваскулярные клетки. Рядом с сосудами расположены симпатические нервные волокна. Кроме того, в костном мозге находятся адипоциты — крупные жировые клетки, количество которых увеличивается с возрастом. Но так как главной функцией костного мозга является кроветворение, его основную массу составляют клетки крови на разных стадиях дифференцировки. Среди них можно выделить гемопоэтические стволовые клетки (ГСК) — примитивные клетки, дающие начало всем клеткам крови и способные поддерживать свое количество относительно постоянным на протяжении всей жизни организма.
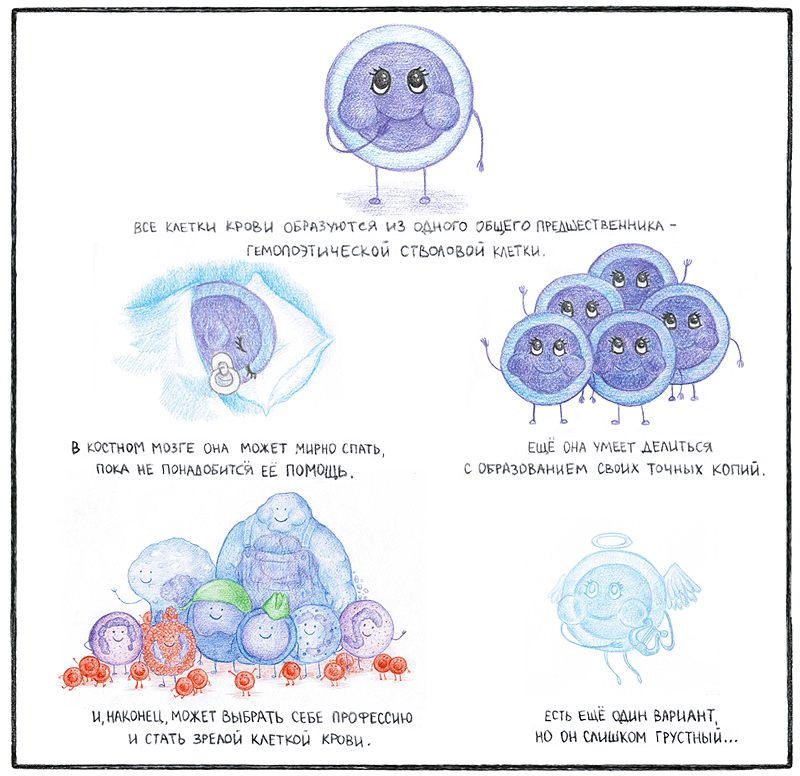
Часть ГСК находится в состоянии покоя: такие клетки неактивны и не участвуют в клеточном цикле. Но проснувшись, гемопоэтическая стволовая клетка делает очень важный выбор. Уникальным свойством всех стволовых клеток является способность к самообновлению — так называют симметричное деление с образованием идентичных копий материнской клетки. Так гемопоэтическая стволовая клетка может практически бесконечно продлять свое детство.
Но если ГСК решила взрослеть, она приступает к асимметричному делению, которое в итоге приводит к дифференцировке (приобретению специфических свойств) [1]. Согласно классической схеме кроветворения*, в результате такого асимметричного деления образуется коммитированный («выбравший свой путь») предшественник, который дает начало одному из двух основных ростков кроветворения — миелоидному («учеба») и лимфоидному («армия») [2].
Общие миелоидные предшественники в дальнейшем выбирают одно из направлений («специальностей»): мегакариоцитарное (конечный результат которого — образование тромбоцитов, участвующих в формировании тромбов при повреждении сосудов), эритроцитарное (с образованием эритроцитов, осуществляющих перенос кислорода к тканям и углекислого газа от них), моноцитарное (моноциты впоследствии превращаются в макрофаги и поглощают чужеродные частицы) или гранулоцитарное (зрелые клетки содержат гранулярные структуры (зернистость), накапливающие специфические вещества, и представлены нейтрофилами, эозинофилами и базофилами, выполняющими разнообразные функции).
* — По современным данным, гемопоэтическая стволовая клетка «взрослеет», постепенно теряя способность к самообновлению и приобретая способность к дифференцировке. А решение выбрать «рабочую специальность», то есть мегакариоцитарное и эритроцитарное направление дифференцировки, клетка принимает еще до того, как рассмотрит варианты с «учебой» и «армией» (миелоидным или лимфоидным ростками) [3].
Общие лимфоидные предшественники дают начало клеткам иммунной системы — NK-клеткам, T- и B-лимфоцитам, — которые защищают организм от вторжения. NK-клетки (большие гранулярные лимфоциты) убивают чужаков, T-лимфоциты могут распознавать эпитоп (участок антигена) врага и организовывать наступление (T-хелперы) или атаковать самостоятельно (цитотоксические лимфоциты), а B-лимфоциты, тоже после знакомства с антигеном, могут превращаться в плазматические клетки, вырабатывать специфические антитела и поражать ими врага на расстоянии.


Каким же образом гемопоэтическая стволовая клетка решает, оставаться ей вечно юной или встать на путь дифференцировки и превратиться в зрелую клетку крови? И как она выбирает свою будущую профессию? Результаты большого количества исследований доказывают, что важную роль играет окружение гемопоэтической стволовой клетки*. В первую очередь, это различные виды клеток, формирующие гемопоэтическую нишу костного мозга.
* — О структуре опухолевой микросреды, метастатических нишах и способах изучения микроокружения рассказывает статья «Опухолевые разговоры, или Роль микроокружения в развитии рака» [4]. — Ред.

Как правило, выделяют эндостальную нишу, компонентами которой являются остеобласты. Есть данные, что в эндостальной нише находятся клетки в состоянии покоя [5]. Также ряд исследований показал, что остеобласты важны для формирования лимфоидных предшественников — будущих «солдат» [6]. Говорят и о васкулярной (сосудистой) нише, образованной эндотелиоцитами синусоидов и периваскулярными клетками [5, 7]. В 2012 году Ванг и соавторы опубликовали работу, в которой описали зону между эндотелиальными клетками синусоида и периваскулярными клетками, назвав ее гемосферой [8]. Именно в этом пространстве обнаруживалось большое количество гемопоэтических стволовых клеток, что свидетельствовало об особых условиях для поддержания «юного» состояния клеток крови. Однако из-за анатомической близости этих ниш однозначно разделить их невозможно. С помощью методов трехмерной визуализации было показано, что эндостальная область костного мозга с хорошей васкуляризацией как раз и обеспечивает условия для существования и функционирования гемопоэтических стволовых клеток [9].
Кроме того, другие клетки костного мозга также могут влиять на судьбу гемопоэтической стволовой клетки. Например, было показано, что адипоциты препятствуют гемопоэзу, а немиелинизирующие шванновские клетки, расположенные рядом с симпатическими нервными волокнами, поддерживают ГСК в состоянии покоя [6].
Кроме непосредственного влияния окружающих клеток, на ГСК воздействует множество растворимых веществ — цитокинов и ростовых факторов. Часть из них вырабатывается клетками ниши, другие синтезируются далеко от костного мозга (например, эритропоэтин — в почках, а паратиреоидный гормон — паращитовидной железой). Некоторые вещества продляют детство ГСК (например, CXCL-12 — хемокин подсемейства CXC), способствуя ее самообновлению [7]. А некоторые заставляют задуматься о взрослении и будущей профессии. Например, интерлейкин-7, как военная игрушка, способствует появлению у юных клеток мыслей о службе, а гранулоцитарный колониестимулирующий фактор развивает тягу к знаниям. Также в регуляции кроветворения участвует симпатическая нервная система, передавая сигналы о ситуации в организме [5].

Однако выбор профессии — непростой процесс. И огромную роль в нём, помимо внешнего воздействия, играют личные предпочтения и склонности. Как и у человека, у гемопоэтической стволовой клетки богатый и сложный внутренний мир, который представлен транскрипционными факторами. Именно их взаимодействия приводят в конечном итоге к принятию решения, кем же ей быть [2, 10, 11].
Например, экспрессия гена транскрипционного фактора GATA1 способствует выбору эритроцитарного и мегакариоцитарного направления дифференцировки, в то время как высокий уровень PU.1 связан с дифференцировкой по моноцитарному пути и подавляет желание клетки стать эритроцитом или мегакариоцитом. Эти два транскрипционных фактора взаимосвязаны таким образом, что повышение продукции одного из них снижает экспрессию гена другого. Уровень экспрессии гена PU.1 (SPI1) также регулируется транскрипционным фактором Ikaros, который стимулирует синтез транскрипционного репрессора Gfi1. Вместе они подавляют экспрессию SPI1. Увеличение концентрации PU.1 активирует транскрипционные факторы Egr, запускающие программу дифференцировки в моноциты. Egr также активируют гены белков семейства Id (ингибиторов ДНК-связывающих белков), что приводит к снижению продукции E2A — важнейшего транскрипционного фактора в развитии B-лимфоцитов. Кроме того, пониженный уровень PU.1 блокирует дифференцировку клетки в B-лимфоцит другим путем — через снижение экспрессии генов факторов EBF [10, 11].
Конечно, представление работы транскрипционных факторов в виде механических блоков — чрезвычайное упрощение. Кроме того, описанные взаимодействия — лишь малая часть огромной сети транскрипционных факторов. В настоящее время ведутся масштабные исследования, чтобы составить представление о внутренних факторах, участвующих в регуляции дифференцировки гемопоэтической стволовой клетки, и об их взаимосвязи с внешними факторами, такими как влияние других клеток и растворимых факторов. Все эти знания помогут лучше понять процессы, лежащие в основе кроветворения в норме и при различных заболеваниях, разработать подходы к лечению этих заболеваний, а также научиться управлять судьбой гемопоэтических стволовых клеток in vitro и in vivo.
Комикс целиком (одним файлом) можно посмотреть по ссылке.
Литература
- биомолекула: «Ствол и ветки: стволовые клетки»;
- Zhu J. and Emerson S.G. (2002). Hematopoietic cytokines, transcription factors and lineage commitment. Oncogene. 21, 3295–3313;
- Rieger M.A. and Schroeder T. (2012). Hematopoiesis. Cold Spring Harb. Perspect. Biol. 4 (12), a008250;
- биомолекула: «Опухолевые разговоры, или Роль микроокружения в развитии рака»;
- Семенова Н.Ю., Бессмельцев С.С., Ругаль В.И. (2014). Биология ниши гемопоэтических клеток. Клиническая онкогематология. 7 (4), 501–511;
- Ugarte F. and Forsberg E.C. (2013). Haematopoietic stem cell niches: new insights inspire new questions. EMBO J. 32 (19), 2535–2547;
- Oh I.H. and Humphries R.K. (2012). Concise review: Multidimensional regulation of the hematopoietic stem cell state. Stem Cells. 30 (1), 82–88;
- Wang L., Benedito R., Bixel M.G., Zeuschner D., Stehling M., Sävendahl L. et al. (2012). Identification of a clonally expanding haematopoietic compartment in bone marrow. EMBO J. 32, 219–230;
- Nombela-Arrieta C., Pivarnik G., Winkel B., Canty K.J., Harley B., Mahoney J.E. et al. (2013). Quantitative imaging of haematopoietic stem and progenitor cell localization and hypoxic status in the bone marrow microenvironment. Nat. Cell Biol. 15, 533–543;
- Borghesi L. (2014). Hematopoiesis in steady-state versus stress: self-renewal, lineage fate choice, and the conversion of danger signals into cytokine signals in HSCs. J. Immunol. 193 (5), 2053–2058;
- Schütte J., Moignard V., Göttgens B. (2012). Establishing the stem cell state: insights from regulatory network analysis of blood stem cell development. Wiley Interdiscip. Rev. Syst. Biol. Med. 4 (3), 285–295.








































































