ВВЕДЕНИЕ
![]() Гетерохронный парабиоз на протяжении десятилетий использовался на лабораторных животных для изучения влияния обмена кровью, объединения органов и окружающей их среды на партнеров, связанных хирургическим путем [1, 2, 3–5]. Общий вывод этих исследований состоял в том, что старые партнеры имели лучшее здоровье и / или восстановление хрящей, мышц, печени, головного мозга, спинного мозга, почек, костей, кожи и т. д. И часто молодые животные испытывали преждевременное старение своих соответствующих тканей [1, 3, 4, 6–8]. В последнее время исследования обмена крови показали, что одна только гетерохронность крови без совместного использования парабиозниками органов или среды быстро омолаживает мышцы и печень, но, что интересно, не нейрогенез гиппокампа или когнитивные функции старых мышей. И и что у молодых мышей наблюдается быстрое и значительное снижение нейрогенеза гиппокампа, ловкости, способности к обучению и регенерации печени после однократного обмена крови на старую [9].
Гетерохронный парабиоз на протяжении десятилетий использовался на лабораторных животных для изучения влияния обмена кровью, объединения органов и окружающей их среды на партнеров, связанных хирургическим путем [1, 2, 3–5]. Общий вывод этих исследований состоял в том, что старые партнеры имели лучшее здоровье и / или восстановление хрящей, мышц, печени, головного мозга, спинного мозга, почек, костей, кожи и т. д. И часто молодые животные испытывали преждевременное старение своих соответствующих тканей [1, 3, 4, 6–8]. В последнее время исследования обмена крови показали, что одна только гетерохронность крови без совместного использования парабиозниками органов или среды быстро омолаживает мышцы и печень, но, что интересно, не нейрогенез гиппокампа или когнитивные функции старых мышей. И и что у молодых мышей наблюдается быстрое и значительное снижение нейрогенеза гиппокампа, ловкости, способности к обучению и регенерации печени после однократного обмена крови на старую [9].
Исторически, явления гетерохронного парабиоза и обмена крови оставались неподтвержденными в отношении ключевого предположения о том, необходимо ли добавление молодых факторов для омоложения, и обусловлено ли преждевременное старение молодых мышей введением старых факторов крови или простым разведением молодых факторов. Чтобы ответить на эти вопросы в хорошо контролируемой экспериментальной установке, мы воспользовались нашей недавно разработанной моделью обмена крови мелких животных [9].
В частности, мы выполнили «нейтральный» обмен крови (NBE), заменив фракцию, обогащенную тромбоцитами (PRP), физиологическим раствором, добавив 5% очищенного коммерческого (фракция V) альбумина (то есть, восполняя истощение уровня альбумина в крови). В течение получасовой серии небольшим по объему обменов 50% PRP старых и молодых мышей заменяли физиологическим раствором и 5% мышиным альбумином, тогда как циркулирующие красные и белые кровяные клетки возвращались животному изохронно.
Молодые (2-4 месяца) и старые (22-24 месяца) мыши C57/B6 подвергались одиночному NBE; и, в качестве контроля процедуры, мы провели изохронный обмен крови: молодой - молодой (YY) и старый - старый (ОО) [9]. Последующие анализы восстановления мышц, ожирения и фиброза печени, нейрогенеза гиппокампа и протеомики сыворотки были выполнены через 6 дней после одиночного NBE.
Процедура обмена крови мелких животных является трудоемкой и времязатратной: кровеносные сосуды мышей канюлируют и проверяют на проходимость, на следующий день животных снова проверяют на проходимость катетера, а затем подвергают обмену под общим наркозом. Следует отметить, что для каждого NBE используются две мыши, одна мышь предоставляет, недавно взятые, синхронные сингенные клетки крови, которые ресуспендируют в солевом растворе + альбумин, для второго животного, которое подвергается NBE. Таким образом, мы рассчитываем минимальное количество экспериментальных животных, необходимое для статистически значимых выводов, и позволяющее выполнить экспериментальную работу.
Распространенной ошибкой является обоснование статистической значимости наблюдения тем, велик ли размер выборки. Статистическая значимость для независимости между образцами, или измерения статистической мощности (мощности) зависит не только от количества выборок (N), но измеряется через величину эффекта (ES) и дисперсию.
Мера, используемая для определения величины статистической мощности в нормальных распределениях, определяется как:

На рисунке 1 ниже мы моделируем мощность, модулируя величину эффекта и нанося их на график с учетом количества образцов. Степень 0,8 - это высокий пороговый стандарт надежных исследований; меньшая мощность часто используется в опубликованных работах, а мощность более 0,8 приходится на непропорциональные затраты ресурсов и времени (уменьшение отдачи от логистической функции) [10, 11]. Как показано на рисунке 1, когда дисперсия независимых экспериментов мала, а разница в ES между когортами высока, например, как и в 2003–2020 гг., включая опубликованные и текущие исследования молодых, старых и омоложенных старых когорт [1–3, 4, 9], нет разницы в мощности между N = 4, 8, 19 или бесконечностью. Напротив, в отсутствие устойчивых фенотипов, если два явления обнаруживаются как одинаковые, или имеют очень скромный эффект, при достаточно высоком N статистическая мощность будет строго возрастать. Следует отметить, что этот подход применяется только к теоретическим данным, полученным без потери точности, без ущерба для статистической мощности и без предпочтений. В реальном мире это может позволить не только обнаружение слабых явлений, но также переоснащение и накопление артефактов, которые неправильно интерпретируются как биологические явления при некоторых более высоких значениях N.
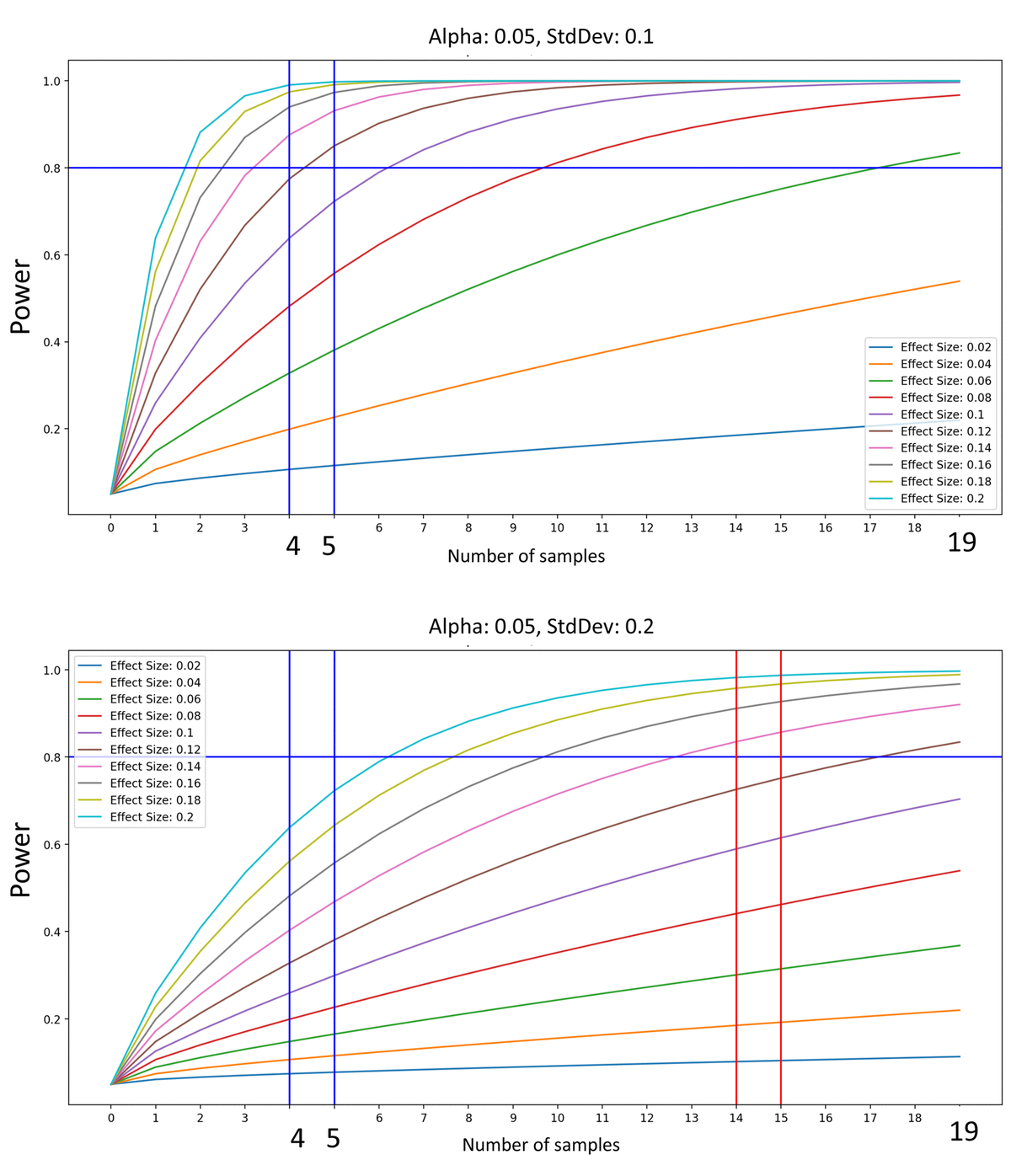 Рисунок 1. Мощность эксперимента определяется размером эффекта. (Вверху). В соответствии с ES и Variance при сравнении молодых, старых и старых омоложенных когорт в наших исследованиях 2003-2020 гг. Мы показываем, что с этими параметрами N = 4 оправдывает независимость в наших выборках, а увеличение N не значительно улучшает это обоснование. (Внизу) Если гипотетические выборки имеют высокую дисперсию (и, следовательно, нормализованный размер эффекта уменьшается), то для получения аналогичной мощности в эксперименте требуется больше выборок (более высокое N). Как правило, увеличение размера образца необходимо для увеличения способности распознавать менее ощутимые явления, которые статистически не обнаруживаются без такого увеличения N.
Рисунок 1. Мощность эксперимента определяется размером эффекта. (Вверху). В соответствии с ES и Variance при сравнении молодых, старых и старых омоложенных когорт в наших исследованиях 2003-2020 гг. Мы показываем, что с этими параметрами N = 4 оправдывает независимость в наших выборках, а увеличение N не значительно улучшает это обоснование. (Внизу) Если гипотетические выборки имеют высокую дисперсию (и, следовательно, нормализованный размер эффекта уменьшается), то для получения аналогичной мощности в эксперименте требуется больше выборок (более высокое N). Как правило, увеличение размера образца необходимо для увеличения способности распознавать менее ощутимые явления, которые статистически не обнаруживаются без такого увеличения N.
На основании приведенного выше анализа и предварительных YY, OO, YNBE и ONBE с N = 3 для каждой когорты, мощность 0,8 и выше и достоверность наших выводов были получены с N = 4. Мы установили 4 изохронных обмена YY и OO, которые являются контрольным повторением тех же исследований (процесс обмена и анализ нейрогенеза мышц, печени и гиппокампа), которые мы ранее опубликовали с 8 мышами YY и OO [9]. Это было сделано параллельно с новыми исследованиями NBE. В работе по восстановлению поврежденной мышцы мы оценили четыре независимые характеристики миогенеза у взрослых: регенеративный индекс, фиброз, минимальный диаметр Ферета и миогенную пролиферацию с согласованием данных между всеми исследованиями на мышах и людях. В исследованиях печени, мы выполнили две характеристики здоровья печени: адипозность и фиброз, последний был проанализирован двумя независимыми методами; Согласование данных наблюдалось в 8 независимых экспериментах от начала до конца с каждой группой. В исследованиях нейрогенеза гиппокампа мы провели 6-7 независимых экспериментов от начала до конца с каждой когортой, и это согласуется с нашими исследованиями in vitro с клетками-предшественниками. Каждый анализ каждого образца и ткани был повторен несколько раз. Дополнительные образцы тканей были использованы для работы над другими идеями и гипотезами (в процессе). Следует отметить, что недавние исследования, сравнимые по объему и методам, опубликованные в журналах с высокой отдачей, имеют N = 3-4, даже когда ES ниже, а дисперсия больше, чем в текущей работе [12].
Восстановление мышц было проанализировано на предмет успешного формирования новых миофибрилл, которые заменили места повреждения и степени фиброза, количественно оцененных с помощью окрашивания гематоксилином и эозином (H & E), и был количественно определен минимальный диаметр Ферета вновь образованных мышечных волокон eMyHC +, как мы ранее опубликованные [1, 6, 7, 9, 13, 14]. Как и ожидалось, мышцы YY регенерируют гораздо лучше, чем ОО [1, 9, 14, 15]. Интересно, что один NBE улучшал регенерацию, уменьшал фиброз и увеличивал минимальный диаметр Feret миоволокон de-novo у старых мышей до такой степени, что они не имели существенных различий с молодыми, и NBE не ухудшал эти признаки восстановления молодых мышц, Рисунок 2A, 2B , Мышечный фиброз не отличался между YY и молодыми контрольными мышами, которые не испытывали обмена крови или OO, и старыми контрольными мышами; регенерация была немного лучше в YY, чем в Y, и в OO, чем в когортах O; и когорты YY / Young имели более высокую регенерацию и меньший фиброз, чем когорты OO / Old (дополнительный рис 1).
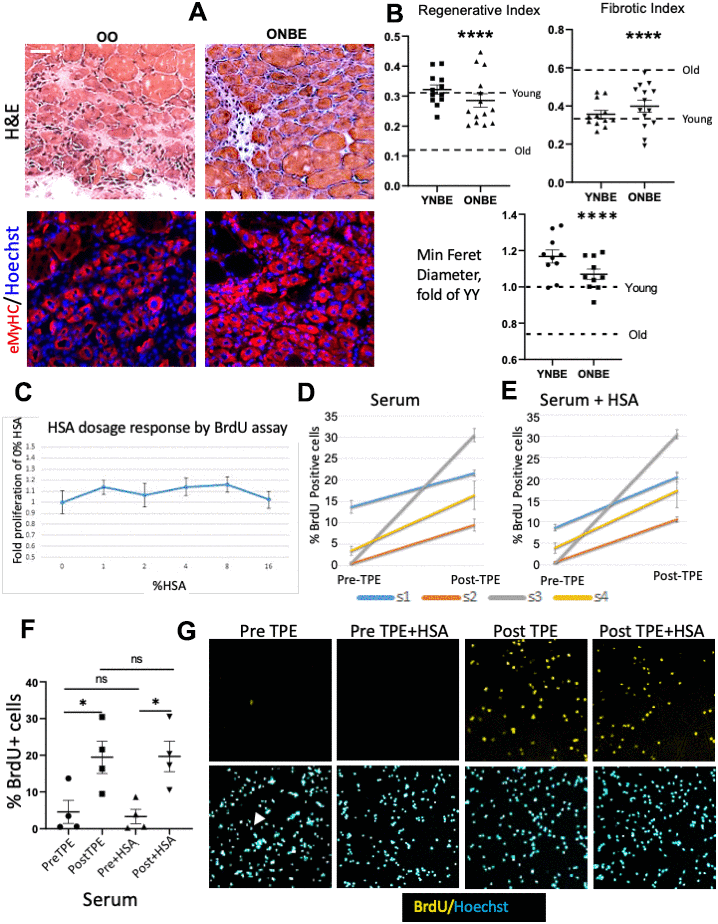 Рисунок 2. Омоложение взрослого миогенеза и альбумин-независимые эффекты TPE. Через один день после NBE мышца была повреждена в двух местах на одну TA за счет кардиотоксина; Через 5 дней мышцу изолировали и подвергали криосекции при 10 мкм. (A) Репрезентативные изображения H & E и eMyHC IF места травмы. Шкала бар = 50 мкм. (B) Регенеративный индекс: количество центрально-ядерных миофибрилл на общее количество ядер. OO против ONBE p = 0,000001, YY против ONBE, несущественный p = 0,4014; Фиброзный индекс: белый, лишенный областей миофибрилл. OO против ONBE p = 0,000048, YY против YNBE незначимых p = 0,1712. Минимальный диаметр Ферета для миофибрилл eMyHC + нормирован на среднее значение YY [9]. OO против ONBE p = 3,04346E-05, YY против YNBE p = 0,009. Точками данных являются места повреждения ТА у 4-5 животных YNBE и 5 животных ONBE. Уровни «Молодой» и «Старый» (подробно на дополнительном рисунке 1) - пунктирные линии. Репрезентативные изображения для когорт YY против YNBE показаны на дополнительном рис 6. (C) Автоматическая микроскопическая количественная оценка реакции на дозу HSA в виде кратного различия в клетках BrdU + от одного OPTI-MEM (0 HSA). Не было увеличения миогенной пролиферации при 1-16% HSA. N = 6. (D) Мета-экспресс-количественная оценка клеток BrdU + с помощью автоматической высокопроизводительной микроскопии для миобластов, культивируемых с 4% PreTPE по сравнению с сывороткой PostTPE, и (E) для этих клеток, культивируемых с 4% каждого: PreTPE сыворотка + HSA или PostTPE сыворотка + HSA. Значительное увеличение количества BrdU-позитивных клеток выявляется у каждого субъекта 1, 2, 3 и 4 для обработанной TPE сыворотки (р = 0,011, <0,0001, <0,0001, 0,0039 соответственно), а также для обработанной TPE сыворотки, когда 4 % HSA присутствует (р <0,0001, <0,0001, <0,0001, = 0,009 соответственно). N = 6. (F) Диаграмма рассеяния со средними значениями и SEM для всех когорт Pre-TPE, Post-TPE, +/- HSA показывает значительное улучшение пролиферации в Pre-TPE по сравнению с когортами после и после TPE (p * = 0,033), а также Pre + HSA и Post + HSA когорты (p * = 0,0116). Напротив, при сравнении Pre с Pre + HSA (p = 0,744) или Post с Post + HSA значительного изменения не наблюдалось (p = 0,9733). N = 4 субъекта X 6 независимых анализов для каждого в каждом условии. (G) Репрезентативное окрашивание BrdU IF и Hoechst в субрегионах одного из 9 участков, которые были получены с помощью автоматической микроскопии. Сыворотка крови от старых особей уменьшала пролиферацию миогенных клеток с очень небольшим количеством видимых клеток BrdU + (показано одной положительной клеткой в Pre-TPE и стрелкой, указывающей на соответствующее ядро); TPE отменил это ингибирование, но HSA не оказал заметного эффекта.
Рисунок 2. Омоложение взрослого миогенеза и альбумин-независимые эффекты TPE. Через один день после NBE мышца была повреждена в двух местах на одну TA за счет кардиотоксина; Через 5 дней мышцу изолировали и подвергали криосекции при 10 мкм. (A) Репрезентативные изображения H & E и eMyHC IF места травмы. Шкала бар = 50 мкм. (B) Регенеративный индекс: количество центрально-ядерных миофибрилл на общее количество ядер. OO против ONBE p = 0,000001, YY против ONBE, несущественный p = 0,4014; Фиброзный индекс: белый, лишенный областей миофибрилл. OO против ONBE p = 0,000048, YY против YNBE незначимых p = 0,1712. Минимальный диаметр Ферета для миофибрилл eMyHC + нормирован на среднее значение YY [9]. OO против ONBE p = 3,04346E-05, YY против YNBE p = 0,009. Точками данных являются места повреждения ТА у 4-5 животных YNBE и 5 животных ONBE. Уровни «Молодой» и «Старый» (подробно на дополнительном рисунке 1) - пунктирные линии. Репрезентативные изображения для когорт YY против YNBE показаны на дополнительном рис 6. (C) Автоматическая микроскопическая количественная оценка реакции на дозу HSA в виде кратного различия в клетках BrdU + от одного OPTI-MEM (0 HSA). Не было увеличения миогенной пролиферации при 1-16% HSA. N = 6. (D) Мета-экспресс-количественная оценка клеток BrdU + с помощью автоматической высокопроизводительной микроскопии для миобластов, культивируемых с 4% PreTPE по сравнению с сывороткой PostTPE, и (E) для этих клеток, культивируемых с 4% каждого: PreTPE сыворотка + HSA или PostTPE сыворотка + HSA. Значительное увеличение количества BrdU-позитивных клеток выявляется у каждого субъекта 1, 2, 3 и 4 для обработанной TPE сыворотки (р = 0,011, <0,0001, <0,0001, 0,0039 соответственно), а также для обработанной TPE сыворотки, когда 4 % HSA присутствует (р <0,0001, <0,0001, <0,0001, = 0,009 соответственно). N = 6. (F) Диаграмма рассеяния со средними значениями и SEM для всех когорт Pre-TPE, Post-TPE, +/- HSA показывает значительное улучшение пролиферации в Pre-TPE по сравнению с когортами после и после TPE (p * = 0,033), а также Pre + HSA и Post + HSA когорты (p * = 0,0116). Напротив, при сравнении Pre с Pre + HSA (p = 0,744) или Post с Post + HSA значительного изменения не наблюдалось (p = 0,9733). N = 4 субъекта X 6 независимых анализов для каждого в каждом условии. (G) Репрезентативное окрашивание BrdU IF и Hoechst в субрегионах одного из 9 участков, которые были получены с помощью автоматической микроскопии. Сыворотка крови от старых особей уменьшала пролиферацию миогенных клеток с очень небольшим количеством видимых клеток BrdU + (показано одной положительной клеткой в Pre-TPE и стрелкой, указывающей на соответствующее ядро); TPE отменил это ингибирование, но HSA не оказал заметного эффекта.
Чтобы подтвердить эти результаты и исследовать их эволюционное сохранение, мы воспользовались тем, что существует процедура для пациентов-людей, аналогичная NBE, где большая часть плазмы заменяется физиологическим раствором с добавлением коммерческого человеческого альбумина, называемая терапевтическим обменом плазмы, TPE, который одобрен FDA и регулярно используется в клинике [16–18]. И так, мы изучили образцы крови человека, которые были собраны до и после TPE, от четырех старых людей (65-70 лет). Ранее нами было установлено, что первичные миобласты мышей можно использовать для определения влияния белков, секретируемых клетками человека, на пролиферацию и дифференцировку миогенных клеток [15, 19, 20]. Здесь мы выполнили анализ пролиферации клеток на основе BrdU в первичных миобластах C57.B6, которые имеют чистоту более 95% по маркерам Pax7 / Myf5 / MyoD ([13] и дополнительная фигура 1). Эти клетки-предшественники мышц культивировали в OPTI-MEM с 4% PreTPE по сравнению с сывороткой человека PostTPE в течение 20 часов в тройных лунках двух повторяющихся 96-луночных планшетов (всего 6 повторов для каждой когорты, 15000 клеток на лунку). BrdU добавляли в течение последних 6 часов культивирования, после чего клетки фиксировали, проводили иммунообнаружение BrdU и использовали высокопроизводительную автоматизированную микроскопию для визуализации 9 участков каждой лунки и для последующего количественного определения данных.
Как показано на рисунке 2, старая человеческая сыворотка сильно снижала пролиферацию миогенных клеток (что согласуется с эффектами старой мышиной сыворотки [1, 2, 6, 7, 13]). Интересно, что одна процедура TPE сняла это ингибирование и позволила обеспечить надежную пролиферацию миогенных предшественников, которые культивировали со старой сывороткой PostTPE, например от того же человека (людей), чья сыворотка PreTPE была сильно ингибирующей.
Положительный контроль на пролиферацию миобластов (анализ BrdU на клетках в ростовой среде, GM), контроль без сыворотки (OPTI-MEM) и отрицательный контроль на неспецифическую флуоресценцию (анализ BrdU на миобластах в GM, которые не обрабатывали BrdU) показаны на дополнительном рис 1, который демонстрирует устойчивую пролиферацию миобластов при GM, хорошую пролиферацию при OPTI-MEM и подтверждает, что иммунофлуоресценция BrdU была высокоспецифичной.
Чтобы начать анализировать возможные механизмы, посредством которых разбавление крови старых млекопитающих физиологическим раствором и альбумином оказывает эти омолаживающие эффекты, мы исследовали, может ли эктопический альбумин (человеческий сывороточный альбумин, HSA) быть определяющим фактором. Во-первых, мы построили кривую дозы HSA, которая продемонстрировала, что эктопический альбумин не способствует пролиферации миобластов (Figure 2F). Основываясь на этой кривой дозы, мы добавили 4% HSA в наш анализ пролиферации миобластов (где клетки культивировали с 4% человеческой сывороткой до и после ТПЭ). Интересно, что, хотя по сравнению с PreTPE сыворотка PostTPE постоянно увеличивала пролиферацию миобластов, HSA не спасала пролиферацию культур миобластов PreTPE и не увеличивала пролиферацию культур после TPE (рис. 2).
Вестерн-блоттинг подтвердил, что сывороточный альбумин не снижается с возрастом (дополнительный рис 2), и нет чистого прироста альбумина в NBE / TPE, а скорее, обратное восполнение альбумина в сыворотке, обедненной процедурой. У людей уровень альбумина коррелирует с заболеванием, питанием и социально-экономическим статусом, а не с хронологическим возрастом; и даже если состояние здоровья и т. д. не учитывается, альбумин уменьшается лишь незначительно, на 2–4% в возрасте 75 лет по сравнению с его возрастом 26 лет [21–24].
Мы также рассмотрели антиоксидантные свойства сыворотки PreTPE по сравнению с сывороткой PostTPE. Альбумин обладает антиоксидантной активностью [16], и, таким образом, мы проверили, может ли сыворотка после TPE стимулировать пролиферацию миогенных клеток просто благодаря улучшенным антиоксидантным свойствам. Интересно, что мы не обнаружили антиоксидантных различий между сывороткой до и после TPE (дополнительный рис 3).
Эти результаты подтверждают, что NBE и TPE оказывают положительное влияние на миогенез у взрослых и что эктопический альбумин не спасает от порожденного старой сывороткой подавления миогенной пролиферации.
В оригинальной работе по омоложению старых животных и старению молодых через гетерохронный парабиоз эффекты были продемонстрированы не только для скелетных мышц, но также для печени и нейрогенеза мозга – гиппокампа [1, 7]. Данные нейрогенеза гиппокампа были рассмотрены в Nature в 2004 году [7], но не были опубликованы в 2005 году [1]; тем не менее, это было повторено и опубликовано в Nature в 2011 году [25]. Точно так же эффекты гетерохронного обмена крови были изучены со всеми этими тремя тканями, полученными из зародышевых слоев [9]. Таким образом, мы выполнили анализ нейрогенеза гиппокампа и состояния печени (степень адипозности и фиброза), чтобы выяснить, могут ли в отсутствие молодой крови быть какие-то иные омолаживающие эффекты помимо эффектов в скелетных мышцах.
Нейрогенез в субгранулярной зоне (SGZ) гиппокампа продолжается в течение всей взрослой жизни, резко снижается с возрастом и зависит от гетерохронности крови [7, 9, 14, 26]. Чтобы проанализировать влияние NBE на нейрогенез SGZ, пролиферацию клеток-предшественников нервной системы в SGZ Dentate Gyrus определяли количественно по всей толщине гиппокампа, используя иммуно-детекцию маркера пролиферации KI67 в последовательных криосекциях головного мозга (фиг. 3A, 3B). У мышей YY было ~ 10 раз больше клеток Ki67 + SGZ, чем у старых, как и ожидалось [9, 15, 26], и, в частности, наблюдалось значительное ~ 8-кратное увеличение нейрогенеза гиппокампа у старых мышей после однократного NBE, без статистического снижения нейрогенеза гиппокампа у молодых мышей (Figure 3A, 3B).
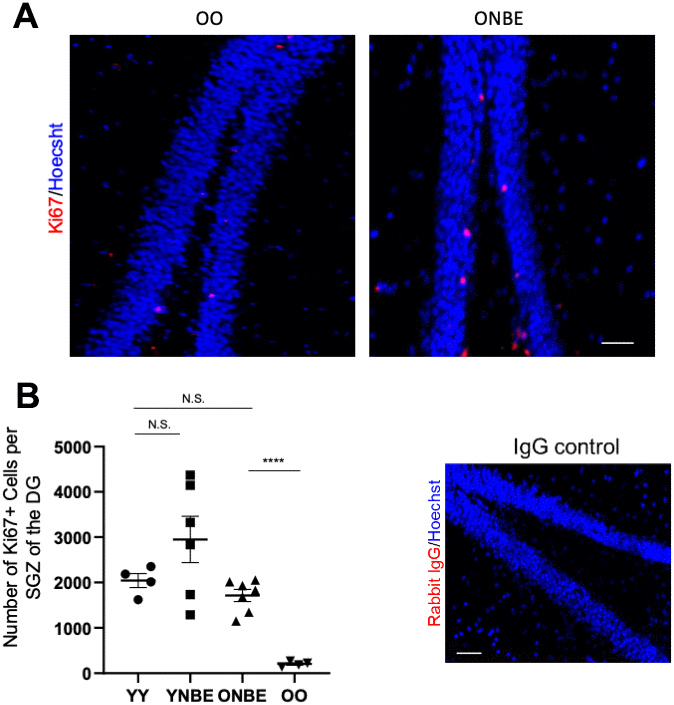 Рисунок 3. Нейрогенез у старых мышей усиливается одной процедурой нейтрального обмена крови. (A) Иммунофлуоресценцию проводили для анализа пролиферативных Ki67-позитивных клеток в субгранулярной зоне (SGZ) зубчатой извилины (DG). Репрезентативные изображения клеток Ki67 + (красный) + / Hoechst (синий) + в DG показаны для мышей OO и ONBE. (B) Количественное определение количества клеток Ki67 + / Hoechst + на SGZ DG (экстраполировано из последовательных срезов, которые охватывают весь гиппокамп). У мышей ONBE количество этих клеток увеличивается примерно в 8 раз по сравнению с OO (**** p-значение = 0,0000145). Количество этих пролиферирующих клеток-предшественников нейральных клеток в SGZ мышей YY существенно не отличается от числа мышей ONBE (значение N.S. p = 0,15235). Тенденция к увеличению ~ 44% у мышей YNBE по сравнению с мышами YY не является статистически значимой (N.S. = 0.20123). Отрицательный контроль IgG, соответствующий изотипу, подтверждает низкую неспецифическую флуоресценцию. N = 4 для YY и OO, N = 6 для YNBE и N = 7 для ONBE. Масштабная линейка составляет 50 микрон. Репрезентативные изображения для когорт YY против YNBE показаны на дополнительном рис 6. Эти данные демонстрируют, что нейрогенез гиппокампа улучшается у старых мышей после всего одного NBE, например, без молодой крови или ее фракций, и что молодые мыши не снижают этот параметр, когда их плазма крови разводится через NBE.
Рисунок 3. Нейрогенез у старых мышей усиливается одной процедурой нейтрального обмена крови. (A) Иммунофлуоресценцию проводили для анализа пролиферативных Ki67-позитивных клеток в субгранулярной зоне (SGZ) зубчатой извилины (DG). Репрезентативные изображения клеток Ki67 + (красный) + / Hoechst (синий) + в DG показаны для мышей OO и ONBE. (B) Количественное определение количества клеток Ki67 + / Hoechst + на SGZ DG (экстраполировано из последовательных срезов, которые охватывают весь гиппокамп). У мышей ONBE количество этих клеток увеличивается примерно в 8 раз по сравнению с OO (**** p-значение = 0,0000145). Количество этих пролиферирующих клеток-предшественников нейральных клеток в SGZ мышей YY существенно не отличается от числа мышей ONBE (значение N.S. p = 0,15235). Тенденция к увеличению ~ 44% у мышей YNBE по сравнению с мышами YY не является статистически значимой (N.S. = 0.20123). Отрицательный контроль IgG, соответствующий изотипу, подтверждает низкую неспецифическую флуоресценцию. N = 4 для YY и OO, N = 6 для YNBE и N = 7 для ONBE. Масштабная линейка составляет 50 микрон. Репрезентативные изображения для когорт YY против YNBE показаны на дополнительном рис 6. Эти данные демонстрируют, что нейрогенез гиппокампа улучшается у старых мышей после всего одного NBE, например, без молодой крови или ее фракций, и что молодые мыши не снижают этот параметр, когда их плазма крови разводится через NBE.
Это увеличение было больше, чем наблюдалось после гетерохронного парабиоза или через определенную фармакологию модуляции путей TGF-бета и окситоцина [15]. SGZ-локализация пролиферирующих клеток использовалась, как это обычно делается, для определения идентичности их клеток-предшественников нервных клеток [27]; Ki67 был ядерным, и неспецифическая иммунофлюоресценция контрольных изотипных IgG была незначительной (рис. 3 и дополнительный рис 6).
Чтобы продолжить исследование с эктопическим альбумином, мы выполнили анализ пролиферации BrdU с нейральными клетками-предшественниками, NPC, которые обеспечивают хорошую корреляцию in vitro с эффективностью нейрогенеза гиппокампа [15, 28]. Интересно, что при отсутствия воздействия на миогенные клетки, эктопический альбумин сам по себе усиливал пролиферацию NPC - в отсутствие сыворотки и улучшал пролиферацию NPC, когда в культурах присутствовала старая сыворотка (дополнительный рис 3B). Эти результаты согласуются с ранее опубликованным усилением пролиферации клеток-предшественников сетчатки альбумином [29] и с эффективной пролиферацией человеческих NPC, полученных из iPSC, при помощи электроспиннинга на волоконных каркасах из сывороточного альбумина [30].
Однако, совокупность опубликованных работ последовательно демонстрирует, что альбумин является негативным фактором для здоровья мозга. Что касается влияния на нервные клетки in vivo, то с возрастом гематоэнцефалический барьер становится протекающим [31, 32], и сывороточный альбумин пересекает его и обнаруживается в спинномозговой жидкости пожилых людей в положительной корреляции с возрастом и с определенными типами деменций. [33]. Более того, при непосредственном тестировании инфузии альбумина в мозг были вредными: вызывали нейровоспаление, повышенный уровень TGF-бета1 и нейрональные дисфункции [34].
В нашей работе общий уровень альбумина не был изменен, а скорее пополнен по сравнению с уровнями NBE / TPE, поэтому негативного воздействия на мозг не ожидалось.
Чтобы расширить наши данные по мышцам (мезодерме) и головному мозгу (эктодерме) до линии эндодермальных тканей и сравнить все с предыдущими экспериментами по гетерохронному парабиозу [1, 7] и гетерохронному обмену крови [9], мы изучили адипозность и фиброз печени в NBE в сравнении с изохронно обмененными кровью мышами. Известно, что адипозность и фиброз печени увеличиваются с возрастом и зависят от гетерохронности крови [1, 9, 14, 35–38].
Адипозность печени, или жир в печени, анализировали с помощью традиционно используемого окрашивания масляным красным (рис. 4, [9, 14, 28, 39]), а фиброз печени - с помощью иммунофлуоресценции альбумина / Хёхста, как опубликовано [2, 14] и показано в приложении. Рисунок 6, и дополнительно, трихом Массона (Рисунок 4). Адипозность и фиброз были выше в печени OO по сравнению с YY, как опубликовано [1, 9, 14]. Интересно, что после NBE эти показатели здоровья печени значительно улучшились у старых мышей и не ухудшились у молодых мышей (Рисунок 4).
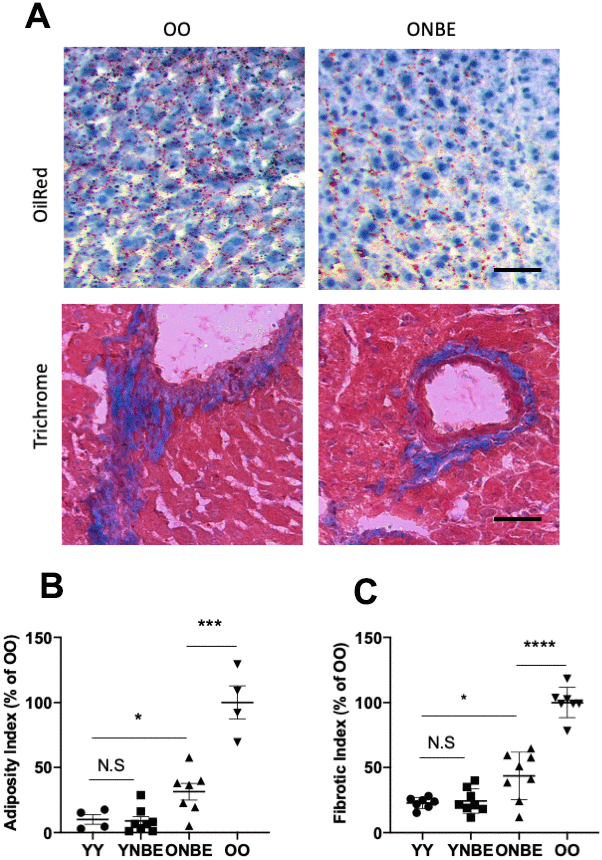 Рисунок 4. Адипозность печени и фиброз уменьшаются у старых мышей после одной процедуры нейтрального обмена крови. Гистологический анализ (окрашивание маслом Ред-О и трихромом Массона) срезов печени размером 10 мкм у неповрежденных мышей, собранных через 6 дней после NBE. (A) Репрезентативные изображения липидных капель (жира), окрашенных маслом Red-O и коллагеном (фиброз), окрашенных в синий цвет с трихромом Массона, показывают, что NBE заметно уменьшает адипозность и фиброз старой печени. (B) Индекс ожирения (красные пиксели на раздел) и (C). Фиброзный индекс (количество фиброзных кластеров на срез) определяли, как в [9] и показанным здесь трихромом. Ожирение: YY-YNBE NS p = 0,8, YY-ONBE * p = 0,04, OO-ONBE *** p = 0,0004. N = 4 YY и OO, N = 8 YNBE и ONBE. Фиброз: YY-YNBE NS p = 0,7, YY-ONBE * p = 0,012, OO-ONBE **** p = 0,00001. N = 8. Все кванты представлены как% от ОО контроля. Шкала бар = 50 мкм. Репрезентативные изображения для когорт YY в сравнении с YNBE и альбумина / Hoechst показаны на дополнительной иллюстрации 6.
Рисунок 4. Адипозность печени и фиброз уменьшаются у старых мышей после одной процедуры нейтрального обмена крови. Гистологический анализ (окрашивание маслом Ред-О и трихромом Массона) срезов печени размером 10 мкм у неповрежденных мышей, собранных через 6 дней после NBE. (A) Репрезентативные изображения липидных капель (жира), окрашенных маслом Red-O и коллагеном (фиброз), окрашенных в синий цвет с трихромом Массона, показывают, что NBE заметно уменьшает адипозность и фиброз старой печени. (B) Индекс ожирения (красные пиксели на раздел) и (C). Фиброзный индекс (количество фиброзных кластеров на срез) определяли, как в [9] и показанным здесь трихромом. Ожирение: YY-YNBE NS p = 0,8, YY-ONBE * p = 0,04, OO-ONBE *** p = 0,0004. N = 4 YY и OO, N = 8 YNBE и ONBE. Фиброз: YY-YNBE NS p = 0,7, YY-ONBE * p = 0,012, OO-ONBE **** p = 0,00001. N = 8. Все кванты представлены как% от ОО контроля. Шкала бар = 50 мкм. Репрезентативные изображения для когорт YY в сравнении с YNBE и альбумина / Hoechst показаны на дополнительной иллюстрации 6.
Эти результаты показывают, что NBE может оказывать положительное влияние, аналогичное влиянию молодой крови, на здоровье старой печени, и что разбавление молодой крови не уменьшает изученные признаки здоровья печени у молодых мышей.
В целом, эти результаты определяют массированное омоложение тканей путем однократной замены старой плазмы крови физиологической жидкостью: восстановление мышц улучшилось, фиброз был ослаблен, а подавление миогенной пролиферации было переключено на усиление; адипозность печени и фиброз были уменьшены; и нейрогенез гиппокампа был увеличен. Это омоложение похоже на то (печень) или сильнее (мышцы и мозг), чем то, которое наблюдается после гетерохронного парабиоза или обмена крови.
Эти результаты в наибольшей степени согласуются с выводом о том, что измененная в связи с возрастом системная среда тормозит здоровье и восстановление множества тканей у старых мышей, а также оказывает доминирующее прогерическое действие на молодых партнеров при парабиозе или обмене крови.
Чтобы выяснить молекулярный механизм этого быстрого омоложения всех трех тканей, полученных из зародышевых слоев, мы выполнили сравнительную протеомику массива антител на мышиной и человеческой сыворотке, которые были получены до и после NBE / TPE, а также на мышиной сыворотке YY и OO ( Рисунок 5). Белки низкого, среднего и высокого уровней детектируются с высокой чувствительностью (высокий динамический диапазон) в этой установке, как показано на рисунке 5, дополнительном рис 4 и дополнительной таблице 1.
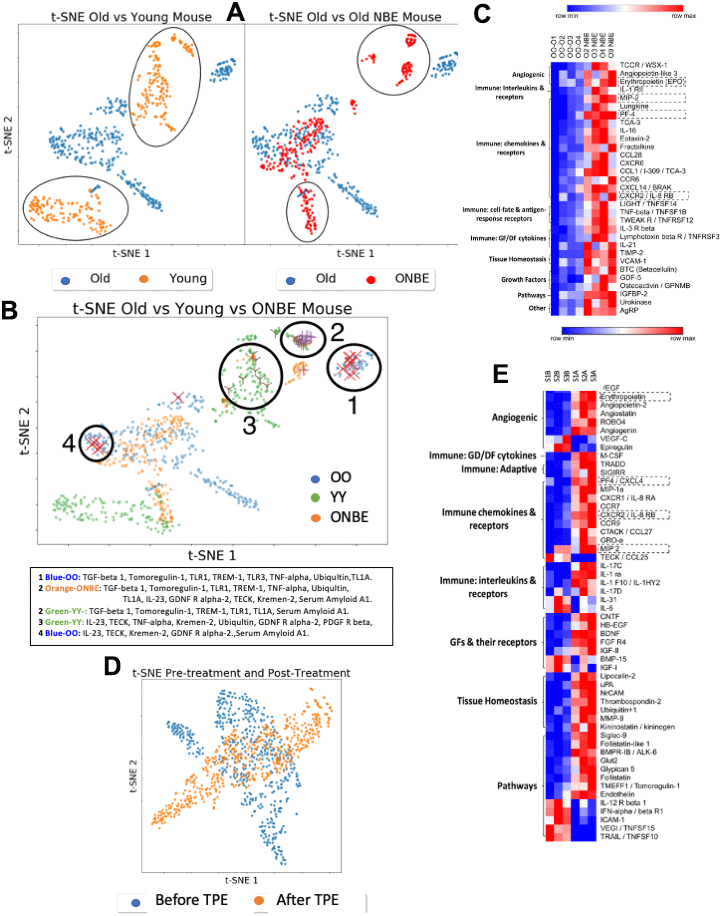 Рисунок 5. Сравнительная протеомика NBE / TPE. Уровни сыворотки 308 мышиных белков (Raybiotech # L-308) и 507 человеческих белков (Raybiotech # L-507) были проанализированы. После вычитания фона суммарные интенсивности для каждого белка (проанализированные в двух экземплярах для каждого образца) были нормализованы для контроля фона внутреннего массива в виде приращений с кратностью с уменьшением чувствительности в 2 раза; эти нормализованные интенсивности выражали как долю внутреннего массива положительного контроля. (A) кластеризация t-SNE мышиных белков, сгруппированных по классам лечения: изохронные контроли OO и YY сравнивали друг с другом (слева), а OO сравнивали с ONBE (справа). Описаны различия между протеомами YY против OO и OO против ONBE. (B) Различная группировка протеомов OO, YY и ONBE показана на графике t-SNE с идентичностью белков в кластерах 1-4, указанных ниже. Анализ статистической мощности на независимость белков, отмеченных X, X и Y, из этих кластеров показан на дополнительном рис 4. (C) Тепловая карта белков мыши иллюстрирует существенные различия между когортами OO и ONBE (белки сгруппированы по своей основной функции, как указано) , (D) Старый сывороточный протеом человека перед TPE (до-B) и через 1 месяц после одной процедуры TPE (после-A): кластеризация t-SNE белков человека, сгруппированных по классам терапии. TPE привел к четкому и устойчивому изменению молекулярного состава системной среды по сравнению с до-TPE. (E) Тепловая карта белков человека иллюстрирует существенные различия между группами S1,2,3 B и S1, 2, 3 A (до и после TPE) (белки сгруппированы по своей основной функции, как указано). Белки в пунктирных клетках одинаковы между мышью и человеком в тепловых картах. Наблюдалось общее повышение (не уменьшение) большинства системных белков через 6 дней после NBE и через 1 месяц после TPE.
Рисунок 5. Сравнительная протеомика NBE / TPE. Уровни сыворотки 308 мышиных белков (Raybiotech # L-308) и 507 человеческих белков (Raybiotech # L-507) были проанализированы. После вычитания фона суммарные интенсивности для каждого белка (проанализированные в двух экземплярах для каждого образца) были нормализованы для контроля фона внутреннего массива в виде приращений с кратностью с уменьшением чувствительности в 2 раза; эти нормализованные интенсивности выражали как долю внутреннего массива положительного контроля. (A) кластеризация t-SNE мышиных белков, сгруппированных по классам лечения: изохронные контроли OO и YY сравнивали друг с другом (слева), а OO сравнивали с ONBE (справа). Описаны различия между протеомами YY против OO и OO против ONBE. (B) Различная группировка протеомов OO, YY и ONBE показана на графике t-SNE с идентичностью белков в кластерах 1-4, указанных ниже. Анализ статистической мощности на независимость белков, отмеченных X, X и Y, из этих кластеров показан на дополнительном рис 4. (C) Тепловая карта белков мыши иллюстрирует существенные различия между когортами OO и ONBE (белки сгруппированы по своей основной функции, как указано) , (D) Старый сывороточный протеом человека перед TPE (до-B) и через 1 месяц после одной процедуры TPE (после-A): кластеризация t-SNE белков человека, сгруппированных по классам терапии. TPE привел к четкому и устойчивому изменению молекулярного состава системной среды по сравнению с до-TPE. (E) Тепловая карта белков человека иллюстрирует существенные различия между группами S1,2,3 B и S1, 2, 3 A (до и после TPE) (белки сгруппированы по своей основной функции, как указано). Белки в пунктирных клетках одинаковы между мышью и человеком в тепловых картах. Наблюдалось общее повышение (не уменьшение) большинства системных белков через 6 дней после NBE и через 1 месяц после TPE.
Многомерный анализ t-SNE и тепловое картирование этих данных выявили, что протеом ONBE значительно отличался от ОО и восстановил некоторые сходства с протеомом YY (рис. 5А-5С). Дополнительный рисунок 4 подтверждает статистическую значимость этой сравнительной протеомики с помощью анализа мощности и показывает тепловую карту YY vs. OO, где возрастные различия менее выражены, чем различия между OO и ONBE, снова подчеркивая сильное влияние NBE на молекулярный состав системной среды.
Что касается данных на мышах, O человека до TPE также сильно отличался от O после TPE, что привело к значительному изменению состава циркулирующих белков человека через один месяц после одной процедуры (рис. 5D, 5E; и дополнительная таблица 1). Эволюционно-консервативным способом у мышей и людей ангиогенные регуляторы, иммунорегуляторы и факторы роста (включая нейрогенные) были изменены в их системных уровнях. Несколько NBE / TPE измененных белков были одинаковыми у обоих видов. Очень интересно, что хотя мы разводили сыворотку крови, многие из модулированных NBE / TPE белков были усилены (Рисунок 5, Дополнительный рисунок 4 и Дополнительная Таблица 1), что позволяет предположить, что их продукция или секреция были ингибированы системными, повышающимися с возрастом, факторами у мышей и у людей.
Предполагается, что возрастное увеличение VCAM-1 объясняет негативное влияние кровообращения на мозг [40]. Мы наблюдали сходные уровни VCAM-1 (p = 0,953) между молодой и старой сывороткой, что было подтверждено вестерн-блоттингом (дополнительный рис 5), а также повышение (не уменьшение) VCAM-1 после NBE, то есть, когда старые ткани у мышей были омоложены (рис. 5, рис. 2–4). Учитывая, что VCAM-1 в крови мало изменяется с возрастом, маловероятно, что NBE действует посредством юношеской нормализации этого белка клеточной поверхности, который может попасть в кровоток. В TPE не было значительных изменений в VCAM-1 по сравнению с до процедуры (p = 0,072675), и, аналогично, мы не видели различий в CCL11 [25]. Следует отметить, что другой белок клеточной поверхности был вовлечен в старение мозга, B2M [41], инвариантная цепь молекулы MHC класса I, что свидетельствует о значительно уменьшенном воспалении [9, 42]. Мы показали, что системные уровни B2M не увеличиваются в кровообращении у старых мышей по сравнению с молодыми; и обмен старых мышей с молодой кровью снижает тканевые уровни B2M [9].
Эта работа сдвигает парадигму гетерохронности крови от доминирования молодых факторов крови и устанавливает, что замена большого объема старой крови физиологической жидкостью нейтрального возраста (физиологический раствор с добавлением 5% очищенного альбумина) достаточна для большинства, если не для всех положительных эффектов, наблюдаемых на мышцах, мозге и печени. Важно отметить, что одобренная FDA в настоящее время процедура способствует молекулярному и функциональному омоложению крови у пожилых людей с улучшением протеомного профиля и поддержкой миогенных реакций.
Многообещающая работа в стадии выполнения неожиданно показала, что TPE анекдотически сводил случаи вирусных заболеваний к нулю у пациентов в течение года, когда только для связанных с гриппом госпитализаций ~ 60% были из той же возрастной группы (https: // www. cdc.gov/flu/about/season/flu-season-2017-2018.htm). TPE обладает потенциалом для улучшения выздоровления от вирусных и иных заболеваний, особенно у пожилых людей, через различные пути, включая изменения цитокинов, интерлейкинов, профилей факторов роста и усиленного иммунитета, а также восстановление ослабленного вирусной инфекцией рецептора окситоцина [43] посредством эффективного ослабления пути TGF-бета [14]. Наши данные также свидетельствуют о лучшем миогенезе, ангиогенезе и васкуляризации тканей в пожилом возрасте, следовательно, улучшается общее состояние и восстановление органов, прогнозируется лучший успех вакцинации.
Наше пилотное долговременное исследование на выборках из нескольких пожилых людей выдвигает на первый план самые сильные эффекты TPE, которые наблюдаются даже при этом небольшом размере выборки, освещая направление для будущей работы, в классической традиции тематических и пилотных исследований. Клинические испытания фазы 2B и фазы 3 активно развиваются; это позволит обобщить наши результаты на прогноз результатов вакцинации и улучшение выздоровления от вирусных заболеваний.
Это исследование не исключает возможности того, что факторы, которые присутствуют в молодой крови, а также совместное использование молодых органов и обогащение окружающей среды, также могут способствовать омолаживающим эффектам гетерохронного парабиоза. Еще предстоит определить, на самом ли деле и в какой степени NBE / TPE улучшают нейрональную дифференцировку, нейропластичность и когнитивную функцию, метаболическое здоровье в целом, не только в части адипозности и фиброза печени, а также здоровье и поддержание других тканей, которые, как сообщалось, омолодились при гетерохронном парабиозе.
Интересно, что один NBE значительно не ухудшает исследуемые параметры у молодых мышей; хотя более высокая вариабельность между мышами YNBE обнаружена для всех исследованных тканей по сравнению с когортой YY. Таким образом, молодые животные могут быть способны компенсировать, при разных индивидуальных степенях, одно разведение их обогащенной тромбоцитами плазмы (возможно, повышающую регуляцию экспрессии генов для компенсаторного повышения продукции белка и / или секреции). Более высокий диаметр миофибрила был обнаружен в YNBE по сравнению с YY, что может отражать различия в миогенной пролиферации и / или дифференцировке.
Функциональные фенотипы и сравнительная системная протеомика предполагают некоторую эволюционную консервацию и помогают объяснить быструю и глубокую перезагрузку системной среды, сопровождающуюся омоложением тканей путем обмена старой крови с солевым альбумином. Мы моделируем это на рис. 6, где многие системные возрастные белки, такие как семейство TGF-бета [7, 14, 1544–47], являются известными аутоиндукторами, а разведение будет уменьшать их экспрессию, и обратная связь будет снижать уровни на длительное время [48–56]. Следовательно, их вторичные мишени - другие белки, экспрессия которых была ингибирована в старости (такие как «молодые» факторы, необходимые для поддержания и восстановления тканей), становятся активированными и увеличиваются (как мы действительно наблюдаем для многочисленных белков); и целые пути (например, MAPK) больше не захватываются для неканонической индукции TGF-бета, Smad1 и воспаления [57, 58], а вместо этого участвуют в продуктивной передаче сигналов своими родственными лигандами, способствуя здоровью тканей, регенерации и гомеостатической продукции цитокинов и факторов роста [59–61] (с их собственной положительной обратной связью), как мы наблюдаем. Когда уровни лиганда (ов) уменьшаются, аттенюаторы также уменьшаются, а рецепторы увеличиваются [62, 63]; перезагрузка передачи сигналов индуцирует негативные регуляторы, как мы наблюдали для фоллистатина и ему подобных, вторично уменьшая интенсивность возрастных путей [64–66]. При многообразных обратных связях и различных периодах полураспада белка мы не ожидаем, что изменения в каждом аутоиндуктивном белке, вторичной мишени, рецепторе и т. д. будут обнаруживаться одновременно в любой момент времени, но многие действительно наблюдаются через 6 дней после NBE и через 1 месяц после TPE.
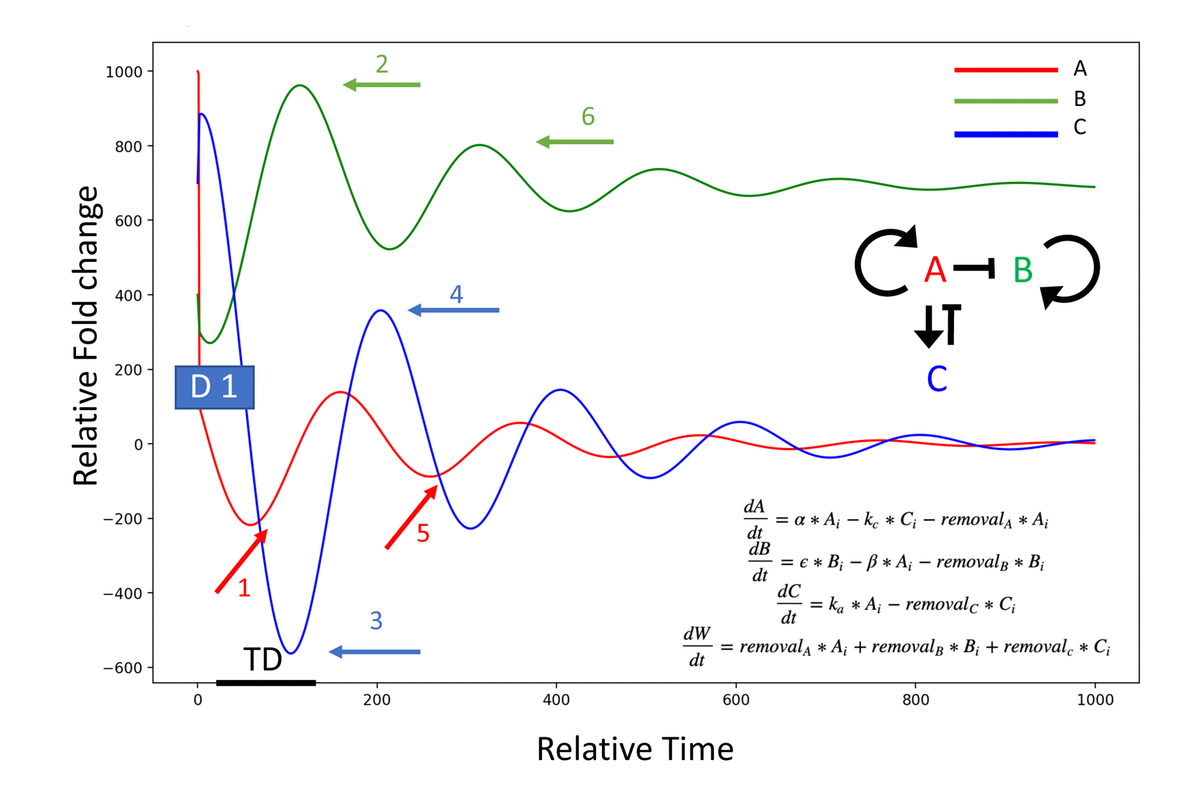 Рисунок 6. Модель эффекта разведения при сбросе кровеносного протеома. Система: A индуцирует себя (A, красный) и C (синий); A подавляет B (зеленый), C подавляет A. Разведение белка повышенного в связи с возрастом (A, на D1: событие начального разведения), нарушает аутоиндукцию и снижает уровень A (событие 1, красная стрелка); вторичная цель A (B, в событии 2 зеленая стрелка) затем становится дерепрессированной и повышается (B индуцирует B, постулируется); аттенюатор A (C, на событии 3 синяя стрелка) имеет уменьшенную задержку по времени (TD), поскольку он является внутриклеточным и не был немедленно разбавлен, а некоторые уровни белка сохраняются даже после более низкой индукции C при помощи A. C уменьшается (больше не индуцируется A), и перезагрузка A приводит к реиндукции C при помощи A (синяя стрелка события 4), ведущая к вторичному снижению интенсивности сигнализации A / автоиндукции и вторичной восходящей волне B (события 5 красная стрелка и 6 зеленая стрелка соответственно).
Рисунок 6. Модель эффекта разведения при сбросе кровеносного протеома. Система: A индуцирует себя (A, красный) и C (синий); A подавляет B (зеленый), C подавляет A. Разведение белка повышенного в связи с возрастом (A, на D1: событие начального разведения), нарушает аутоиндукцию и снижает уровень A (событие 1, красная стрелка); вторичная цель A (B, в событии 2 зеленая стрелка) затем становится дерепрессированной и повышается (B индуцирует B, постулируется); аттенюатор A (C, на событии 3 синяя стрелка) имеет уменьшенную задержку по времени (TD), поскольку он является внутриклеточным и не был немедленно разбавлен, а некоторые уровни белка сохраняются даже после более низкой индукции C при помощи A. C уменьшается (больше не индуцируется A), и перезагрузка A приводит к реиндукции C при помощи A (синяя стрелка события 4), ведущая к вторичному снижению интенсивности сигнализации A / автоиндукции и вторичной восходящей волне B (события 5 красная стрелка и 6 зеленая стрелка соответственно).
Приведенная выше концепция хорошо согласуется с возрастным увеличением количества системных лигандов семейства TGF-бета (например, GDF11 и TGF-бета 1), что способствует прогероническим фенотипам [7, 14, 1544–47] и тем фактом, что ослабление передачи сигналов TGF-бета у старых животных имеет эффекты, подобные эффектам NBE [7, 14, 15, 28, 44]. Также прогнозируется, что NBE будет способствовать более сильному омоложению, чем ингибитор Alk5, поскольку он ослабляет только одну ветвь одного пути, и поскольку белки, отличные от семейства TGF-бета, которые повышаются с возрастом, будут перенастроены на более молодые уровни экспрессии генов и / или интенсивность передачи сигналов NBE / TPE (подлежит профилированию в будущем). Подбор модели, показанной на рисунке 6, с экспериментальными данными в нескольких временных точках после NBE / TPE для нескольких белков и нескольких уровней регуляции (мРНК, белка, интенсивности передачи сигналов), является центром нашей долгосрочной работы.
Также вполне возможно, что множественные механизмы способствуют омоложению трех тканей зародышевого слоя с помощью NBE, причем описанная выше модель является всего лишь одним. Например, хотя мы не видим эффекта в миогенезе, эктопический альбумин может способствовать усилению иммунитета при NBE / TPE, особенно после нескольких процедур in vivo. Было положительное влияние альбумина на пролиферацию NPC, что согласуется с опубликованными результатами; и тем не менее доставка эктопического альбумина ухудшает здоровье мозга, а альбумин CSF является маркером старения и болезней мозга. В целом, не похоже, что альбумин является единственным детерминантом NBE / TPE, но он может внести свой вклад, особенно когда возрастные факторы становятся разбавленными.
Следует отметить, что мы группировали белки свободно, так как многие из них являются плейотропными и играют роль в более чем одной функциональной группе. Например, липокалины являются гомеостатическими переносчиками липофильных молекул, но также играют роль в продуктивном врожденном иммунитете [67], а бета-рецептор IL-8, также известный как CXCR2, играет роль в иммунных реакциях, ангиогенезе и имеет перекрестные контакты с сигнальными путями PI3K, p38 / ERK и JAK / Stat [68].
Что касается белков, одинаковых у мышей и людей и модулированных в одном и том же направлении NBE и TPE, увеличение эритропоэтина, вероятно, улучшит количество и здоровье эритроцитов, ослабляя возрастную анемию [69] , MIP2 контролирует миграцию нейтрофилов в места воспаления, и его увеличение может помочь устранить воспаление [70]. PF4 способствует агрегации тромбоцитов, он широко хемотаксический, играет роль в заживлении ран и обладает антимикробной активностью [71]. Передача сигналов рецептора IL-8 способствует выживанию клеток, миграции, хемотаксису, ангиогенезу, позиционированию олигодендроцитов и может ослаблять нейропатию [72].
Говоря об общих категориях белков, ожидается, что увеличение ангиогенных регуляторов в целом будет способствовать улучшению васкуляризации [73, 74] и, благодаря этой усиленной перфузии тканей, восстановлению тканей. Иммунные регуляторы способствуют лучшему наблюдению и очистке раны во многих тканях [75, 76]. Увеличение нейротрофических факторов роста BDNF и CNTF, а также GDF5, который широко и позитивно регулирует образование хряща, коричневого жира и нейронов аксонов и дендритов, имеет значение для лучшего поддержания и восстановления повреждений в ЦНС и периферии.
Модуляция нескольких ключевых регуляторных путей клеточной судьбы, включая ослабление передачи сигналов pSmad2,3 фоллистатином, важна для пролиферации и регенерации продуктивных клеток в скелетных мышцах, сердце и в целом по всему организму [77–79]. Также, фоллистатин-родственный протеин обладает широкими противовоспалительными свойствами [80], которые, как ожидается, также будут способствовать улучшению здоровья млекопитающего. Точно так же общие положительные эффекты ожидаются от повышения TPE Tomoreguilin-1, который противодействует передаче сигналов Nodal и Junk, а также,как было показано, противодействует гипертрофии сердца [81], необходим для формирования и поддержания ЦНС [82], и является нейропротективным, связывая токсичный амилоид бета (болезнь Альцгеймера) [83].
Наконец, улучшенное поддержание тканей обычно сопровождается здоровым ремоделированием [77, 84, 85], что подчеркивает значимость того, что MMP9, VCAM-1, TIMP2 и тромбоспондин модулируются NBE и / или TPE. Следует отметить, что в то время как мы наблюдали увеличение TIPM2 после NBE (рис. 4), например, в соответствии с более активным ремоделированием ткани, на исходном уровне не было никаких возрастных изменений в TIMP-2 (p = 0,217 YY против OO) ,
В целом, акцент на системную протеомику «до» и «после» определил ключевые изменения, которые коррелируют и логически соответствуют быстрому и устойчивому омоложению множества тканей. Возможно, что многие наблюдаемые молекулярные системные изменения одновременно необходимы для улучшения поддержания и здоровья старых тканей, или, в качестве альтернативы, меньшие группы этих белков могут быть достаточными для омоложения нескольких тканей.
Теоретическая значимость этого исследования заключается в лучшем понимании того, каким образом гетерохронность крови быстро и глубоко омолаживает старых млекопитающих, а клиническая значимость этой работы заключается в развитии TPE, как нового способа эффективного улучшения здоровья и восстановления органов у пожилых людей, предотвращающего болезни, которые развиваются или становятся более серьезными в последующие десятилетия жизни.
Материалы и методы
животные
Все эксперименты и процедуры in vivo выполнялись в соответствии с политикой, установленной Управлением по уходу за лабораторными животными, и в соответствии с утвержденным протоколом. Молодые самцы мышей C57BL / 6 (в возрасте 2 месяца) были приобретены в лаборатории Джексона, в то время как мыши в возрасте (18 месяцев) были приобретены в Национальном институте старения.
Образцы человеческой крови (собранные через FDA, одобренные и регулярно используемые в клинической процедуре терапевтического плазменного обмена [16–18]), были предоставлены нам доктором Добри Кипровым без личных идентификаторов и не были связаны или прослежены к любой личной информации в нашем исследовании протеомики. Работа с кровью человека выполнялась в соответствии с утвержденным протоколом разрешения на биологическое использование.
Обмен крови проводился как в [9]. Вкратце, мышей предварительно анестезировали бупренорфином и анестезировали изофлураном в кислороде до полного расслабления. Глазную мазь наносили на каждый глаз, чтобы предотвратить высыхание. В яремную вену вводили гепаринизированный катетер с 1 по 3 Fr (Instech Labs, C10PU-MJV1403) и хвостовую лигатуру затягивали, чтобы удерживать катетер на месте. После подтверждения проходимости делается дополнительная черепная лигатура для фиксации катетера на месте. Антибиотическая мазь с лидокаином была нанесена на сайт. Мышей снимали с анестезии и вводили подкожный мелоксикам (5 мг / кг с.кв.) в течение 7 дней после процедуры. Кровь от молодых или пожилых донорских мышей получали путем терминальной пункции сердца и антикоагулировали 3 единицами гепарина. Образцы крови центрифугировали по 500g в течение 5 минут. Фракции плазмы, обогащенные тромбоцитами, осторожно удаляли, осадки клеток крови ресуспендировали в нормальном физиологическом растворе и затем снова вращали при 500 g в течение дополнительных 5 минут. Соляной слой удаляли, а осадок клеток крови затем ресуспендировали в равном объеме 5% MSA в физиологическом растворе, 0,9% хлорида натрия. По данным производителя, запасной альбумин имеет чистоту> 95% (https://mol-innov.com/products/albumin-mouse-plasma/). Эти смеси крови пропускали через 50-миллиметровую пробирку с сетчатым колпачком FACS, чтобы отделить клетки и отфильтровать любые сгустки. Экстракорпоральный обмен крови проводился между парами молодых мышей, парами старых мышей и молодыми мышами или старыми мышами и пробиркой с синхронизированными клетками крови в 5% MSA через несколько часов после операций. Эти процедуры обмена были выполнены аналогично тому, как ранее опубликовано [9].
Экспериментальное повреждение мышц
Мышцы Tibialis anterior (TA) мышей были повреждены внутримышечными инъекциями кардиотоксина (CTX; Sigma Aldrich). 10 мкл CTX вводили на ТА при 0,1 мкл / мл. ТА были изолированы через пять дней после травмы.
Анализ BrdU проводили как в [15, 20]
Первичные миобласты C57.B6, полученные из мышечных сателлитов, высевали в OPTI-MEM с 4% человеческой сывороткой на покрытые матригелем прозрачные пластиковые 96-луночные планшеты Greiner при 15000 клеток / лунку в течение 20 часов. Человеческий сывороточный альбумин добавляли в некоторые лунки при 4%. BrdU добавляли в течение последних 6 часов культивирования. Клетки фиксировали 4% PFA в течение 5 минут и 70% EtOH в течение 15 минут. 3М HCl использовали в течение 30 минут. Блокирование осуществляли с использованием 1% BGS в PBS (окрашивающий буфер) в течение 1 часа. Клетки инкубировали с первичными антителами против BrdU крысы в концентрации 0,5 мкг / мл в PBS, 1% BGS в течение ночи при 4 ° С; и затем, после трехкратного промывания, вторичными антителами (козлиными крысиными) в концентрации 0,5 мкг / мл и Hoechst at в PBS, 1% BGS в течение 1,5 часов при комнатной температуре. Клетки промывали 3 раза PBS на каждой стадии смены буфера. Клетки визуализировали с помощью Image Xpress Micro (IXM), так что изображения получали в 9 местах на лунку 96-луночных планшетов. Количественную оценку проводили с использованием MetaXpress для процента положительных по BrdU клеток (TRIT-C) из всех клеток (Hoechst). Один выброс с очень низким числом ячеек, например одна скважина (из 6) для одного образца была удалена из анализа данных. ImageJ использовался для равных настроек яркости и контрастности репрезентативных изображений.
Клетки-предшественники крыс культивировали на предметных стеклах в базальной среде с указанным процентом старой мышиной сыворотки и / или очищенного мышиного сывороточного альбумина (5% маточного раствора в физиологическом растворе, например, «4% альбумина» составляет 4% от 5% раствора) , Культуры акклиматизировали в течение дня и BrdU добавляли в течение ночи, затем культуры фиксировали в 4% параформальдегиде с последующим добавлением 70% этанола. Образцы подвергали иммуноокрашиванию на BrdU с использованием кислотного извлечения антигена, и% BrdU + ve клеток подсчитывали и оценивали два слепых исследователя с усреднением результатов.
Тканевая изоляция
Мыши были принесены в жертву в соответствии с руководящими принципами администрации OLAC Калифорнийского университета в Беркли. Кровь собирали путем терминальной пункции сердца и позволяли сворачиваться при комнатной температуре в течение 30 минут. Сыворотку крови для протеомного анализа получали центрифугированием образцов свернутой крови со скоростью 5000 g в течение 5 минут. Была проведена посмертная изоляция мышц, печени и мозга. Ткани помещали в оптимальную температуру резания с помощью tissue-tek (OCT, Sakura Finetek, Нидерланды) и быстро замораживали в изопентане, охлажденном до -70 ° C сухим льдом.
Раздел ткани
Внедренные ОКТ ткани были разрезаны с помощью криостата. Мышцы и печень были срезаны до толщины 10 мкм, а венечные срезы головного мозга были получены при 25 мкм. Срезы тканей прикрепляли к дополненным золотом положительно заряженным предметным стеклам на предметных стеклах при подготовке к иммунофлуоресценции или гистологическому анализу.
Окрашивание гематоксилином и эозином
Окрашивание H & E проводили, как описано ранее [9, 14]. Предметные стекла с установленными срезами мышечной ткани обезвоживали в 70% этаноле в течение 3 минут и затем в 95% этаноле в течение 30 секунд. Ткани повторно гидратировали в деионизированной воде в течение 1 мин, а затем помещали в гематоксилин на 5 мин и 1X воду Скотта на 1 мин. Предметные стекла промывали водой в течение 1 минуты, обрабатывали эозином в течение 4 минут и снова промывали водой в течение 30 секунд. Конечную серию дегидратации, состоящую из 70%, 95% дважды, 99 и 100% этанола, проводили в течение 1 мин каждая. Срезы промывали ксилолами дважды, по 1 мин каждый. 2 капли монтажной среды 50% смолы / 50% ксилолов добавляли к каждому предметному стеклу и помещали стеклянные покровные стекла. Места травм были отображены соответственно.
Антитела и маркирующие реагенты
Следующие антитела использовали в дозе 0,5-1 мкг / мл:
- Альбумин: R & D Systems, мышь, MAB1455, 1: 1000 для иммунофлюоресценции, 1: 2000 для вестерн-блоттинга.
- αRat-BrdU (Abcam ab6326)
- Тяжелая цепь эмбрионального миозина: клон F1.652, банк развития гибридом, Университет Айовы, депонировано Blau, HM) 1: 100
- Ki67: Abcam, Rabbit, ab16667, 1: 200
- Sox2: R & D Systems, мышь, MAB2018, 1:50
- VCAM1: Abcam, Rabbit, ab134047, 1: 2000
- Соответствующие изотипу IgG: Сигма Олдрич, Мышь и Кролик, 1: 500 и 1: 1000 соответственно
- Donkey anti-mouse Alexa 488: Life Technologies, Invitrogen, Eugene, Oregon, A21202, лот № 1975519, 1: 2000
- вторичное антитело козы против мышиного IgG (H + L), HRP, Invitrogen # 62-6520, 1: 2000
- вторичное антитело к кроличьему IgG (H + L), HRP, Invitrogen # 65-6120, 1: 2000
- Ослиный кролик против кролика Alexa 546: Life Technologies, Invitrogen, Юджин, Орегон, A10040, лот № 1946340, 1: 2000
- Коза анти-Крыса 546, Abcam ab150165.
Краситель Hoechst был использован для окрашивания ДНК: Hoechst 33342, Sigma Aldrich (B2261), 1: 1000
Тканевые срезы для иммунофлюоресценции
Все срезы тканей для иммунофлуоресцентного исследования были установлены на положительно заряженных золотых суперпростом предметных стеклах.
мышцы
Срезы мышц толщиной 10 мкм блокировали в 1% окрашивающем буфере (1% сыворотки теленка в 1X PBS) в течение 45 минут при комнатной температуре без фиксации или пермеабилизации. Образцы покрывали первичными антителами и инкубировали при 4 ° С в течение ночи. Предметные стекла промывали в окрашивающем буфере и затем покрывали вторичными в течение 2 часов при комнатной температуре на следующий день. Примечание: мышечные срезы, окрашенные для тяжелой цепи эмбрионального миозина (eMyHC), не были фиксированными или проницаемыми; их блокировали, как указано, и непосредственно обрабатывали антителами против eMyHC.
Печень
Срезы печени толщиной 10 мкм фиксировали в 70% этаноле в течение ночи и промывали 1X PBS на следующий день. Срезы печени пронизывали 0,1 тритоном Х-100 в течение 5 минут на льду, блокировали окрашивающим буфером в течение 45 минут при комнатной температуре, затем инкубировали с первичными антителами в течение ночи при 4 ° С. Образцы промывали окрашивающим буфером и покрывали вторичными, как отмечено.
Головной мозг
Срезы мозга толщиной 25 мкм фиксировали 4% параформальдегидом (PFA) в течение 4 минут в темноте при комнатной температуре. Срезы промывали в обильных количествах 1X фосфатно-солевом буфере (PBS) и затем проникали через 0,1% Triton X-100 в течение дополнительных 5 минут на льду. Образцы тщательно промывали 1X PBS и блокировали в 1% окрашивающем буфере в течение 45 минут при комнатной температуре. Срезы головного мозга инкубировали с первичными антителами в течение ночи при 4 ° С. На следующий день срезы трижды промывали окрашивающим буфером и покрывали вторичными антителами, как описано.
Все образцы
Добавляли 2 капли монтажной среды Fluoromount (Sigma F4680) и на каждом предметном стекле помещали покровные стекла после заключительной промывки окрашивающим буфером вторичных антител и инкубации Hoechst. Для получения изображений использовали флуоресцентный микроскоп Zeiss Axioscope.
Масло Ред-О окрашивание
Окрашивание маслом Red-O проводили, как описано ранее [9, 14]. 10 мкм срезы печени регидратировали в 1X PBS в течение 5 минут. Эти срезы промывали в 60% изопропаноле в течение 15 минут, помещали в окрашивающий раствор Oil Red-O на основе изопропанола в течение 15 минут и, наконец, еще раз промывали в 60% изопропаноле в течение 5 минут. Одну минуту промывки гематоксилином окрашивали ядра в этих срезах печени. Заключительную промывку деионизированной водой проводили. К предметным стеклам добавляли 2-3 капли фторсодержащего монтажного средства, помещали покровные стекла и образцы визуализировали.
Массон Трихромное окрашивание
Окрашивание в трихроме Массона проводили согласно протоколу производителя. Вкратце, срезы печени 10 мкм фиксировали в растворе Боуина в течение 1 часа при 56 ° С, затем окрашивали в железном гематоксилине Вейгерта в течение 10 минут, в фибсине алого кислоты Бибриха в течение 15 минут, в растворе фосфомолибденфосфорновольфрамма в течение 15 минут, а затем раствор анилинового синего в течение 10 минут и промывают в 1% растворе уксусной кислоты в течение 5 минут. Срезы печени окончательно обезвоживали в 70%, 95% и 100% этиловом спирте и очищали в ксилоле. К предметным стеклам добавляли 2-3 капли фторсодержащего монтажного средства, помещали покровные стекла и образцы визуализировали.
Протеомика массива антител
Мышиные сывороточные уровни 308 белков (стеклянная матрица L-308, RayBiotech, Norcross, GA, USA) и человеческие сывороточные уровни 506 белков (матрица L-506) были измерены в соответствии с инструкциями производителя. Вкратце, равные объемы соответствующего образца сыворотки были подвергнуты диализу, биотинилированию и повторному диализу. Мембраны матрицы обрабатывали блокирующим буфером в течение 1 часа с последующей инкубацией в течение ночи при 4 ° C с образцом биотинилированной сыворотки. После промывки матрицы инкубировали со флуоресцентным красителем Cy3, конъюгированным со стрептавидином, в течение 2 часов при комнатной температуре. Наконец, высушенные предметные стекла сканировали с использованием сканера GenePix 4000B от Molecular Devices для получения интенсивностей флуоресценции и получения изображений соответствующих массивов. Microsoft Excel был использован для анализа данных. После вычитания фона общие интенсивности для каждого белка были нормализованы до отрицательного контроля в виде кратных приращений с отсечением в 2 раза в качестве значительного увеличения. Наконец, соответствующие интенсивности были нормализованы к положительному контролю для сравнения с различными образцами в соответствующих группах.
Вестерн-блоттинг
Образцы мышиной сыворотки готовили путем разведения образцов 1:10 и 1: 100 в 1X Laemmli и нагревания образцов до 95 ° C в течение десяти минут. 10 мкл каждого образца наносили на сборные 4–20% гели TGX (Bio-Rad) и переносили на поливинилидендифторидные мембраны 0,45 мкм (Millipore). Чтобы заблокировать мембрану, ее инкубировали в PBS с 0,1% Твин-20 и 2% бычьего сывороточного альбумина в течение одного часа. Первичные антитела (мышиный анти-VCAM-1 и кроличьи антиальбумин) разводили 1: 2000 в PBS 0,1% Tween-20 и 2% бычьего сывороточного альбумина и инкубировали в течение ночи при 4 ° C. Вторичные антитела, конъюгированные с пероксидазой хрена (HRP) (козьи анти-кроличьи и козьи антимышиные), разводили 1: 2000 в PBS 0,1% Tween-20 и 2% бычьим сывороточным альбумином и инкубировали 1 час при 25 ° C. Блоты были разработаны с использованием реагента Western Lightning Plus-ECL (Perkin Elmer) и проанализированы с помощью системы визуализации Bio-Rad Gel Doc / Chemi Doc и Quantity One software.
Для блоттинга альбумина
2 мкл каждого образца сыворотки разводили в 18 мкл 1X буфера Лэмли и нагревали до 95 ° С в течение 10 минут. 1 мкл от каждого из нагретых образцов растворяли в 9 дополнительных мкл 1X буфера Лэмли. 10 мкл серийно разведенных образцов загружали на линию для исследования альбумина (общее разведение образца 1: 100). Красное пятно Понсо было выполнено, и пятна были визуализированы. Мембраны блокировали в течение более 3 часов в 5% обезжиренном сухом молоке в 1X PBST при 4 ° С, а затем исследовали на наличие мышиного антиальбумина (1: 2000) в 5% обезжиренном сухом молоке в течение ночи в холодной комнате. После 3 полосканий PBST, 10 минут на полоскание, мембраны обрабатывали вторичными антителами козы против мышиного HRP (оба 1: 1000) в 1% BSA в течение 2 часов в холодной комнате. Образцы снова промывали PBST, обрабатывали реагентом ECL и визуализировали.
Анализ антиоксидантной активности
Не идентифицированную кровь пациента собирали в пробирки с сывороткой BD, отмечая только дату, номер субъекта, раунд TPE и то, была ли она собрана до или после TPE. Крови позволяли сворачиваться при 37 ° С в течение 1 часа, а эритроциты осаждали центрифугированием при 500 × g в течение 20 минут. Сыворотку аликвотировали и замораживали при -70 до использования. Анализы проводили, как описано (Koracevic 2001, doi 10.1136 / jcp.54.5.356, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1731414/ Вкратце, 10 микролитров сыворотки крови анализировали в трех экземплярах и сравнивали с серией разведений мочевой кислоты в качестве стандартной активности и поглощением прореагировавшей тиобарбитуровой кислоты измеряли при 532 нм.
Количественная оценка данных и статистика
Данные были проанализированы с использованием t-критерия Стьюдента (двусторонний), и значения P, равные или ниже 0,05, считались статистически значимыми. Размеры выборки n = 4 или более были определены для каждого эксперимента на основе анализа мощности, соображений IACUC и на основе размера эффекта, дисперсии и N, которые дали мощность 0,8 в предыдущих экспериментальных исследованиях (2005-2020 годы).
Количественная оценка иммунофлуоресцентных изображений для включения BrdU
Был выполнен как в [15]; Вкратце, девять 10-кратных изображений были сняты на автоматическом эпифлуоресцентном имидж-сканере Molecular Devices ImageXpress Micro для каждой реплицируемой лунки с последующим автоматическим количественным определением клеток с использованием модуля многоволновой оценки клеток в программном обеспечении для анализа MetaXpress.
Тканевая гистология и иммунофлюоресценция
Индексы регенерации мышц рассчитывали путем подсчета частоты центрально зародышевых de-novo myofibers относительно общего количества ядер на 2-4 репрезентативных изображениях на 10 мкм срезы мышц для каждой когорты. Мышечный фиброз определяли количественно путем измерения областей фиброза в местах повреждения мышц. Эти полученные фиброзные области были нормализованы к общей площади места повреждения. Нейрогенез определяли количественно путем подсчета количества клеток Ki67 + / H + в 200 мкМ SGZ от каждой мыши из множества, как описано ранее [9]. Фиброзные показатели в печени определяли количественно на срезах по 10 мкм. Общие измеренные площади альбумин-отрицательных фиброзных кластеров или кластеров трихромового синего были нормализованы к общей площади ткани печени, присутствующей в каждом изображении на группу. Количественное определение масла Red-O проводили путем измерения общей площади красных жировых капель в срезах печени. Эти красные области были нормализованы к общей площади ткани печени на каждом изображении на группу. Все анализы проводились при 20-кратном увеличении. Непарные двухсторонние t-тесты были выполнены в Microsoft Excel для всех данных анализа ткани.
Вестерн-блоттинг
Результаты были количественно оценены с использованием программного обеспечения Image J. Интенсивность пикселей полос VCAM-1 нормализовали с помощью интенсивности пикселей альбумина, и для сравнения когорт использовали непарный двухсторонний t-критерий.
Сыворотка протеомика t-SNE участки
Анализ 308 белков плазмы, измеренных у мышей с t-распределенной проекцией стохастического соседа (t-SNE), с perplexity 40. Анализ t-SNE также был выполнен на 506 белках плазмы человека с perplexity 40. Пакет для изучения многообразия Python-SciPy использовался для выполнения анализа t-SNE, а Python-Matplotlib использовался для визуализации результатов кластеризации.
Протеомика сыворотки: анализ данных массива и генерация тепловых карт
Данные массива антител мыши и человека анализировали в Excel 2016. Белки идентифицировали с использованием двустороннего t-критерия Стьюдента (в паре для данных человека, гетероскедастического для мыши) с р <0,05. Идентифицированные белки затем сортировали по среднему кратному изменению от наибольшего к наименьшему. Тепловые карты были созданы с помощью бесплатного онлайн-генератора тепловых карт MORPHEUS, который можно найти по адресу https://software.broadinstitute.org/morpheus/.
Доступность данных
Все соответствующие для этого исследования данные должны быть предоставлены при публикации.
Авторы
Melod Mehdipour1 , Colin Skinner1, * , Nathan Wong1, * , Michael Lieb1, * , Chao Liu1 , Jessy Etienne1 , Cameron Kato1 , Dobri Kiprov2 , Michael J. Conboy1 , Irina M. Conboy1
- 1 Department of Bioengineering and QB3, UC Berkeley, Berkeley, CA 94720, UDS
- 2 California Pacific Medical Center, Apheresis Care Group, San-Francisco, CA 94115, USA
Вклад авторов
М.М. участвовал в разработке эксперимента и выполнил процедуры NBE, предоставил рисунки 2А, В, 3, дополнительные рисунки 2 и 6 и внес вклад в написание рукописи. ML предоставил рисунок 2 C-G и дополнительный рисунок 1B. CS и NW предоставили рисунки 1, 5, дополнительный рисунок 4 и дополнительную таблицу 1. MJC и CL провели сывороточную протеомику; MJC также предоставил дополнительные рисунки 1A и 3. JE предоставил рисунки 4 и дополнительные рисунки 6. CK предоставил рисунки 2A-2C и дополнительные рисунки 2 и 5. DK предоставил образцы сыворотки человека и принял участие в обсуждении данных. MJC разработал исследование, руководил работой и соавтором рукописи. IMC разработал исследование, спланировал и направил работу, интегрировал и интерпретировал данные, внес вклад в рисунок 6 и написал рукопись.
Подтверждения
Мы хотели бы поблагодарить Лерана Мао, Гилберта Лин, Кевина Спехара, Конни Хуанга, Кешава Шарму, Ву Лав, Трам До и Лакшмиту Чандрисари за техническую помощь в проведении этих исследований. Мы благодарим д-ра Мэри Уэст из Центра общего анализа стволовых клеток, клеток и тканей CIRM / QB3 в Калифорнийском университете в Беркли. Эта работа была выполнена частично в CTAF, которая предоставила Molecular Devices IXM Image Express, микроскоп Zeiss Axioimager и криотомы.
Конфликт интересов
Авторы данного исследования не заявляют о финансовых конфликтах интересов.
Финансирование
Эта работа была поддержана грантами NIH R56 AG058819, R01 EB023776, R01 HL139605 и премией Open Philanthropy IC, а также стипендиями NIH T32 и Cooke CS.
Источник
Перевод








































































