
Оригинальная статья (PDF): Limited rejuvenation of aged hematopoietic stem cells in young bone marrow niche
Введение
![]()
Гемопоэтические стволовые клетки (HSC) дают начало всем линиям клеток крови на протяжении всей жизни. Однако возможности HSC заметно меняются с возрастом, включая нарушение регенерации, миелоидно- и тромбоцитарно- обусловленное видоизменение, за счет выработки функциональных лимфоцитов, а также и более высокую склонность к формиелоидным злокачественным новообразованиям (Oshima and Iwama, 2014; Akunuru andGeiger, 2016; Verovskaya et al. др., 2019). Эти изменения являются следствием зависящих от времени внутренних изменений HSC и постоянного воздействия внешних стрессов; однако степень, в которой эти факторы способствуют старению HSC, еще не выяснена (de Haan, Lazare, 2018; Verovskaya et al., 2019). Считается, что старые HSC несут присущие клетке молекулярные изменения, которые не могут быть восстановлены молодой нишей, как предполагало предыдущее исследование, показавшее, что старые HSC, трансплантированные в смертельно облученных молодых мышей-реципиентов, демонстрировали функциональные нарушения по сравнению с молодыми HSC, трансплантированными молодым реципиентам (Dykstra и др., 2011).
Напротив, молодые HSC, трансплантированные смертельно облученным пожилым реципиентам, прививаются хуже, чем при трансплантации молодым реципиентам, что указывает на то, что возрастные внешние клеточные изменения влияют на функцию HSC (Rossi et al., 2005; de Haan and Lazare, 2018). находки подчеркивают критическую роль внутренних и внешних факторов в процессе старения HSC. Тем не менее, предварительное кондиционирование на основе облучения значительно изменяет структуру и функции микросреды костного мозга (КМ) (Hooper et al., 2009; Tikhonova et al., 2019), что исключает возможность точной оценки прямого вклада возрастзависимых внешних изменений на функции HSC.
Специализированные микроокружения костного мозга (BM), названные нишами HSC, поддерживают количество и функцию HSC посредством клеточных взаимодействий и секретируемых факторов (Morrison and Scadden, 2014). Пространство для HSC, которое они занимают в BM, считается ограниченным из-за небольшого количества доступных ниш. И поскольку, большинство этих ниш уже занято эндогенными HSC, требуется миелоаблативное предварительное кондиционирование, такое, как облучение и химиотерапия, чтобы освободить ниши для трансплантированных HSC (Nilsson et al. др., 1997; Шиозава и др., 2008). Однако облучение и химиотерапия повреждают интактные ниши костного мозга, как было продемонстрировано ранее (Hooper et al., 2009; Tikhonova et al., 2019). Облучение вызывает расширение сосудов, проницаемость и пролиферацию эндотелиальных клеток (Chen et al., 2019).
Мы продемонстрировали, что в эндотелиальных клетках BM после облучения и химиотерапии активировался p53, что приводило к расширению и коллапсу эндотелиальных клеток сосудов, а также снижению количества периваскулярных мезенхимальных стромальных клеток (Si et al., 2018). Хотя эти изменения являются временными, долговременные дефекты сосудистой сети костного мозга после облучения еще не выяснены. Кроме того, летальное облучение оставляет стойкие повреждения стромы костного мозга. Мультипотентные клетки-предшественники стромы костного мозга были потеряны и не смогли спонтанно восстановиться после облучения. По сравнению с необработанными контролями соответствующего возраста, их уровни оставались ниже 10% в течение как минимум 4 месяцев после облучения (Abbuehl et al., 2017). Таким образом, было технически сложно напрямую исследовать взаимосвязь между трансплантированными HSC и интактными нишами. Чтобы преодолеть это ограничение, в предыдущих исследованиях использовали моноклональные антитела Anti- c-Kit, которые истощают HSC из ниш BM, тем самым позволяя приживать донорские HSC у иммунодефицитных мышей (Chechowiczet al., 2007). Повышение Fc-опосредованной эффекторной активности антител за счет блокады CD47, миелоид-специфического иммунного маркера, далее позволило распространить кондиционирование Anti-c-Kit на полностью иммунокомпетентных мышей (Chhabra et al., 2016) Напротив, Shimoto et al. (2017) недавно сообщили, что при трансплантации большого количества HSC мышам-реципиентам без миелоабляции донорские HSC внедрялись в ниши, которые не были заняты HSC-хозяевами, и впоследствии регенерировали BM, что согласуется с предыдущими данными (Bhattacharya et al., 2006; Westerhuiset al. ., 2011). Таким образом, многочисленные пустые ниши HSC, по-видимому, доступны для приживления и пролиферации донорских HSC. В настоящем исследовании мы трансплантировали избыток старых HSC молодым реципиентным мышам без предварительного кондиционирования и оценивали влияние неповрежденной молодой ниши на функции, транскриптом. и эпигеном старых HSC.
Полученные результаты
Характеристики старых HSC, привитых в неповрежденную молодую нишу
Первоначально мы оценивали гематопоэз у мышей в возрасте 8–10 недель (молодые), 12 месяцев (средний возраст) и 20–21 месяцев (пожилые) мышей и подтвердили, что частота миелоидных клеток (Mac-1 + и / или Gr1 +) значительно увеличивается в периферической крови (PB), в то время как количество T-клеток (CD4 + или CD8 +) и B-клеток (B220 +) с возрастом уменьшается (рис. 1 A). . Затем мы исследовали следующие компоненты гематопоэтических стволовых клеток и предшественников (HSPC) в BM: HSC (CD150 + CD48-CD135-CD34-линия-Sca-1 + c-Kit + [LSK]), мультипотентные предшественники 1 (MPP1; CD150+ CD48- CD135- CD34+ LSK), MPP2 (CD150+ CD48+ CD135- CD34+ LSK), MPP3 (CD150- CD48+ CD135- CD34+ LSK) и MPP4 (CD150- CD48+ CD135+ CD34+ LSK; Cabezas-Wallscheid et al., 2014). Как сообщалось ранее (Sudo et al., 2000; Geiger et al., 2013; Young et al., 2016; Elias et al., 2017), как абсолютное количество, так и частота HSC значительно увеличиваются с возрастом, тогда как для MPP4, предрасположенных к лимфоидной дифференцировке, они значительно снижаются (Fig. 1 B). Чтобы оценить влияние ниши стареющего костного мозга на фенотипические изменения в HSC при старении, мы попытались переключиться со стареющей ниши на неповрежденную молодую нишу путем трансплантации избытка стареющих HSC молодым реципиентным мышам без какого-либо предварительного кондиционирования с использованием ранее описанного метода (Shimoto et al. ., 2017).
Первоначально мы очищали 1 × 10в4 HSC, LSK и c-Kit + клетки, которые содержали 1 × 10в4 HSC от 10-недельных мышей, и трансплантировали их 8-недельным мышам без облучения (рис. 1C). Через два месяца после трансплантации мы оценили приживление донорских клеток в периферической крови (PB) и костном мозге (BM). Клетки c-Kit + установили самый высокий химеризм в PB, за которым следуют клетки LSK. Напротив, HSC были неэффективны в репопуляции гемопоэза у некондиционных мышей-реципиентов (рис. 1, D и E). Эти результаты ясно продемонстрировали, что эффективность приживления и повторного заселения значительно различается в зависимости от фракций HSPC при трансплантации без предварительного кондиционирования. Присутствие гематопоэтических клеток-предшественников может способствовать приживлению HSC, а включение различных антител для очистки может препятствовать приживлению HSC. Основываясь на этих результатах, мы впоследствии выполнили следующие трансплантации без предварительного кондиционирования с использованием клеток Aged LSK или c-Kit+.
Мы очистили клетки LSK от 10-недельных и 20-месячных мышей и трансплантировали их в дозах, соответствующих 1-2 × 10в4 и 1,8-8,6 × 10в4 HSC (CD150+ CD48- CD135- CD34- LSK) соответственно. в молодых мышей-реципиентов без миелоабляции. Затем повторно заселяли донорские молодые (Young ) и старые (Aged) HSC молодым мышам-реципиентамов (Y) в течение 2 мес. (Далее называемые Young / Y и Aged / Y, соответственно; рис. 1 F). В соответствии с предыдущими результатами, мы наблюдали успешное приживление донорских HSC у молодых мышей-реципиентов через 2 месяца после трансплантации (рис. 1, G – K). В костном мозге HSC Aged / Y показали более высокий химеризм в компартменте (в отдельной фракции) HSC, чем в находящихся ниже по течению компартментах LSK и lineage-c-Kit + (LK), в отличие от HSC Young / Y, для которых химеризм был выше в компартментах LK (рис. 1 H). Полученные от донора HSPC были относительно сбалансированы компартментами HSC и MPP1 соответственно MPP4 у реципиентов HSC Young / Y, что указывает на то, что трансплантация без предварительного кондиционирования не влияет на способность дифференцировки HSC (Рис. 1 I).
Напротив, у Aged / Y HSC реципиентов среди полученных от донора HSPC преобладали в основном незрелые HSC, что указывает на то, что старые HSC плохо дифференцируются в стадию MPP (Fig. 1 I). Соответственно, HSC Young / Y установили более высокий химеризм в PB, чем Aged HSC (рис. 1 J). По сравнению с HSC реципиента, HSC Aged / Y преимущественно демонстрировали заметно миелоидную дифференцировку в PB, тогда как Young / Y HSCs обнаруживали лимфоидно-доминантную репопуляцию (Fig. 1 K). Эти результаты показали, что длительные процессы старения нарушают способность дифференцировки HSC в мультипотентные предшественники (MPP), что может лежать в основе накопления HSC у пожилых мышей. Более того, возрастные дефекты дифференцировки в HSC, по-видимому, не восстанавливаются даже после переноса в молодую нишу BM.
Чтобы изучить способность к репопуляции Aged / Y HSCs более подробно, мы выполнили вторичную трансплантацию BM (рис. 2A). Мы собрали полученные от донора Aged / Y и полученные от реципиента клетки-хозяева Young LSK, содержащие 100 HSC, от первичных мышей-реципиентов и трансплантировали их смертельно облученным вторичным реципиентам с 2 × 10в5 конкурирующими клетками ВМ. Мы также трансплантировали клетки Aged LSK, содержащие 100 HSC, в качестве контроля. Способность к повторному заселению клеток Aged / Y была значительно ниже, чем у HSC Young хозяина. Вклад Aged / Y HSC в PB-клетки не был больше, чем вклад Aged HSC (рис. 2, B и C), что указывает на то, что старые HSC не были функционально омоложены молодой нишей у первичных реципиентов. Анализ BM также выявил, что дефектная дифференцировка Aged HSC в MPP, наблюдаемая у первичных молодых реципиентов, сохраняется после вторичной трансплантации (Fig. 2 D). Мы повторили вторичную трансплантацию костного мозга после трансплантации костного мозга без предварительной обработки с использованием 100 молодых, Aged/Y, и Aged HSC на реципиента. И получили те же результаты (данные не показаны). Напротив, 12-месячные HSC, которые прижились в молодой нише (Middle / Y HSC), показали профили дифференцировки HSPC между Young / Y и Aged / Y HSC в BM (рис.2, E и F) и умеренную репопуляцию, обусловленную миелоидным смещением в PB (Fig. 2 G). Middle / Y HSCs показали умеренное восстановление способности к репопуляции, но не смещенной дифференцировки, у вторичных реципиентов по сравнению с контрольными средними HSC (Fig. 2, HJ). Эти результаты демонстрируют, что интактная молодая ниша BM имеет тенденцию частично восстанавливать способность к репопуляции средних, но не старых HSC.
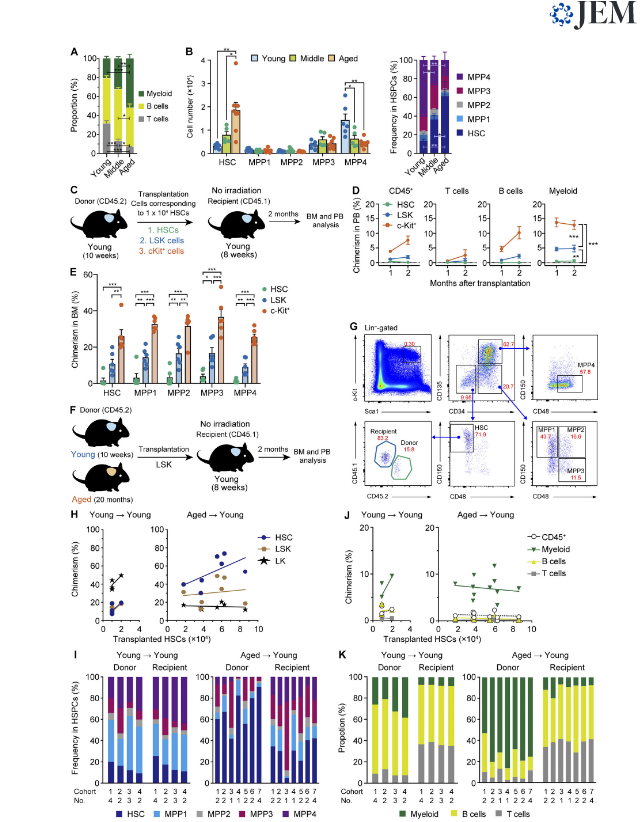 Рисунок 1. Гематопоэз с помощью старых HSC, привитых в некондиционированную молодую нишу. (A) Частоты миелоидных (Mac-1 + и / или Gr-1 +), B (B220 +) и T (CD4 + или CD8 +) клеток в PB молодых, средних и пожилых мышей. (B) Число клеток (слева) и частоты (справа) BM HSPCs. Данные представлены как среднее значение ± стандартная ошибка (n = 5-7, представитель двух независимых экспериментов). (C) Экспериментальная стратегия для оценки эффективности приживления фракций HSPC в молодой нише. Очищенные 1 × 10в4 HSC и клетки LSK и c-Kit +, которые содержали 1 × 10в4 HSC от 10-недельных мышей, трансплантировали 8-недельным мышам без облучения. (D) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гемопоэтические клетки, миелоидные, В- и Т-клетки в PB мышей-реципиентов (n = 6). (E) Химеризм донорских клеток в HSCs и MPP BMP мышей-реципиентов через 2 мес после трансплантации (n = 6, объединены из трех независимых экспериментов). (F) Экспериментальная стратегия для функциональной оценки старых HSCs в молодой нише. Различное количество клеток LSK, содержащих 1-2 × 10в4 HSC от молодых мышей (молодые HSC) или клеток LSK, содержащих 1,8-8,6 × 10в4 HSC из старых HSC, трансплантировали 8-недельным мышам без облучения. Мы использовали объединенные донорские HSC, собранные от нескольких мышей. (G) Стратегии гейтинга для идентификации молодых и пожилых / Y HSC и MPP1-4. Указаны частоты в общих клетках ВМ. (H) Химеризм донорских клеток в HSC, LSK и LK клетках КМ через 2 месяца после трансплантации. Каждая точка представляет собой среднее значение одной когорты, состоящей из от одной до четырех мышей. Оси x указывают количество HSC, которые содержались в трансплантированных клетках LSK. (I) Частоты HSC и MPP, происходящие от донора и реципиента, и MPP в клетках BM, соответственно. Данные по среднему значению для каждой когорты, состоящей из одной-четырех мышей, показаны на отдельных столбцах. (J) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гемопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов. Каждая точка представляет собой среднее значение для одной когорты, состоящей из от одной до четырех мышей. Оси x указывают количество HSC, которые содержали интрансплантированные клетки LSK. (K) Частоты миелоидных, B- и T-клеток, полученных от донора и реципиента, в клетках PB, соответственно. Данные о среднем значении каждой когорты, состоящей из от одной до четырех мышей, показаны в отдельных столбцах. Планки погрешностей представляют SEM. *, P <0,05; **, P <0,01; ***, P <0,001 однофакторным дисперсионным анализом.
Рисунок 1. Гематопоэз с помощью старых HSC, привитых в некондиционированную молодую нишу. (A) Частоты миелоидных (Mac-1 + и / или Gr-1 +), B (B220 +) и T (CD4 + или CD8 +) клеток в PB молодых, средних и пожилых мышей. (B) Число клеток (слева) и частоты (справа) BM HSPCs. Данные представлены как среднее значение ± стандартная ошибка (n = 5-7, представитель двух независимых экспериментов). (C) Экспериментальная стратегия для оценки эффективности приживления фракций HSPC в молодой нише. Очищенные 1 × 10в4 HSC и клетки LSK и c-Kit +, которые содержали 1 × 10в4 HSC от 10-недельных мышей, трансплантировали 8-недельным мышам без облучения. (D) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гемопоэтические клетки, миелоидные, В- и Т-клетки в PB мышей-реципиентов (n = 6). (E) Химеризм донорских клеток в HSCs и MPP BMP мышей-реципиентов через 2 мес после трансплантации (n = 6, объединены из трех независимых экспериментов). (F) Экспериментальная стратегия для функциональной оценки старых HSCs в молодой нише. Различное количество клеток LSK, содержащих 1-2 × 10в4 HSC от молодых мышей (молодые HSC) или клеток LSK, содержащих 1,8-8,6 × 10в4 HSC из старых HSC, трансплантировали 8-недельным мышам без облучения. Мы использовали объединенные донорские HSC, собранные от нескольких мышей. (G) Стратегии гейтинга для идентификации молодых и пожилых / Y HSC и MPP1-4. Указаны частоты в общих клетках ВМ. (H) Химеризм донорских клеток в HSC, LSK и LK клетках КМ через 2 месяца после трансплантации. Каждая точка представляет собой среднее значение одной когорты, состоящей из от одной до четырех мышей. Оси x указывают количество HSC, которые содержались в трансплантированных клетках LSK. (I) Частоты HSC и MPP, происходящие от донора и реципиента, и MPP в клетках BM, соответственно. Данные по среднему значению для каждой когорты, состоящей из одной-четырех мышей, показаны на отдельных столбцах. (J) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гемопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов. Каждая точка представляет собой среднее значение для одной когорты, состоящей из от одной до четырех мышей. Оси x указывают количество HSC, которые содержали интрансплантированные клетки LSK. (K) Частоты миелоидных, B- и T-клеток, полученных от донора и реципиента, в клетках PB, соответственно. Данные о среднем значении каждой когорты, состоящей из от одной до четырех мышей, показаны в отдельных столбцах. Планки погрешностей представляют SEM. *, P <0,05; **, P <0,01; ***, P <0,001 однофакторным дисперсионным анализом.
Одним из основных фенотипов старых HSC, который не разрешился в молодой нише, был миелоидный перекос в дифференцировке. В предыдущих исследованиях сообщалось о значительном увеличении частоты миелоидных HSC с возрастом (Muller-Sieburget al., 2004; Beerman et al., 2010; Challen et al., 2010; Dykstraet al., 2011). Старение связано с прогрессирующим увеличением количества миелоидных HSC с высоким уровнем экспрессии CD150 (Beerman et al., 2010). Старые HSC показали более высокие уровни экспрессии CD150, чем молодые HSC, что указывает на то, что большинство трансплантированных старых HSC были внутренне миелоидно- смещенными. Aged / Y HSC через 2 месяца после трансплантации имели тенденцию снижать уровни своей экспрессии, но все же сохраняли более высокие уровни, чем молодые HSC (рис. 2 K). Эти результаты предполагают, что старые HSC претерпели ограниченное омоложение с точки зрения экспрессии CD150 и сохранили миелоидно-зависимые свойства дифференцировки даже после приживления в некондиционированной молодой нише. Поскольку миелоидно-смещенные HSC также присутствовали у молодых мышей, молодая ниша, возможно, не изменила заметно выход клонов старых HSC.
Двухмесячная инкубация в молодой нише может быть недостаточной для того, чтобы старые HSC подверглись омоложению. Поэтому мы трансплантировали молодые и старые клетки c-Kit +, содержащие 1 × 10в4 HSC, мышам-реципиентам без кондиционирования и провели долгосрочные последующие исследования (рис. S1 A). Гематопоэз, полученный из молодых и старых HSPC, привитых в молодую нишу (Young / Y и Aged / YHSPC, соответственно), оценивали через 4 месяца после трансплантации. Старые / Y HSPC выявляли заметно более низкий химеризм, чем Young / Y HSPC в PB (рис. S1). Б). Aged/ Y HSPC показали более выраженную миелоидно-смещенную репопуляцию, чем Young / Y HSPC, которая была более заметна через 4 мес, чем через 2 месяца после трансплантации (рис. S1, B и C). В BM, Aged / Y HSPCs плохо дифференцировались в стадию MPP даже через 4 месяца после трансплантации (Fig. S1 D). Уровни экспрессии CD150 были значительно выше в HSC Aged / Y, чем в HSC молодого хозяина (рис. S1E). Затем мы очистили 100 HSC Young / Y и Aged / Y от первичных реципиентов и трансплантировали их смертельно облученным мышам с 2 × 10в5 конкурентными клетками. Aged / Y HSC снова обнаружили миелоидную репопуляцию в PB и нарушенную дифференцировку HSC в MPP в BM (Fig.S1, F-H). Эти результаты показали, что ниша молодого костного мозга не способна функционально омолаживать старые HSC даже с более длительным периодом приживления.
Молодая ниша в значительной степени омолаживает профили транскриптомов Aged HSC. Чтобы получить более детальное понимание влияния старой ниши на транскриптомы HSC, мы выполнили анализ секвенирования РНК Aged, Young и Aged / Y HSCs (рис. 3A). Анализ главных компонентов (PC) с первыми двумя компонентами (PC1, 32,1%; PC2, 21,3%) показал, что Aged / Y HSC транскрипционно отличны от Aged HSC и близки к HSC молодых (рис. 3 B). Более того, иерархическая кластеризация показала, что Aged / Y HSCs были отнесены к тому же кластеру, что и Young HSC (Рис. 3 C), что указывает на то, что старые HSC транскрипционно репрограммировались в сторону молодых HSC.
Затем мы определили дифференциально экспрессируемые гены (DEG) между молодыми и старыми HSC, используя значение отсечения q <0,05. В целом, 629 и 957 генов подвергались повышающей и понижающей регуляции, соответственно, в Aged HSC по сравнению с таковыми в Young HSC, соответственно (Рис. 3 D и таблица S1). Эти DEG были разделены на пять кластеров (C1 – C5) с помощью кластеризации K-средних, причем DEG в C1, C3 и C5 подавлялись, а DEG в C2 и C4 активировались в старых HSC по сравнению с таковыми в молодых HSC. (Рис. 3 E). Чтобы оценить степень, в которой транскриптом в Aged / Y HSC был инвертирован молодой нишей, мы произвольно установили средние уровни экспрессии DEG в каждой группе молодых и Aged HSC на 0 (группы HSC с низким уровнем экспрессии) или 1 (HSC группы с более высокими уровнями экспрессии), а затем рассчитали средние уровни экспрессии DEG в Aged / Y HSC (Рис. 3 E). Показатели Aged / Y HSC в C1, C2 и C5 были заметно ближе к показателям молодых HSC, чем Aged HSC, что указывает на то, что DEG в этих кластерах в значительной степени подвергались нишезависимому репрограммированию в молодые HSC. Напротив, оценки Aged / Y HSCs в C3 и C4 были заметно ближе к показателям Aged HSC, указывая на то, что DEG в этих кластерах в значительной степени представляют собой устойчивые к нише, внутренние изменения HSC (рис. 3, E и F). Мы получили аналогичные результаты в другой когорте (когорта 3; рис. S2, A – C), в которой DEG, идентифицированные в когортах 1 и 2 (C1 – C5 на рис. 3 D), показали аналогичные изменения экспрессии (рис. S2 D). В совокупности эти результаты показали, что многие изменения транскриптома Aged HSC зависят от старения ниши и, таким образом, обратимы при переносе в молодую нишу.
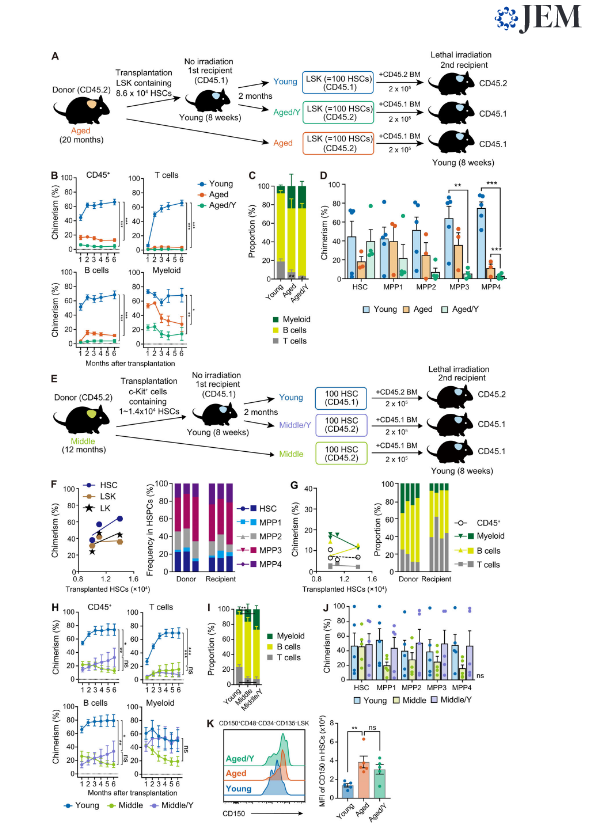 Рисунок 2: стойкие функциональные дефекты пожилых HSC в молодой нише. (A) Экспериментальная стратегия для функциональной оценки старых HSCs в молодой нише. Старые клетки LSK, содержащие 8,6 × 10в4 HSC, трансплантировали молодым мышам-реципиентам без облучения. Донорские (Aged / Y) и хозяйские (молодые) LSK-клетки, содержащие 100 HSC, были очищены от первичных реципиентов через 2 месяца после трансплантации и затем трансплантированы смертельно облученным 8-недельным вторичным реципиентным мышам вместе с 2 × 10в5 клетками-конкурентами. Свежевыделенные Aged LSK клетки, содержащие 100 HSC, также трансплантировали в качестве контролей. (B) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гематопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов, получавших Young, Старые или Старые / Y LSK клетки (n = 3-5). (C) Частоты миелоидных, B- и T-клеток в донорских клетках PB через 6 месяцев после трансплантации (n = 3-5). (D) Химеризм. донорских HSPCs в BM HSCs и MPP у мышей-реципиентов через 6 месяцев после трансплантации (n = 3-5, репрезентативные из трех независимых экспериментов). (E) Экспериментальная стратегия для функциональной оценки средних HSCs в молодой нише. Клетки c-Kit +, содержащие ~ 1,0–1,4 × 10в4 HSC от 12-месячных мышей, трансплантировали 8-недельным мышам без облучения. Через 2 месяца после трансплантации анализировали гемопоэтические клетки, полученные из прививаемых средних HSC (средние / Y HSC) и хост-HSC (молодые HSC) (F и G; данные были объединены из четырех независимых экспериментов). В то же время 100 HSC Middle / Y и хозяина (Young), очищенные от первичных реципиентов, были трансплантированы смертельно облученным 8-недельным вторичным реципиентным мышам вместе с 2 × 10в5 BM клетками-конкурентами. Свежевыделенные HSC от 12-месячных мышей. (Средние HSC) также трансплантировали в качестве контроля (H – J; показаны репрезентативные данные из двух независимых экспериментов). (F) Химеризм клеток, происходящих из средних HSC, в BM HSC, LSK-клетках и LK-клетках через 2 месяца после трансплантации (n = 4). Оси x указывают количество HSC, которые содержались в трансплантированных клетках c-Kit + (левая панель). Показаны частоты происходящих из средних HSC и получателя HSC и MPP в фракции HSC / MPP (правая панель). Данные для каждой мыши-реципиента показаны в отдельных столбцах. (G) Химеризм гемопоэтических клеток, полученных из средних HSC, в гематопоэтических клетках CD45 + (CD45.1 + CD45.2), миелоидных, B- и Т-клеток в PB мышей-реципиентов (n = 4). По оси x указано количество HSC, которые содержали трансплантированные клетки c-Kit + (левая панель). Частоты донорских (средние HSC) и полученных от реципиента миелоидных, B- и T-клеток в PB (правая панель). Данные для каждой мыши-реципиента показаны в отдельных столбцах. (H) Химеризм донорских гематопоэтических клеток в CD45 + (CD45.1 + CD45.2) гематопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов, получавших Young, Middle / Y- и средние HSC (n = 5). (I) Частоты миелоидных, B- и T-клеток в клетках, полученных от донора, через 6 месяцев после трансплантации в H (n = 5). (J) Химеризм клеток, полученных от донора в HSC и MPP в BM у мышей-реципиентов через 6 месяцев после трансплантации в H (n = 5). (K) Экспрессия CD150 в HSC Aged / Y у мышей-реципиентов через 2 месяца после трансплантации в D. Репрезентативные гистограммы, показывающие экспрессию CD150 в HSC (левая панель) и средняя интенсивность флуоресценции (MFI) CD150, показанная как среднее ± стандартная ошибка среднего (n = 5). *, P <0,05; **, P <0,01; ***, P <0,001 однофакторным дисперсионным анализом. Данные представлены как среднее значение ± стандартная ошибка среднего. *, P <0,05; **, P <0,01; ***, P <0,001; ns, не имеет значения при одностороннем дисперсионном анализе.
Рисунок 2: стойкие функциональные дефекты пожилых HSC в молодой нише. (A) Экспериментальная стратегия для функциональной оценки старых HSCs в молодой нише. Старые клетки LSK, содержащие 8,6 × 10в4 HSC, трансплантировали молодым мышам-реципиентам без облучения. Донорские (Aged / Y) и хозяйские (молодые) LSK-клетки, содержащие 100 HSC, были очищены от первичных реципиентов через 2 месяца после трансплантации и затем трансплантированы смертельно облученным 8-недельным вторичным реципиентным мышам вместе с 2 × 10в5 клетками-конкурентами. Свежевыделенные Aged LSK клетки, содержащие 100 HSC, также трансплантировали в качестве контролей. (B) Химеризм донорских гемопоэтических клеток в CD45 + (CD45.1 + CD45.2) гематопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов, получавших Young, Старые или Старые / Y LSK клетки (n = 3-5). (C) Частоты миелоидных, B- и T-клеток в донорских клетках PB через 6 месяцев после трансплантации (n = 3-5). (D) Химеризм. донорских HSPCs в BM HSCs и MPP у мышей-реципиентов через 6 месяцев после трансплантации (n = 3-5, репрезентативные из трех независимых экспериментов). (E) Экспериментальная стратегия для функциональной оценки средних HSCs в молодой нише. Клетки c-Kit +, содержащие ~ 1,0–1,4 × 10в4 HSC от 12-месячных мышей, трансплантировали 8-недельным мышам без облучения. Через 2 месяца после трансплантации анализировали гемопоэтические клетки, полученные из прививаемых средних HSC (средние / Y HSC) и хост-HSC (молодые HSC) (F и G; данные были объединены из четырех независимых экспериментов). В то же время 100 HSC Middle / Y и хозяина (Young), очищенные от первичных реципиентов, были трансплантированы смертельно облученным 8-недельным вторичным реципиентным мышам вместе с 2 × 10в5 BM клетками-конкурентами. Свежевыделенные HSC от 12-месячных мышей. (Средние HSC) также трансплантировали в качестве контроля (H – J; показаны репрезентативные данные из двух независимых экспериментов). (F) Химеризм клеток, происходящих из средних HSC, в BM HSC, LSK-клетках и LK-клетках через 2 месяца после трансплантации (n = 4). Оси x указывают количество HSC, которые содержались в трансплантированных клетках c-Kit + (левая панель). Показаны частоты происходящих из средних HSC и получателя HSC и MPP в фракции HSC / MPP (правая панель). Данные для каждой мыши-реципиента показаны в отдельных столбцах. (G) Химеризм гемопоэтических клеток, полученных из средних HSC, в гематопоэтических клетках CD45 + (CD45.1 + CD45.2), миелоидных, B- и Т-клеток в PB мышей-реципиентов (n = 4). По оси x указано количество HSC, которые содержали трансплантированные клетки c-Kit + (левая панель). Частоты донорских (средние HSC) и полученных от реципиента миелоидных, B- и T-клеток в PB (правая панель). Данные для каждой мыши-реципиента показаны в отдельных столбцах. (H) Химеризм донорских гематопоэтических клеток в CD45 + (CD45.1 + CD45.2) гематопоэтических, миелоидных, B и T-клетках в PB мышей-реципиентов, получавших Young, Middle / Y- и средние HSC (n = 5). (I) Частоты миелоидных, B- и T-клеток в клетках, полученных от донора, через 6 месяцев после трансплантации в H (n = 5). (J) Химеризм клеток, полученных от донора в HSC и MPP в BM у мышей-реципиентов через 6 месяцев после трансплантации в H (n = 5). (K) Экспрессия CD150 в HSC Aged / Y у мышей-реципиентов через 2 месяца после трансплантации в D. Репрезентативные гистограммы, показывающие экспрессию CD150 в HSC (левая панель) и средняя интенсивность флуоресценции (MFI) CD150, показанная как среднее ± стандартная ошибка среднего (n = 5). *, P <0,05; **, P <0,01; ***, P <0,001 однофакторным дисперсионным анализом. Данные представлены как среднее значение ± стандартная ошибка среднего. *, P <0,05; **, P <0,01; ***, P <0,001; ns, не имеет значения при одностороннем дисперсионном анализе.
Анализ обогащения набора генов (GSEA) подтвердил, что Aged / Y HSC подвергались транскрипционному репрограммированию в сторону частичного ослабления сигнатуры старения (Wahlestedt et al., 2013; Fig. 4A and Table S2 A). Анализ онтологии генов (GO) выявил, что обратимые DEG в C1, C2 и C5 были связаны с клеточными метаболическими процессами (рис. 4B и таблица S2 B), предполагая главную роль ниши BM в регуляции метаболизма HSC. Связь между необратимыми DEG (C3 и C4) и конкретными путями / процессами не была ясна из-за их небольшого количества (рис. 4 B и таблица S2 B).
Возрастное аберрантное метилирование ДНК устойчиво к омоложению ниши
Различные эпигенетические изменения, включая метилирование ДНК, были признаны одним из признаков старения (López-Ot ́ınet al., 2013). Эпигенетические маркеры могут легко меняться со временем, и этот «эпигенетический дрейф», который зависит как от внутренних, так и от внешних факторов, может играть важную роль в старении HSC (Issa, 2014). Чтобы оценить изменения в метилировании ДНК, мы выполнили полногеномное бисульфитное секвенирование (WGBS) на Young, Aged,и Aged/Y HSC (Таблица S3 A). В целом, низкие уровни метилирования ДНК были обнаружены на CpG-островках (CGI), которые включали промоторные CGI, тогда как высокие уровни метилирования ДНК наблюдались в энхансерных областях (Рис. 5 A). Не было отмечено значительных изменений в уровнях метилирования ДНК среди Young, Aged,и Aged/Y HSC в CGI или энхансерных областях; тем не менее, старые HSC показали умеренное увеличение (рис. 5 A). Иерархическая кластеризация не выявила значительного восстановления глобального метилирования ДНК в Aged / Y HSC, но скорее показала умеренное прогрессирование аберрантного метилирования ДНК в Aged / Y HSC во время повторного заселения в молодой нише BM (Рис. 5 B). Мы определили дифференциально метилированные области (DMR) среди Young, Aged и Aged/Y HSC как те, которые показывают значения отсечения q <0,05. Мы идентифицировали 3 463 и 1 125 DMR во время старения (Aged vs. Young), 3699 и 1145 DMR после приживления в молодой нише (Aged / Y по сравнению с Young) и 1925 и 848 DMR (Aged / Y по сравнению с Aged) в CGI и энхансерах, соответственно. (Рис. S3 A). Мы определили гипер- и гипо-DMR как те, которые демонстрируют разницу в метилировании ≥5,0% (рис. S3 A и таблица S3 B). HSC приобрели больше гипер-, чем гипо-DMR (619 против 120) на CGI с возрастом (Aged vs. Young), но показали очень легкий сдвиг от гипер- к гипо-DMR (606 против 179) после приживления в молодой нише (Aged / Y против Янга). Напротив, HSC приобретают больше гипо-DMRs на энхансерах, чем CGIs, с возрастом и после приживления в молодой нише (Рис. 5 C). Следовательно, различия в метилировании ДНК в DMR были немного ниже в Aged / Y HSC, чем в Aged HSC, причем редукции были больше у энхансеров, чем у CGI (рис. 5 D). Более того, гипер-DMR в Aged HSC и Aged / Y HSC значительно перекрывались в CGI, тогда как в энхансерных областях были более вариабельны (Рис. 5 E). В соответствии с предыдущими выводами (Beerman et al., 2013) связь между уровнями экспрессии генов и уровнями метилирования ДНК в HSC не кажется сильной. Гены Hyper-DMR в Aged HSC не показали значительных изменений в экспрессии (рис. 5 F), и гены гипер-DMR, которые перестали быть гипер-DMR в Aged / Y HSC, не были связаны с активацией транскрипции (рис. S3 B). Мы подтвердили эти результаты в другой когорте, используя анализ WGBS (рис. S3, C – H). В совокупности эти результаты указывают на то, что связанные с возрастом изменения в метилировании ДНК были более стабильными, чем в транскриптоме, и устойчивы к омоложению ниши. Более того, омоложение ниши преимущественно индуцировало деметилирование ДНК в энхансерных областях; однако это, по-видимому, не объясняет омоложение транскрипции.
Таким образом, мы продемонстрировали, что транскриптом старых HSC, но не профиль метилирования ДНК или их функции, могут в значительной степени восстанавливаться до таковых у молодых HSC после приживления в неповрежденной молодой нише.
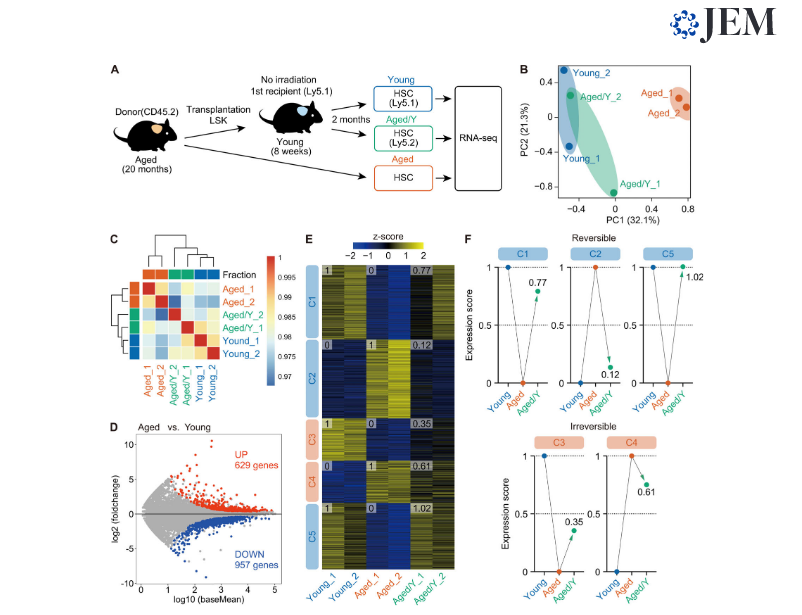 Рисунок 3. Молодая ниша в значительной степени омолаживает профиль транскриптома старых HSC. (А) Экспериментальная стратегия. 3000 донорских HSC Aged / Y и Young HSC хозяина, очищенных от первичных реципиентов через 2 месяца после трансплантации Aged HSC без облучения, вместе с 3000 HSC от 20-месячных мышей подвергали анализу РНК-секвенирования. (B) PC анализ на основе ряда значений Z величины экспрессии (нормализованное количество DESeq2) в Young, Aged, и Aged/Y HSC (n = 2 для каждого, объединенные из двух независимых экспериментов). (C) Иерархическая кластеризация на основе коэффициента корреляции Пирсона DESeq2 нормализованных значений в Young, Aged, и Aged/Y HSC (n = 2). (D) График MA, показывающий log10 нормализованных значений и log2 кратных изменений в старых и молодых HSC Красные и синие точки представляют 629 активированных (UP) и 957 отрицательных (DOWN) DEG во время старения. Пороговое значение q <0,05 использовалось для определения DEG. (E) К-средние кластеризации DEG, определенные в D. Тепловая карта представляет собой Z-величины нормализованных значений в Young, Aged, и Aged/Y HSC. Указаны номера кластеров (C1 – C5) и средние показатели экспрессии генов для каждой группы HSC. (F) Обратимые и необратимые изменения средней экспрессии генов в Aged / Y HSC. Средние оценки экспрессии DEG в молодых или старых HSC были масштабированы от 0 до 1, а оценки DEG в Aged / Y HSC были нормализованы.
Рисунок 3. Молодая ниша в значительной степени омолаживает профиль транскриптома старых HSC. (А) Экспериментальная стратегия. 3000 донорских HSC Aged / Y и Young HSC хозяина, очищенных от первичных реципиентов через 2 месяца после трансплантации Aged HSC без облучения, вместе с 3000 HSC от 20-месячных мышей подвергали анализу РНК-секвенирования. (B) PC анализ на основе ряда значений Z величины экспрессии (нормализованное количество DESeq2) в Young, Aged, и Aged/Y HSC (n = 2 для каждого, объединенные из двух независимых экспериментов). (C) Иерархическая кластеризация на основе коэффициента корреляции Пирсона DESeq2 нормализованных значений в Young, Aged, и Aged/Y HSC (n = 2). (D) График MA, показывающий log10 нормализованных значений и log2 кратных изменений в старых и молодых HSC Красные и синие точки представляют 629 активированных (UP) и 957 отрицательных (DOWN) DEG во время старения. Пороговое значение q <0,05 использовалось для определения DEG. (E) К-средние кластеризации DEG, определенные в D. Тепловая карта представляет собой Z-величины нормализованных значений в Young, Aged, и Aged/Y HSC. Указаны номера кластеров (C1 – C5) и средние показатели экспрессии генов для каждой группы HSC. (F) Обратимые и необратимые изменения средней экспрессии генов в Aged / Y HSC. Средние оценки экспрессии DEG в молодых или старых HSC были масштабированы от 0 до 1, а оценки DEG в Aged / Y HSC были нормализованы.
Предыдущие исследования сообщали об изменениях в нише костного мозга с возрастом (Pinho and Frenette, 2019) и предполагали, что воздействие дифференциальных сигналов из стареющей ниши играет роль в функциональных изменениях HSC. Экспрессия генов, связанных с метаболическими процессами, нарушение регуляции которых является одним из отличительных признаков старения HSC (Chandel et al., 2016), также была обратима за счет изменения ниши, что подчеркивает ключевой вклад старения ниши в нарушение регуляции транскрипции и метаболизма в старых HSC. Тем не менее, старые HSC не были функционально омоложены в неповрежденной молодой нише, что указывает на то, что внутренние клеточные изменения в старых HSC сохраняются независимо от условий ниши. Эти чередования включают генетические и эпигенетические изменения и ухудшение митохондрий, и здесь мы наблюдали тонкие изменения в статусе метилирования ДНК в старых HSC после замены ниши. Ранее было показано, что дифференцированное метилирование ДНК HSC, связанное с возрастом, в значительной степени зависит от пролиферативной истории HSC. Физиологическое старение и экспериментально усиленная пролиферация HSCs приводят к гиперметилированию ДНК генов, регулируемых репрессивным комплексом Polycomb 2 (Beerman et al., 2013; Sun et al., 2014). Следовательно, принудительное повторное заселение старых HSC в молодую нишу, даже если молодая ниша свободна от повреждений, вызванных миелоабляционным воздействием, возможно, способствовало распространению изменений в ландшафте метилирования ДНК в Aged HSC. Yu et al. (2016) исследовали функциональные, транскрипционные и эпигенетические (метилирование ДНК и доступность хроматина) атрибуты HSC на аклональном уровне с использованием эндогенного флуоресцентного мечения и обнаружили, что внутриклональное поведение было задано эпигенетическим сценарием, но не всегда соответствовало состоянию транскрипции, что предполагает, что ответственность за клеточно-автономное поведение HSC несут различия в эпигеноме, а не в нише.
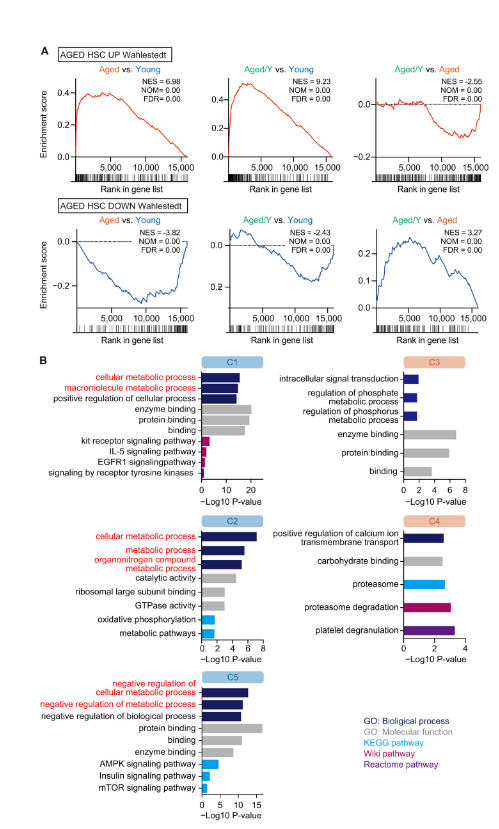 Рисунок 4: Нишезависимое частичное транскрипционное омоложение старых HSC. (A) Графики GSEA с наборами генов, которые активируются (UP) или подавляются (DOWN) в Aged HSC (Wahlestedt et al., 2013). Указаны нормализованная оценка обогащения (NES), номинальное значение P (NOM) и частота ложных обнаружений (FDR). (B) GO-анализы биологических процессов и другие анализы указанных путей с использованием DEG в каждом кластере. Пороговое значение P <0,05 используется для обозначения значительного обогащения.
Рисунок 4: Нишезависимое частичное транскрипционное омоложение старых HSC. (A) Графики GSEA с наборами генов, которые активируются (UP) или подавляются (DOWN) в Aged HSC (Wahlestedt et al., 2013). Указаны нормализованная оценка обогащения (NES), номинальное значение P (NOM) и частота ложных обнаружений (FDR). (B) GO-анализы биологических процессов и другие анализы указанных путей с использованием DEG в каждом кластере. Пороговое значение P <0,05 используется для обозначения значительного обогащения.
В совокупности эти находки и настоящие результаты предполагают, что эпигеном является более подходящей метрикой для функций HSC, чем транскриптом. Мы предполагаем, что клоны HSC со специфическими эпигенетическими конфигурациями отбираются во время старения, что приводит к функциональным изменениям HSC в целом. Необходимы дальнейшие исследования для выяснения механизмов, которые необратимо влияют на функцию HSC во время старения.
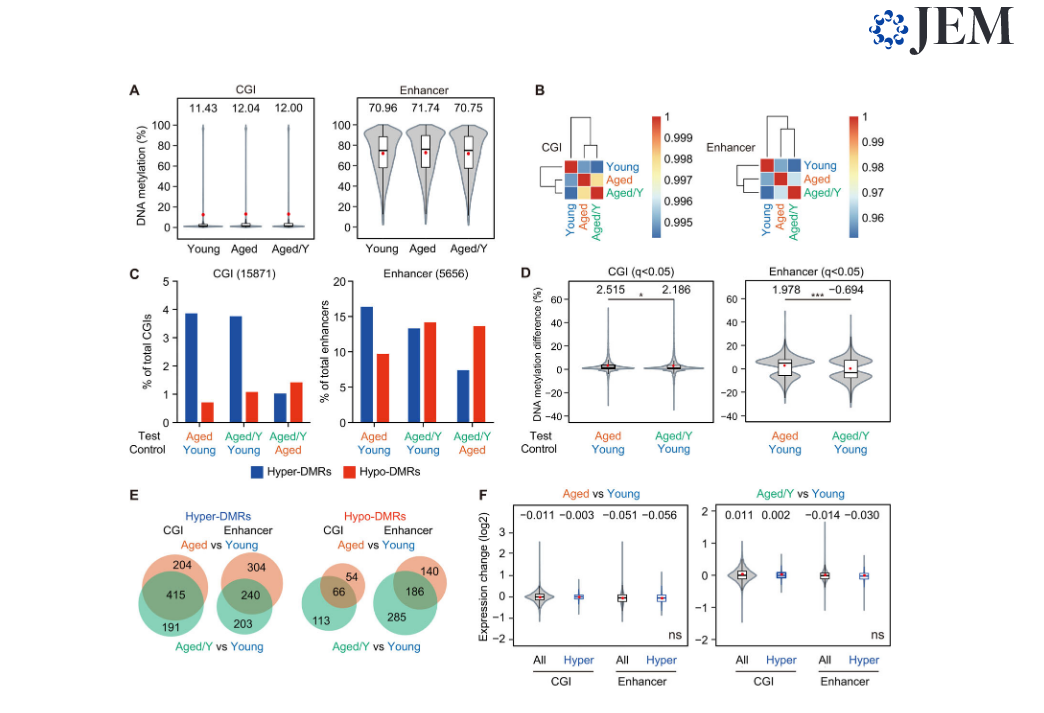 Рисунок 5. Связанное с возрастом аберрантное метилирование ДНК устойчиво к омоложению ниши. (A) Скрипичные диаграммы, показывающие глобальные уровни метилирования ДНК в Young,Aged, и Aged/Y HSC на CGI и энхансерах. Средние и медианные значения обозначены красными точками и горизонтальными полосами, соответственно. (B) Данные иерархической кластеризации, основанные на коэффициенте корреляции Пирсона метилирования ДНК в CGI и энхансерах в Young,Aged, и Aged/Y. HSC (C) Процентные доли гипер- и гипо-DMR в CGI и энхансерах в Aged и Aged / Y HSC по сравнению с указанными HSC. Среди DMR со значительными различиями в уровнях метилирования от таковых в контрольных HSC (q <0,05) те, которые демонстрируют разницу в метилировании ≥5,0%, были определены как гипер- и гипо-DMR. (D) Скрипичные диаграммы, показывающие разницу в метилировании ДНК (процент) в DMR между тестом (Aged или Aged / Y HSC) и контролем (молодые HSC). Средние и медианные значения обозначены как красные точки и горизонтальные полосы, соответственно. (E) Диаграммы Венна, показывающие перекрытие гипер- и гипо-DMR на CGI и энхансерах между Aged и Aged / YHSC. Гипер- и гипо-DMR были определены в Aged и Aged / Y HSC с использованием молодых HSC в качестве контроля. (F) Скрипичные диаграммы, показывающие изменения экспрессии всех генов (все) и генов с гипер-DMR на CGI и энхансеров (Hyper) между тестом (Aged и Aged/Y HSCs HSC) и контролем (Молодые HSC). Средние и медианные значения обозначены красными точками и горизонтальными полосами соответственно. Данные представлены как среднее ± стандартное отклонение. Данные второй когорты представлены на рис. S3. *, P <0,05; ***, P <0,001; ns, не являются значительными по тесту Стьюдента.
Рисунок 5. Связанное с возрастом аберрантное метилирование ДНК устойчиво к омоложению ниши. (A) Скрипичные диаграммы, показывающие глобальные уровни метилирования ДНК в Young,Aged, и Aged/Y HSC на CGI и энхансерах. Средние и медианные значения обозначены красными точками и горизонтальными полосами, соответственно. (B) Данные иерархической кластеризации, основанные на коэффициенте корреляции Пирсона метилирования ДНК в CGI и энхансерах в Young,Aged, и Aged/Y. HSC (C) Процентные доли гипер- и гипо-DMR в CGI и энхансерах в Aged и Aged / Y HSC по сравнению с указанными HSC. Среди DMR со значительными различиями в уровнях метилирования от таковых в контрольных HSC (q <0,05) те, которые демонстрируют разницу в метилировании ≥5,0%, были определены как гипер- и гипо-DMR. (D) Скрипичные диаграммы, показывающие разницу в метилировании ДНК (процент) в DMR между тестом (Aged или Aged / Y HSC) и контролем (молодые HSC). Средние и медианные значения обозначены как красные точки и горизонтальные полосы, соответственно. (E) Диаграммы Венна, показывающие перекрытие гипер- и гипо-DMR на CGI и энхансерах между Aged и Aged / YHSC. Гипер- и гипо-DMR были определены в Aged и Aged / Y HSC с использованием молодых HSC в качестве контроля. (F) Скрипичные диаграммы, показывающие изменения экспрессии всех генов (все) и генов с гипер-DMR на CGI и энхансеров (Hyper) между тестом (Aged и Aged/Y HSCs HSC) и контролем (Молодые HSC). Средние и медианные значения обозначены красными точками и горизонтальными полосами соответственно. Данные представлены как среднее ± стандартное отклонение. Данные второй когорты представлены на рис. S3. *, P <0,05; ***, P <0,001; ns, не являются значительными по тесту Стьюдента.
Материалы и методы
Мыши 8-недельных мышей C57BL / 6 (B6-CD45.2) были приобретены в Japan SLC и разводились в течение 16–19 мес. В экспериментальных помещениях на животных Университета Чиба и Института медицинских наук Университета Токио. . Мыши C57BL / 6, конгенные по локусу Ly5 (B6-CD45.1), были приобретены в Sankyo-Lab Service. В настоящем исследовании использовались только самки мышей. Все эксперименты с использованием мышей проводились в соответствии с нашими институциональными руководящими принципами по использованию лабораторных животных и одобрены Наблюдательным советом по экспериментам на животных Университета Чиба (идентификатор утверждения 30–56) и Институтом медицинских наук Токийского университета (разрешение ID ПС18-02)
Проточная цитометрия и антитела
Клетки ВМ были выделены путем дробления костей таза, бедренной кости и голени. Проточные цитометрические анализы и сортировку клеток проводили с использованием моноклональных антител, распознающих следующие антигены: CD45.2 (10в4), CD45.1 (A20), Gr-1 (RB6-8C5), CD11b / Mac-1 (M1 / 70), Ter- 119 (TER-119), CD127 / IL7Rα (SB / 199), CD4 (GK1.5), CD8α (53–6,7), B220 (RA3-6B2), CD117 / c-Kit (2B8), Sca-1 ( D7), CD135 / Flk2 (A2F10), CD34 (RAM34), CD150 (TC15-12F12.2) и CD48 (HM48-1). Эти антитела были приобретены у BD Biosciences, eBioscience, BioLegend, TOMBO и R&D Systems. Мертвые клетки удаляли окрашиванием йодидом пропидия 0,5 мкг / мл (Sigma-Aldrich). Все анализы проточной цитометрии и сортировка клеток выполнялись на FACS Aria III, FACS Canto II или FACS Celesta (BD Biosciences).
Трансплантация BM без предварительной подготовки
Что касается трансплантации BM без предварительной обработки, очищенные клетки LSK от 20-месячных мышей CD45.2 в возрасте и c-Kit + HSPC от 12-месячных или 8-недельных мышей CD45.2 трансплантировали путем инъекции в хвостовую вену некондиционированных мышей-реципиентов CD45.1 в возрасте 8 недель. Клетки c-Kit + обогащали с использованием CD117 / c-Kit (2B8) –APCantibody (BioLegend) и анти-APC MicroBeads (MACS MiltenyiBiotec), а затем клетки LSK сортировали на FACS Aria III. Количество HSC в трансплантированных клетках LSK или c-Kit + рассчитывали по пропорциям HSC в тестируемых клетках. При функциональной оценке трансплантированных HSC без предварительного кондиционирования LSK-клетки или HSC очищали из позвоночника, таза, бедренной кости и голени через 2 месяца после трансплантации, а затем трансплантировали смертельно облученным (9,5 Гр) мышам CD45.1 свежеприготовленные 2 × 105CD45 .2 клетки-конкуренты BM.
Секвенирование РНК
3000 HSC были выделены от мышей-первичных реципиентов (CD45.2 + Aged / Y HSC и CD45.1 + Young HSC) и 20-месячных мышей CD45.2 + (Aged HSC). РНК экстрагировали с использованием набора RNeasy Plus Micro Kit (Qiagen) и подвергали обратной транскрипции и амплификации с помощью набора SMARTer Ultra Low Input RNA для секвенирования (Clontech). После обработки ультразвуком с помощью ультразвукового прибора (Covaris) библиотеки для секвенирования РНК были созданы из фрагментированной ДНК с восемью циклами амплификации с использованием набора NEB Next Ultra DNA Library Prep Kit (New England Biolabs). После количественной оценки библиотек с помощью Bioanalyzer (Agilent) образцы подвергали секвенированию с помощью Hiseq1500 (Illumina) и проводили 61 цикл реакции секвенирования. TopHat2 (версия 2.0.13; с параметрами по умолчанию) и Bowtie2 (версия 2.1.0) использовались для выравнивания с эталонным геномом мыши (mm10 от Калифорнийского университета, Santa Cruz Genome Browser). Нормализация и удаление пакетных эффектов значения подсчета и значительных различий в выражениях были обнаружены с помощью DESeq2 (версия 2.2.1; Love et al., 2014), первичные значения созданы с помощью StringTie. Нормализованное количество было преобразовано в log2 и масштабировано по Z-значениям перед выполнением анализа ПК и анализа тепловой карты, за исключением иерархической кластеризации. GSEA проводился по генам, связанным со старением (Wahlestedt et al., 2013). Анализ путей биологических процессов GO, молекулярных механизмов GO, пути KEGG, пути Wiki и пути Reactome, связанных с генами-кандидатами, проводился с использованием g: Profiler инструмент с P <0,05.
WGBS
Геномную ДНК экстрагировали из 7500 очищенных HSC с использованием набора aDNeasy Blood & Tissue (Qiagen). Подготовка библиотек секвенирования для WGBS в основном выполнялась с использованием протокола маркировки адаптера бисульфита (tPBAT), как описано ранее (Miura et al., 2019,2012). Чтобы контролировать эффективность превращения бисульфита, неметилированную лямбда-ДНК (Promega) добавляли к каждой ДНК в количестве 1%. Концентрацию библиотек для секвенирования оценивали с помощью набора для количественного определения библиотеки от Takara Bio. Библиотеки tPBAT смешивали с контрольной библиотекой PhiX (Illumina) в молярном соотношении 80:20, и общую концентрацию смешанной библиотеки доводили до 600 пМ. Библиотеки были отправлены в Macrogen Japan, и секвенирование было выполнено с использованием HiSeq X с режимом парных концов (2 × 150 циклов). Данные последовательностей, демультиплексированные Macro-gen Japan, использовали для последующего анализа. Считывания были сопоставлены с эталонным геномом, который состоит из генома мыши (mm10) и фага энтеробактерий лямбда (GenBank, номер доступа J02459.1) с использованием BMap, программы картирования бисульфитов, как описано ранее (Miura et al., 2019). С помощью ряда внутренних программ были подведены итоги согласований. Результаты базового статистического анализа данных метилома показаны в таблице S3 A. Данные WGBS были сопоставлены с геномом мыши (мм10) с использованием программного обеспечения Bismark (Институт Бабрахама). Баллы метилирования рассчитывались как количество неконвертированных считываний, разделенное на количество общих считываний в каждом CGI (университет Калифорнии в мм10, Santa Cruz Genome Browser) и энхансерной области, активной в долгосрочных HSC, определенных ранее (Lara-Astiaso et al. 2014). DMR, которые показали значительную разницу в уровнях метилирования (q <0,05) и разницу в метилировании ≥ 5,0%, были идентифицированы с помощью methylKit (BioMed Central). AnnotatePeaks использовался в дополнение к связыванию пиков с соседними генами.
Статистический анализ
Статистический анализ выполняли с использованием Graph Pad Prismversion 8. Непарный двусторонний t-тест или однофакторный дисперсионный анализ ANOVA выполняли, как показано на рисунках. В скрипичных диаграммах прямоугольники обозначают диапазоны 25–75-го процентиля. Вертикальные линии представляют диапазоны 10–90-го процентиля. Красные точки и горизонтальные полосы указывают среднее и медианное значения соответственно. Данные представлены как среднее значение ± стандартная ошибка среднего (SEM) или стандартное отклонение, как указано. Достоверность принималась при значениях *, P <0,05; **, P <0,01; и ***, P <0,001.
Номера доступа
Данные РНК-секвенирования и WGBS были депонированы в Банке данных ДНК Японии под номером доступа. DRA010901.
Дополнительные материалы
На рис. S1 представлены данные длительного кроветворения с помощью старых HSC, приживленных в некондиционированной молодой нише. S2 показывает профиль транскриптома старых HSC (когорта 3). S3 показывает сравнение метилирования ДНК между Young, Aged, и Ag-ed/Y HSC. В таблице S1 показаны DEG между молодыми и пожилыми HSC. В таблице S2, A и B показаны данные GSEA для старых HSC и сводка анализа путей пяти кластерных генов. В таблице S3, A и B показаны основные статистические данные по метиломам и DMR в старых HSC.
Благодарности
Мы хотели бы поблагодарить Тацуки Сугияму и Такаши Нагасаву за технические советы; Ацунори Сарая, Макико Юи и Хироко Цукуи за их любезную помощь; и Микако Курибаяси за графические иллюстрации. Ресурсы для суперкомпьютеров были предоставлены Центром генома человека Института медицинских наук Токийского университета при частичной поддержке Министерства образования, культуры, спорта, науки и технологий в рамках грантов на научные исследования (JP19H05653) , Научные исследования в инновационных областях «Старение и болезнь стволовых клеток» (JP26115002) и «Репликация негеномных кодов» (JP19H05746), а также Проект платформы Японского агентства медицинских исследований и разработок для поддержки открытия лекарств и исследований в области наук о жизни (основа за поддержку открытия инновационных лекарств и исследований в области наук о жизни) в рамках гранта JP20am0101103 (номер поддержки 1803). Вклад авторов: В. Курибаяси провел эксперименты, проанализировал результаты, сделал рисунки и активно написал рукопись; М. Осима, Н. Итокава, С. Койде, Ю. Накадзима-Такаги, С. Ямазаки, М. Ямасита, Б. Рахмутулла, Ф. Миура и Т. Ито помогали в проведении экспериментов; М. Ямасита редактировал рукопись; А. Канеда концептуализировал исследование и отредактировал рукопись; А. Ивама задумал и руководил проектом, обеспечил финансирование и активно написал рукопись.
Авторы
Wakako Kuribayashi 1,2, Motohiko Oshima 2, NaokiItokawa 1,2, Shuhei Koide 2, Yaeko Nakajima-Takagi 2, Masayuki Yamashita 2, Satoshi Yamazaki 3,4, Bahityar Rahmutulla 5, FumihitoMiura 6, Takashi Ito 6, Atsushi Kaneda 5, and Atsushi Iwama 1,2
Раскрытие информации
авторы заявляют об отсутствии конкурирующих интересов.
Поступило: 4 декабря 2019 г.
Доработана: 17 сентября 2020 г.
Принята в печать: 19 октября 2020 г.
Оригинальная статья (PDF): Limited rejuvenation of aged hematopoietic stem cells in young bone marrow niche
Перевод Ник Сестрин







































































