
Оригинальная статья: Multi-omic rejuvenation of human cells by maturation phase transient reprogramming
Введение
![]()
Старение - это постепенное снижение функции клеток и тканей с течением времени, которое происходит почти у всех организмов и связано с множеством молекулярных признаков, таких как истощение теломер, генетическая нестабильность, эпигенетические и транскрипционные изменения и накопление неправильно свернутых белков (López-Otín и др., 2013). Это приводит к нарушению восприятия питательных веществ, митохондриальной дисфункции и увеличению частоты клеточного старения, что влияет на общую функцию клеток, межклеточную коммуникацию, способствует истощению пулов стволовых клеток и вызывает тканевую дисфункцию (López-Otín et al., 2013). Развитие некоторых связанных со старением изменений, таких как транскриптомные и эпигенетические, можно измерить с высокой точностью, и поэтому их можно использовать для построения «часов старения», которые предсказывают хронологический возраст с высокой точностью у людей (Fleischer et al., 2018; Hannum et al., 2013; Horvath, 2013; Peters et al., 2015) и у других млекопитающих (Stubbs et al., 2017; Thompson et al., 2017, 2018). Поскольку транскриптомные и эпигенетические изменения обратимы, по крайней мере в принципе, возникает интригующий вопрос о том, можно ли обратить вспять молекулярные атрибуты старения и фенотипически омолодить клетки (Rando and Chang, 2012).
Перепрограммирование индуцированных плюрипотентных стволовых клеток (iPSC) - это процесс, с помощью которого практически любая соматическая клетка может быть преобразована в состояние, подобное эмбриональным стволовым клеткам. Интересно, что перепрограммирование iPSC обращает вспять многие возрастные изменения, включая истощение теломер и окислительный стресс (Lapasset et al., 2011). Примечательно, что эпигенетические часы сбрасываются примерно до 0, что указывает на то, что перепрограммирование может обратить вспять эпигенетические изменения, связанные со старением (Horvath, 2013). Однако перепрограммирование iPSC также приводит к потере исходной идентичности клетки и, следовательно, к потере функции. Напротив, подходы к перепрограммированию, при которых факторы Яманака (Oct4, Sox2, Klf4, c-Myc) экспрессируются в течение коротких периодов времени, могут быть способны достичь омоложения без потери идентичности клеток. Перепрограммирование может быть выполнено in vivo (Abad et al., 2013), и действительно, циклическая экспрессия факторов Yamanaka in vivo может увеличивать продолжительность жизни прогероидных мышей и улучшать клеточную функцию у мышей дикого типа (Ocampo et al., 2016). Альтернативный подход к перепрограммированию in vivo продемонстрировал обратимость связанных со старением изменений в ганглиозных клетках сетчатки и был способен восстанавливать зрение на модели глаукомы на мышах (Lu et al., 2020). Совсем недавно было показано, что временное перепрограммирование in vitro обращает вспять множество аспектов старения фибробластов и хондроцитов человека (Sarkar et al., 2020). Тем не менее, степень эпигенетического омоложения, достигнутая с помощью предыдущих методов частичного перепрограммирования, была умеренной (~ 3 года) по сравнению с резким скачком, достигнутым полным ИПСК перепрограммированием. Здесь мы устанавливаем новую стратегию временного перепрограммирования, при которой факторы Яманака экспрессируются до достижения фазы созревания с последующей отменой их индукции (кратковременное перепрограммирование фазы созревания, MPTR), с помощью которой мы смогли добиться надежного и очень существенного омоложения (~ 30 лет), при сохранении исходной идентичности клетки.
Полученные результаты
Кратковременно перепрограммированные клетки восстанавливают свою первоначальную клеточную идентичность
Перепрограммирование можно разделить на три фазы: инициация, созревание и стабилизация (Samavarchi-Tehrani et al., 2010) (рис. 1A). Предыдущие попытки частичного перепрограммирования проводились только на стадии инициации (Ocampo et al., 2016; Sarkar et al., 2020). Однако дальнейшее перепрограммирование, вплоть до фазы созревания, может привести к более существенному омоложению. Чтобы исследовать потенциал частичного перепрограммирования на фазе созревания (MPTR) для обращения фенотипов старения, мы создали индуцируемую доксициклином полицистронную кассету перепрограммирования, которая кодирует Oct4, Sox2, Klf4, c-Myc и GFP. Используя полицистронную кассету, мы могли гарантировать, что отдельные клетки способны экспрессировать все четыре фактора Яманака. Эта кассета перепрограммирования была способна генерировать независимые от доксициклина линии ИПСК из человеческих фибробластов и индуцировала значительное снижение возраста метилирования ДНК на протяжении всего процесса перепрограммирования, что согласуется с предыдущей работой с использованием другой системы перепрограммирования (Olova et al., 2018) (Рисунок 1A) . В частности, возраст метилирования ДНК, измеренный с помощью эпигенетических часов (Horvath, 2013), был существенно снижен на относительно ранней стадии процесса перепрограммирования (для завершения которого требуется около 50 дней) с приблизительным омоложением на 20 лет к 10-му дню и 40 лет на день 17 (рис. 1А). Аналогичные результаты были получены с использованием часов кожи и крови (Horvath et al., 2018) (дополнительный рисунок 1A). Поэтому мы сосредоточились на промежутке между 10 и 17 днями, чтобы разработать наш протокол MPTR для человеческих фибробластов (рис. 1B), прогнозируя, что это позволит существенно изменить фенотипы старения, потенциально позволяя клеткам восстановить исходную клеточную идентичность. Кассету перепрограммирования вводили в фибробласты от трех доноров среднего возраста (38, 53 и 53 года) с помощью лентивирусной трансдукции перед отбором успешно трансдуцированных клеток путем сортировки на GFP. Затем мы перепрограммировали фибробласты на разное время (10, 13, 15 или 17 дней), добавив в среду 2 мкг / мл доксициклина, и провели сортировку в потоке, чтобы выделить клетки, которые успешно перепрограммировались (обозначены как «промежуточный продукт кратковременного перепрограммирования»: SSEA4 положительный, CD13 отрицательный), а также клетки, которые не смогли перепрограммироваться (помеченные как «неудачный промежуточный продукт кратковременного перепрограммирования»: CD13 положительный, SSEA4 отрицательный). На этом этапе примерно 25% клеток успешно перепрограммировались, и примерно 35% клеток не могли перепрограммироваться, в то время как остальные были дважды положительными или дважды отрицательными (дополнительный рисунок 1B). Клетки собирали на матрицу метилирования ДНК или РНК-seq, а также повторно высевали для дальнейшего культивирования в отсутствие доксициклина, чтобы остановить экспрессию кассеты перепрограммирования. Дальнейшее культивирование в отсутствие доксициклина генерировало «кратковременно перепрограммированные фибробласты», которые ранее экспрессировали SSEA4 на промежуточной стадии, а также «не сумевшие перепрограммироваться фибробласты», которые экспрессировали кассету перепрограммирования (были GFP-положительными), но не экспрессировали SSEA4. В качестве отрицательного контроля мы одновременно берем «якобы инфицированные» популяции фибробластов от одних и тех же доноров. Эти клетки прошли первоначальную потоковую сортировку на жизнеспособность (для учета эффектов сортировки по GFP) перед культивированием в тех же условиях, что и перепрограммируемые клетки, и потоковую сортировку на CD13 (клетки, собранные на этой стадии, генерировали «промежуточный продукт отрицательного контроля» для метиломного и транскриптомного анализов). Наконец, эти «промежуточные отрицательные контрольные клетки» выращивали в отсутствие доксициклина в течение того же периода времени, что и экспериментальные образцы, чтобы учесть эффекты расширенной клеточной культуры, генерирующие «отрицательные контрольные фибробласты» (рис. 1В).
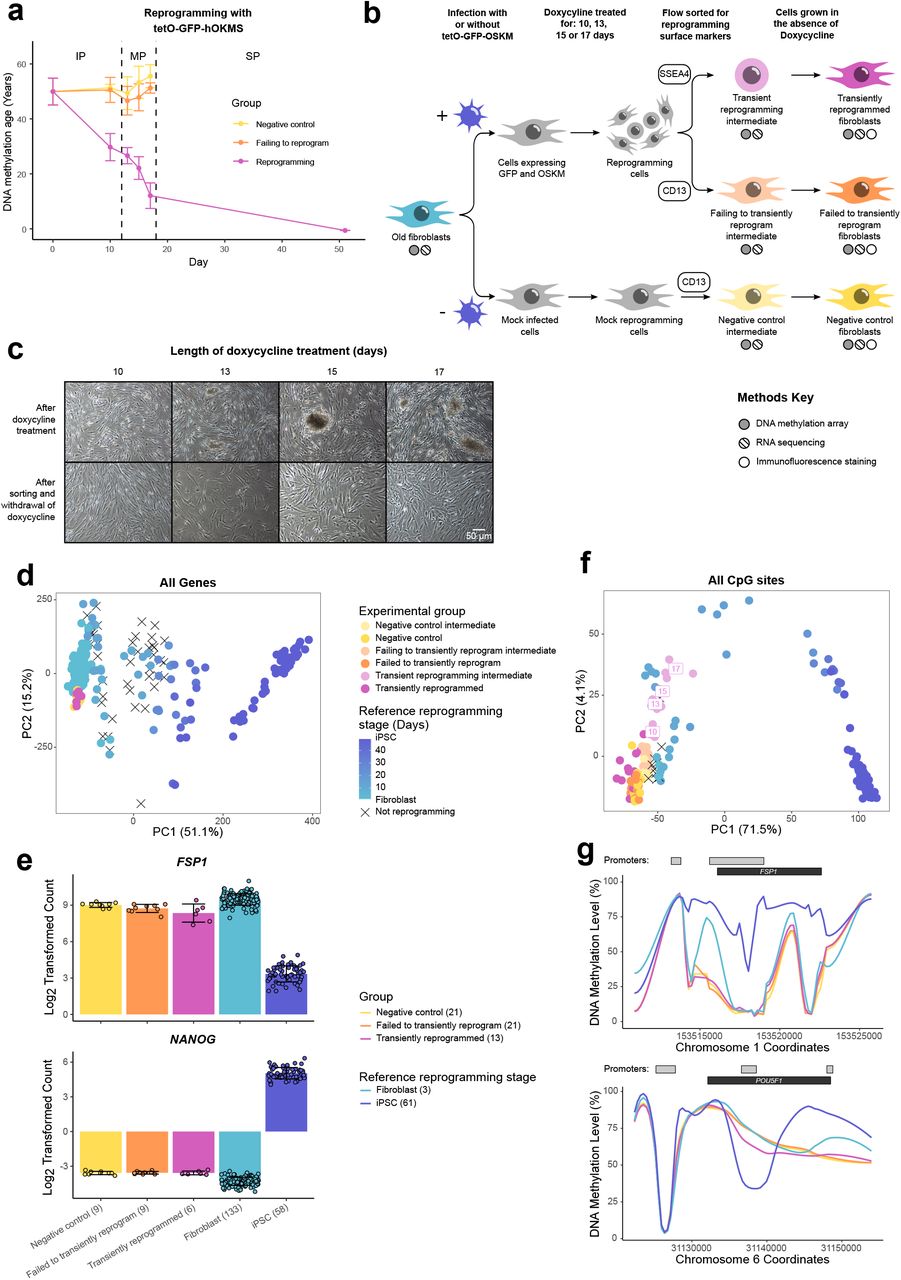 Рисунок 1. Кратковременно перепрограммированные клетки снова обретают свою первоначальную клеточную идентичность. (A) Средний возраст метилирования ДНК (рассчитанный с использованием мульти-тканевых часов (Horvath, 2013)) на протяжении всего процесса перепрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Возраст метилирования ДНК существенно снизился во время фазы созревания перепрограммирования в клетках, которые были успешно перепрограммированы (пурпурная линия), но не в контрольных клетках (желтые и оранжевые линии представляют нетрансдуцированные клетки и клетки, экспрессирующие hOKMS, но не сумевшие перепрограммироваться, как указано маркерами клеточной поверхности. , соответственно). Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (B) Экспериментальная схема для фазы созревания кратковременного перепрограммирования (MPTR). Перепрограммирующую конструкцию tetO-GFP-hOKMS вводили в фибробласты от старых доноров с помощью лентивирусной трансдукции. В качестве альтернативы клетки были «ложно инфицированы» в качестве отрицательного контроля. После этого клетки выращивали в присутствии 2 мкг / мл доксициклина для инициации перепрограммирования. В некоторые моменты времени во время фазы созревания клетки были отсортированы в потоке и успешно перепрограммированые клетки (CD13-SSEA4 +), и клетки, которые не смогли перепрограммироваться (CD13 + SSEA4-), были собраны для анализа. Они было названы «промежуточным продуктом кратковременного перепрограммирования» и «промежуточным продуктом неудачного перепрограммирования» соответственно. Отсортированные клетки также дополнительно культивировали и выращивали в отсутствие доксициклина в течение по крайней мере четырех недель - это было названо «кратковременно перепрограммированные» (CD13-SSEA4 +) или «не удалось перепрограммировать» (CD13 + SSEA4-).(C) Фазово-контрастные микроскопические изображения клеток после обработки доксициклином (промежуточный продуктом кратковременного перепрограммирования) и после отмены доксициклина (кратковременно перепрограммированные), как описано в B. Морфология некоторых клеток изменилась после обработки доксициклином. Эти клетки, по-видимому, образовывали колонии, которые становились больше при более длительном воздействии доксициклина. После сортировки эти клетки культивировали в среде, больше не содержащей доксициклин, и оказалось, что они вернулись к своей первоначальной морфологии фибробластов. (D) Анализ основных компонентов транскриптомов образцов кратковременно перепрограммированных и эталонных перепрограммированных образцов (от светло-синего до темно-синего, данные Banovich et al (2018), Fleischer et al (2018) и наш новый набор данных перепрограммирования Sendai). Контрольные образцы образуют траекторию перепрограммирования вдоль ПК1. В начале этой траектории находились временно перепрограммированные образцы и контрольные образцы.(E) Средние уровни экспрессии гена, специфичного для фибробластов, FSP1 и гена, специфичного для ИПСК, NANOG. Кратковременно перепрограммированные образцы экспрессировали эти гены на уровнях, аналогичных контрольным фибробластам. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Образцы, временно перепрограммированные в течение 13, 15 или 17 дней, объединяли. В скобках указано количество образцов в каждой группе.(F) Анализ основных компонентов временного перепрограммирования (пурпурные точки) и эталонных метиломов перепрограммированных образцов (от светло-синего до темно-синего, данные Banovich et al (2018), Ohnuki et al (2014) и наш новый набор данных перепрограммирования Sendai). Контрольные образцы формировали траекторию перепрограммирования вдоль ПК1. Образцы временного перепрограммирования перемещались по этой траектории при продолжающемся воздействии доксициклина (светло-пурпурные точки) и возвращались к началу траектории после изъятия доксициклина (пурпурные точки). Контрольные образцы (желтые и оранжевые точки) оставались в начале траектории на протяжении всего эксперимента.(G) Средние уровни метилирования ДНК в специфическом для фибробласта гене FSP1 и в специфическом для ИПСК гене POU5F1 (кодирующем OCT4). Кратковременно перепрограммированные образцы имели профили метилирования по этим генам, которые напоминают профили, обнаруженные в фибробластах. Серые полосы и черные полосы показывают расположение аннотированных промоторов и генов Ensembl, соответственно. Образцы, временно перепрограммированные на 10, 13, 15 или 17 дней, были объединены для визуализации. В скобках указано количество образцов в каждой группе.
Рисунок 1. Кратковременно перепрограммированные клетки снова обретают свою первоначальную клеточную идентичность. (A) Средний возраст метилирования ДНК (рассчитанный с использованием мульти-тканевых часов (Horvath, 2013)) на протяжении всего процесса перепрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Возраст метилирования ДНК существенно снизился во время фазы созревания перепрограммирования в клетках, которые были успешно перепрограммированы (пурпурная линия), но не в контрольных клетках (желтые и оранжевые линии представляют нетрансдуцированные клетки и клетки, экспрессирующие hOKMS, но не сумевшие перепрограммироваться, как указано маркерами клеточной поверхности. , соответственно). Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (B) Экспериментальная схема для фазы созревания кратковременного перепрограммирования (MPTR). Перепрограммирующую конструкцию tetO-GFP-hOKMS вводили в фибробласты от старых доноров с помощью лентивирусной трансдукции. В качестве альтернативы клетки были «ложно инфицированы» в качестве отрицательного контроля. После этого клетки выращивали в присутствии 2 мкг / мл доксициклина для инициации перепрограммирования. В некоторые моменты времени во время фазы созревания клетки были отсортированы в потоке и успешно перепрограммированые клетки (CD13-SSEA4 +), и клетки, которые не смогли перепрограммироваться (CD13 + SSEA4-), были собраны для анализа. Они было названы «промежуточным продуктом кратковременного перепрограммирования» и «промежуточным продуктом неудачного перепрограммирования» соответственно. Отсортированные клетки также дополнительно культивировали и выращивали в отсутствие доксициклина в течение по крайней мере четырех недель - это было названо «кратковременно перепрограммированные» (CD13-SSEA4 +) или «не удалось перепрограммировать» (CD13 + SSEA4-).(C) Фазово-контрастные микроскопические изображения клеток после обработки доксициклином (промежуточный продуктом кратковременного перепрограммирования) и после отмены доксициклина (кратковременно перепрограммированные), как описано в B. Морфология некоторых клеток изменилась после обработки доксициклином. Эти клетки, по-видимому, образовывали колонии, которые становились больше при более длительном воздействии доксициклина. После сортировки эти клетки культивировали в среде, больше не содержащей доксициклин, и оказалось, что они вернулись к своей первоначальной морфологии фибробластов. (D) Анализ основных компонентов транскриптомов образцов кратковременно перепрограммированных и эталонных перепрограммированных образцов (от светло-синего до темно-синего, данные Banovich et al (2018), Fleischer et al (2018) и наш новый набор данных перепрограммирования Sendai). Контрольные образцы образуют траекторию перепрограммирования вдоль ПК1. В начале этой траектории находились временно перепрограммированные образцы и контрольные образцы.(E) Средние уровни экспрессии гена, специфичного для фибробластов, FSP1 и гена, специфичного для ИПСК, NANOG. Кратковременно перепрограммированные образцы экспрессировали эти гены на уровнях, аналогичных контрольным фибробластам. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Образцы, временно перепрограммированные в течение 13, 15 или 17 дней, объединяли. В скобках указано количество образцов в каждой группе.(F) Анализ основных компонентов временного перепрограммирования (пурпурные точки) и эталонных метиломов перепрограммированных образцов (от светло-синего до темно-синего, данные Banovich et al (2018), Ohnuki et al (2014) и наш новый набор данных перепрограммирования Sendai). Контрольные образцы формировали траекторию перепрограммирования вдоль ПК1. Образцы временного перепрограммирования перемещались по этой траектории при продолжающемся воздействии доксициклина (светло-пурпурные точки) и возвращались к началу траектории после изъятия доксициклина (пурпурные точки). Контрольные образцы (желтые и оранжевые точки) оставались в начале траектории на протяжении всего эксперимента.(G) Средние уровни метилирования ДНК в специфическом для фибробласта гене FSP1 и в специфическом для ИПСК гене POU5F1 (кодирующем OCT4). Кратковременно перепрограммированные образцы имели профили метилирования по этим генам, которые напоминают профили, обнаруженные в фибробластах. Серые полосы и черные полосы показывают расположение аннотированных промоторов и генов Ensembl, соответственно. Образцы, временно перепрограммированные на 10, 13, 15 или 17 дней, были объединены для визуализации. В скобках указано количество образцов в каждой группе.
После перепрограммирования в течение 10-17 дней мы обнаружили, что фибробласты претерпели резкие изменения морфологии. При визуальном осмотре с использованием светового микроскопа выяснилось, что клетки претерпели переход от мезенхимы к эпителию и образовали колонии, которые постепенно становились больше с более длительными периодами перепрограммирования, что согласуется с появлением раннего маркера плюрипотентности SSEA4. После сортировки клеток и культивирования в отсутствие доксициклина мы обнаружили, что они смогли вернуться к своей первоначальной морфологии фибробластов, показывая, что морфологическая реверсия возможна даже после 17 дней перепрограммирования (рис. 1C). Мы дополнительно исследовали идентичность клеток после этого MPTR путем проведения анализа массива метилирования ДНК и секвенирования РНК для изучения их метиломов и транскриптомов, соответственно. Мы включили опубликованные наборы данных перепрограммирования в наш анализ, а также новый набор данных перепрограммирования, который мы создали на основе доставки вирусом Sendai факторов Яманака, чтобы использовать в качестве референсного образца (Banovich et al., 2018; Fleischer et al., 2018; Ohnuki et al. ., 2014). Анализ главных компонент значений экспрессии всех генов в транскриптоме разделил клетки по степени перепрограммирования, и контрольные наборы данных сформировали траекторию перепрограммирования вдоль PC1 (рис. 1D). Кратковременно перепрограммированные образцы группируются в начале этой траектории, показывая, что эти образцы транскрипционно напоминают фибробласты, а не промежуточные продукты перепрограммирования или ИПСК (рис. 1D). Например, кратковременно перепрограммированные клетки не экспрессировали маркер плюрипотентности NANOG и экспрессировали высокие уровни маркера фибробластов FSP1 (рис. 1E). Аналогичным образом, анализ главных компонент метиломов разделил клетки по степени перепрограммирования, и контрольные наборы данных сформировали траекторию перепрограммирования. Действительно, промежуточные образцы из нашего эксперимента по кратковременному перепрограммированию (собранные после фазы перепрограммирования, но до фазы реверсии) сгруппировались вдоль этой траектории перепрограммирования (рис. 1F), показывая, что клетки эпигенетически движутся в сторону плюрипотентности, соответствующей потере поверхностного маркера фибробластов CD13 и увеличению поверхностного маркера ИПСК SSEA4. Примечательно, что кратковременно перепрограммированные образцы вернулись к началу этой траектории (с референсными образцами фибробластов), обнаружив, что они снова эпигенетически напоминают фибробласты. Мы обнаружили, что типичные области, которые изменяются во время перепрограммирования, возвращаются к фибробластоподобным состояниям (Takahashi et al., 2007), такие как гиперметилирование промотора OCT4 и гипометилирование промотора FSP1 в наших временно перепрограммированных клетках (рис. 1G). Вместе эти данные демонстрируют, что фибробласты могут временно перепрограммироваться до фазы созревания и затем возвращаться в состояние, которое морфологически, эпигенетически и транскрипционно сходно с идентичностью исходной клетки. Насколько нам известно, это первый метод кратковременного перепрограммирования фазы созревания, при котором факторы Яманака временно экспрессируются вплоть до фазы созревания перепрограммирования, прежде чем экспрессия факторов отменяется.
Память о метилировании энхансеров сохраняется на промежуточном этапе кратковременного перепрограммирования.
Хотя кратковременно перепрограммированные фибробласты временно утратили свою клеточную идентичность (становясь SSEA4-положительными), они смогли повторно приобрести ее после удаления факторов перепрограммирования, что позволяет предположить, что они сохранили память о своей первоначальной клеточной идентичности. Мы предположили, что это, возможно, форма эпигенетической памяти, и поэтому исследовали уровни метилирования ДНК в промоторах и энхансерах во время процесса перепрограммирования. Мы использовали Ensembl Regulatory Build, чтобы получить расположение промоторов и энхансеров, а также статус их активности в дермальных фибробластах и ИПСК. Мы сосредоточились на промоторах и энхансерах, которые активны в фибробластах, но больше не активны в ИПСК, и классифицировали их как промоторы и энхансеры, специфичные для фибробластов (рис. 2А, В, нижние панели). В целом, мы обнаружили, что уровни метилирования ДНК были относительно низкими на промоторах, специфичных для фибробластов, даже в ИПСК (рис. 2А), за исключением небольшого подмножества промоторов (14 из 479), которые стали гиперметилированными во время перепрограммирования, но все еще были слабо метилированы в промежуточный этап кратковременного перепрограммирования. Эти промоторы могут давать некоторую память о начальном типе клеток, но они явно не связаны с функцией фибробластов (рис. 2А). Таким образом, метилирование промоторной ДНК вряд ли является источником существенной памяти об идентичности фибробластов. Напротив, мы обнаружили, что метилирование ДНК было относительно динамичным на фибробласт-специфичных энхансерах. Примерно половина всех фибробласт-специфичных энхансеров (2351 из 4204) приобретает метилирование ДНК во время перепрограммирования в ИПСК. Однако даже на 17 день процесса перепрограммирования (самый продолжительный срок перепрограммирования, протестированный здесь), эти энхансеры все еще оставались деметилированными (рис. 2В). Мы также сравнили метилирование этих энхансеров в наших промежуточных и конечных образцах с референсными наборами данных с использованием PCA. Образцы остаются фибробластоподобными на этих энхансерах примерно до 20 дня перепрограммирования, когда начинается фаза стабилизации (рис. 2C), в отличие от метилома в целом (рис. 1F). Таким образом, в целом эти энхансеры, вероятно, будут оставаться в равновесии во время кратковременного перепрограммирования и в результате могут действовать как источник памяти о первоначальной идентичности клеток в то время, когда программа соматической транскрипции репрессируется и соматические белки, такие как CD13, теряются (Дэвид и Поло, 2014).
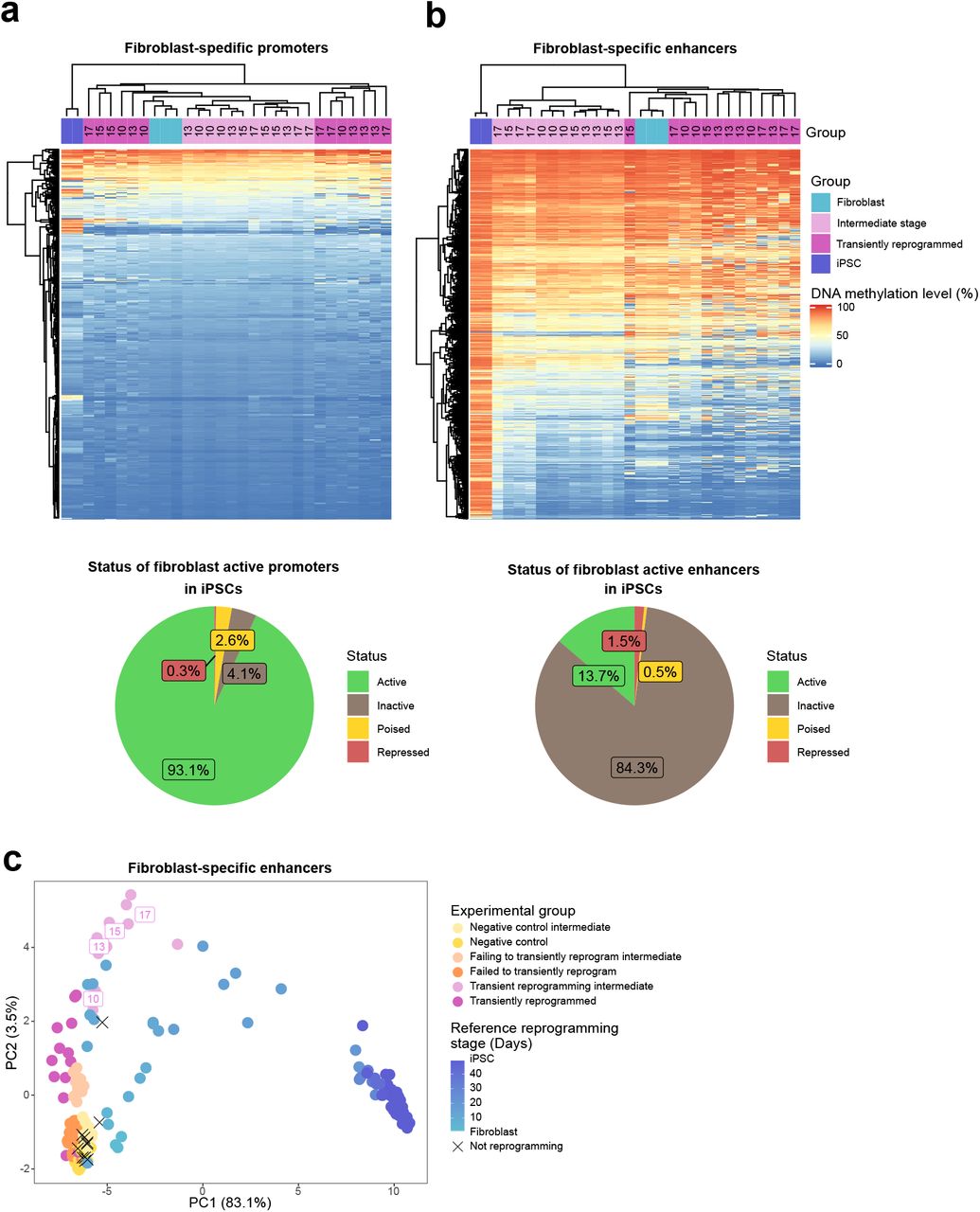 Рисунок 2. Эпигенетическая память на энхансерах может позволить клеткам вернуться к своей исходной идентичности.(A) Тепловая карта (верхняя панель), исследующая уровни метилирования ДНК фибробласт-специфичных промоторов в клетках до (светло-синяя группа), во время (светло-пурпурная группа, промежуточные клетки с кратковременным перепрограммированием, определенные на рисунке 1B) и после (пурпурная группа, кратковременно перепрограммированные фибробласты, определенные на рисунке 1B), кратковременное перепрограммирование, а также в ИПСК (темно-синяя группа). Каждый образец был нанесен на график как отдельный столбец, независимо от того, перепрограммирован ли он в течение 10, 13, 15 или 17 дней. Промоторы фибробластов в значительной степени остаются деметилированными во время полного перепрограммирования и на промежуточных стадиях кратковременного перепрограммирования. Промоторы, специфичные для фибробластов, были определены как промоторы, которые активны в фибробластах, но больше не активны в ИПСК, на основании аннотаций регуляторных построений Ensembl (становятся неактивными, колеблющимися или репрессированными). Это происходит только в небольшом подмножестве промоторов, которые активны в фибробластах, как показано на круговой диаграмме (545 из 7910; нижняя панель).(B) Тепловая карта (верхняя панель), изучающая уровни метилирования ДНК фибробласт-специфичных энхансеров в клетках до (светло-синяя группа), во время (светло-пурпурная группа) и после (пурпурная группа) временного репрограммирования, а также в ИПСК (темно-синяя группа) ). Каждый образец был нанесен на график как отдельный столбец, независимо от того, перепрограммирован ли он на 10, 13, 15 или 17 дней. Энхансеры фибробластов становились гиперметилированными во время полного репрограммирования, но все еще деметилировались на промежуточных стадиях временного репрограммирования. Специфичные для фибробластов энхансеры были определены как энхансеры, которые активны в фибробластах, но больше не активны в ИПСК (становятся неактивными, уравновешенными или репрессированными) на основе аннотаций регуляторных построений Ensembl. Это происходит с большинством энхансеров, которые активны в фибробластах, как показано на круговой диаграмме (13831 из 16026; нижняя панель).(C) Анализ основных компонентов данных метилирования от временного репрограммирования (пурпурные точки) и эталонных образцов репрограммирования на фибробласт-специфичных энхансерах (от светло-синего до темно-синего, данные Banovich et al (2018), Ohnuki et al (2014) и наш роман Набор данных перепрограммирования Сендай). Контрольные образцы формировали траекторию перепрограммирования вдоль ПК1. Промежуточные образцы с временным перепрограммированием и образцы с временным перепрограммированием тесно группируются с фибробластами вдоль PC1.
Рисунок 2. Эпигенетическая память на энхансерах может позволить клеткам вернуться к своей исходной идентичности.(A) Тепловая карта (верхняя панель), исследующая уровни метилирования ДНК фибробласт-специфичных промоторов в клетках до (светло-синяя группа), во время (светло-пурпурная группа, промежуточные клетки с кратковременным перепрограммированием, определенные на рисунке 1B) и после (пурпурная группа, кратковременно перепрограммированные фибробласты, определенные на рисунке 1B), кратковременное перепрограммирование, а также в ИПСК (темно-синяя группа). Каждый образец был нанесен на график как отдельный столбец, независимо от того, перепрограммирован ли он в течение 10, 13, 15 или 17 дней. Промоторы фибробластов в значительной степени остаются деметилированными во время полного перепрограммирования и на промежуточных стадиях кратковременного перепрограммирования. Промоторы, специфичные для фибробластов, были определены как промоторы, которые активны в фибробластах, но больше не активны в ИПСК, на основании аннотаций регуляторных построений Ensembl (становятся неактивными, колеблющимися или репрессированными). Это происходит только в небольшом подмножестве промоторов, которые активны в фибробластах, как показано на круговой диаграмме (545 из 7910; нижняя панель).(B) Тепловая карта (верхняя панель), изучающая уровни метилирования ДНК фибробласт-специфичных энхансеров в клетках до (светло-синяя группа), во время (светло-пурпурная группа) и после (пурпурная группа) временного репрограммирования, а также в ИПСК (темно-синяя группа) ). Каждый образец был нанесен на график как отдельный столбец, независимо от того, перепрограммирован ли он на 10, 13, 15 или 17 дней. Энхансеры фибробластов становились гиперметилированными во время полного репрограммирования, но все еще деметилировались на промежуточных стадиях временного репрограммирования. Специфичные для фибробластов энхансеры были определены как энхансеры, которые активны в фибробластах, но больше не активны в ИПСК (становятся неактивными, уравновешенными или репрессированными) на основе аннотаций регуляторных построений Ensembl. Это происходит с большинством энхансеров, которые активны в фибробластах, как показано на круговой диаграмме (13831 из 16026; нижняя панель).(C) Анализ основных компонентов данных метилирования от временного репрограммирования (пурпурные точки) и эталонных образцов репрограммирования на фибробласт-специфичных энхансерах (от светло-синего до темно-синего, данные Banovich et al (2018), Ohnuki et al (2014) и наш роман Набор данных перепрограммирования Сендай). Контрольные образцы формировали траекторию перепрограммирования вдоль ПК1. Промежуточные образцы с временным перепрограммированием и образцы с временным перепрограммированием тесно группируются с фибробластами вдоль PC1.
Временное перепрограммирование обращает вспять возрастные изменения транскриптома
Чтобы исследовать влияние MPTR на транскриптом старения, мы обучили предиктор транскрипционного возраста, используя регрессию методом случайного леса на опубликованных данных фибробластов РНК-seq от доноров в возрасте от 1 до 94 лет (Fleischer et al., 2018). Предиктор транскрипционного возраста был обучен на трансформированном возрасте, подобно эпигенетическим часам Хорвата, для учета ускоренного созревания в детстве и подростковом возрасте (Horvath, 2013). Окончательный предиктор возраста транскрипции имел среднюю абсолютную ошибку 13,5 лет, причем эта ошибка была выше, чем ошибка эпигенетических часов, согласующихся с предыдущими предикторами транскрипционного возраста (Fleischer et al., 2018; Peters et al., 2015). Используя наш предиктор, мы обнаружили, что кратковременное перепрограммирование снижает возраст транскрипции примерно на 30 лет и что все исследованные времена перепрограммирования MPTR были способны уменьшать возраст транскрипции в аналогичной степени. Мы также наблюдали умеренное снижение возраста транскрипции в клетках, которые не смогли временно перепрограммировать (SSEA4 отрицательный в промежуточный момент времени), предполагая, что экспрессия только факторов перепрограммирования способна омолаживать некоторые аспекты транскриптома (рис. 3А). Это снижение транскрипционного возраста значительно больше, чем недавно достигнутое с помощью временной трансфекции факторов Яманака (Sarkar et al., 2020), что, согласно нашему предиктору транскрипционного возраста (дополнительный рисунок 2A), составило примерно 10 лет, что соответствует нашему подходу перепрограммирования далее в фазу созревания, а не только до конца фазы инициации. Чтобы изучить это транскриптомное омоложение более подробно, мы идентифицировали гены, которые значительно коррелировали с возрастом в эталонном наборе данных о старении фибробластов (Fleischer et al., 2018), и использовали эти гены для проведения анализа основных компонентов (3707 генов). Образцы, в основном разделенные по возрасту, и контрольные образцы фибробластов формировали траекторию старения. Кратковременно перепрограммированные образцы сгруппированы ближе к молодым фибробластам вдоль PC1, чем образцы отрицательного контроля, что дополнительно подтверждает выводы нашего предиктора транскрипционного возраста, что MPTR омолаживает транскриптом (рис. 3B).
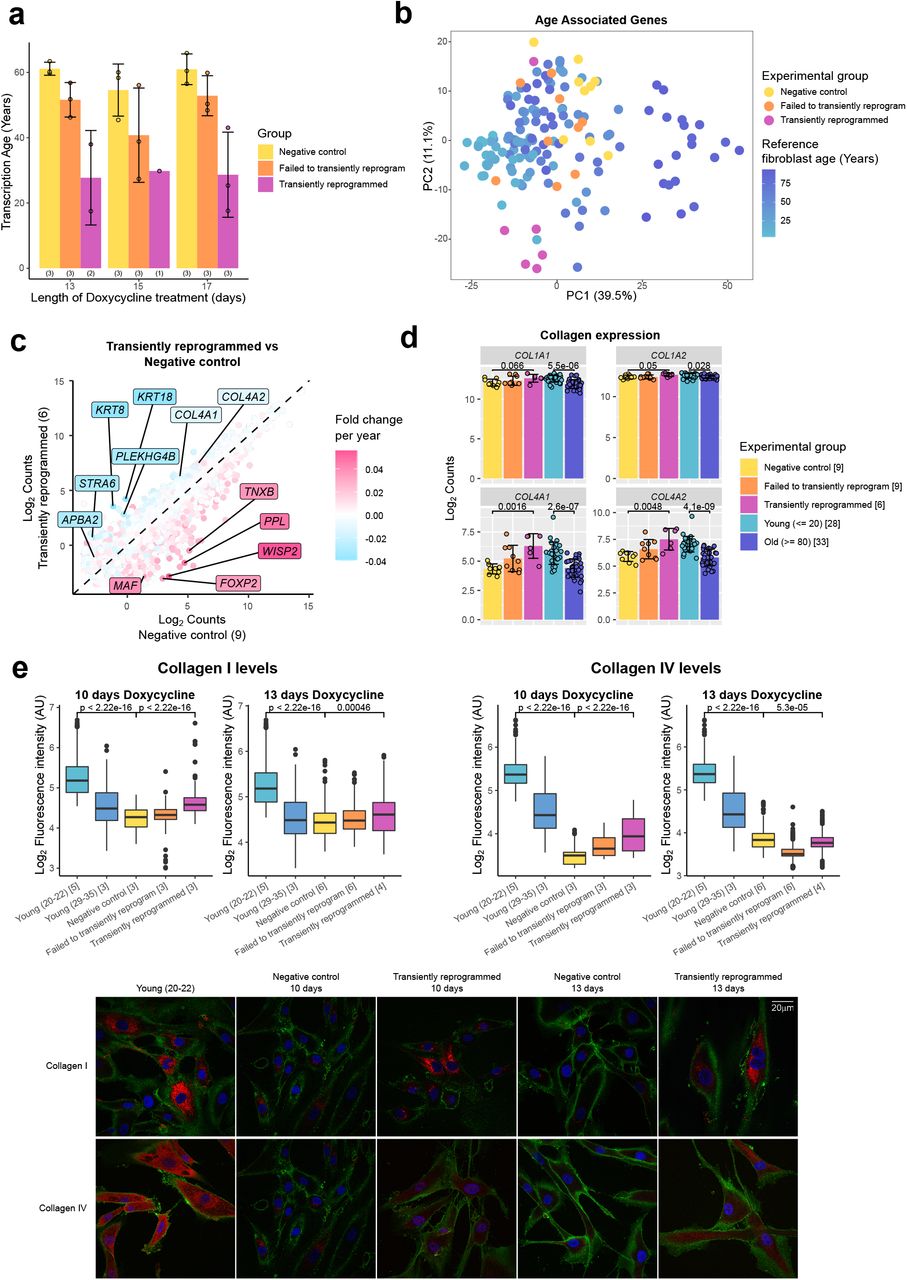 Рисунок 3. Кратковременное перепрограммирование обращает вспять возрастные изменения транскриптома. (A) Средний транскрипционный возраст, рассчитанный с использованием адаптированных часов транскриптома (средняя абсолютная ошибка = 13,5 лет) для образцов отрицательного контроля (желтый), образцов, которые экспрессировали OSKM, но их не удалось перепрограммировать, судя по маркерам клеточной поверхности (оранжевый) и клеток, которые были успешно ератковременно перепрограммированы (пурпурный), как показано на рисунке 1B, в течении 13, 15 или 17 дней. В скобках указано количество образцов в каждой группе. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. (B) Анализ главных компонентов уровней экспрессии гена, связанного со старением фибробластов, при кратковременном перепрограммировании (пурпурный) и эталонных образцах стареющих фибробластов (голубой-темно-синий). Контрольные образцы формировали траекторию старения вдоль ПК1. Образцы с кратковременным перепрограммированием, расположенные ближе к молодым фибробластам, чем образцы отрицательного контроля, предполагают, что они были транскрипционно моложе. (C) Средние уровни экспрессии всех генов в кратковременно перепрограммированных образцах по сравнению с таковыми в образцах отрицательного контроля. Кроме того, гены имеют цветовую маркировку по изменению их экспрессии с возрастом. Гены, которые активируются с возрастом, подавлялись с помощью кратковременного перепрограммирования, а гены, которые подавлялись с возрастом, активировались с помощью кратковременного перепрограммирования. Были выделены известные примеры генов. В скобках указано количество образцов в каждой группе. (D) Уровни экспрессии генов коллагена, которые были восстановлены до юношеского уровня после кратковременного перепрограммирования. Образцы, кратковременно перепрограммированные в течение 13, 15 и 17 дней, объединяли. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Количество образцов в каждой группе указано в квадратных скобках. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (E) Коробчатые диаграммы уровней белка коллагена I и IV в отдельных клетках после временного репрограммирования в течение 10 или 13 дней, рассчитанные на основе интенсивности флуоресценции в сегментированных клетках после иммунофлуоресцентного окрашивания. Прямоугольники представляют верхний и нижний квартили, а центральные линии - медиана. Уровни белка коллагена I и IV увеличиваются после временного перепрограммирования. Количество образцов в каждой группе указано в квадратных скобках. Репрезентативные изображения включены (нижняя панель). CD44 окрашен в зеленый цвет, коллаген I и IV - в красный, а окрашивание DAPI - в синий. Значимость рассчитывалась с помощью U-критерия Манна-Уитни.
Рисунок 3. Кратковременное перепрограммирование обращает вспять возрастные изменения транскриптома. (A) Средний транскрипционный возраст, рассчитанный с использованием адаптированных часов транскриптома (средняя абсолютная ошибка = 13,5 лет) для образцов отрицательного контроля (желтый), образцов, которые экспрессировали OSKM, но их не удалось перепрограммировать, судя по маркерам клеточной поверхности (оранжевый) и клеток, которые были успешно ератковременно перепрограммированы (пурпурный), как показано на рисунке 1B, в течении 13, 15 или 17 дней. В скобках указано количество образцов в каждой группе. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. (B) Анализ главных компонентов уровней экспрессии гена, связанного со старением фибробластов, при кратковременном перепрограммировании (пурпурный) и эталонных образцах стареющих фибробластов (голубой-темно-синий). Контрольные образцы формировали траекторию старения вдоль ПК1. Образцы с кратковременным перепрограммированием, расположенные ближе к молодым фибробластам, чем образцы отрицательного контроля, предполагают, что они были транскрипционно моложе. (C) Средние уровни экспрессии всех генов в кратковременно перепрограммированных образцах по сравнению с таковыми в образцах отрицательного контроля. Кроме того, гены имеют цветовую маркировку по изменению их экспрессии с возрастом. Гены, которые активируются с возрастом, подавлялись с помощью кратковременного перепрограммирования, а гены, которые подавлялись с возрастом, активировались с помощью кратковременного перепрограммирования. Были выделены известные примеры генов. В скобках указано количество образцов в каждой группе. (D) Уровни экспрессии генов коллагена, которые были восстановлены до юношеского уровня после кратковременного перепрограммирования. Образцы, кратковременно перепрограммированные в течение 13, 15 и 17 дней, объединяли. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Количество образцов в каждой группе указано в квадратных скобках. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (E) Коробчатые диаграммы уровней белка коллагена I и IV в отдельных клетках после временного репрограммирования в течение 10 или 13 дней, рассчитанные на основе интенсивности флуоресценции в сегментированных клетках после иммунофлуоресцентного окрашивания. Прямоугольники представляют верхний и нижний квартили, а центральные линии - медиана. Уровни белка коллагена I и IV увеличиваются после временного перепрограммирования. Количество образцов в каждой группе указано в квадратных скобках. Репрезентативные изображения включены (нижняя панель). CD44 окрашен в зеленый цвет, коллаген I и IV - в красный, а окрашивание DAPI - в синий. Значимость рассчитывалась с помощью U-критерия Манна-Уитни.
Затем мы посмотрели на весь транскриптом и наложили изменение экспрессии при старении на изменение экспрессии после кратковременного перепрограммирования. Как и ожидалось, мы наблюдали общую реверсию тенденции старения: гены, активируемые во время старения, подавлялись после кратковременного перепрограммирования, а гены, подавляемые во время старения, усиливались после кратковременного перепрограммирования (Рисунок 3C, дополнительный рисунок 2B). Примечательно, что структурные белки, подавляемые с возрастом, которые усиливаются при кратковременном перепрограммировании, включают цитокератины 8 и 18, а также субъединицы коллагена IV.
Производство коллагенов является основной функцией фибробластов (Humphrey et al., 2014), поэтому мы исследовали экспрессию всех генов коллагена во время старения фибробластов и во время кратковременного перепрограммирования (Рисунок 3D). Как было показано ранее (Lago and Puzzi, 2019; Varani et al., 2006), мы обнаружили, что коллаген I и IV снижается с возрастом, причем коллаген IV демонстрирует более резкое снижение. Примечательно, что экспрессия обоих генов восстановилась до юношеского уровня после кратковременного перепрограммирования (Рисунок 3D). Затем мы оценили с помощью иммунофлуоресценции, приводит ли эта повышенная экспрессия мРНК к увеличению уровней белка, и действительно обнаружили, что кратковременное перепрограммирование привело к увеличению белка коллагена I и IV в сторону более молодых уровней (рис. 3E). Наши данные показывают, что кратковременное перепрограммирование с последующей реверсией может омолаживать фибробласты как транскрипционно, так и на уровне белка, по крайней мере, на основе продукции коллагена. Это указывает на то, что наш протокол омоложения, в принципе, может восстановить молодую функциональность человеческих клеток.
Оптимальное кратковременное перепрограммирование может обратить вспять возрастные изменения в эпигеноме
Обнаружив доказательства транскриптомного омоложения, мы попытались определить, присутствуют ли также аспекты омоложения в эпигеноме. Первоначально мы исследовали глобальные уровни H3K9me3 с помощью иммунофлуоресценции. H3K9me3 представляет собой модификацию гистона, связанную с гетерохроматином, которая, как ранее было показано, уменьшается в глобальном масштабе с возрастом у ряда организмов (Ni et al., 2012), включая фибробласты человека (O'Sullivan et al., 2010; Scaffidi and Misteli , 2006). Мы смогли подтвердить это наблюдение и обнаружили, что MPTR смог существенно обратить вспять это возрастное сокращение до уровня, сопоставимого с фибробластами от более молодых доноров (средний возраст 33 года). Как 10, так и 13 дней кратковременного перепрограммирования увеличивают глобальные уровни H3K9me3, указывая на то, что эта эпигенетическая метка, подобная транскриптому, имеет относительно широкое окно для омоложения с помощью кратковременного перепрограммирования. Мы также наблюдали небольшое увеличение уровней H3K9me3 в клетках, которые не смогли перепрограммировать, что предполагает, что экспрессия только факторов перепрограммирования способна частично восстанавливать эту эпигенетическую метку (рис. 4A), как это наблюдалось для нашего предиктора возраста на основе транскриптома ( Рисунок 3А). Величина омоложения уровней H3K9me3 в наших кратковременно перепрограммированных клетках сходна с наблюдаемой при перепрограммировании фазы инициации (Sarkar et al., 2020).
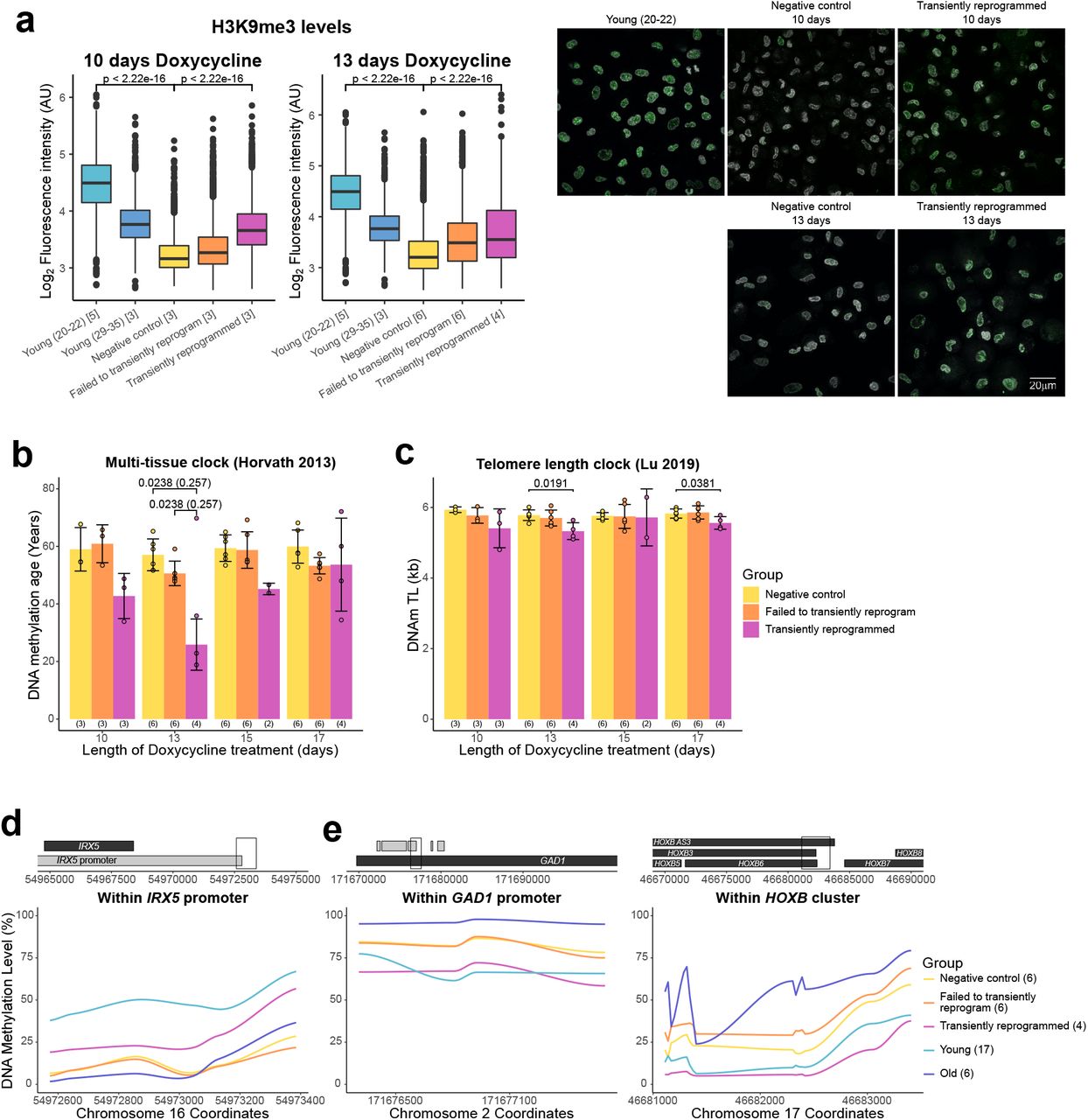 Рис. 4. Оптимальное временное репрограммирование может обратить вспять возрастные изменения в эпигеноме. (A) Коробчатые диаграммы уровней H3K9me3 в отдельных клетках, рассчитанные на основе интенсивности флуоресценции в ядрах (сегментированные с использованием DAPI). Было обнаружено, что уровни H3K9me3 снижаются с возрастом и повышаются после кратковременного перепрограммирования в течение 10 или 13 дней. Прямоугольники представляют верхний и нижний квартили, а центральные линии - медиана. Количество образцов в каждой группе указано в квадратных скобках. Репрезентативные изображения включены (правая панель). H3K9me3 окрашен в зеленый цвет, а окрашивание DAPI - в оттенки серого. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (B) Средний возраст метилирования ДНК образцов после кратковременного перепрограммирования, рассчитанный с использованием мульти-тканевых часов (Horvath, 2013). Возраст метилирования ДНК существенно снижается после 13 дней перепрограммирования. Более короткие и более длительные периоды перепрограммирования приводят к меньшему сокращению возраста метилирования ДНК. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Выбросы в группе кратковременного перепрограммирования 13 дней были исключены из расчета среднего и стандартного отклонения. Значимость рассчитывалась с помощью U-критерия Манна-Уитни с (в скобках) и без выброса. Количество образцов в каждой группе указано в скобках под столбиками. (C) Средняя длина теломер в образцах после кратковременного перепрограммирования, рассчитанная с помощью часов длины теломер (Lu et al., 2019). Длина теломер либо не изменилась, либо несколько уменьшилась после кратковременного перепрограммирования. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (D) Средние уровни метилирования ДНК в омоложенной возрастной гипометилированной области. Эта область находится внутри промотора IRX5. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе. (E) Средние уровни метилирования ДНК в омоложенных возрастных гиперметилированных областях. Эти области находятся внутри промотора GAD1 и локуса HOXB. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе.(E) Средние уровни метилирования ДНК в омоложенных возрастных гиперметилированных областях. Эти области находятся внутри промотора GAD1 и локуса HOXB. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе.
Рис. 4. Оптимальное временное репрограммирование может обратить вспять возрастные изменения в эпигеноме. (A) Коробчатые диаграммы уровней H3K9me3 в отдельных клетках, рассчитанные на основе интенсивности флуоресценции в ядрах (сегментированные с использованием DAPI). Было обнаружено, что уровни H3K9me3 снижаются с возрастом и повышаются после кратковременного перепрограммирования в течение 10 или 13 дней. Прямоугольники представляют верхний и нижний квартили, а центральные линии - медиана. Количество образцов в каждой группе указано в квадратных скобках. Репрезентативные изображения включены (правая панель). H3K9me3 окрашен в зеленый цвет, а окрашивание DAPI - в оттенки серого. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (B) Средний возраст метилирования ДНК образцов после кратковременного перепрограммирования, рассчитанный с использованием мульти-тканевых часов (Horvath, 2013). Возраст метилирования ДНК существенно снижается после 13 дней перепрограммирования. Более короткие и более длительные периоды перепрограммирования приводят к меньшему сокращению возраста метилирования ДНК. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Выбросы в группе кратковременного перепрограммирования 13 дней были исключены из расчета среднего и стандартного отклонения. Значимость рассчитывалась с помощью U-критерия Манна-Уитни с (в скобках) и без выброса. Количество образцов в каждой группе указано в скобках под столбиками. (C) Средняя длина теломер в образцах после кратковременного перепрограммирования, рассчитанная с помощью часов длины теломер (Lu et al., 2019). Длина теломер либо не изменилась, либо несколько уменьшилась после кратковременного перепрограммирования. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. (D) Средние уровни метилирования ДНК в омоложенной возрастной гипометилированной области. Эта область находится внутри промотора IRX5. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе. (E) Средние уровни метилирования ДНК в омоложенных возрастных гиперметилированных областях. Эти области находятся внутри промотора GAD1 и локуса HOXB. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе.(E) Средние уровни метилирования ДНК в омоложенных возрастных гиперметилированных областях. Эти области находятся внутри промотора GAD1 и локуса HOXB. Образцы, кратковременно перепрограммированные в течение 10, 13, 15 и 17 дней, объединяли для визуализации. В скобках указано количество образцов в каждой группе.
Затем мы применили к нашим данным эпигенетические часы, мультитканевый предсказатель возраста, который предсказывает возраст на основе уровней метилирования ДНК в 353 сайтах CpG (Horvath, 2013). Примечательно, что за 13 дней кратковременного перепрограммирования мы наблюдали существенное снижение среднего возраста метилирования ДНК - примерно на 30 лет, количественно такое же омоложение, как мы видели в транскриптоме (Рисунок 4B). Более короткий период перепрограммирования (10 дней) привел к меньшему снижению возраста метилирования ДНК, что согласуется с нашими результатами профилирования возраста метилирования ДНК на протяжении всего процесса перепрограммирования, где возраст метилирования ДНК постепенно снижается на протяжении фазы созревания (Рисунок 1A). Удивительно, но мы также наблюдали меньшее снижение возраста метилирования ДНК при более длительном переходном времени перепрограммирования, предполагая, что некоторые аспекты наблюдаемого эпигенетического омоложения теряются во время фазы реверсии нашего протокола MPTR. Потенциально, длительное перепрограммирование (в течение 15 или 17 дней) может затруднить реверсию и привести к клеточным стрессам, которые "повторно состаривают" метилом во время процесса. Сходные результаты были получены с использованием другого предиктора возраста метилирования, кожных и кровяных часов (Horvath et al., 2018) (дополнительный рисунок 3A).
Теломеры - это защитные структуры на концах хромосом, состоящие из повторяющихся последовательностей. Длина теломер уменьшается с возрастом из-за репликации клеток в отсутствие ферментов теломеразы и восстанавливается после полного перепрограммирования в iPSC (Lapasset et al., 2011). Чтобы исследовать влияние кратковременного перепрограммирования на длину теломер, мы использовали часы длины теломер, которые предсказывают длину теломер на основании уровней метилирования в 140 сайтах CpG (Lu et al., 2019). Мы обнаружили, что MPTR не влияет на длину теломер, а в некоторых случаях немного уменьшает ее (Рисунок 4C). Это согласуется с нашими результатами профилирования длины теломер на протяжении всего перепрограммирования с использованием нашей системы, индуцируемой доксициклином, где длина теломер не увеличивалась до фазы стабилизации (дополнительный рисунок 3B).
Затем мы исследовали расположение обновленных сайтов CpG и обнаружили, что большинство из них были отдельными сайтами, разбросанными по геному (дополнительный рисунок 3C). Некоторые из этих отдельных сайтов CpG могут быть частью более крупных регионов омоложенного метилирования, которые мы не можем полностью обнаружить из-за целенаправленного характера профилирования массива метилирования ДНК, однако было обнаружено несколько небольших кластеров омоложенных сайтов CpG. Мы обнаружили, что небольшая область в промоторе IRX5 становится деметилированной с возрастом, и кратковременное перепрограммирование способно частично реметилировать эту область (рис. 4D). IRX5 участвует в эмбриональном развитии, поэтому деметилирование его промотора с возрастом может приводить к несоответствующей экспрессии (Cheng et al., 2005; Costantini et al., 2005). Мы также обнаружили две области, которые становятся гиперметилированными с возрастом и деметилируются в результате кратковременного перепрограммирования (рис. 4E). Одна из этих областей находится в промоторе GAD1; кодирует фермент, который катализирует превращение гамма-аминомасляной кислоты в глутаминовую кислоту (Bu et al., 1992). Другая область находится в локусе HOXB, участвует в формировании передне-заднего паттерна во время развития (Pearson et al., 2005). В целом, наши данные демонстрируют, что кратковременное перепрограммирование в течение 13 дней (но, по-видимому, не на более длительные или короткие периоды) представляет собой «золотую середину», которая способствует частичному омоложению метилома, уменьшая эпигенетический возраст примерно на 30 лет.
Обсуждение
Здесь мы разработали новый метод, кратковременное перепрограммирование в фазу созревания (MPTR), при котором факторы Яманака эктопически экспрессируются до тех пор, пока не будет достигнута фаза созревания перепрограммирования, а затем их индукция прекращается. MPTR значительно омолаживает все измеренные молекулярные признаки старения, включая транскриптом, эпигеном и функциональную экспрессию белка. Предыдущие попытки кратковременного перепрограммирования были ограничены фазой инициации, чтобы сохранить исходную идентичность клеток (Lu et al., 2020; Ocampo et al., 2016; Sarkar et al., 2020). Это серьезное беспокойство, так как полностью перепрограммированные iPSC может быть трудно дифференцировать в зрелые взрослые клетки, и вместо этого эти дифференцированные клетки часто напоминают свои фетальные аналоги (Hrvatin et al., 2014). С нашим подходом, клетки временно теряют свою клеточную идентичность, когда они вступают в фазу созревания, но, что важно, повторно приобретают свою первоначальную соматическую судьбу, когда факторы перепрограммирования удаляются. Это может быть результатом стойкой эпигенетической памяти в энхансерах (Jadhav et al., 2019), которая, как мы обнаружили, не стирается до фазы стабилизации. С помощью нашего метода, использующего более длительные периоды перепрограммирования, мы наблюдали устойчивое и существенное омоложение всего транскриптома, а также некоторых аспектов эпигенома, при этом многие функции стали примерно на 30 лет моложе. Эта степень омоложения существенно больше, чем то, что наблюдалось ранее для подходов перепрограммирования в фазе инициации. Метилом, по-видимому, требует более длительного перепрограммирования для существенного омоложения, и, следовательно, предыдущая работа с использованием более коротких отрезков перепрограммирования привела к умеренному омоложению метилома (Lu et al., 2020; Sarkar et al., 2020).
Что интересно, мы также наблюдали транскриптомное омоложение генов с нефибробластными функциями. В частности, возрастная понижающая регуляция APBA2 и возрастная повышенная регуляция MAF были обращены (рис. 3C). APBA2 стабилизирует белок-предшественник амилоида, который играет ключевую роль в развитии болезни Альцгеймера (Araki et al., 2003). MAF регулирует развитие эмбриональных клеток волокон хрусталика, а дефекты этого гена приводят к развитию катаракты, которые являются частым осложнением в пожилом возрасте (Ring et al., 2000). Эти наблюдения могут сигнализировать о потенциале MPTR способствовать более общим сигнатурам омоложения, которые могут иметь значение для других типов клеток, таких как нейроны. Было бы интересно определить, возможно ли омоложение, вызванное MPTR, в других типах клеток, что может помочь нам понять и потенциально лечить возрастные заболевания, такие как болезнь Альцгеймера и катаракта.
В целом, наши результаты демонстрируют, что существенное омоложение возможно без достижения стабильной плюрипотентности, и предлагают захватывающую концепцию, согласно которой программа омоложения может быть отделена от программы плюрипотентности. Необходимы дальнейшие исследования для определения степени, в которой эти две программы могут быть разделены и могут привести к открытию новых мишеней, которые способствуют омоложению без необходимости перепрограммирования в ИПСК.
Методы
Производство плазмидов и лентивирусов
Полицистронный репрограммирующий вектор, индуцируемый доксициклином, был создан путем клонирования последовательности GFP-IRES ниже ответного элемента тетрациклина в основной цепи FUW-tetO-hOKMS (Addgene 51543). Этот вектор использовали в сочетании с FUW-M2rtTA (Addgene 20342). Вирусные частицы получали путем трансфекции клеток HEK293T упаковывающими плазмидами pMD2.G (Addgene 12259) и psPAX2 (Addgene 12260) и либо FUW-tetO-GFP-hOKMS, либо FUW-M2rtTA.
Перепрограммирование в ИПСК
Кожные фибробласты доноров среднего возраста (38-53 года) были приобретены у Lonza. Для лентивирусного перепрограммирования в ИПСК фибробласты размножались в среде фибробластов (DMEM-F12, 10% FBS, 1X глутамакс, 1X MEM-NEAA, 1X бета-меркаптоэтанол, 0,2X пенициллин / стрептомицин, 16 нг / мл FGF2) перед спинфекцией tetO -GFP-hOKMS и лентивирусы M2rtTA, где к клеткам добавляли 10% вирусного супернатанта и 8 мкг / мл полибрена перед центрифугированием при 1000 об / мин в течение 60 минут при 32 ° C. Перепрограммирование было инициировано через 24 часа после трансдукции лентивирусом путем введения в среду доксициклина (2 мкг / мл). Впоследствии среду меняли ежедневно на протяжении всего эксперимента. На 2 день перепрограммирования клетки отсортировывали в потоке на наличие жизнеспособных GFP-положительных клеток и затем культивировали на планшетах, покрытых желатином. На 7 день перепрограммирования клетки повторно высевали на облученные эмбриональные фибробласты мыши (iMEF), а на 8 день перепрограммирования среду заменяли на среду hES (DMEM-F12, 20% KSR, 1X Glutamax, 1X MEM-NEAA, 1X beta -меркаптоэтанол, 0,2Х пенициллин / стрептомицин, 8 нг / мл FGF2). Для кратковременного перепрограммирования клетки сортировали в потоке на 10, 13, 15 или 17 день перепрограммирования на популяции CD13 + SSEA4- и CD13-SSEA4 +. Затем эти клетки повторно высевали на iMEF в среде фибробластов без доксициклина и впоследствии поддерживали как фибробласты без iMEF. Для полного перепрограммирования колонии отбирали на 30 день и переносили на покрытые витронектином планшеты в среде E8 без доксициклина. Колонии поддерживали, как описано ранее (Milagre et al., 2017), и собирали на 51 день перепрограммирования.
Для перепрограммирования в iPSC при помощи вируса Sendai с использованием набора CytoTune ™ -iPS 2.0 Sendai Reprogramming Kit (Invitrogen) фибробласты перепрограммировали, как описано ранее (Milagre et al., 2017).
Сортировка клеток с активацией флуоресценции (FACS) промежуточных продуктов перепрограммирования
Клетки предварительно обрабатывали 10 мкМ Y-27632 (технологии STEMCELL) в течение 1 часа. Клетки собирали с использованием реагента для диссоциации клеток StemPro ™ Accutase ™ и инкубировали с антителами против CD13 (PE, 301704, Biolegend), SSEA4 (AF647, 330408, Biolegend) и CD90.2 (APC-Cy7, 105328, Biolegend) в течение 30 минут. Клетки дважды промывали 2% FBS в PBS и пропускали через фильтр 50 мкм для получения суспензии отдельных клеток. Непосредственно перед сортировкой клетки окрашивали DAPI с концентрацией 1 мкг / мл. Одноцветные контроли использовались для выполнения компенсации, и ворота были установлены на основе образцов «промежуточного отрицательного контроля». Клетки сортировали с помощью проточного цитометра BD FACSAria ™ Fusion (BD Biosciences) и собирали либо для дальнейшего культивирования, либо для экстракции ДНК / РНК.
Массив метилирования ДНК
Геномную ДНК экстрагировали из образцов клеток с помощью набора для крови и тканей DNeasy (Qiagen), следуя инструкциям производителя и включая необязательный этап расщепления РНКазой. Для промежуточных стадий репрограммирования геномная ДНК экстрагировалась вместе с РНК с помощью мини-набора AllPrep DNA / RNA (Qiagen). Образцы геномной ДНК были дополнительно обработаны в Barts и Лондонском центре генома и обработаны на массивах Infinium MethylationEPIC (Illumina).
РНК-Seq
РНК экстрагировали из образцов клеток с помощью мини-набора RNeasy (Qiagen), следуя инструкциям производителя. Для промежуточных стадий репрограммирования и репрограммированных образцов вируса Sendai РНК экстрагировали вместе с геномной ДНК с помощью мини-набора AllPrep DNA / RNA (Qiagen). Образцы РНК обрабатывали ДНКазой (Thermo Scientific) для удаления загрязняющей ДНК. Библиотеки РНК-Seq были приготовлены в Wellcome Sanger Institute и запущены в системе HiSeq 2500 (Illumina) для одностороннего секвенирования 50 п.н. Для перепрограммированных образцов вируса Sendai библиотеки готовили, как описано ранее (Milagre et al., 2017), и запускали на HiSeq 2500 (Illumina) для секвенирования парных концов 75 п.н.
Анализ метилирования ДНК
Данные массива были обработаны с помощью пакета minfi R и нормализации NOOB для генерации бета-значений. Возраст метилирования ДНК рассчитывали с использованием мультиканевых часов (Horvath, 2013) и часов кожи и крови (Horvath et al., 2018). Длину теломер рассчитывали с помощью часов длины теломер (Lu et al., 2019). Справочные наборы данных для перепрограммирования фибробластов и ИПСК были получены от Ohnuki et al (2014) (GEO: GSE54848), Banovich et al (2018) (GEO: GSE110544) и Horvath et al (2018). Кроме того, контрольные наборы данных включали новые данные, исследующие промежуточные стадии перепрограммирования дермальных фибробластов с помощью набора CytoTune ™ -iPS 2.0 Sendai Reprogramming Kit (Invitrogen).
РНК-Seq анализ
Считывания были обрезаны с помощью Trim Galore (версия 0.6.2) и сопоставлены с геномом человека (GRCh38) с помощью Hisat2 (версия 2.1.0). Необработанные подсчеты и log2 преобразованные подсчеты были созданы с помощью Seqmonk (версия 1.45.4). Справочные наборы данных для фибробластов и ИПСК были получены от Fleischer et al (2018) (GEO: GSE113957) и Banovich et al (2018) (GEO: GSE107654). Кроме того, контрольные наборы данных включали новые данные, исследующие промежуточные стадии перепрограммирования дермальных фибробластов с помощью набора CytoTune ™ -iPS 2.0 Sendai Reprogramming Kit (Invitrogen). Образцы переносились для дальнейшего анализа, если у них было общее количество считываний не менее 500000, при этом не менее 70% считываний отображались на гены и не менее 65% считываний отображались на экзоны.
Иммунофлуоресценция и визуализация
Молодые контрольные дермальные фибробласты были приобретены у Lonza и Coriell Institute (GM04505, GM04506, GM07525, GM07545 и AG09309). Окрашивание антител выполняли, как описано ранее (Santos et al., 2003), на клетках, выращенных на покровных стеклах или цитоспанте на покровном стекле после фиксации 2% PFA в течение 30 минут при комнатной температуре. Вкратце, клетки пермеабилизировали 0,5% TritonX-100 в PBS в течение 1 часа; блокировали 1% BSA в 0,05% Tween20 в PBS (BS) в течение 1 часа; инкубировали в течение ночи при 4 ° C с соответствующим первичным антителом, разведенным в BS; с последующей промывкой BS и вторичным антителом. Все вторичные антитела были конъюгированы с Alexa Fluor (Molecular Probes), разведены 1: 1000 в BS и инкубированы в течение 30 минут. Инкубации проводили при комнатной температуре, если не указано иное. ДНК контрастировали с 5 мкг / мл DAPI в PBS. Оптические срезы были получены с помощью микроскопа Zeiss LSM780 (иммерсионный объектив 63x). Полуколичественный анализ флуоресценции выполняли с помощью Volocity 6.3 (Improvision). Для полуколичественного определения коллагена I и IV использовали 3D-рендеринг z-стеков. Одиночные средние оптические срезы использовались для полуколичественного определения H3K9me3. Используемые антитела и разведения перечислены ниже:
Anti-H3K9me3; 07-442, Merck/ Millipore (1:500)
Anti-Collagen I; ab254113, Abcam (1:400)
Anti-Collagen IV; PA5-104508, Invitrogen (1:200)
Anti-CD44-BB515; 564587, BD Biosciences (1:400)
Анализ данных
Последующий анализ данных РНК-seq и метилирования ДНК был выполнен с использованием R (версия 4.0.2). Ggplot2 (версия 3.3.2) использовался для создания гистограмм, коробчатых диаграмм, линейных диаграмм, круговых диаграмм, диаграмм рассеяния и скрипичных диаграмм. Ggalluvial (версия 0.12.2) использовался для создания аллювиальных графиков. ComplexHeatmap (версия 2.4.3) использовался для создания тепловых карт. Боевая функция из пакета sva (версия 3.36.0) использовалась на рисунке 1F для пакетной коррекции нового набора данных перепрограммирования Sendai для других наборов данных. Боевая функция также использовалась на рисунке 3 для пакетной корректировки эталонного набора данных о старении фибробластов (Fleischer et al., 2018) в наш набор данных. Часы транскрипции были обучены на эталонном наборе данных о старении с пакетной коррекцией с использованием пакета Caret R (Kuhn, 2008) и случайной лесной регрессии с 10-кратной перекрестной проверкой. Обновленные сайты CpG были обнаружены путем сравнения разницы в метилировании из-за возраста (рассчитанной с помощью набора данных Horvath et al, 2018) с разницей в метилировании из-за 13 дней кратковременного перепрограммирования. Сайты CpG были классифицированы как обновленные, если они демонстрировали разницу в метилировании 10% за 40 лет старения, которая была обращена кратковременным перепрограммированием.
Вклад авторов
D.G.задумал проект, разработал и выполнил эксперименты по временному перепрограммированию, провел анализ данных и написал рукопись. A.P.помог разработать эксперименты по временному перепрограммированию и написать рукопись. F.S. провели иммунофлуоресцентные эксперименты. I.H. предоставил биоинформатическую поддержку анализу метилирования. T.M.S. предоставил полезные обсуждения для разработки проекта и помог с дизайном экспериментов по кратковременному перепрограммированию. I.M. провел полезные обсуждения для разработки проекта, разработал и провел эксперименты по перепрограммированию Sendai и помог написать рукопись. W.R. провел полезные обсуждения проекта и интерпретации данных, а также помог написать рукопись.
Дополнительные изображения
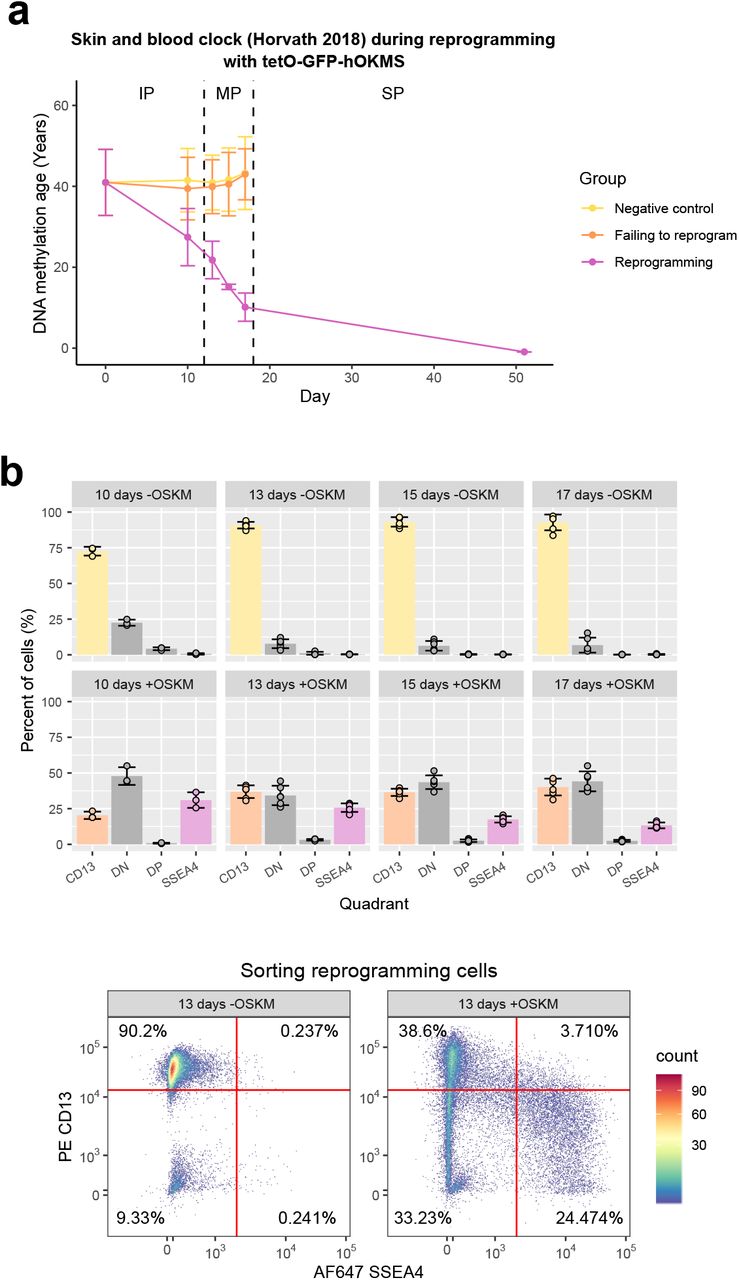 Дополнительный рисунок 1. (A) Средний возраст метилирования ДНК (рассчитанный с использованием часов кожи и крови (Horvath et al., 2018)) на протяжении всего процесса репрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. . Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Возраст метилирования ДНК существенно снизился во время фазы созревания репрограммирования в клетках, которые были успешно перепрограммированы (пурпурная линия), но не в контрольных клетках (желтые и оранжевые линии представляют нетрансдуцированные клетки и клетки, экспрессирующие hOKMS, но неспособные перепрограммироваться, как указано маркерами клеточной поверхности. , соответственно). Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (B) Процент клеток, измеренный в каждом квадранте во время сортировки потока для успешного перепрограммирования ячеек (верхняя панель). Клетки были классифицированы как только CD13 (CD13 + SSEA4-), дважды отрицательные («DN», CD13-SSEA4-), дважды положительные («DP», CD13 + SSEA4 +) или только SSEA4 (CD13-SSEA4 +). Собранные клетки имеют цветовую маркировку (светло-желтый = промежуточный продукт отрицательного контроля, светло-оранжевый = не удалось временно перепрограммировать промежуточный продукт, светло-пурпурный = промежуточный промежуточный продукт репрограммирования). Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Типичные графики проточной цитометрии (нижняя панель) показывают, где были размещены ворота для определения наличия / отсутствия поверхностных маркеров.
Дополнительный рисунок 1. (A) Средний возраст метилирования ДНК (рассчитанный с использованием часов кожи и крови (Horvath et al., 2018)) на протяжении всего процесса репрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. . Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Возраст метилирования ДНК существенно снизился во время фазы созревания репрограммирования в клетках, которые были успешно перепрограммированы (пурпурная линия), но не в контрольных клетках (желтые и оранжевые линии представляют нетрансдуцированные клетки и клетки, экспрессирующие hOKMS, но неспособные перепрограммироваться, как указано маркерами клеточной поверхности. , соответственно). Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (B) Процент клеток, измеренный в каждом квадранте во время сортировки потока для успешного перепрограммирования ячеек (верхняя панель). Клетки были классифицированы как только CD13 (CD13 + SSEA4-), дважды отрицательные («DN», CD13-SSEA4-), дважды положительные («DP», CD13 + SSEA4 +) или только SSEA4 (CD13-SSEA4 +). Собранные клетки имеют цветовую маркировку (светло-желтый = промежуточный продукт отрицательного контроля, светло-оранжевый = не удалось временно перепрограммировать промежуточный продукт, светло-пурпурный = промежуточный промежуточный продукт репрограммирования). Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Типичные графики проточной цитометрии (нижняя панель) показывают, где были размещены ворота для определения наличия / отсутствия поверхностных маркеров.
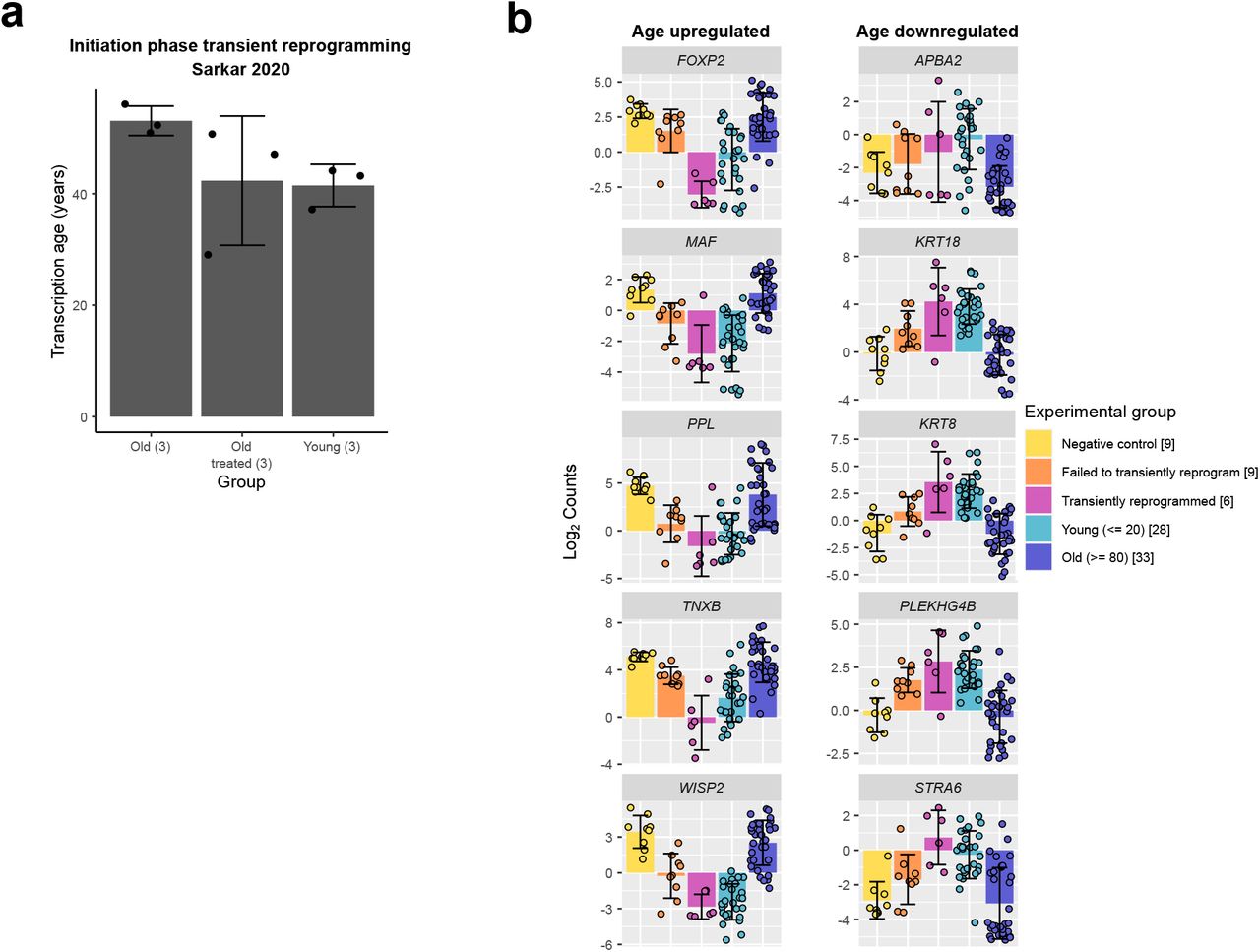 Дополнительный рисунок 2. (A) Средний возраст транскрипции, рассчитанный с использованием пользовательских часов транскриптома (ошибка = 13,5 лет) для кратковременно перепрограммированных фибробластов в фазе инициации (Sarkar et al., 2020). В скобках указано количество образцов в каждой группе. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. (B) Уровни экспрессии известных генов, которые были восстановлены до юношеских уровней после кратковременного перепрограммирования. Образцы, перепрограммированные в течение 13, 15 и 17 дней, объединяли. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Количество образцов в каждой группе указано в квадратных скобках.
Дополнительный рисунок 2. (A) Средний возраст транскрипции, рассчитанный с использованием пользовательских часов транскриптома (ошибка = 13,5 лет) для кратковременно перепрограммированных фибробластов в фазе инициации (Sarkar et al., 2020). В скобках указано количество образцов в каждой группе. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. (B) Уровни экспрессии известных генов, которые были восстановлены до юношеских уровней после кратковременного перепрограммирования. Образцы, перепрограммированные в течение 13, 15 и 17 дней, объединяли. Столбцы представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. Количество образцов в каждой группе указано в квадратных скобках.
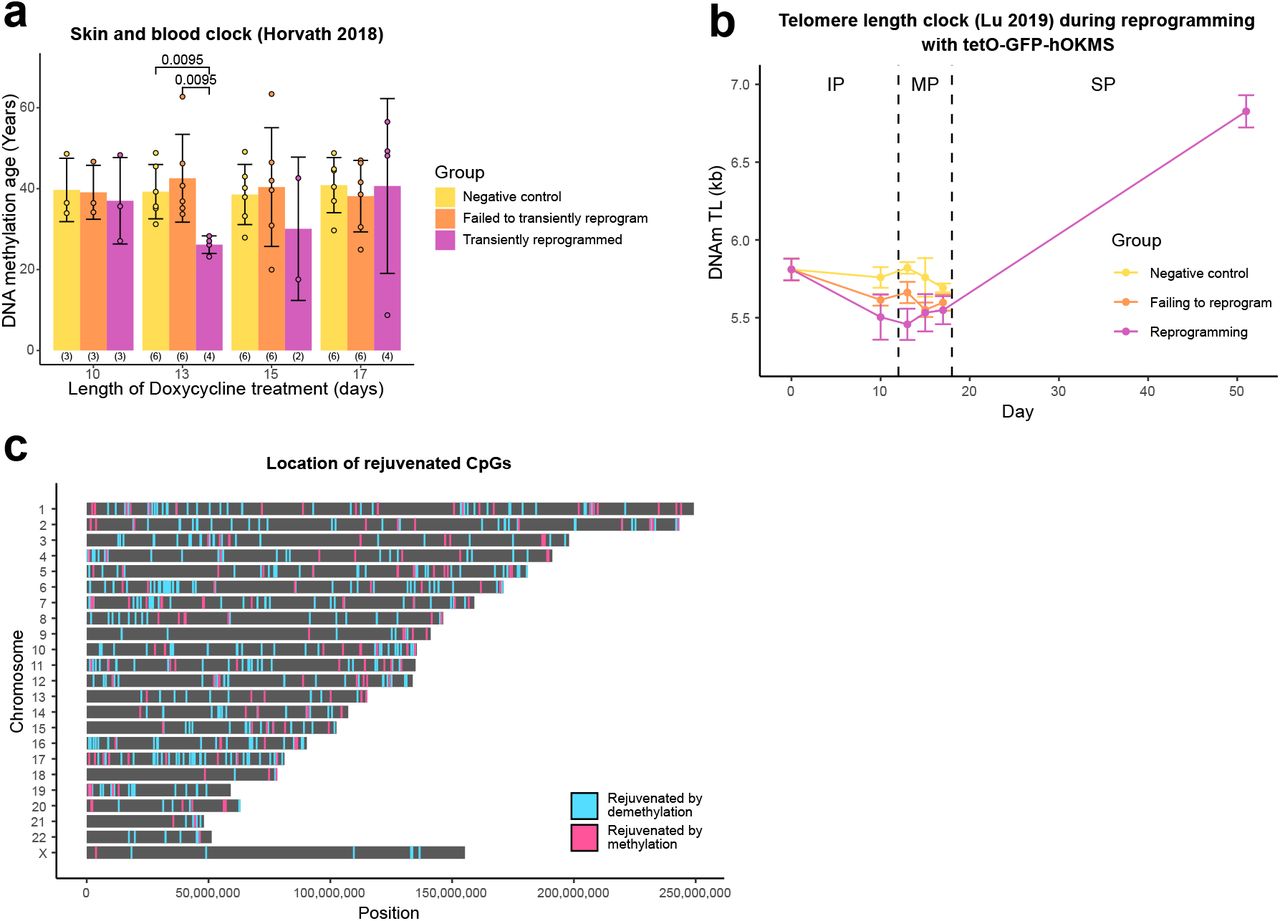 Дополнительный рисунок 3.(A) Средний возраст метилирования ДНК образцов после кратковременного перепрограммирования, рассчитанный с использованием часов кожи и крови (Horvath et al., 2018). Возраст метилирования ДНК существенно снижается после 13 дней перепрограммирования. Более короткие и более длительные периоды перепрограммирования приводят к меньшему сокращению возраста метилирования ДНК. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. В скобках указано количество образцов в каждой группе. (B) Средняя длина теломер (рассчитанная с использованием часов длины теломер (Lu et al., 2019)) на протяжении всего процесса перепрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Длина теломер уменьшается во время фаз инициации и созревания и начинает увеличиваться во время фазы стабилизации. Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (C) Расположение омоложенных сайтов CpG после 13 дней перепрограммирования. Сайты, омоложенные деметилированием, окрашены в синий цвет, а сайты, омоложенные метилированием, окрашены в розовый цвет.
Дополнительный рисунок 3.(A) Средний возраст метилирования ДНК образцов после кратковременного перепрограммирования, рассчитанный с использованием часов кожи и крови (Horvath et al., 2018). Возраст метилирования ДНК существенно снижается после 13 дней перепрограммирования. Более короткие и более длительные периоды перепрограммирования приводят к меньшему сокращению возраста метилирования ДНК. Столбцы представляют собой среднее значение, а столбцы ошибок представляют собой стандартное отклонение. Значимость рассчитывалась с помощью U-критерия Манна-Уитни. В скобках указано количество образцов в каждой группе. (B) Средняя длина теломер (рассчитанная с использованием часов длины теломер (Lu et al., 2019)) на протяжении всего процесса перепрограммирования, когда клетки трансдуцировались нашим вектором tetO-GFP-hOKMS и непрерывно обрабатывались 2 мкг / мл доксициклина. Перепрограммирование делится на три отдельные фазы: фаза инициации (IP); фаза созревания (MP) и фаза стабилизации (SP). Длина теломер уменьшается во время фаз инициации и созревания и начинает увеличиваться во время фазы стабилизации. Точки представляют собой среднее значение, а столбцы ошибок - стандартное отклонение. N = 3 биологических повтора для каждого состояния, когда фибробласты были получены от разных доноров. N = 2 биологических повтора для временной точки ИПСК (день 51). (C) Расположение омоложенных сайтов CpG после 13 дней перепрограммирования. Сайты, омоложенные деметилированием, окрашены в синий цвет, а сайты, омоложенные метилированием, окрашены в розовый цвет.
Благодарности
Мы хотели бы поблагодарить всех сотрудников лаборатории Рейка за полезные обсуждения. Мы хотели бы поблагодарить центр биоинформатики в Институте Бабраама за обработку данных секвенирования и центр проточной цитометрии в Институте Бабраама за сортировку клеток. Мы также хотели бы поблагодарить службы секвенирования в Институте Сэнгера и Барта и Лондонском центре генома за услуги по секвенированию и метилированию соответственно. Эта работа финансировалась BBSRC. A.P. поддерживается стипендией сэра Генри Веллкома (215912 / Z / 19 / Z). W.R. - консультант и акционер Cambridge Epigenetix. T.S.является генеральным директором и акционером Chronomics.
Опубликовано: 17 января 2021 г.
Авторы: Diljeet Gill, Aled Parry, Fátima Santos, Irene Hernando-Herraez, Thomas M. Stubbs, Inês Milagre, Wolf Reik
Оригинальная статья: Multi-omic rejuvenation of human cells by maturation phase transient reprogramming
Перевод Ник Сестрин







































































