Озвучить текст роботом:

Краткое содержание
Коронавирус (HCoV-19) вызвал новую вспышку коронавирусной болезни (COVID-19) в Ухане, Китай. Профилактика и реверсия цитокинового шторма могут стать ключом к спасению пациентов с тяжелой пневмонией, вызванной COVID-19. Было показано, что мезенхимальные стволовые клетки (МСК) обладают всесторонней мощной иммуномодулирующей функцией. Это исследование направлено на изучение того, улучшает ли трансплантация MSC клинический исход для 7 пациентов с зарегистрированной пневмонией COVID-19 в больнице YouAn в Пекине, Китай, с 23 января 2020 г. по 16 февраля 2020 г. Клинические исходы, а также изменения уровней воспаления , иммунной функции и побочные эффекты у 7 зарегистрированных пациентов оценивались в течение 14 дней после MSC - инъекции. MSC могли излечить или значительно улучшить функциональные результаты семи пациентов с пневмонией COVID-19 за 14 дней без наблюдаемого неблагоприятного эффекта. Легочная функция и симптомы у всех пациентов с пневмонией COVID-19 значительно улучшились спустя 2 дня после трансплантации MSC. Среди них два обычных и один тяжелый пациент были вылечены и выписаны через 10 дней после процедуры. После лечения число периферических лимфоцитов увеличилось, и активированные цитокин-секретирующие иммунные CXCR3 + CD4 + T-клетки, CXCR3 + CD8 + T-клетки и CXCR3 + NK-клетки исчезли в течении 3-6 дней. Группа CD14 + CD11c + CD11bmid регуляторных популяций DC клеток резко увеличилась. При этом в группе лечения МСК по сравнению с контрольной группой плацебо уровень TNF-α значительно снизился, в то время как уровень IL-10 увеличился. Кроме того, профиль экспрессии гена показал, что MSC были ACE2- и TMPRSS2-, что указывало на то, что MSC свободны от инфекции COVID-19. Таким образом, внутривенная трансплантация MSC оказалась безопасной и эффективной при лечении пациентов с пневмонией COVID-19, особенно для пациентов в критическом состоянии.
Ключевые слова
COVID-19, ACE2 негатив, мезенхимальные стволовые клетки, трансплантация клеток, иммуномодуляция, восстановление функции
Введение
Новая коронавирусная болезнь 2019 года (COVID-19) стала глобальной чрезвычайной ситуацией в области общественного здравоохранения с тех пор, как были обнаружены первые пациенты в , в декабре 2019 года , в Ухане, Китай. С тех пор число подтвержденных COVID-19 пациентов резко возросло не только в Китае, но также и во всем мире, включая Германию, Южную Корею, Вьетнам, Сингапур и США [1]. В настоящее время нет специальных лекарств или вакцин для лечения пациентов с инфекцией COVID-19. Следовательно, существует большая неудовлетворенная потребность в безопасном и эффективном лечении пациентов, инфицированных COVID-19, особенно в тяжелых случаях. В нескольких сообщениях показано, что первым шагом патогенеза HCoV-19 является то, что вирус специфически распознает рецептор фермента 2, преобразующий ангиотензин I (ACE2), при помощи спайкового протеина [2-4]. ACE2-положительные клетки инфицируются HCoV-19 так же, как и SARS-2003 [5,6]. Кроме того, исследовательская группа из Германии обнаружила, что клеточная сериновая протеаза TMPRSS2 для праймирования спайкового белка HCoV-19 также важна для проникновения в клетку-хозяина и распространения [7], подобно другому коронавирусу (то есть SARS-2003) [8,9]. К сожалению, рецептор ACE2 широко распространен на поверхности клеток человека, особенно в альвеолярных клетках типа II (AT2) и капиллярном эндотелии [10], а клетки AT2 высоко экспрессируют TMPRSS2 [9]. Однако в костном мозге, лимфатических узлах, тимусе и селезенке иммунные клетки, такие как Т- и В-лимфоциты и макрофаги, неизменно ACE2- отрицательны [10]. Полученные данные свидетельствуют о том, что иммунологическая терапия может использоваться для лечения инфицированных пациентов. Однако иммуномодулирующая способность может быть недостаточно сильной, если используются только один или два иммунных фактора, поскольку вирус может стимулировать настоящий цитокиновый шторм в легких, а именно IL-2, IL-6, IL-7, GSCF, IP10, MCP1, MIP1A и TNFα, за которыми следуют отек, дисфункция воздухообмена, острый респираторный дистресс-синдром, острое повреждение сердца и вторичная инфекция [11], которая может привести к смерти. Таким образом, предотвращение цитокинового шторма может быть ключом к лечению пациентов, инфицированных HCoV-19. Благодаря своей мощной иммуномодулирующей способности MSC могут оказывать благоприятное воздействие на предотвращение или ослабление цитокинового шторма. MSC широко используются в клеточной терапии, от фундаментальных исследований до клинических испытаний [12,13]. Безопасность и эффективность были четко задокументированы во многих клинических испытаниях, особенно при иммуноопосредованных воспалительных заболеваниях, таких как болезнь трансплантат против хозяина (GVHD) [14] и системная красная волчанка (SLE) [15]. Положительная роль MSC обусловливается в основном двумя их проявлениями, а именно иммуномодулирующими эффектами и способностью дифференцироваться [16]. MSC могут выделять многие типы цитокинов путем паракринной секреции или осуществлять прямые взаимодействия с иммунными клетками, что приводит к иммуномодуляции [17]. Иммуномодулирующие эффекты MSC запускаются далее активацией рецептора TLR в MSC, который стимулируется ассоциированными с патогеном молекулами, такими как LPS или двухцепочечная РНК вируса [18,19], подобного HCoV-19. Здесь мы провели пилотное исследование по трансплантации MSC, чтобы изучить их терапевтический потенциал для пациентов, инфицированных HCoV-19. Кроме того, мы также изучили основные механизмы с использованием высокопроизводительного кластерного анализа РНК (10× Genomics) на МСК и масс-цитометрии.
Материалы и методы
Дизайн исследования
Пилотное исследование внутривенной трансплантации MSC было выполнено на семи пациентах с пневмонией, инфицированной COVID-19. Исследование было проведено в Пекинской больнице YouAn, Столичный медицинский университет, Китай, и одобрено этическим комитетом больницы (LL-2020-013-K). Безопасность и научная обоснованность этого исследования («Клинические испытания мезенхимальных стволовых клеток для лечения пневмонита, вызванного новым коронавирусом» , Шанхайский университет / PUMC) были рассмотрены научным комитетом Международного общества по проблемам старения и болезней (ISOAD) , исследование включено в Китайский реестр клинических испытаний (ChiCTR2000029990).
Пациенты
Пациенты были включены в исследование с 23 января 2020 года по 31 января 2020 года. Все зарегистрированные пациенты были подтверждены с помощью анализа обратной транскрипционной полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени на РНК HCoV-19 в Китайском центре контроля и профилактики заболеваний с использованием протокол, как описано ранее [11,20]. Последовательности были следующими: прямой праймер 5'-TCAGAATGCCAATCTCCCCAAC-3 '; обратный праймер 5'-AAAGGTCCACCCGATACATTGA-3 '; и зонд 5'CY5-CTAGTTACACTAGCCATCCTTACTGC-3'BHQ1.
Первоначально мы включили пациентов с COVID-19 (возраст 18–95 лет) в соответствии с руководством Национальной комиссии здравоохранения и здравоохранения Китая (Таблица 1).
Если при стандартном лечении никаких признаков улучшения не наблюдалось, пациентам могло быть предложено получить MSC-трансплантацию. Исключались пациенты, если у них был диагностирован какой-либо вид рака или врач объявил, что ситуация относится к критически тяжелому состоянию. Мы исключили пациентов, которые участвовали в других клинических испытаниях или были участниками других клинических испытаниях в течение 3 месяцев до того.
Подготовка клеток и трансплантация
МСК клинического уровня поставлялись бесплатно Шанхайским университетом, Циндао, Qingdao Co-orient Watson Biotechnology group co. LTD и Институтом фундаментальных медицинских наук Китайской академии медицинских наук. Клеточный продукт был сертифицирован Национальным институтом по контролю за продуктами и лекарствами Китая (номер разрешения: 2004L04792,2006L01037 , CXSB1900004). Перед внутривенным капельным введением MSC суспендировали в 100 мл физиологического раствора, и общее количество трансплантированных клеток рассчитывали по 1 × 106 клеток на килограмм веса. Период окна для трансплантации клеток определялся как время, когда симптомы и / или признаки все еще ухудшались, даже когда проводилось ожидаемое лечение. Инъекцию проводили около сорока минут со скоростью ~ 40 капель в минуту. Пациенты оценивались исследователями посредством 14-дневного наблюдения после получения исследуемого продукта. Клинические, лабораторные и рентгенологические результаты были зарегистрированы и подтверждены обученной группой врачей. Подробный отчет включал первичные данные о безопасности (инфузионные и аллергические реакции, вторичные инфекции и опасные для жизни побочные эффекты) и первичные данные об эффективности (уровень вариации цитокинов, уровень С-реактивного белка в плазме и насыщение кислородом). Вторичные результаты эффективности в основном включали общее количество лимфоцитов и субпопуляции, КТ грудной клетки, частоту дыхания и симптомы пациента (особенно лихорадку и одышку). Кроме того, были также изучены терапевтические меры (то есть противовирусная медицина и респираторная поддержка) и их результаты.
статистический анализ
MIMICS 21.0 (Интерактивная система управления медицинским изображением, Materialise, Бельгия) была использована для оценки данных КТ грудной клетки. Анализ массовой цитометрии мононуклеарных клеток периферической крови описан в Дополнительном Материале 1. Анализ исследования 10 x RNA-seq описан в Дополнительном Материале 2. Данные были проанализированы с помощью программного обеспечения SPSS (SPSS 22.0). Различия между двумя группами оценивались с использованием непарных двусторонних t-тестов. Данные с участием более двух групп были оценены с помощью дисперсионного анализа (ANOVA). Значения P <0,05 указывают на статистическую значимость.
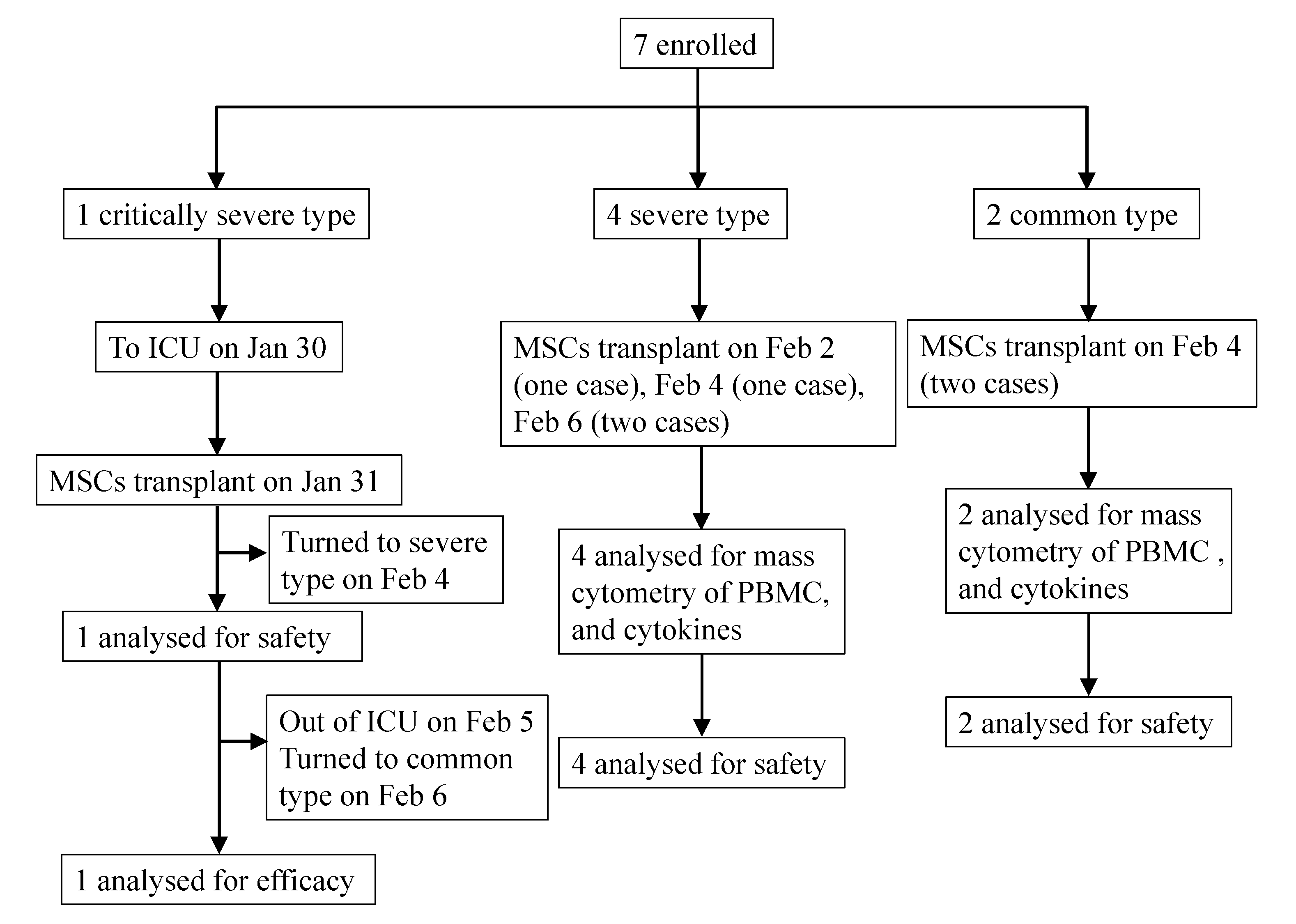
Рисунок 1. Блок-схема лечения с помощью трансплантации клеток
Результаты
Процедура лечения MSC и общая информация о пациенте
Это исследование проводилось с 23 января 2020 года по 16 февраля 2020 года. В исследование было включено семь подтвержденных пациентов с COVID-19, включая 1 критически тяжелого типа (пациент 1), 4 тяжелых типа (пациент 2, 3, 6, 7) и 2 распространенных типа (пациент 4, 6). Время пересадки MSC для каждого пациента показано на рисунке 1. Общая информация о 7 пациентах приведена в таблице 1. До настоящего времени пациент с тяжелой степенью тяжести завершил лечение MSC. У этого пациента был 10-летний медицинский анамнез гипертонии с самым высоким уровнем 180/90 мм рт. Была зафиксирована вся информация о лечении пациентов.
Первичная оценка безопасности
До трансплантации МСК у пациентов наблюдались симптомы высокой температуры (38,5 ± 0,5 °), слабости, одышки и низкого насыщения кислородом. Однако через 2-4 дня после трансплантации у всех пациентов исчезли все симптомы, насыщение кислородом возросло до ≥ 95% в покое, без или с поглощением кислорода (5 литров в минуту). Кроме того, никаких острых инфузионных или аллергических реакций не наблюдалось в течение двух часов после трансплантации. Аналогично, после лечения не было выявлено отсроченной гиперчувствительности или вторичных инфекций.
Подробные процедуры диагностики и лечения пациентов с тяжелой степенью тяжести показаны в Дополнительном Материале 3. Основные симптомы и признаки приведены в таблице 3.
Оценка эффективности
Иммуномодулирующая функция МСК внесла основной вклад в эффективность лечения, и трансплантация МСК показала впечатляющие положительные результаты (Таблица 3). Что касается первичного исхода у критически тяжелого пациента 1, уровень белка C-реакции в плазме снизился с 105,5 г / л (30 января) до 10,1 г / л (13 февраля), при этом самый высокий уровень 191,0 г / л был в 1 февраля , что указывает на то, что состояние воспаления быстро улучшалось. Насыщение кислородом без дополнительного кислорода возросло с 89% (31 января) до 98% (13 февраля), что указывало на то, что легочные альвеолы восстановили функцию воздухообмена.
Вторичные результаты также улучшились (Таблица 4). Например, для критически тяжелого пациента 1, лимфопения была значительно улучшена после трансплантации клеток. Пациент был изолирован в больничной палате с историей гипертонии, артериальное давление достигало уровня 3-й степени гипертензии. 1 февраля биохимические показатели в анализе крови показали, что аспарагиновая аминотрансфераза, активность креатинкиназы и миоглобин резко возросли до 57 ед / л, 513 ед / л и 138 нг / мл соответственно, что указывает на серьезное повреждение печени и миокарда. Однако уровни этих функциональных биохимических показателей были снижены до нормальных референтных значений через 2 ~ 4 дня после лечения (таблица 4). 13 февраля все показатели достигли нормальных уровней, а именно 19 ед / л, 40 ед / л и 43 нг / мл соответственно. Частота дыхания была снижена до нормального уровня на 4-й день после трансплантации МСК. И лихорадка, и одышка исчезли на 4-й день после трансплантации МСК. КТ грудной клетки показала, что симптом матового стекла и инфильтрация пневмонии значительно уменьшились на 9-й день после трансплантации МСК (рис. 2).
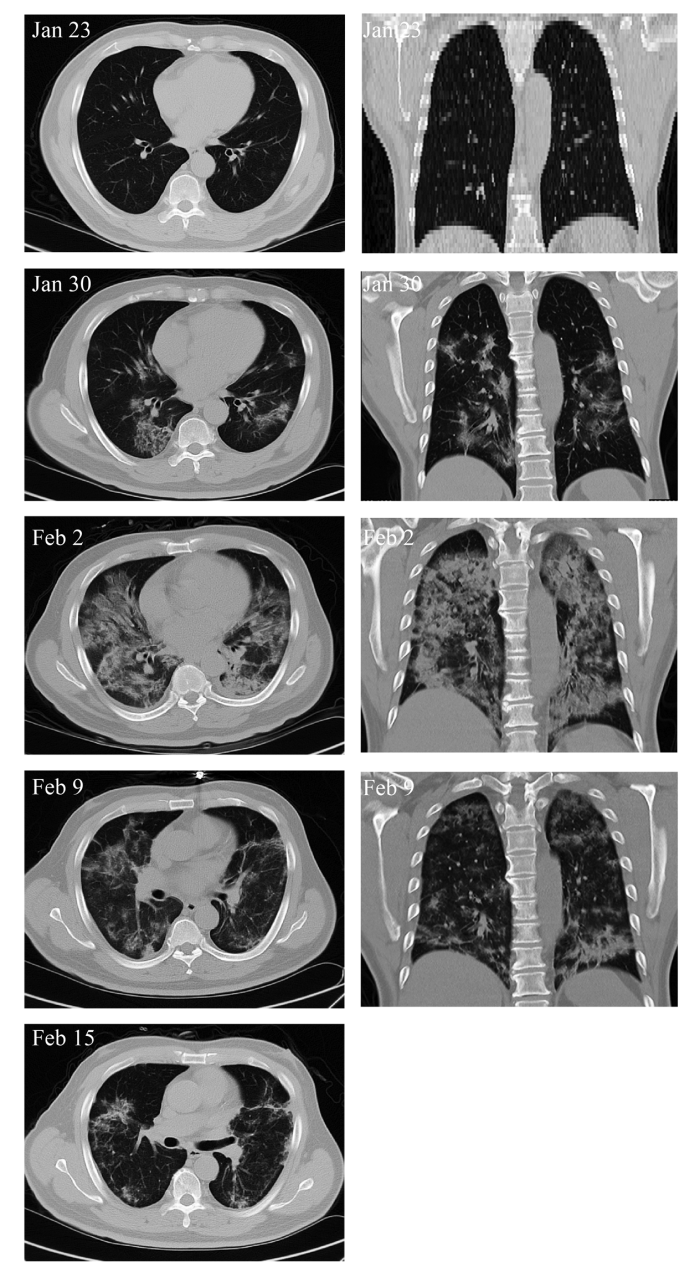 Рисунок 2. Изображения компьютерной томографии (КТ) грудной клетки критически тяжелого пациента с COVID-19. 23 января показатели пневмонии не наблюдались. 30 января синдром матового стекла и инфильтрация пневмонии наблюдались во множественных сегментах с обеих сторон. Трансплантация клеток была проведена 31 января. 2 февраля пневмония захватила все легкое. 9 февраля инфильтрация пневмонии очень сильно уменьшилась. 15 февраля на местном уровне осталась лишь небольшая матовость.
Рисунок 2. Изображения компьютерной томографии (КТ) грудной клетки критически тяжелого пациента с COVID-19. 23 января показатели пневмонии не наблюдались. 30 января синдром матового стекла и инфильтрация пневмонии наблюдались во множественных сегментах с обеих сторон. Трансплантация клеток была проведена 31 января. 2 февраля пневмония захватила все легкое. 9 февраля инфильтрация пневмонии очень сильно уменьшилась. 15 февраля на местном уровне осталась лишь небольшая матовость.
Анализ на нуклеиновую кислоту HCoV-19
ОТ-ПЦР-анализ на нуклеиновую кислоту HCoV-19 проводили до и после трансплантации МСК. Для критически тяжелого пациента до трансплантации (23 января) и через 6 дней после трансплантации (6 февраля) нуклеиновая кислота HCoV-19 была положительной. Через 13 дней после трансплантации (13 февраля) нуклеиновая кислота HCoV-19 оказалась отрицательной. Пациенты 3, 4,5 также показали отрицательный результат на нуклеиновую кислоту HCoV-19 на дату этого отчета.
Масс-цитометрия (CyTOF) периферической крови пациентов
Для исследования состояния иммунной системы во время трансплантации MSC, мы провели CyTOF периферической крови пациентов до и после трансплантации. CyTOF показал, что почти не было увеличения регуляторных Т-клеток (CXCR3-) или дендритных клеток (DC, CXCR3-) для двух пациентов общего типа (пациент 4 и 5). Но у пациентов с тяжелыми состояниями регуляторные Т-клетки и ДК после клеточной терапии повышались, особенно у пациентов с тяжелой степенью тяжести. Примечательно, что CXCR3-DC не повышался значительно после лечения плацебо у трех тяжелых контрольных пациентов. Кроме того, для пациента с критической степенью тяжести до трансплантации MSC процентное содержание клеток CXCR3 + CD4 + T, T CXCR3 + CD8 + T и CXCR3 + NK в PBMC пациента было значительно выше по сравнению со здоровым контролем, что вызвало воспалительный шторм цитокинов. , Тем не менее, через 6 дней после трансплантации MSC, чрезмерно активированные T-клетки и NK-клетки почти исчезли, и количество субпопуляций других клеток было почти восстановлено до нормальных уровней, особенно популяции регуляторных дендритных клеток CD14 + CD11c + CD11bmid (рис. 3).
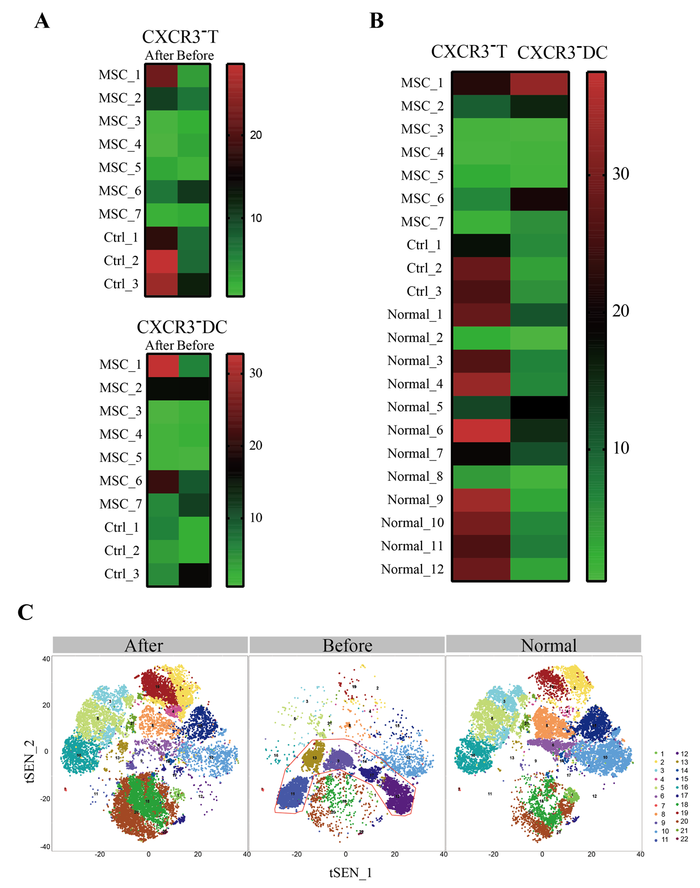 Рисунок 3. Результаты масс-цитометрии мононуклеарных клеток периферической крови зарегистрированных пациентов (A, B) и критически тяжелого пациента (C). Нет увеличения регуляторных T-клеток (CXCR3-) или дендритных клеток (DC, CXCR3-) для двух пациентов общего типа (пациент 4 и 5, Figrue 3A). Но у пациентов с тяжелыми состояниями регуляторные Т-клетки и ДК увеличивались после клеточной терапии, особенно у пациентов с критической степенью тяжести 1 (Рисунок 3B). Кроме того, для пациента 1 с критической степенью тяжести до трансплантации МСК процент сверхактивированных T-клеток CXCR3 + CD4 + (# 9), T-клеток CXCR3 + CD8 + (# 17) и NX-клеток CXCR3 + (# 12) в РВМС был заметно выше по сравнению со здоровым контролем (рис. 3С). Однако через 6 дней после трансплантации MSC избыточно активированные Т-клетки и NK-клетки почти исчезли, и число других подгрупп клеток было почти полностью изменено до нормальных уровней, особенно в популяции CD14 + CD11c + CD11bmid DC (# 20). Normal: здоровые люди, MSCs: группа трансплантации мезенхимальных стволовых клеток, Ctrl: контрольная группа плацебо.
Рисунок 3. Результаты масс-цитометрии мононуклеарных клеток периферической крови зарегистрированных пациентов (A, B) и критически тяжелого пациента (C). Нет увеличения регуляторных T-клеток (CXCR3-) или дендритных клеток (DC, CXCR3-) для двух пациентов общего типа (пациент 4 и 5, Figrue 3A). Но у пациентов с тяжелыми состояниями регуляторные Т-клетки и ДК увеличивались после клеточной терапии, особенно у пациентов с критической степенью тяжести 1 (Рисунок 3B). Кроме того, для пациента 1 с критической степенью тяжести до трансплантации МСК процент сверхактивированных T-клеток CXCR3 + CD4 + (# 9), T-клеток CXCR3 + CD8 + (# 17) и NX-клеток CXCR3 + (# 12) в РВМС был заметно выше по сравнению со здоровым контролем (рис. 3С). Однако через 6 дней после трансплантации MSC избыточно активированные Т-клетки и NK-клетки почти исчезли, и число других подгрупп клеток было почти полностью изменено до нормальных уровней, особенно в популяции CD14 + CD11c + CD11bmid DC (# 20). Normal: здоровые люди, MSCs: группа трансплантации мезенхимальных стволовых клеток, Ctrl: контрольная группа плацебо.
Сывороточный цитокин / хемокин / анализ факторов роста
После внутривенной инъекции MSC уменьшение провоспалительного цитокина TNF-α в сыворотке в сравнении до и после лечения MSC было значительным (p <0,05). Между тем, увеличение соотношения противовоспалительного IL-10 (р <0,05) также заметно проявилось в группе лечения MSC. Уровни хемокинов в сыворотке, таких как IP-10 и фактор роста VEGF, были увеличены, но незначительно (Рисунок 4).
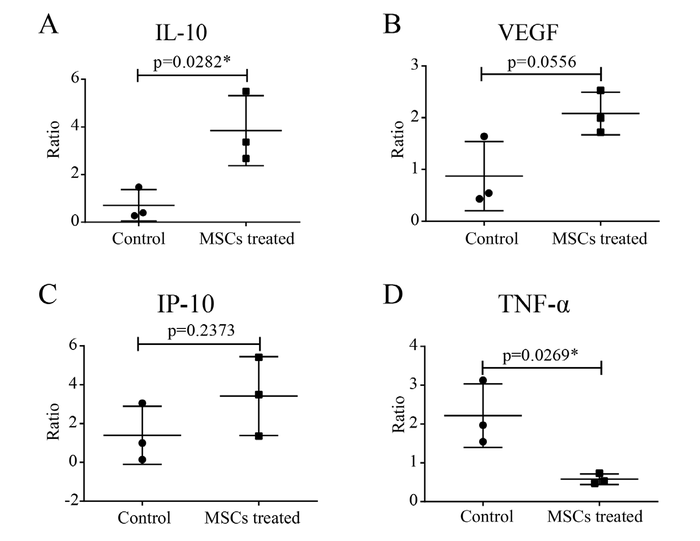 Рисунок 4. Соотношение сывороточных цитокинов IL-10 (A), фактора роста VEGF (B), хемокина IP-10 (C) и TNF-α (D) до и после лечения MSC , выявленное у тяжелых пациентов по сравнению с контрольной группой без MSC с помощью панельного анализа соответственно. Ctrl: контрольная группа плацебо. P-значения были определены с помощью t-критерия Стьюдента. * Р <0,05.
Рисунок 4. Соотношение сывороточных цитокинов IL-10 (A), фактора роста VEGF (B), хемокина IP-10 (C) и TNF-α (D) до и после лечения MSC , выявленное у тяжелых пациентов по сравнению с контрольной группой без MSC с помощью панельного анализа соответственно. Ctrl: контрольная группа плацебо. P-значения были определены с помощью t-критерия Стьюдента. * Р <0,05.
10-х секвенирование RNA для трансплантированных MSC
Чтобы дополнительно выяснить механизмы, лежащие в основе MSC-опосредованной защиты пациентов, инфицированных COVID-19, мы провели 10-х секвенирование RNA для трансплантированных MSC. В результате было обнаружено 12500 MSC, которые затем были полностью секвенированы с 881,215,280 необработанными считываниями (дополнительный материал 4). Результаты показали, что MSC являются ACE2 или TMPRSS2 отрицательными, что указывает на то, что MSC свободны от инфекции COVID-19. Более того, противовоспалительные и трофические факторы, такие как TGF-β, HGF, LIF, GAL, NOA1, FGF, VEGF, EGF, BDNF и NGF, были высоко экспрессированы в MSC, что дополнительно демонстрирует иммуномодулирующую функцию MSC. Кроме того, SPA и SPC были высоко экспрессированы в MSC, что указывает на то, что MSC могут дифференцироваться в клетки AT2 (рисунок 5). Анализ путей KEGG показал, что MSC были тесно задействованы в противовирусных путях (дополнительный материал 4).
 Рисунок 5. Обзор экспрессии генов MSC с помощью 10 x RNA-seq: ACE2 (A) и TMPRSS2 (B) экспрессировались редко. TGF-β (C), HGF (D), LIF (E), GAL (F), NOA1 (G), FGF (H), VEGF (I), EGF (J), BDNF (K) и NGF ( L) были высокоэкспрессированы, что указывало на иммуномодулирующую функцию МСК. SPA (M) и SPC (N) были высокоэкспрессированы, что указывает на то, что MSC обладают способностью дифференцироваться в альвеолярные эпителиальные клетки II. Одна точка представляла одну клетку, а красный и серый цвета демонстрировали высокую экспрессию и низкую экспрессию соответственно.
Рисунок 5. Обзор экспрессии генов MSC с помощью 10 x RNA-seq: ACE2 (A) и TMPRSS2 (B) экспрессировались редко. TGF-β (C), HGF (D), LIF (E), GAL (F), NOA1 (G), FGF (H), VEGF (I), EGF (J), BDNF (K) и NGF ( L) были высокоэкспрессированы, что указывало на иммуномодулирующую функцию МСК. SPA (M) и SPC (N) были высокоэкспрессированы, что указывает на то, что MSC обладают способностью дифференцироваться в альвеолярные эпителиальные клетки II. Одна точка представляла одну клетку, а красный и серый цвета демонстрировали высокую экспрессию и низкую экспрессию соответственно.
Обсуждение
И новый коронавирус, и SARS-2003 могут проникать в клетку-хозяина, связывая белок S на вирусной поверхности с ACE2 на поверхности клетки [3,5]. Помимо легких, ACE2 широко экспрессируется в тканях человека, включая сердце, печень, почки и органы пищеварения [10]. Фактически, почти все эндотелиальные клетки и клетки гладких мышц в органах экспрессируют ACE2, поэтому, как только вирус попадает в кровообращение, он широко распространяется. Все ткани и органы, экспрессирующие ACE2, могут стать полем битвы новых коронавирусов и иммунных клеток. Это объясняет, почему все инфицированные пациенты ОИТ страдают не только от острого респираторного дистресс-синдрома, но и от таких осложнений, как острое повреждение миокарда, аритмия, острое повреждение почек, шок и смерть от синдрома полиорганной дисфункции [11] (рис. 6). Более того, HCoV-19 чаще поражает мужчин старшего возраста с сопутствующими заболеваниями и может привести к тяжелым и даже смертельным респираторным заболеваниям, таким как острый респираторный дистресс-синдром [21], как в случае с критически тяжелым пациентом в данном исследовании. Тем не менее, лечение COVID-2019 существенно зависит от собственной иммунной системы пациента. Когда сверхактивированная иммунная система убивает вирус, она производит большое количество воспалительных факторов, что приводит к сильным цитокиновым штормам [20]. Это говорит о том, что основной причиной повреждения этих органов может быть вызванный вирусом цитокиновый шторм. Пожилые люди могут быть намного более подвержены риску из-за иммуночувствительности.
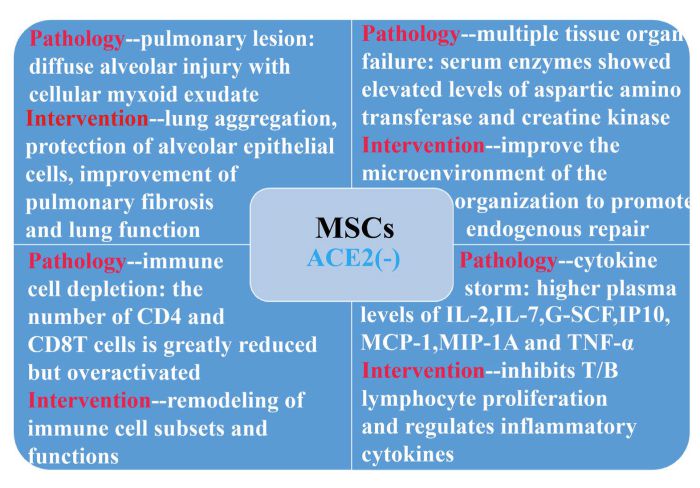
Рисунок 6. ACE2-MSC приносят пользу пациентам с COVID-19 через функцию иммунорегуляции
Анализ нашего 10x scRNA-seq показывает, что MSC отрицательны по ACE2 и TMPRSS2 (насколько нам известно, это впервые сообщается) и секретируют противовоспалительные факторы для предотвращения цитокинового шторма. Они обладают естественным иммунитетом к HCoV-19. Согласно результатам потоковой масс-цитометрии, вирусная инфекция вызвала полный сбой функции лимфоцитов, даже всей иммунной системы. MSC играли жизненно важную роль в иммуномодуляции для реверсирования подмножеств лимфоцитов в основном через дендритные клетки. Наше предыдущее исследование показало, что совместное культивирование с MSC может уменьшить дифференцировку cDC от человеческих CD34 + клеток, одновременно увеличивая дифференцировку pDC через PGE2 [22]. Кроме того, индукция IL-10-зависимых регуляторных дендритных клеток и IRF8-контролируемых регуляторных дендритных клеток из HSC также была обнаружена у крыс [23,24]. MSC также могут индуцировать зрелые дендритные клетки в новую Jagged-2-зависимую регуляторную популяцию дендритных клеток [25]. Все эти взаимодействия с различными дендритными клетками приводили к сдвигу иммунной системы от ответов Th1 к ответам Th2.
Несколько сообщений также были посвящены лимфопении и высоким уровням C-реактивного белка у пациентов с COVID-19 [20,21]. С-реактивный белок является биомаркером с высокой чувствительностью к воспалению и реакции хозяина на продукцию цитокинов, в частности TNFα, IL-6, MCP1 и IL-8, секретируемых Т-клетками [26]. Тем не менее, большинство механистических исследований показывают, что сам С-реактивный белок вряд ли станет целью вмешательства. С-реактивный белок также является биомаркером повреждения миокарда [27].
MSC-терапия может подавлять чрезмерную активацию иммунной системы и способствовать эндогенной репарации путем улучшения микросреды. После попадания в организм человека путем внутривенного вливания часть МСК накапливается в легких, что может улучшить легочную микроокружение, защитить альвеолярные эпителиальные клетки, предотвратить фиброз легких и улучшить функцию легких.
Как сообщается командой Cao [11], уровни сывороточных IL-2, IL-7, G-SCF, IP10, MCP-1, MIP-1A и TNF-α у пациентов с ОИТ были выше, чем у нормальных пациентов. Синдром высвобождения цитокинов, вызванный аномально активированными иммунными клетками, ухудшает состояние пациента, что может привести к нарушению функции эндотелиальных клеток, проницаемости капилляров, блокированию слизи в легких и, наконец, дыхательной недостаточности. И они даже могут вызвать воспалительный цитокиновый шторм, ведущий к полиорганной недостаточности. Введение внутривенных инъекций MSC значительно улучшило ситуацию воспаления у пациентов с тяжелой формой COVID-19. Благодаря своей уникальной иммуносупрессорной способности уровни провоспалительных цитокинов и хемокинов в сыворотке были значительно снижены, что привлекало меньше мононуклеаров / макрофагов к поврежденному легкому, в то же время индуцировав большее количество регуляторных дендрических клеток в нише воспалительных тканей. Кроме того, увеличение IL-10 и VEGF способствовало восстановлению легких. В конечном счете, пациенты с тяжелой пневмонией COVID-19 пережили пик ухудшения состояния и восстановились.
Следовательно, улучшение исхода пациентов с COVID-2019 после трансплантации MSC может быть обусловлено регулированием воспалительного ответа и содействием восстановлению и регенерации тканей.
Благодарности
Эта работа была поддержана Национальной ключевой программой исследований и разработок Китая (2016YFA0101000, 2018YFE0114200), CAMS Innovation Fund for Medical Sciences (2017-I2M-3-007) и проект 111 (B18007), Национальный фонд естественных наук Китая (81971324, 81672313, 81700782, 81972523, 81771349).
Ссылка на статью: Скачать бесплатно
Перевод: Ник Сестрин







































































