Событие омоложения во время раннего эмбриогенеза
Чтобы оценить эпигенетическую возрастную динамику во время эмбриогенеза, мы собрали доступные наборы данных о метилировании ДНК человека и мыши (Таблица 1) и оценили их различными часами эпигенетического старения (Таблица 2). Мы также разработали часы метилирования мульти-тканевой рибосомной ДНК (rDNAm) (рис. S1, S2). РДНК характеризуется большим количеством связанных с возрастом сайтов CpG, которые демонстрируют высокий охват последовательностей из-за множественности рДНК в геноме (35, 44). Новые часы способны предсказывать эпигенетический возраст RRBS (reduced representation bisulfite sequencing, бисульфитное секвенирование с уменьшенным представлением ), WGBS (полногеномное бисульфитное секвенирование) и даже псевдогрупповые образцы секвенирования отдельных клеток в различных тканях. Все часы, которые мы использовали, показали высокую точность (r> 0,8) в предсказании возраста тестовых выборок и были чувствительны к возраст-связанным состояниям и интервенциям долголетия (Таблица 2).
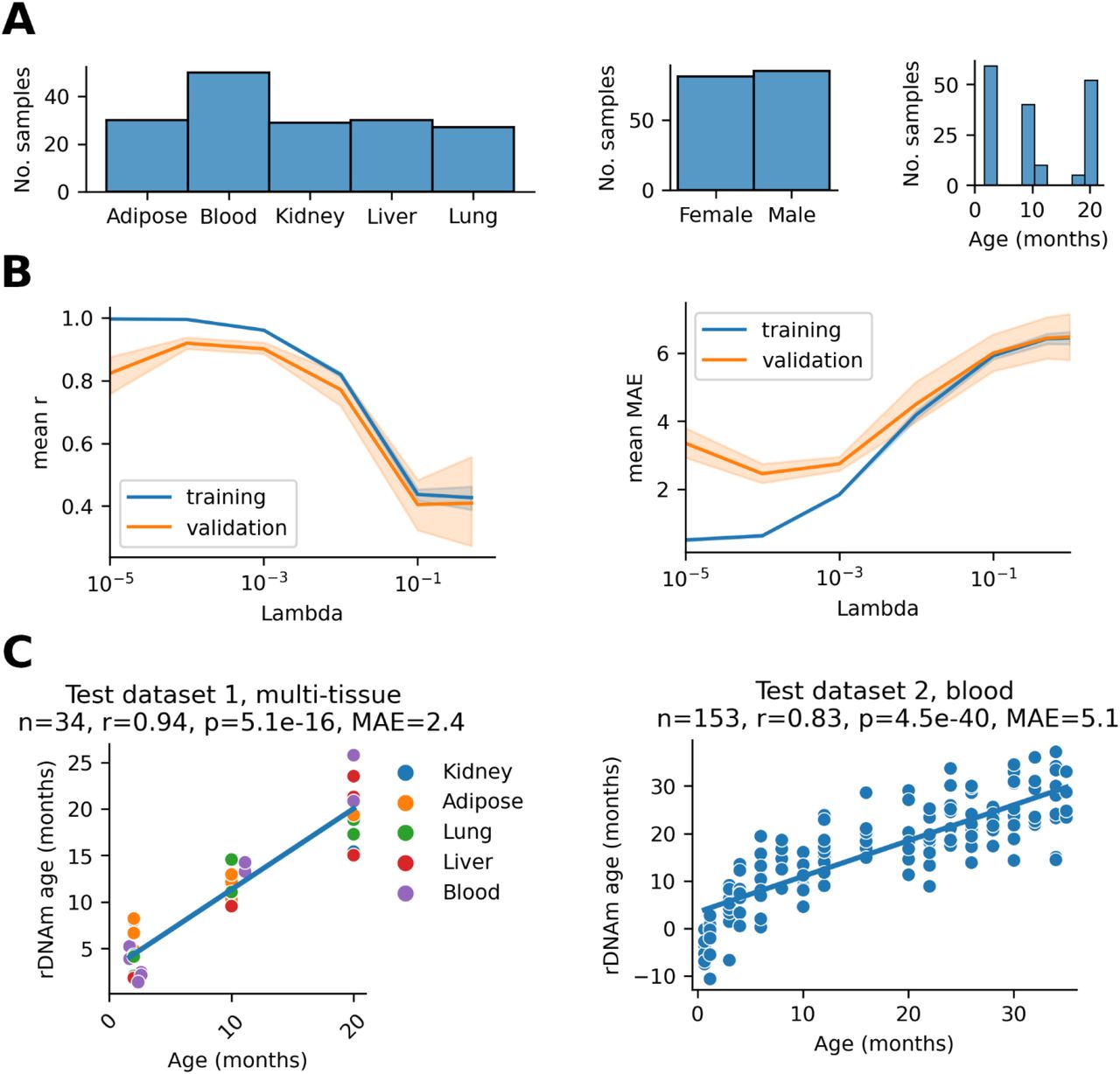 Рисунок S1. Разработка часов мульти-тканевого метилирования рибосомной ДНК (рДНК) мыши. (A) Распределение выборки, используемое для обучения и тестирования. (B) Нахождение оптимального лямбда-параметра (0,0001) ElasticNet с использованием 5-кратной перекрестной проверки. (C) Производительность часов рДНК на мультитканевой тестовой выборке и тестовой выборке крови, оба в нормальных / контрольных условиях.
Рисунок S1. Разработка часов мульти-тканевого метилирования рибосомной ДНК (рДНК) мыши. (A) Распределение выборки, используемое для обучения и тестирования. (B) Нахождение оптимального лямбда-параметра (0,0001) ElasticNet с использованием 5-кратной перекрестной проверки. (C) Производительность часов рДНК на мультитканевой тестовой выборке и тестовой выборке крови, оба в нормальных / контрольных условиях.
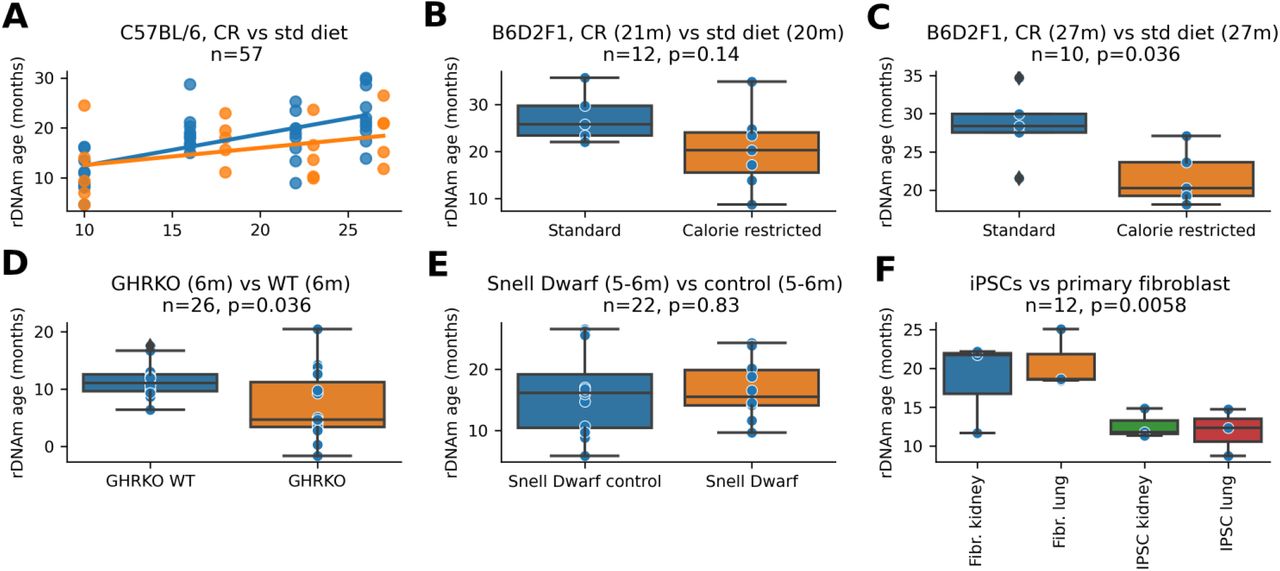 Рисунок S2. Применение часов мульти-тканевой рДНК к различным моделям старения и воздействиям на долголетие.(A) Ограничение калорийности (оранжевый) по сравнению со стандартной диетой (синие) мышей C57BL / 6.(B) Ограничение калорийности 21-месячных мышей по сравнению со стандартной диетой, получавших 20-месячных мышей B6D2F1.(C) Ограничение калорийности 27-месячных мышей по сравнению со стандартной диетой, получавших 27-месячных мышей B6D2F1.(D) Мыши с нокаутом рецептора гормона роста (возраст 6 месяцев) по сравнению с мышами дикого типа (возраст 6 месяцев).(E) Карликовые мыши Snell в возрасте 5-6 месяцев по сравнению с контрольными мышами.(F) Фибробласты легких и почек мыши по сравнению с индуцированными фибробластами плюрипотентными стволовыми клетками (ИПСК).
Рисунок S2. Применение часов мульти-тканевой рДНК к различным моделям старения и воздействиям на долголетие.(A) Ограничение калорийности (оранжевый) по сравнению со стандартной диетой (синие) мышей C57BL / 6.(B) Ограничение калорийности 21-месячных мышей по сравнению со стандартной диетой, получавших 20-месячных мышей B6D2F1.(C) Ограничение калорийности 27-месячных мышей по сравнению со стандартной диетой, получавших 27-месячных мышей B6D2F1.(D) Мыши с нокаутом рецептора гормона роста (возраст 6 месяцев) по сравнению с мышами дикого типа (возраст 6 месяцев).(E) Карликовые мыши Snell в возрасте 5-6 месяцев по сравнению с контрольными мышами.(F) Фибробласты легких и почек мыши по сравнению с индуцированными фибробластами плюрипотентными стволовыми клетками (ИПСК).
Таблица 1. Наборы данных о метилировании эмбриональной ДНК, использованные в этом исследовании.
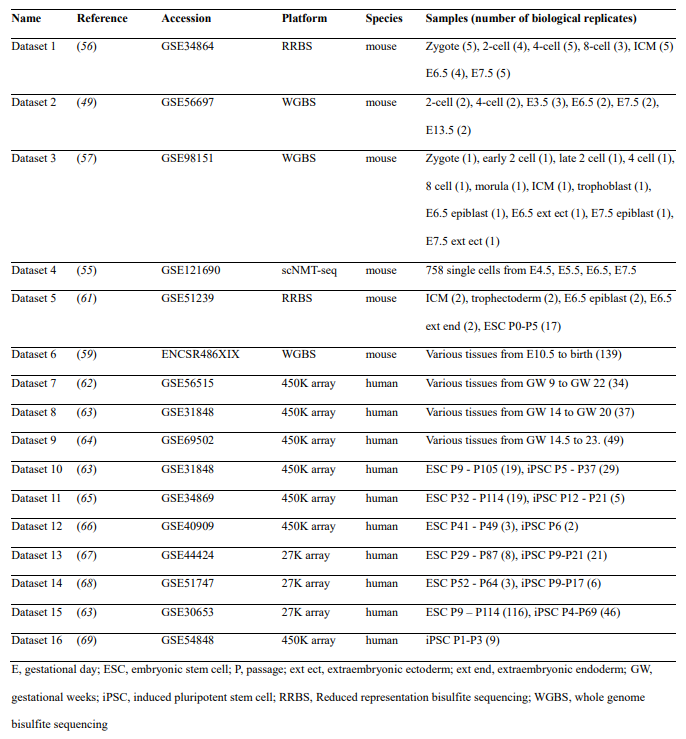
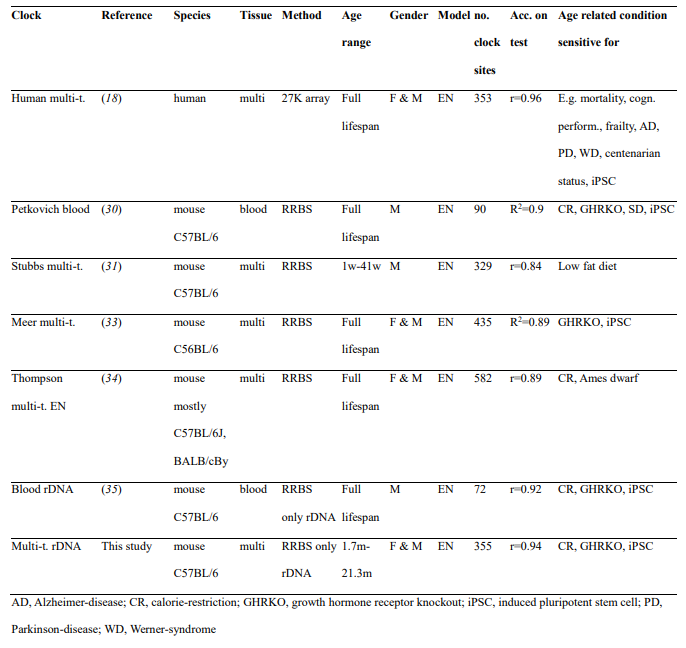
Таблица 2. Часы эпигенетического старения, использованные в этом исследовании.
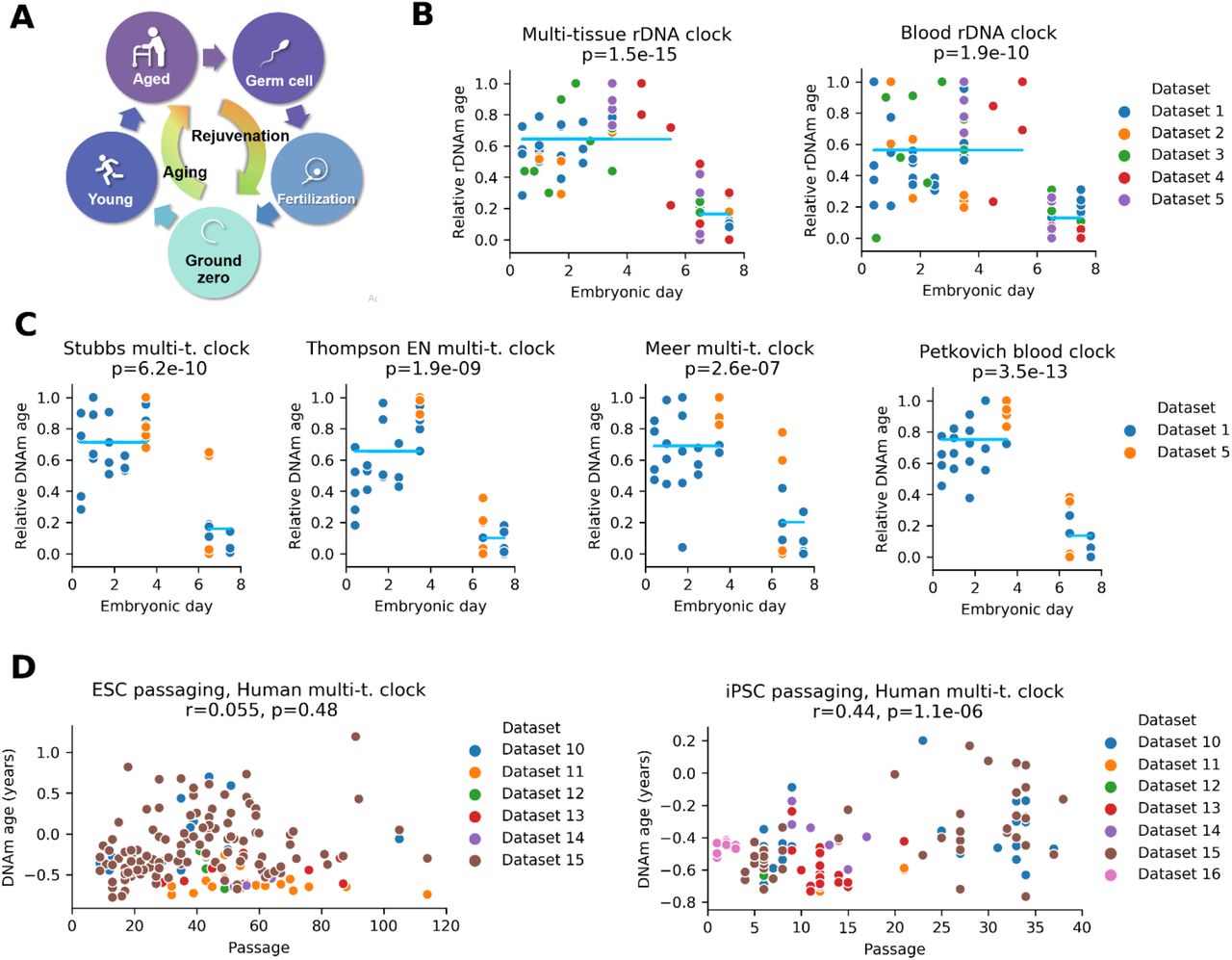
Во-первых, мы изучили поведение часов rDNAm при применении к пяти независимым наборам данных ранних эмбрионов мышей. Мы обнаружили, что средний эпигенетический возраст эмбрионов E6.5 / E7.5 был постоянно ниже, чем на более ранних стадиях эмбриогенеза (рис. 1B, рис. S3AB, рис. S4AB). Мы также применили четыре вида геномных часов эпигенетического старения на основе RRBS к наборам данных RRBS (наборы данных 1 и 2). Это снова показало, что эпигенетический возраст эмбрионов E6.5 / E7.5 ниже, чем в период от зиготы до бластоцисты (рис. 1C, рис. S3CD, рис. S4CD). Таким образом, эпигенетический возраст уменьшается на раннем этапе эмбриогенеза, и поэтому эмбриональные клетки не только не стареют в этот период, но и в какой-то момент омолаживаются.
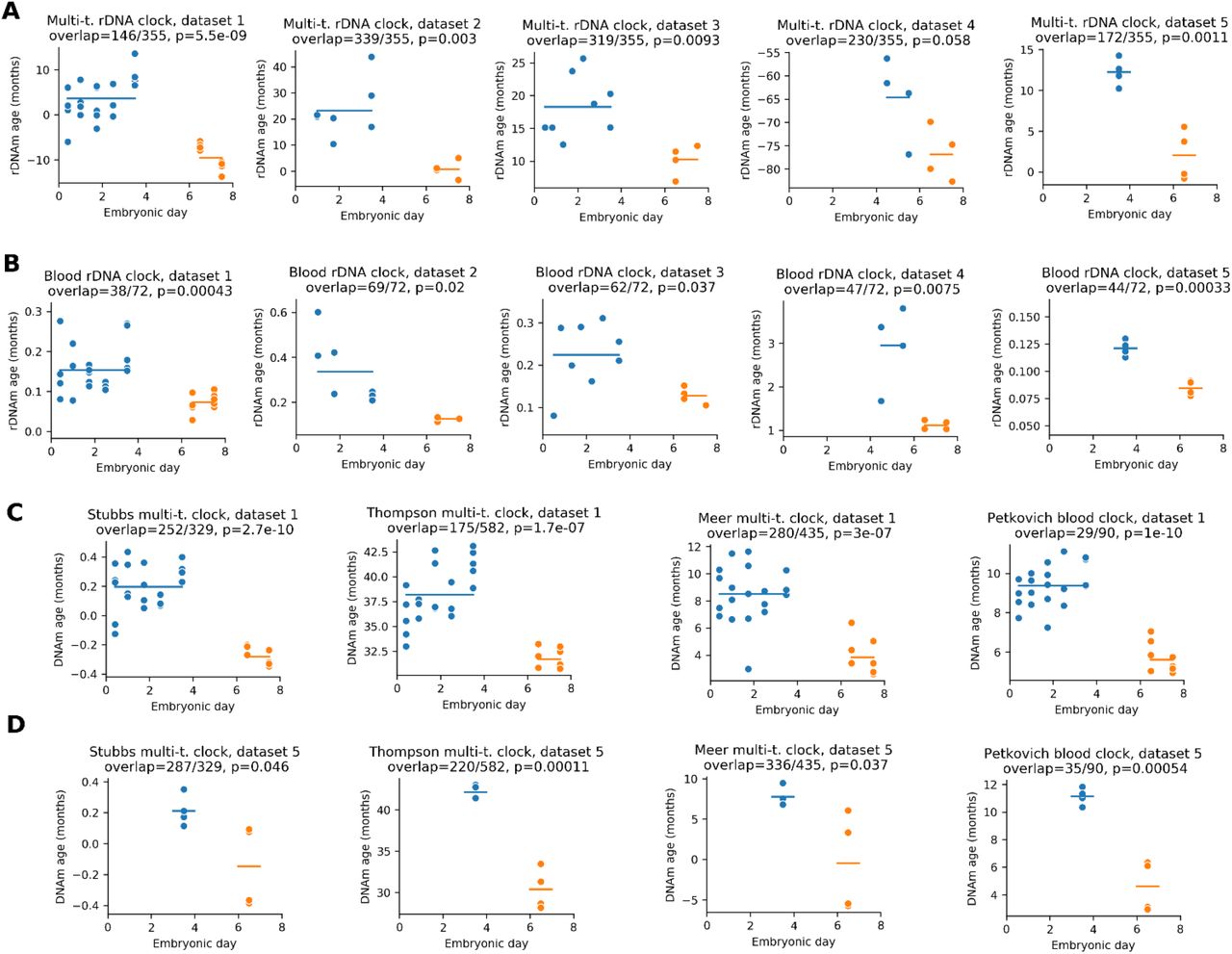 Рисунок S3. Часы старения показывают событие омоложения во время раннего эмбриогенеза. (A) Мульти-тканевые часы и часы рДНК крови, примененные к пяти наборам данных, охватывающих первые 8 дней эмбриогенеза мышей (таблица 1, наборы данных 1-5). Отображается прогнозируемый эпигенетический возраст (изменение масштаба не применяется). Для каждого графика мы указываем количество сайтов CpG часов, которые были включены в набор данных приложения («перекрытие»). Синие линии показывают среднее значение каждой группы; p-значение двустороннего t-критерия сравнивает среднее значение двух групп.(B) Часы метилирования рДНК крови, примененные к тем же пяти наборам данных.(C) Применение четырех общегеномных часов эпигенетического старения к набору данных 1.(D) Применение четырех общегеномных часов эпигенетического старения к набору данных 5.
Рисунок S3. Часы старения показывают событие омоложения во время раннего эмбриогенеза. (A) Мульти-тканевые часы и часы рДНК крови, примененные к пяти наборам данных, охватывающих первые 8 дней эмбриогенеза мышей (таблица 1, наборы данных 1-5). Отображается прогнозируемый эпигенетический возраст (изменение масштаба не применяется). Для каждого графика мы указываем количество сайтов CpG часов, которые были включены в набор данных приложения («перекрытие»). Синие линии показывают среднее значение каждой группы; p-значение двустороннего t-критерия сравнивает среднее значение двух групп.(B) Часы метилирования рДНК крови, примененные к тем же пяти наборам данных.(C) Применение четырех общегеномных часов эпигенетического старения к набору данных 1.(D) Применение четырех общегеномных часов эпигенетического старения к набору данных 5.
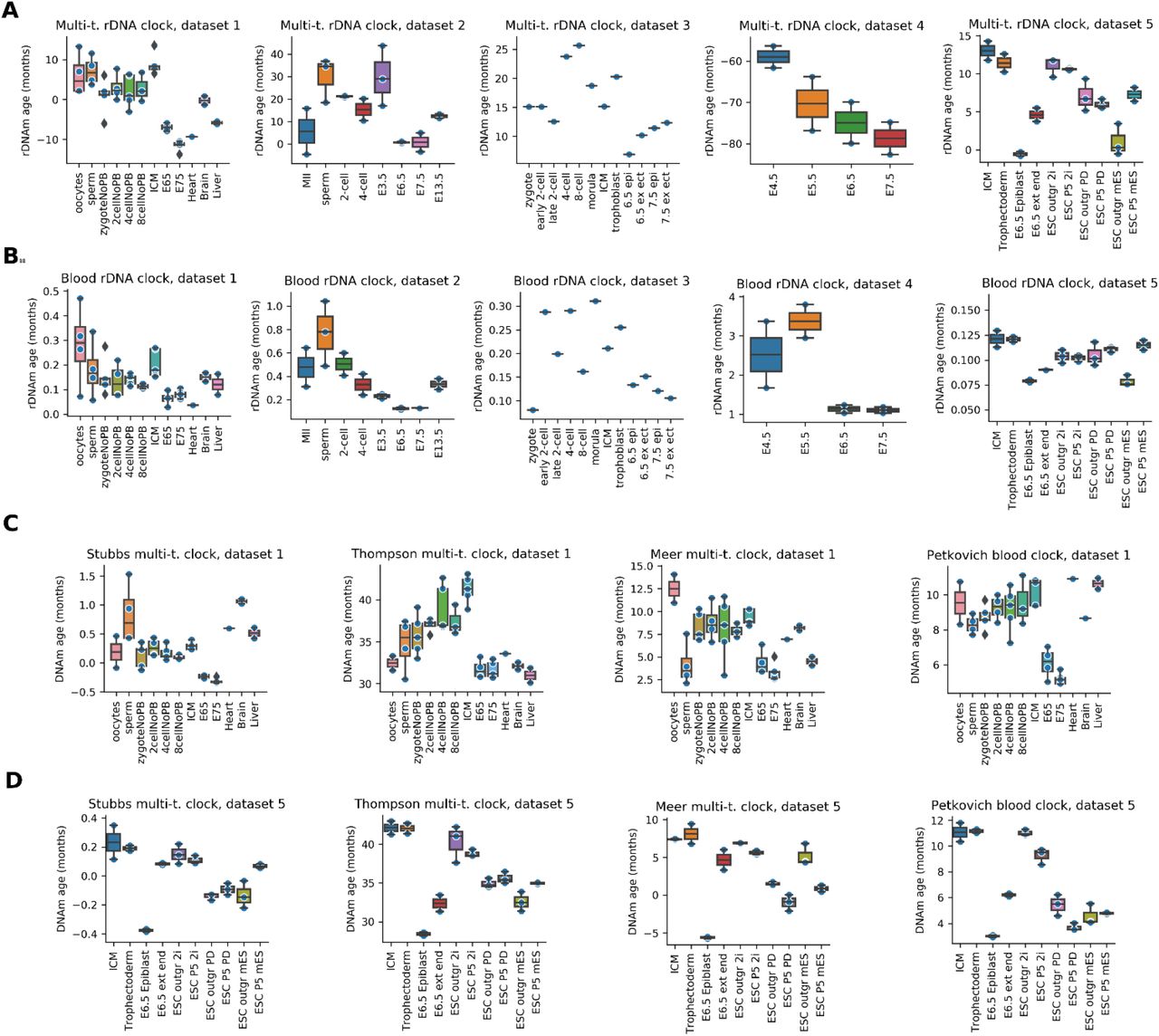 Рисунок S4. Часы старения показывают событие омоложения во время раннего эмбриогенеза. (A) - (D), тот же анализ, что и на рис. S3, но с разделением по типу образца (вместо эмбрионального времени). Также отображается эпигенетический возраст гамет и взрослых образцов (сердце, мозг и печень).
Рисунок S4. Часы старения показывают событие омоложения во время раннего эмбриогенеза. (A) - (D), тот же анализ, что и на рис. S3, но с разделением по типу образца (вместо эмбрионального времени). Также отображается эпигенетический возраст гамет и взрослых образцов (сердце, мозг и печень).
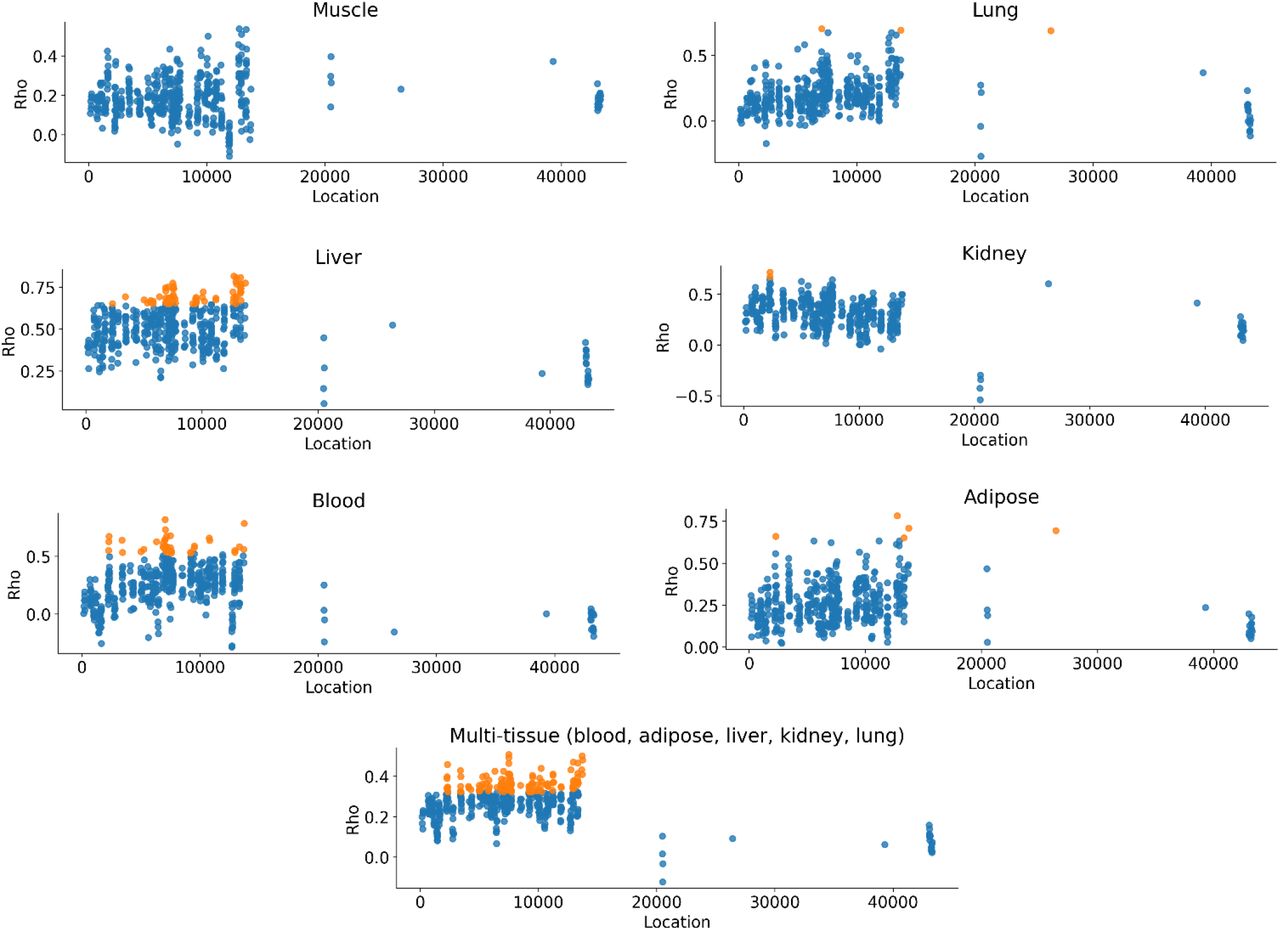 Рисунок S5. Метилирование рибосомной ДНК связано с возрастом в разных тканях мышей C57BL / 6J. Коэффициенты ранговой корреляции Спирмена с возрастом (Rho) для сайтов CpG в последовательности рДНК. Значимые корреляции после коррекции Бонферрони (p < 0,05 / n) обозначены оранжевым цветом.
Рисунок S5. Метилирование рибосомной ДНК связано с возрастом в разных тканях мышей C57BL / 6J. Коэффициенты ранговой корреляции Спирмена с возрастом (Rho) для сайтов CpG в последовательности рДНК. Значимые корреляции после коррекции Бонферрони (p < 0,05 / n) обозначены оранжевым цветом.
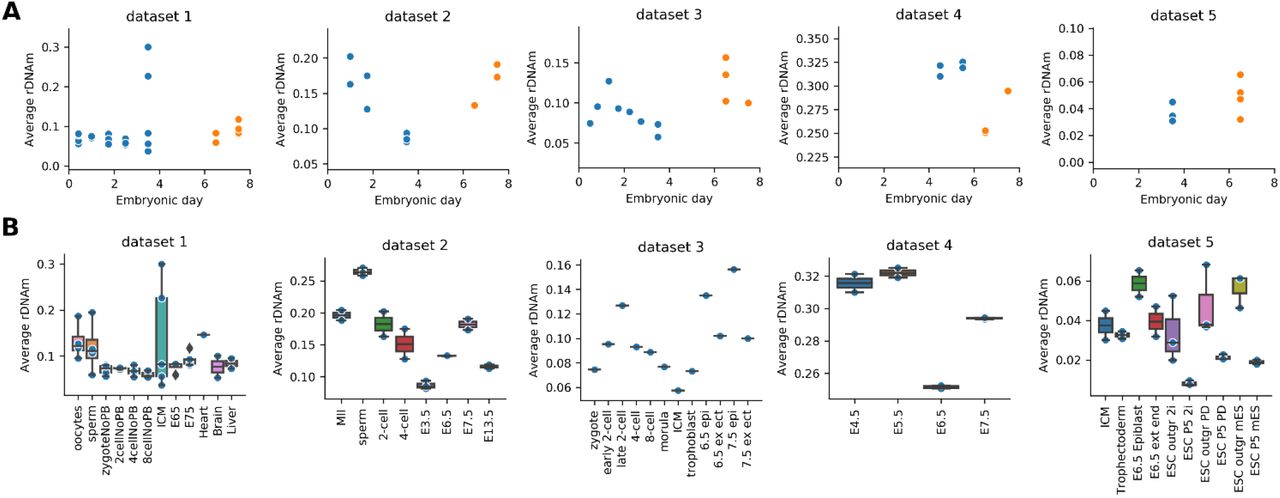 Рисунок S6. Средний уровень метилирования CpG-сайтов рибосомальной ДНК мыши, измеренный в различных наборах данных. (A) Образцы разделяются по эмбриональному времени. (B) Образцы разделены по типу.
Рисунок S6. Средний уровень метилирования CpG-сайтов рибосомальной ДНК мыши, измеренный в различных наборах данных. (A) Образцы разделяются по эмбриональному времени. (B) Образцы разделены по типу.
Ранее, почти нулевой эпигенетический возраст человеческих эмбриональных стволовых клеток и ИПСК был продемонстрирован мульти-тканевыми часами Хорватии даже после обширного пассирования (18). Мы проанализировали ИПСК и ЭСК на основе нескольких доступных в настоящее время наборов данных, чтобы дополнительно оценить, имеют ли эти клетки, которые соответствуют раннему эмбриогенезу, возраст (рис. 1D). Эпигенетический возраст клеток был очень низким (в основном ниже нуля) даже после более чем 100 пассажей. Даже в искусственных условиях культивирования, при уровне кислорода выше физиологического и при количестве пассажей, значительно превышающих физиологический (что может привести к накоплению вредных мутаций), либо не наблюдалось увеличения эпигенетического возраста, либо наблюдалось очень небольшое увеличение. Эти данные подтверждают мнение о том, что клетки, соответствующие ранним стадиям эмбриогенеза, по существу не стареют.
Организменное старение у мышей и людей начинается в середине эмбрионального развития.
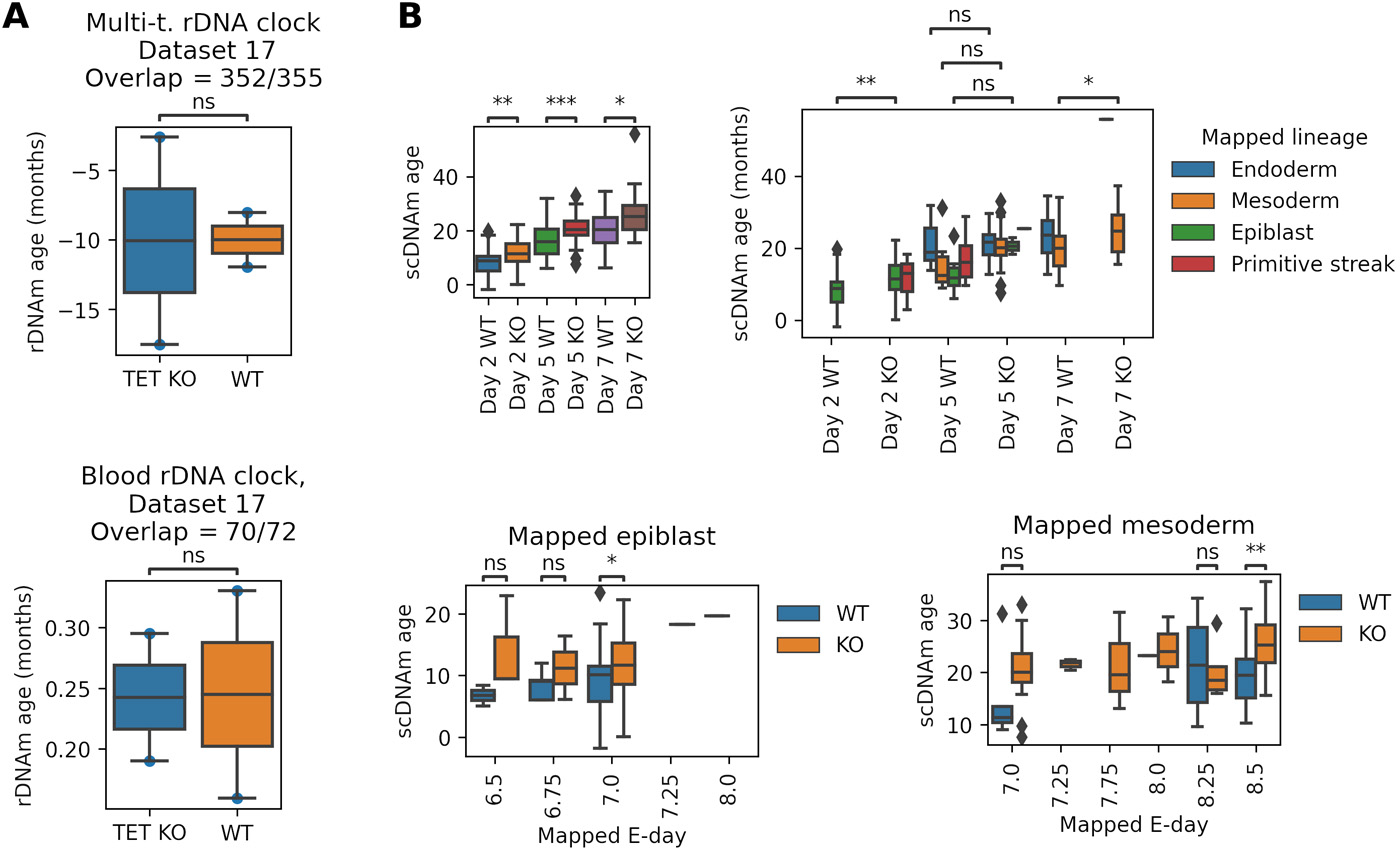
Мы количественно оценили эпигенетический возраст, применив часы рДНК к единственному доступному набору данных мышей, который содержит образцы как ранних, так и поздних эмбрионов (рис. 2A). Эпигенетический возраст на E6.5 и E7.5 был значительно ниже, чем на E13.5 (первичные клетки зародышевой линии, которые являются прямыми предшественниками сперматозоидов и ооцитов).
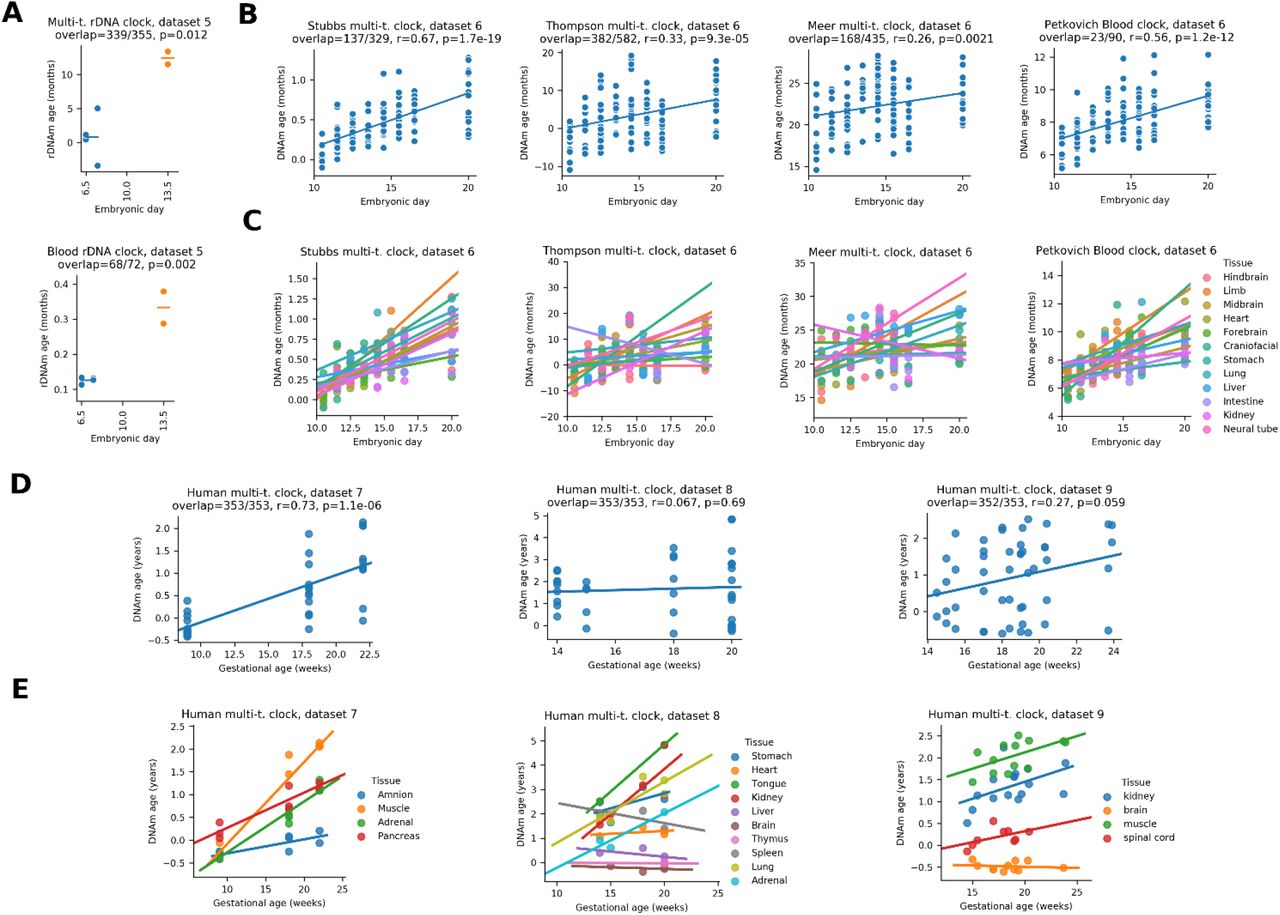 Рис. 2. Организменное старение начинается в середине эмбрионального развития мыши и человека. (A) Эпигенетический возраст (часы мульти-ткани и рДНК крови) анализ набора данных, который содержит образцы как ранних, так и поздних эмбрионов мыши (образцы E13.5 основаны на первичных клетках зародышевой линии). (B) Применение полногеномных эпигенетических часов на более поздних стадиях эмбриогенеза мышей (r, коэффициент корреляции Пирсона; p, p-значение корреляции). (C) Те же данные, что и выше, но разделенные тканью. Тенденция к увеличению наблюдается почти для всех тканей, за некоторыми незначительными исключениями. (D) Эпигенетическая возрастная динамика четырех независимых массивов пренатальных наборов данных 450k метилирования человека на основе мультитканевых часов человека Horvath. (E) Те же данные, что и выше, но разделенные по тканям (5 значительных увеличений, 9 незначительных увеличений, 4 незначительных уменьшения, 0 значительных сокращений).
Рис. 2. Организменное старение начинается в середине эмбрионального развития мыши и человека. (A) Эпигенетический возраст (часы мульти-ткани и рДНК крови) анализ набора данных, который содержит образцы как ранних, так и поздних эмбрионов мыши (образцы E13.5 основаны на первичных клетках зародышевой линии). (B) Применение полногеномных эпигенетических часов на более поздних стадиях эмбриогенеза мышей (r, коэффициент корреляции Пирсона; p, p-значение корреляции). (C) Те же данные, что и выше, но разделенные тканью. Тенденция к увеличению наблюдается почти для всех тканей, за некоторыми незначительными исключениями. (D) Эпигенетическая возрастная динамика четырех независимых массивов пренатальных наборов данных 450k метилирования человека на основе мультитканевых часов человека Horvath. (E) Те же данные, что и выше, но разделенные по тканям (5 значительных увеличений, 9 незначительных увеличений, 4 незначительных уменьшения, 0 значительных сокращений).
Мы также оценили эпигенетический возраст эмбрионов мыши в 9 временных точках от эмбрионального дня 10,5 до рождения (набор данных 6) с помощью часов метилирования всего генома. В течение этого периода наблюдалось последовательное увеличение эпигенетического возраста как при рассмотрении всех данных (рис. 2B), так и при разделении по тканям (рис. 2C). Кроме того, мы проанализировали пренатальные наборы данных человека, применив часы Horvath multi-fabric DNAm к четырем независимым массивам данных 450K метилирования человека (наборы данных 7–9). Увеличение (или, в некоторых случаях, отсутствие изменений) эпигенетического возраста наблюдалось как при рассмотрении всех данных (рис. 2D), так и для каждой ткани (рис. 2E). Таким образом, в определенный момент во время эмбрионального развития у мыши и человека биологический возраст начинает увеличиваться в большинстве или во всех тканях. Учитывая, что эпигенетические часы отслеживают процесс старения, данные предполагают, что к тому времени организмы уже стареют.
Эпигенетический возраст ЭСК мыши во время раннего пассирования
Мы оценили эпигенетический возраст эмбриональных стволовых клеток мыши после роста (пассаж 0) и раннего пассажа (пассаж 5) в трех различных условиях культивирования (рис. 3AB). В отсутствие двух ингибиторов (PD0325901, который вызывает блокаду дифференцировки, и CHIR99021, который поддерживает самообновление (45)), мы наблюдали более низкий эпигенетический возраст после отрастания по сравнению с состоянием, когда были включены два ингибитора. Данные предполагают, что ESC в условиях неполного самообновления культуры могут продолжать свое развитие (без самообновления) и омолаживаться, подобно тому, что мы наблюдали in vivo (Рис. 1).
 Рис. 3. Эпигенетический возраст ЭСК мыши при раннем пассировании в различных условиях культивирования. (A) Эпигенетический возраст (по часам рДНК) мышиных ESC после разрастания (пассаж 0) и пассажа 5 в трех различных условиях культивирования (2i, используются оба ингибитора, поддерживающих самообновление; PD, только один ингибитор; mES, без ингибитора). (B) Применение полногеномных эпигенетических часов мыши к тем же данным. (C) Анализ основных компонентов (PCA) профилей метилирования RRBS эмбрионов (кружки) и ESC (крестики) групп образцов после пассажа 0 (слева) и пассажа 5 (справа). Выпуклая оболочка вокруг образцов ESC в той же группе (если n> 2) отображается, чтобы помочь отличить образцы ESC от образцов эмбриона.
Рис. 3. Эпигенетический возраст ЭСК мыши при раннем пассировании в различных условиях культивирования. (A) Эпигенетический возраст (по часам рДНК) мышиных ESC после разрастания (пассаж 0) и пассажа 5 в трех различных условиях культивирования (2i, используются оба ингибитора, поддерживающих самообновление; PD, только один ингибитор; mES, без ингибитора). (B) Применение полногеномных эпигенетических часов мыши к тем же данным. (C) Анализ основных компонентов (PCA) профилей метилирования RRBS эмбрионов (кружки) и ESC (крестики) групп образцов после пассажа 0 (слева) и пассажа 5 (справа). Выпуклая оболочка вокруг образцов ESC в той же группе (если n> 2) отображается, чтобы помочь отличить образцы ESC от образцов эмбриона.
Локализация эпигенетического минимума возраста (нулевой точки) во время эмбрионального развития мыши
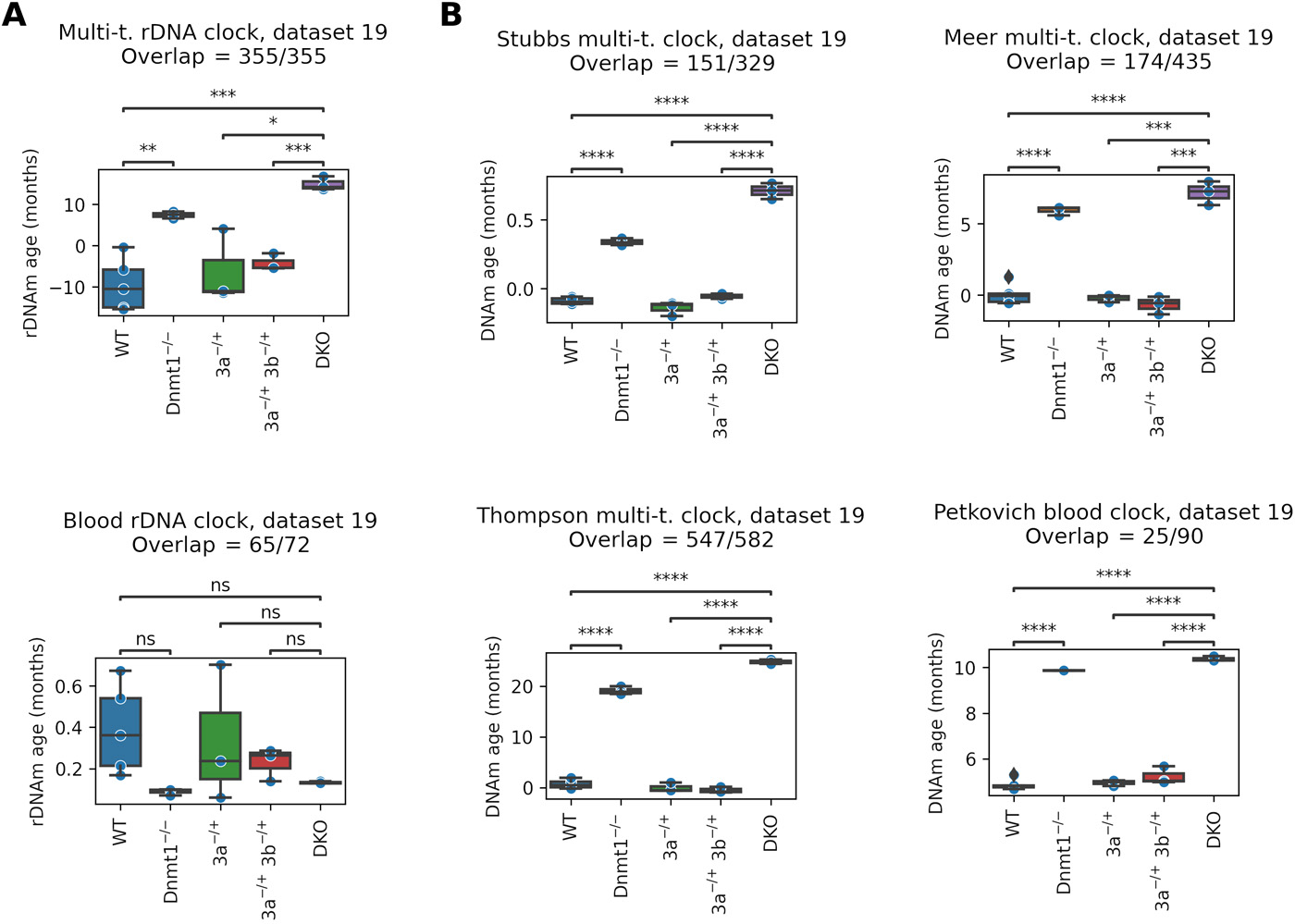
Мы объединили результаты для ранних и более поздних стадий эмбриогенеза, применив полногеномные мышиные эпигенетические часы (рис. 4A) и часы рДНК (рис. 4B). Переменное количество перекрывающихся участков часов на всех этапах вызвало cовокупный эффект сдвига фактического прогнозируемого возраста между ранними и поздними этапами. Однако эпигенетическая возрастная динамика показывала четкую U-образную структуру в каждом случае с минимумом на уровне E6,5 / E7,5 в четырех случаях и E10,5 в двух случаях. Результаты показывают, что нулевой уровень может лежать в диапазоне от E4,5 до E10,5. Чтобы уточнить интервал, мы также проанализировали набор данных, содержащий средние эмбриональные стадии от E3.5 до E11.5 [набор данных 20, (46)]. Минимальный эпигенетический возраст находился на уровне E6,5 / E7,5 в пяти случаях и на уровне E8,5 в одном случае (рис. 4, C и D, и рис. S7). В совокупности наши данные предполагают, что нулевой уровень может лежать в диапазоне от E4,5 до E10,5, наиболее вероятно, в E6,5 / E7,5. После этого омоложения начинается старение организма.
 Рис. 4. Локализация эпигенетического минимума возраста (нулевой точки) во время эмбрионального развития мыши. (А) Мы объединили результаты за весь период эмбриогенеза, используя указанные эпигенетические часы мыши в масштабе всего генома. (Б) Мы объединили результаты за весь период эмбриогенеза, используя указанные эпигенетические часы рДНК мыши. (C) Применение эпигенетических часов мыши в масштабе всего генома к набору данных 20, который содержит промежуточные эмбриональные стадии от E3.5 до E11.5. (D) Применение эпигенетических часов мыши с рДНК к набору данных 20.
Рис. 4. Локализация эпигенетического минимума возраста (нулевой точки) во время эмбрионального развития мыши. (А) Мы объединили результаты за весь период эмбриогенеза, используя указанные эпигенетические часы мыши в масштабе всего генома. (Б) Мы объединили результаты за весь период эмбриогенеза, используя указанные эпигенетические часы рДНК мыши. (C) Применение эпигенетических часов мыши в масштабе всего генома к набору данных 20, который содержит промежуточные эмбриональные стадии от E3.5 до E11.5. (D) Применение эпигенетических часов мыши с рДНК к набору данных 20.
Заключительные комментарии, обсуждение
Еще в 19 веке Август Вейсманн предложил идею наследственной нестареющей зародышевой линии и одноразовой стареющей сомы. Тем не менее, в зародышевой линии наблюдаются молекулярные изменения, характерные для старения (7–9). Наше исследование предполагает, что зародышевые линии стареют, но омолаживаются у потомства в какой-то момент во время раннего эмбриогенеза. Это омоложение происходит на ранних стадиях после имплантации, когда потомство достигает минимального биологического возраста. Мы предполагаем, что этот минимум, точка отсчета, знаменует начало старения организма. Потомство естественным образом переходит к нулевому уровню из стадии зиготы, но соматические клетки также могут быть вынуждены перейти на эту молодую стадию, например путем перепрограммирования с факторами Яманака (или другими методами), генерируя ИПСК. Улучшение связанных с возрастом признаков in vivo уже было продемонстрировано частичным перепрограммированием (46). Совсем недавно частичное перепрограммирование восстановило зрение у мышей путем сброса молодой эпигенетической информации (47). Таким образом, и сома, и зародышевые линии могут стареть и омолаживаться.
Ранний эмбриогенез, когда мы наблюдали период омоложения, также сопровождается другими молекулярными изменениями в подготовке к жизни организма, такими как постепенное удлинение теломер (48), волны глобального деметилирования и метилирования (49), переход от использования материнских генных продуктов к продуктам самого эмбриона, инактивация хромосомы X и развитие моноаллельной экспрессии генов (50). Омоложение также должно включать уменьшение молекулярных повреждений и других вредных возрастных изменений, которые накапливаются в родительской зародышевой линии (51, 52). Данные показывают, что нулевой уровень у мышей находится между E4,5 и E10,5, а текущие оценки показывают, что он близок к E6,5 / E7,5. Этот период примерно соответствует гаструляции, когда формируются три зародышевых листка. Однако необходимы дальнейшие исследования, чтобы точно определить местонахождение нулевой точки у людей и мышей.
Начало старения является предметом споров. Часто обсуждается, что старение начинается после завершения развития, в начале воспроизводства и в то время, когда сила естественного отбора начинает уменьшаться. Однако наш недавний анализ пагубных возрастных изменений показал, что старение начинается в раннем возрасте, даже до рождения (53). Наша текущая работа теперь привязывает начало старения к нулевой точке (ground zero).
Сайты CpG, связанные со старением и продолжительностью жизни, могут быть как гипометилированы, так и гиперметилированы при старении (54). Привлекательная возможность состоит в том, что омоложение может поддерживаться реметилированием, а не деметилированием. Действительно, глобальное реметилирование было зарегистрировано между E3.5 и E7.5 (49, 55-57), что является тем же периодом, когда мы наблюдаем омоложение. Если глобальное реметилирование действительно связано с уменьшением эпигенетического возраста, нулевой уровень и максимум глобального метилирования должны соответствовать одной и той же стадии развития. Это имело бы смысл с той точки зрения, что для устранения «эпигенетического повреждения» геном должен быть сначала частично деметилирован, а затем снова реметилирован.
Мы также обнаружили, что клетки, соответствующие раннему эмбриогенезу, то есть ЭСК и ИПСК, не стареют при культивировании и пассировании. Однако раннее пассирование, по-видимому, приводит к эпигенетическому снижению возраста. В соответствии с этим сокращением возраста было обнаружено, что первоначально пассирование вызывает удлиннение теломер, и что мыши, полученные из этих омоложенных клеток, живут дольше и лучше защищены от возрастных заболеваний, чем мыши из тех же клеток, которые не были пассированы (58). Это предполагает захватывающую возможность того, что событие естественного омоложения, которое мы раскрываем в этой работе, может быть целевым, так что организмы могут начинать стареть в более низком биологическом возрасте и, следовательно, могут достичь более высокой продолжительности жизни и более высокой продолжительности здоровой жизни. Это также может быть полезно во время оплодотворения in vitro, когда приоритет может отдаваться эмбрионам с более низким биологическим возрастом.
Глобальное метилирование цитозина (средний уровень метилирования сайтов CpG, представляющих весь геном) изменяется волнообразно во время эмбриогенеза млекопитающих: первоначальное снижение от зиготы до E3.5 сопровождается увеличением до E6.5 / E7.5 (49), и уникальной тканеспецифической динамикой во время / после органогенеза (59). Однако глобальное метилирование цитозина показывает очень мало изменений после рождения (60), и, следовательно, не дает точных прогнозов биологического возраста или его снижения. Напротив, возраст, прогнозируемый часами эпигенетического старения (обычно на основе нескольких сотен сайтов CpG), показывает сильную корреляцию с возрастом (r> 0,8), указывая на то, что его можно использовать для прогнозирования биологического старения и омоложения (Таблица 2).
В целом, эта работа идентифицирует естественное событие омоложения в раннем возрасте и предполагает, что старение организма начинается во время эмбриогенеза, примерно во время гаструляции. Эти открытия дают возможность понять, что влечет за собой этот процесс раннего омоложения, похож ли он на перепрограммирование Яманаки и может ли он быть вызван в соматических клетках для их омоложения.
Вклад авторов
В.Н.Г. задумал и руководил исследованием. C.K. собрали данные, провели анализ данных и разработали часы мульти-тканевой рДНК. Б.З. создал схематический рисунок и помог с анализом данных и обсуждениями. Все авторы интерпретировали результаты. В.Н.Г. и С.К. написали текст. Б.З., С.Л. и А.Т. редактировали текст.
Доступность данных и доступность кода
Уровни метилирования сайтов CpG рДНК будут доступны для всех наборов данных о мышах после публикации вместе с кодами рабочего процесса эпигенетических часов.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Сбор и обработка наборов данных секвенирования
Необработанные последовательности были загружены и извлечены с помощью SRA Toolkit. Чтения были обрезаны, а качество отфильтровано TrimGalore! v0.6.4 с использованием параметра --rrbs для RRBS. Уровни метилирования были извлечены с использованием Bismark v0.22.2 (70) в двух отдельных процессах: (i) для часов рДНК, чтения были сопоставлены с последовательностью рДНК мыши (BK000964.3), (ii) для геномных часов, чтения были сопоставлены с полной последовательностью генома мыши (mm10 / GRCm38.p6). Метилированные и неметилированные цитозины технических повторов суммировали для каждой позиции. В случае набора данных 6 мы напрямую использовали доступные файлы BED (URL-адреса были извлечены из файлов GEO).
Фильтрация сайтов CpG и вменение наборов данных RRBS / WGBS
Наша стратегия фильтрации была оптимизирована для достижения трех конкурирующих целей: (i) максимально возможное покрытие чтения; (ii) максимально возможное перекрытие сайтов часов; и (iii) сравнение наилучших (объективных) выборок. Мы использовали только те сайты CpG, которые охвачены по крайней мере 5 чтениями (или 50 в двух наиболее покрытых случаях, когда часы рДНК применялись к наборам данных 2 и 3) по крайней мере в 90% выборок данного набора данных. В случае набора данных 6 мы просто использовали сайты CpG, которые охватываются как минимум 5 чтениями без каких-либо других ограничений (чтобы избежать слишком большого количества пропущенных значений). Мы исключили два образца самого низкого качества (оба были ооцитами) набора данных 1 для геномного анализа. Недостающие значения часовых сайтов были вменены средними уровнями метилирования покрытых часовых участков для всех образцов. Наша стратегия вменения привела к единому числу для каждого тактового сигнала и набора данных, что позволило менее предвзято сравнивать выборки по сравнению с методом, который вменяет разные значения для каждой выборки. Мы использовали среднее по часам вместо среднего по всем сайтам, потому что мы предположили, что уровни метилирования CpG у сайтов часов ближе друг к другу, чем к другим сайтам.
Применение эпигенетических часов мыши к наборам данных RRBS / WGBS
В применении ранее разработанных часов мы руководствовались описаниями авторов. Все доступные часы мыши, которые мы использовали, были основаны на линейной регрессии (таблица 2). Мы использовали параметры, предоставленные авторами. Трансформация была также применена в случае кровяных часов Петковича (30), многотканевых часов Стаббса (31) и часов рДНК крови (35). В случае многотканевых часов Стаббса начальная нормализация была проделана с помощью опубликованного обучающего набора. Применение часов на основе RRBS с сайтами, разбросанными по геному, часто является сложной задачей из-за различного количества покрытых сайтов часов, что приводит к отсутствующим значениям. Поэтому мы требовали, чтобы покрытие сайтов часов составляло не менее 25%. Сайты часов на основе RRBS не имели достаточного покрытия, когда мы применяли их к наборам данных 2, 3 и 4 (все они являются наборами данных WGBS).
Рабочий процесс часов с одной клеткой
Уровни метилирования получали с помощью рабочего процесса картирования рДНК, описанного выше. В итоге мы получили данные о метилировании для каждой из 758 клеток отдельно. Мы использовали только те сайты CpG, которые были охвачены по крайней мере 5 чтениями и показали стабильные уровни метилирования (выше 0,8 или ниже 0,2). Затем мы случайным образом разделили клетки на две группы для каждой стадии эмбриона (всего 8 групп клеток). Мы вычислили средний статус метилирования для каждого сайта CpG каждой из 8 групп (ранее статус метилирования был переназначен на 0 или 1). Наконец, мы применили часы рДНК к 8 группам, так как это было бы для 8 образцов балк-секвенирования.
Применение часов DNAm человека к массивам данных метилирования 450K
Наборы данных были загружены из базы данных GEO. Мы переиндексировали данные в массив 27K и использовали сценарий R калькулятора Horvath DNAm, как описано в руководстве (TUTORIAL1). В случае наборов данных PSC мы анализировали только ESC, полученные из нормальных оплодотворенных бластоцист, и iPSC, полученные из нормальных клеток (то есть иммортализованные клетки были исключены).
Разработка часов мульти-тканевой рДНК мыши
Набор данных RRBS мышей с несколькими тканями (GSE120132) использовался для обучения и тестирования часов путем перекрестной проверки. Дополнительный набор данных RRBS мышей крови (GSE80672) был использован для тестирования образцов независимого исследования. Необработанные последовательности были загружены из базы данных SRA. Чтения были обрезаны, а качество отфильтровано TrimGalore! v0.6.4, а уровни метилирования экстрагировали с помощью Bismark v0.22.2. путем сопоставления с последовательностью рДНК мыши (BK000964.3). Были объединены файлы Fastq технических повторов. Мы использовали только сайты CpG (и только цитозины с положительной цепью), которые охватываются как минимум 50 чтениями во всех выборках обоих наборов данных. Мы использовали только C57BL / 6J из набора данных GSE120132 и пропустили образцы мышц, потому что мы наблюдали низкую возрастную корреляцию сайтов CpG мышечной рДНК (рис. S5). После фильтрации для обучения и тестирования оставалось 166 образцов (рис. S2A). Затем была проведена 5-кратная перекрестная проверка всех 166 образцов для различных лямбда-параметров ElasticNet (Scikit-learn v0.23.2), чтобы найти оптимальный параметр лямбда (рис. S1B). Мы повторно обучили окончательную модель (фактические часы) на том же наборе данных с оптимальным параметром (лямбда 0,0001) на случайных 80% всех выборок и протестировали на остальных выборках (рис. S1C, таблица S1). Наша окончательная модель показала производительность, аналогичную средней производительности перекрестной проверки. Однако тестирование модели на наборе данных перекрестной проверки может привести к завышению производительности. Чтобы решить эту проблему, мы также проверили нашу модель в независимом тесте. То есть мы проверили мульти-тканевые часы на 153 нормальных (контрольное питание, дикий тип) образцах крови C57BL / 6J (рис. S1C). Мы также применили его при возрастных заболеваниях (рис. S2).
Благодарности
Авторы благодарят Сун Хи Йим, Анастасию Шиндяпину, Маргариту Меер, Марко Мариотти, Максима Геращенко за обсуждение. При поддержке грантов NIH V.N.G.
Опубликовано: 12.03.2021г.
Обновлено: 25.06.2021г.
Авторы: Csaba Kerepesi, Bohan Zhang, Sang-Goo Lee, Alexandre Trapp, Vadim N. Gladyshev
Оригинальная статья: Epigenetic clocks reveal a rejuvenation event during embryogenesis followed by aging
Обновленная статья: Epigenetic clocks reveal a rejuvenation event during embryogenesis followed by aging (advances.sciencemag.org)
Перевод Ник Сестрин