Старение — сложный, многофакторный и почти универсальный процесс. А главное — пока не очень понятный. Еще менее понятно, но уж очень обнадеживает нестарение живых организмов. В этой статье поговорим о животных, для которых показан или только предполагается режим незначительного (пренебрежимого) старения. В качестве примера анализа этого феномена у конкретной группы организмов рассмотрим проверку популярных теорий старения на морских ежах, коснемся других долгожителей и оценим перспективы работы с такими животными. А на десерт «попробуем» пару специфических подходов к достижению пренебрежимого старения у людей. Во второй (отдельной) части статьи познакомимся с молекулярными особенностями грызунов-долгожителей и разберем механизмы их устойчивости к раку.

Рожденная в скафандре. Тихоходка — символ не вечной молодости, но уникальной для животных стрессоустойчивости: в состоянии ангидробиоза переносит замораживание до −272 °С, нагрев до 151 °С, огромные дозы ионизирующей радиации, высокое давление и вакуум. Вот таких и берут в космонавты! Однако стрессоустойчивость — ключ к долголетию и более «обычных» организмов. Рисунок «The Tardigrade Queen», художник Thomas A. Gieseke.
Организмы, не ощущающие груза прожитых лет
Термин «пренебрежимое старение» (negligible senescence) предложил Калеб Финч, пионер в области изучения нестареющих животных. Он же позаботился и о разработке критериев отнесения организмов в категорию пренебрежимо (чрезвычайно медленно) стареющих: с возрастом не должен повышаться темп их смертности и не должны заметно снижаться фертильность, физиологические возможности и устойчивость к болезням [1]. Но для биогеронтологических изысканий ценными считают любых животных с ранним плато на кривой смертности при аномально долгой для их веса и таксона жизни. В случае млекопитающих не менее ценный признак — отсутствие типичных для класса старческих недугов.
«Официально» подтвержденного списка пренебрежимо (незначительно) стареющих животных нет. Уважаемый тематический ресурс AnAge включил в эту категорию пока восемь организмов, однако число видов-кандидатов постоянно растет (табл. 1) — собственно, целенаправленно собирать информацию по ним начали только в конце прошлого века. Пренебрежимое старение вовсе не подразумевает бессмертие (замахнуться на него могут разве что модульные создания типа губок и гидроидных). Такие организмы, во-первых, «внезапно смертны» (как и все остальные — от болезней, травм, смены условий), а во-вторых, в преклонном возрасте на них могут действовать специфические факторы, часто связанные с их непрерывным ростом. Гигантским черепахам становится тесен панцирь, слишком тяжелого двустворчатого моллюска Arctica islandica проблемы с передвижением обрекают на голодную смерть, огромные рыбы проигрывают юрким мелким сородичам в конкурентной борьбе за пищу, азиатский слон лишается последнего набора зубов, кита подводит зрение... Тем не менее для животных с пренебрежимым (замедленным) старением не характерно экспоненциальное наращивание темпов смертности с возрастом.
жизни, годы |
||
| 1. Двустворчатый моллюск Arctica islandica |  |
|
| 2. Морской ёж Strongylocentrotus franciscanus |  |
|
| 3. Алеутский морской окунь, Sebastes aleutianus |  |
|
| 4. Европейский протей, Proteus anguinus |  |
|
| 5. Каролинская коробчатая черепаха, Terrapene carolina (черепахи Chrysemys picta (6) и Emydoidea blandingii (7) также живут больше 60 лет) |
 |
|
| Трубчатый многощетинковый червь Lamellibrachia luymesi |  |
|
| Тихоходка, Tardigrada («водяной медведь»)** |  |
|
| Галапагосская черепаха, Chelonoidis elephantopus |  |
|
| Альдабрская гигантская черепаха, Aldabrachelys gigantea |  |
|
| Гаттерия (туатара), Sphenodon punctatus |  |
|
| Сине-желтый ара, Ara ararauna |  |
|
| Какаду майора Митчела (какаду инка) Lophochroa leadbeateri |  |
|
| Темноспинный альбатрос, Phoebastria immutabilis |  |
|
| Азиатский слон, Elephas maximus |  |
|
| Гренландский кит, Balaena mysticetus |  |
|
| Косатка, Orcinus orca |  |
|
| Ночница Брандта, Myotis brandtii |  |
|
| Голый землекоп, Heterocephalus glaber |  |
|
| * Феномен пренебрежимого старения характерен и для растительного мира (это без учета клональных организмов). Например, найдены экземпляры межгорной остистой сосны Pinus longaeva, без функциональных проблем живущие около 5000 лет и даже дольше. Это восьмой организм, включенный в список AnAge. Не учтены в таблице потенциально бессмертные модульно организованные животные (например, губки и колониальные кишечнополостные), обладающие беспрецедентными способностями к регенерации [29]. ** Описано временное обретение тихоходками — микроскопическими первичноротыми животными из надтипа Ecdysozoa — жизнеспособности (возможности двигать ногами) после 120-летнего обезвоживания, полноценно же функционировать они могут спустя 10 лет анабиоза. Старение тихоходки покрыто мраком (в благоприятных условиях она живет несколько месяцев), однако механизмы ее неистребимости экстремальными факторами среды (например, гиперпродукция антиоксидантов) представляют немалый интерес и для геронтологии. | ||
Феномен пренебрежимого старения возникал в эволюции многократно — независимо в разных систематических категориях: есть среди незначительно стареющих и растения, и представители разных классов животных (рис. 1), причем даже в пределах одного семейства у каких-то видов развился этот признак, а у других — нет. Может показаться странным, но оценка максимальной продолжительности жизни и режима старения у того или иного животного представляет огромную сложность. Большая удача, если каких-то особей услужливо пометили, например, парочку веков назад — и они живут и здравствуют по сей день. На наблюдения за потенциальными долгожителями в защищенных условиях уходят десятилетия; по внешнему виду обычно сложно судить о возрасте таких животных. С морскими обитателями — некоторыми моллюсками и иглокожими — работать проще: их возраст определяют по годичным зонам роста твердых структур (раковин и панцирей), а подтверждают радиоуглеродным анализом.
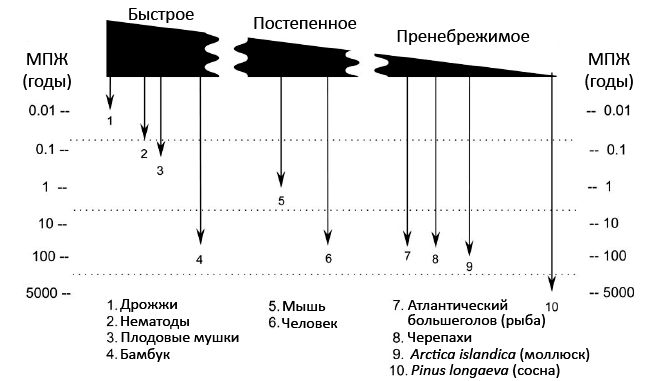
Рисунок 1. Диапазон продолжительности жизни и типы старения организмов. Очевидно, что МПЖ — максимальная продолжительность жизни — у организмов различается на порядки, а режим пренебрежимого старения (горизонтальная шкала) возникал в эволюции неоднократно — независимо у филогенетически удаленных организмов. Быстрое старение характерно, например, для дрожжей Saccharomyces cerevisiae (живут 2–4 дня при бесполом размножении), нематоды Caenorhabditis elegans (30 дней), мушки Drosophila melanogaster (60 дней), тихоокеанского лосося (3–6 лет), растений Phyllostachys bambusoides, P. nigra f. henonis (виды бамбука, МПЖ — 120 лет) и Puya raimondii (да, пуйя таки существует, хоть в ней и на одну букву больше, — это родственница ананаса, живущая до 150 лет). Постепенное старение наблюдается у мыши Mus musculus (МПЖ — 4,2 года) и человека (122,4 года). Пренебрежимым старением наделены: лучепёрые рыбы (алеутский морской окунь, атлантический большеголов, глубоководный солнечник, озерный осетр), живущие более 130 лет; черепахи (МПЖ некоторых >150 лет), двустворчатый моллюск Arctica islandica (авторы рисунка ориентируются на МПЖ 220 лет, но позже обнаружили и 507-летний экземпляр), межгорная остистая сосна (около 5000 лет) и многие другие организмы. Рисунок из [1], адаптирован.
Считают, что «наткнуться» на пренебрежимо стареющее животное вероятнее в экстремальных, но защищенных от врагов, нишах: стрессоустойчивость, по-видимому, общая черта долгожителей [2], а высокая ожидаемая продолжительность жизни способствует отбору детерминант долголетия. Примерную продолжительность жизни особей конкретного вида предсказывают по размеру (массе) тела животных. В общем случае удвоение видовой массы тела у наземных млекопитающих сопровождается 16-процентным продлением жизни. Разумеется, виды с пренебрежимым или замедленным старением (кстати, и человек) не оправдывают эти математические ожидания. К видам-долгожителям принято относить организмы, живущие в два и более раза дольше, чем это «предписано» их массой. Чаще медленно стареют, действительно, крупные животные, но определяющим здесь является развитый мозг. Португальский ученый Жуан Педро де Магальяйнш и его коллеги показали, что продолжительность жизни позвоночных прямо коррелирует с возрастом достижения половозрелости и обратно — с темпами постнатального развития (у млекопитающих, но не у птиц). А вот скорость метаболизма (с корректировкой на филогению и массу тела) не связана с продолжительностью жизни птиц и плацентарных млекопитающих [3].
Чем шире будет спектр обнаруженных и изученных организмов-долгожителей, тем яснее перспективы вмешательств в процесс старения человека. Схемы меж- и внутриклеточной сигнализации, системы поддержания стабильности генома и протеома, да и вообще клеточное устройство у всех животных сходны, а разница в продолжительности их жизни достигает нескольких порядков (рис. 1). Значит, разгадка может крыться в особенностях регуляции экспрессии генов и их полиморфизмах. И потому особенно ценны в качестве геронтологических моделей животные с замедленным старением, имеющие короткоживущих родственников и филогенетически близкие человеку. В этом смысле настоящим подарком стал голый землекоп — млекопитающее если не с пренебрежимым, то с сильно отсроченным старением, живущее минимум в 6-7 раз дольше мышей и крыс (особенности этого уникального грызуна мы обсудим отдельно.)
Еще до землекопа внимание биогеронтологов привлекли морские неколониальные обитатели — двустворчатые моллюски и морские ежи. Это промысловые животные, а ежи — еще и «подопытные» биологии развития с позапрошлого века, поэтому накопилось много сведений об их образе жизни, росте и размножении. Эволюционно они гораздо ближе человеку, чем черви или мушки, а моллюск Мин (1499–2006) — представитель вида Arctica islandica — вообще действующий чемпион по долгожительству среди животных. В то же время продолжительность жизни сильно варьирует в этих группах морских беспозвоночных [4], что делает их прекрасными объектами для сравнительного анализа механизмов поддержания жизни.
Пренебрежимое старение: рецепт морского ежа (пример исследовательского подхода)
Поскольку старение — процесс мультифакторый, какая-то одна теория, фокусирующаяся на определенном типе повреждений (не сетевая), не может объяснить и само старение, и его ничтожность. Однако часто биогеронтологи прибегают к «прогону» биологических особенностей пренебрежимо стареющего организма по самым популярным теориям — это упорядочивает структуру сравнительного анализа, дает хоть какие-то первоначальные ориентиры, а главное — испытывает сами теории старения на жизнеспособность. Таким образом выстроила свой аналитический обзор, посвященный основам долголетия морских ежей, и Андреа Боднар [5].
Теломерная теория
Теоретическая основа (главное положение теории): укорочение теломер ведет к старению клетки (посредством репликативного старения или геномной нестабильности) и организма в целом. Наоборот, стабилизация теломер за счет их регулярной достройки теломеразой дарует клеткам бессмертие [6]. Старение человека сопровождается сокращением длины теломер, дисфункция теломер ускоряет старение у мышей и людей, а активация теломеразы откладывает старение у мышей с дефицитом этого фермента.
Биологию теломер изучали у коротко-, средне- и долгоживущих видов морских ежей: Lytechinus variegatus (продолжительность жизни около 4 лет), Echinometra lucunter (40 лет) и Strongylocentrotus franciscanus (100-200 лет). Ни у одного из видов длина теломер с возрастом не уменьшалась, что, скорее всего, обусловлено постоянной активностью теломеразы. Более того, долгожительство у морских ежей вообще не связано с длиной теломер, даже наоборот: самыми длинными концевыми повторами располагает L. variegatus.
Вывод: репликативного старения у этих животных нет, потому искать истоки пренебрежимости их старения в биологии теломер не имеет смысла. Интересен, правда, один момент: при пожизненной активности теломеразы иглокожие редко страдают от неоплазии (рака). Значит, характерные для них механизмы репарации и (или) избавления от «клеток-изменниц» искать, безусловно, следует.
Свободнорадикальная теория
Теоретическая основа: активные формы кислорода вызывают накопление повреждений клеточных структур, играют ключевую роль в старении и определении продолжительности жизни. Окислительный стресс — результат дисбаланса между продукцией активных форм кислорода (АФК) — в митохондриях и не только — и профилактикой / элиминацией повреждений за счет работы антиоксидантных систем и механизмов репарации или утилизации поврежденных биомолекул [7–9]. Хотя в ряде исследований показано повышение с возрастом уровня окислительных повреждений в тканях многих организмов, пока не ясно, причина это или эффект старения.
Сравнение трех видов морских ежей с разной продолжительностью жизни не выявило у них возрастзависимого изменения общего уровня окислительных повреждений. Это можно объяснить пожизненно стабильной работой антиоксидантных систем и протеасом у этих организмов. Однако с годами в их тканях возрастает содержание липофусцина -флуоресцентного желто-коричневого «пигмента старения». Предполагают, что при интенсивном окислении белков системы протеолиза не справляются с их удалением, поврежденные белки «сшиваются» друг с другом и иными молекулами (в том числе в составе мембран органелл) — формируется конгломерат липофусцина, в котором помимо дефектных белков «консервируются» окисленные липиды, сахара и переходные металлы. Последние — особенно железо — образуют поверхность, способную к окислению-восстановлению, делая гранулы липофусцина сильными окислителями (а по некоторым данным, и стимуляторами апоптоза). Более того, подозревают, что липофусцин конкурентно ингибирует активность протеасом [10]. Всё это замыкает патологический круг.
У человека липофусцин обычно накапливается в лизосомах, и не «перевариться», ни вывестись экзоцитозом не может. Особенно страдают от этого постмитотические клетки типа нейронов. У морских ежей липофусцин накапливается не внутри, а вне клеток. Возможно, экспорт цитотоксичного «хлама» снижает уровень окислительных повреждений в клетках и позволяет протеасомам работать стабильно в любом возрасте. Правда, остается открытым вопрос, не мешает ли липофусцин тканям в целом? Авторы работы отмечают, что у короткоживущего L. variegatus уровень окислительных повреждений и содержание липофусцина были выше, чем у сородичей-долгожителей — то есть здесь связь окисления со старением, вроде бы, прослеживается. Однако изучаемые виды морских ежей обитают в абсолютно разных климатических условиях, что может объяснить различия в продукции АФК.
Вывод: связь окислительного стресса с продолжительностью жизни у морских ежей не очевидна и требует подтверждения (для корректного сравнения нужна другая выборка). В отличие от человека и классических модельных животных, антиоксидантные системы и протеасомы, утилизирующие окисленные белки, работают у трех видов иглокожих стабильно на протяжении всей жизни и без особой межвидовой разницы. Организаторы исследования считают, что есть смысл разобраться, почему L. variegatus производит больше АФК (раз другие уровни защиты от окислительного стресса «не сломаны»).
Теория генетической регуляции
Теоретическая основа: изменения в регуляции активности генов приводят к старению. Неоднократно показано, что у модельных животных и человека с возрастом меняется экспрессия многих генов (это уже обсуждалось на примере исследований Дж. Зан [11], см. статью «Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить» [12]). Причинно-следственные связи, опять же, не очевидны, не ясны до конца и комплексные изменения в интенсивности сигнализации по тем или иным путям при старении.
В 2012 году обнаружили некоторые возрастзависимые (и в основном тканеспецифичные) изменения транскрипционного профиля у морского ежа S. purpuratus [13]. Общим для трех исследованных тканей было повышение с годами активности генов сигнального пути Notch, а для двух тканей — снижение активности гена Wnt1 (чуть позже было показано дополнительное, рецепторзависимое подавление Wnt-сигнализации). Специфический баланс между этими важнейшими для развития организма сигнальными путями может определять способность к умеренной регенерации у зрелых S. purpuratus и вносить вклад в постоянный рост и высокую продолжительность их жизни (более 50 лет). Способность к регенерации не зависит от возраста у половозрелых морских ежей с разной продолжительностью жизни (S. franciscanus, S. purpuratus, и L. variegatus) и может обеспечиваться либо поддержанием приличного пула стволовых клеток (что пока не подтверждается), либо дедифференцировкой специализированных клеток в стволовые.
Описанный Дж. Заном как общий для разных ветвей филогенетического древа животных маркер старения — снижение экспрессии генов ЭТЦ — у S. purpuratus не работает (и это логично для видов с пренебрежимым старением): активность генов, связанных с продукцией энергии, у него стабильна, а в нервной ткани даже растет. Повышается и экспрессия некоторых генов протеасомной деградации, поддерживающей белковый гомеостаз.
Вывод: возрастзависимые изменения экспрессии генов у S. purpuratus выявлены, однако необходимо их сравнение с транскрипционными профилями других иглокожих.
Общий вывод: Способность к пожизненной регенерации тканей без допущения гиперпролиферации, ведущей к раку, — важнейшая особенность иглокожих-долгожителей, которая заслуживает сáмого пристального внимания геронтологов [5].
А. Боднар считает, что пренебрежимо стареющие морские ежи (S. franciscanus) и двустворчатые моллюски (A.islandica, Panopea abrupta) станут прекрасными модельными животными, особенно если подобрать им достойный «фон» — идентифицировать ближайших родственников, обитающих в сходных условиях: это позволит устранить «шум» при сравнении [4].
А что же предлагают другие животные?
К сожалению, сведения о молекулярных механизмах долголетия и онкорезистентности почти всех животных пока разрозненные и в основном гипотетические. Главные надежды возлагаются на системные исследования, сравнивающие клеточные процессы у разных возрастных когорт близкородственных видов, стареющих быстро vs. пренебрежимо. Для некоторых групп уже доступна аналитика по сопоставлению геномов. Чаще же приходится довольствоваться результатами, полученными на малых выборках и потому противоречивыми.
Помимо анализа иглокожих, коллектив А. Боднар попытался систематизировать доступные данные по двустворчатым моллюскам, к которым относится долгожитель-рекордсмен A. islandica [4]. Оказалось, что у этого вида после полового созревания антиоксидантная защита работает стабильно на протяжении всей жизни, в то время как у некоторых короткоживущих видов она постепенно ослабевает, страдает функция митохондрий, АФК образуется больше, растет доля окисленных белков. С другой стороны, отменное состояние митохондрий и белков у долгоживущих моллюсков контрастирует с накоплением продуктов перекисного окисления мембранных липидов (это может быть общим свойством организмов холодных вод, связанным с жирнокислотным составом их мембран) — и это никак не мешает им ставить возрастные рекорды. Еще один интересный момент — «старческий пигмент» липофусцин таки накапливается у A. islandica, но только в определенных участках тела, что минимизирует его влияние на функции тканей. Более позднее исследование показало, что моллюски-долгожители отличаются экстремальной устойчивостью к действию не только окислительных агентов, но и генотоксических веществ с разными механизмами повреждения ДНК [14]. Такая «мультистрессоустойчивость» может быть общим свойством пренебрежимо стареющих организмов.
С размерами и темпом укорочения теломер двустворчатых моллюсков пока ничего не ясно — кроме того, что теломераза у них «не отключается», — а различия в восприимчивости к раку пока связывают с полиморфизмом гена белка р53. Как ни странно, у представителей некоторых видов не фиксировали ни одного случая онкопатологии, в то время как их ближайшие родственники нередко гибнут от одного из двух видов рака — и гибнут в любом возрасте, связи заболеваемости со старением не прослеживается. Понятно, что антираковым механизмам невосприимчивых видов исследователи уделят особое внимание.
С другими долгожителями всё еще сложнее. Очевидная защищенность от хищников в зрелом возрасте у крупных черепах, их низкий уровень метаболизма и растянутое во времени развитие, способность длительно выживать в неблагоприятных природных условиях с дефицитом пищевых ресурсов — всё это вершина айсберга. Молекулярную же основу еще предстоит установить. Интересно, что выраженная активность теломеразы в соматических клетках характерна, вероятно, для многих, если не всех рептилий и амфибий. Еще определеннее это можно сказать о рыбах. Значит, холоднокровные используют иные механизмы защиты от рака, нежели репликативное старение, а их теломераза честно работает на рост и регенерацию — ведь многие виды растут до самой смерти, с сохранением способности к делению большинства соматических клеток.
Птицы и млекопитающие представляют особый интерес для геронтологии, и небольшие подвижки в раскрытии их молекулярных тайн уже есть.
Ночница Брандта. У этой насекомоядной летучей мыши наиболее впечатляющий «разрыв» между массой тела и продолжительностью жизни среди млекопитающих. Геном и транскриптомы ночницы секвенировали в 2013 году (кстати, «прочитанные» зверьки были российскими, а координатором проекта — Вадим Гладышев). Помимо ожидаемых приспособлений к образу жизни (эхолокации и гибернации) в ее ДНК обнаружили и особенности, в настоящее время уже вполне ожидаемые для долгожителя: мутации генов рецепторов к гормону роста (GHR) и инсулиноподобному фактору роста 1 (IGF1R). Ранее была показана связь дисфункции GHR с повышенной устойчивостью к диабету и раку у мышей и людей, а нокаута daf-2 — гена рецептора IGF1 у нематод — с продлением жизни червя Caenorhabditis elegans. Слабая чувствительность к гормону роста ведет к низкой секреции инсулина и подавлению «старческой» сигнализации, что должно способствовать устойчивости к диабету, раку и старению. Но не стόит забывать, что гормон роста выполняет и массу полезных функций. Участники проекта полагают, что именно обусловленные мутациями GH/IGF1-узла и сезонной спячкой изменения метаболизма вкупе с низким темпом размножения и защищенной средой обитания позволяют этим мелким рукокрылым доживать почти до полувека [15]. Однако в крупном сравнительном анализе генов этих рецепторов у разных видов рукокрылых и грызунов не удалось однозначно связать вариации GHR/IGF1R с долголетием летучих мышей и землекопов. [16]. Не исключено, что вклад в долголетие некоторых рукокрылых вносят особенности эволюции их митохондриальной ДНК, которые могут определять относительно низкую продукцию АФК и устойчивость к их мутагенному действию самόй мтДНК [17].
Птицы. Продолжительность жизни птиц сильно варьирует, но все они удивляют не только геронтологов, но и эндокринологов. Как и у бодрствующих летучих мышей, у птиц скорость метаболических процессов (и температура тела) очень высока, а живут они гораздо дольше наземных животных с подобными габаритами и умеренным «темпом жизни». Понятно, что обе группы лучше защищены от внешних угроз (некоторые птицы — еще и благодаря высоким интеллекту и социальности), но у них должны работать и внутренние механизмы долголетия. Интересно, что масштабное производство АФК, сопутствующее интенсивному обмену, птицам никак не вредит. Частично это пытаются объяснить, например, особыми свойствами их митохондриальных белков и ДНК и/или невысоким содержанием ненасыщенных жирных кислот в клеточных мембранах (невозможностью масштабного перикисного окисления мембранных липидов).
Но самое удивительное то, что концентрация глюкозы в плазме крови пернатых достигает 17 мМоль/л. Такой показатель мог бы довести человека до коматозного состояния, а у птиц нет и намека на диабетические симптомы. И хотя еще многое нужно подтвердить, завидную устойчивость тканей птиц к хронической гипергликемии объясняют вероятным отсутствием рецептора конечных продуктов гликирования (RAGE). Связывание этих продуктов с RAGE в эндотелии сосудов меняет работу сигнальных систем, активируя провоспалительные гены и вызывая перестройки базальной мембраны с последующим накоплением жидкости в тканях. Предполагают, что RAGE-сигналинг замешан в развитии не только осложнений диабета II типа, но и атеросклероза, болезни Альцгеймера и некоторых видов рака.
Зловредные лиганды рецептора активно образуются в крови на фоне высокого содержания сахаров путем неферментативного гликирования белков (реакция Майяра), причем с аминокислотами взаимодействует карбонильная группа сахара. Есть мнение, что у птиц не только нет рецептора RAGE, но и самих конечных продуктов гликирования образуется меньше. Показано, что в их крови содержится гораздо больше — по сравнению с млекопитающими — таурина и других свободных аминокислот, замечательных «ловушек» реактивных карбонильных групп. Кроме того, у птиц образуется меньше гликирующего агента метилглиоксаля, который к тому же может напрямую взаимодействовать с нервными окончаниями, участвуя в развитии симптомов диабетической нейропатии. Некоторые биологи полагают, что метилглиоксаль может быть ключевым посредником в схеме развития осложнений диабета, соответственно, и бороться с последними можно путем подавления продукции метилглиоксаля или очисткой крови от него [18].
Гренландский кит. Выводы по секвенированию генома и транскриптомов этого потенциального чемпиона по долгожительству среди млекопитающих были опубликованы группой де Магальяйнша в 2015 году. Особое внимание авторы уделили возможным причинам устойчивости кита к возрастзависимым заболеваниям, включая рак (при массе животного до 100 тонн, а значит, и мощнейшей клеточной пролиферации, механизмы онкоконтроля должны быть просто выдающимися!). Сравнение с ближайшим, но не слишком долгоживущим родственником показало, что из белков, связанных со старением и онкогенезом, наиболее своеобразны у гренландского кита гистондеацетилазы HDAC1 и HDAC2 и репарационная хеликаза XPB, или ERCC3 (excision repair cross-complementation group 3). Известно, что без последнего белка мыши стареют и умирают быстрее. Гистондеацетилазы — эпигенетические регуляторы, участвующие в изменении структуры хроматина, регуляции транскрипции и клеточного деления; их активность связывают с долголетием дрозофил.
Биогеронтологов также заинтересовали дупликации генов, связанных с трансляцией и убиквитин-протеасомной системой, митозом и стресс-ответом, а особенно — дупликации с мутациями в новых копиях генов PCNA (proliferating cell nuclear antigen) и LAMTOR1 (late endosomal/lysosomal adaptor, MAPK and MTOR activator 1). Продукт первого гена, кофактор ДНК-полимераз, участвует в репликации и репарации повреждений ДНК, второго — в регуляции TOR-сигналинга. Вносить вклад в устойчивость китов к раку может и утрата генов карбоксипептидазы А — CPA2 и CPA3: CPA-полиморфизм связывают с повышенным риском развития рака простаты у человека. [19].
Резюме и программа на будущее
Позднее плато на кривой смертности, соответствующее фазе пренебрежимого старения, характерно для многих стареющих животных, включая человека (хотя не все исследования это подтверждают). Ряд организмов почти не стареет или стареет чрезвычайно медленно — даже по сравнению с близкородственными видами. Вероятность их смерти не зависит от возраста: кривая смертности может выходить на плато уже после полового созревания. Молекулярные механизмы старения эволюционно древние, значит, установление способов переведения его в режим пренебрежимого у филогенетически различающихся модельных животных-долгожителей даст шанс на радикальное продление активной жизни человека и смещение заветного плато на ранний возраст.
Простым путь вряд ли будет: подобрать способ перепрограммирования настраиваемых миллионами лет систем, не чреватый серьезными побочными эффектами, сложно — об этом красноречиво свидетельствует ряд проваленных клинических испытаний лекарственных средств с миллиардными вложениями [20]. Потому «семь раз отмерять» придется на животных: оценивать изменения ключевых молекулярных и биохимических процессов у разных возрастных категорий организмов с пренебрежимым старением, сравнивать их транскриптомы и протеомы с таковыми ближайших короткоживущих родственников, выявлять точки возможных вмешательств, подтверждать их путем генетической модификации короткоживущих или традиционных модельных животных — изменится ли чувствительность к возрастным болезням или режим старения, не проявятся ли крайне нежелательные эффекты?
Вероятнее всего, вначале удастся перенести на человека результаты по борьбе с некоторыми заболеваниями (метаболическим синдромом, диабетом, аутоиммунными и нейродегенеративными патологиями, раком, атеросклерозом), а уж затем замахнуться на «нормальное» старение — хотя бы медикаментозно [21]. Тем не менее обнадеживающие результаты уже поступают из лабораторий, работающих как с классическими модельными организмами [22, 23], так и со стареющими пренебрежимо. Оптимистично настроенная часть геронтологов полагает, что при должных вложениях в технологии, замедляющие старение, мы можем стать последним поколением с относительно короткой жизнью или даже первым — со значительно продленной.
«Сделай сам»: оригинальные пути к пренебрежимости человеческого старения
Средняя продолжительность жизни человека за последний век существенно повысилась и продолжает расти — это факт. Защищенность от негативных внешних факторов, похоже, сыграла в этом главную роль: антибиотики, прививки, доступность ресурсов, защита от врагов и климатических стрессов... (Понятно, что не всем так повезло, но речь идет об усредненных процессах.) Это могло сказаться и на характере нашей эволюции. Есть мнение, что ранее у человека отбирались признаки, полезные для переживания видом какого-то случившегося катастрофического события, а не для долгой индивидуальной жизни. Но теперь, создав для себя особые условия, мы, возможно, ужé ступили на другой эволюционный путь — путь нестареющего вида [2].
Но ждать милости от природы слишком долго, пока же можно рассчитывать только на собственные технологии. Крупные современные проекты, нацеленные на коррекцию старения и связанных с ним патологий, основаны на разных, иногда диаметрально противоположных идеях.
Разработчик новой концепции старения Майкл Роуз (рис. 2, справа) с 1977 года и по сей день — но уже с помощью сотен коллег — управляет эволюцией лабораторных животных [24]. Такая эволюция называется экспериментальной. Она полностью контролируема и позволяет быстро и произвольно продлять или сокращать жизнь членов экспериментальных популяций в разных условиях, оценивать генетические и физиологические механизмы, которыми природа «включает» или «отключает» старение (делает его пренебрежимым), отслеживать побочные эффекты отбора по конкретному признаку. Коллективу Роуза путем откладывания начала размножения в череде поколений дрозофил удалось удвоить продолжительность их жизни и улучшить показатели здоровья. Этих насекомых назвали мушками Мафусаила. На очереди — мышки Мафусаила. В конце концов — по замыслу пионеров направления — результаты экспериментальной эволюции должны создать прочные основы для инженерных вмешательств в старение человека [25].
Мафусаиловы мыши, кстати, неплохо оплачиваются учредителем Фонда Мафусаила и премии M-Prize Обри ди Греем (рис. 2, слева). Для получения премии мышей-долгожителей можно вывести селекцией и генной инженерией, а можно омолодить уже взрослых особей или даже просто достойно поработать на поприще продления жизни. Премия вручалась уже четырежды. В частности, за рекордное продление мышиной жизни в 2003 году наградили профессора Анджея Бартке. Его мышь с незатейливой и очень рабочей кличкой GHR-KO 11C (от уже знакомого нам Growth Hormone Receptor) не дотянула всего неделю до своего пятилетия. Прожить 1819 дней ей (точнее, ему: рекордсменом оказался самец) позволил нокаут гена рецептора гормона роста [26]. Особь получилась карликовая, с пониженным уровнем IGF-1, инсулина и глюкозы в крови и повышенной устойчивостью к окислительному стрессу [27]. Этакий типичный для долгожителя фенотип!
Обри ди Грей — автор стратегии достижения пренебрежимого старения инженерными методами (SENS, Strategies for Engineered Negligible Senescence) — довольно неоднозначной и сомнительной в отношении скорой ее реализации и, в общем-то, настолько же экстравагантной, как и ее автор. Он считает, что существующий уровень знаний о механизмах старения (накопления повреждений) и возрастзависимых заболеваний достаточен для разработки человеческих омолаживающих техник. Дожидаться полного понимания причин старения ни к чему, да и вообще вмешиваться в множественные и переплетенные механизмы не стόит — результат непредсказуем. Потому надо сфокусироваться прямо на регулярной починке повреждений — но до того, как они нанесут непоправимый ущерб здоровью. Причем, по мнению ди Грея, требуют коррекции лишь семь классов «неполадок»: 1) потеря клеточной массы, атрофия тканей; 2) состарившиеся и более не делящиеся клетки, устойчивые к смерти; 3) раковые клетки (как единственный значимый продукт хромосомных мутаций); 4) мутации митохондриальной ДНК; 5) ригидность внеклеточного матрикса (утрата гелеобразной консистенции из-за сшивок белков); 6) внутриклеточные агрегаты («мусор»); 7) внеклеточные агрегаты. Биотехнологические подходы к решению этих проблем тоже предложены [28]. Однако SENS — гибкая стратегия, инженерные подходы будут меняться в зависимости от новой информации. Несмотря на то, что проект Обри ди Грея сильно раздражает некоторых респектабельных геронтологов, существующий уровень знаний не позволяет признать SENS ошибочной стратегией.

Рисунок 2. Активные борцы со смертью: Обри ди Грей (слева) и Майкл Роуз (справа)
ЧИТАЙТЕ ЧАСТЬ ll ЗДЕСЬ: Преодолевшие старение. Часть II. Дети подземелья
Литература
- Finch C.E. and Austad S.N. (2001). History and prospects: symposium on organisms with slow aging. Exp. Gerontol. 36 (4–6), 593–597;
- Федичев П. FAQ: Пренебрежимое старение. 7 фактов о животных, которые не знают старости. Портал «Постнаука»;
- de Magalhães J.P., Costa J., Church G.M. (2007). An analysis of the relationship between metabolism, developmental schedules, and longevity using phylogenetic independent contrasts. J. Gerontol. A Biol. Sci. Med. Sci. 62, 149–160;
- Bodnar A.G. (2009). Marine invertebrates as models for aging research. Exp. Gerontol. 44, 477–484;
- Bodnar A.G. (2015). Cellular and molecular mechanisms of negligible senescence: insight from the sea urchin. Invertebr. Reprod. Dev. 59, 23–27;
- биомолекула: «„Нестареющая“ Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе»;
- биомолекула: «Активный кислород: друг или враг, или о пользе и вреде антиоксидантов»;
- биомолекула: «Сказка-комикс о великой битве между радикалами и антиоксидантами»;
- биомолекула: «Старение: остановить нельзя смириться»;
- Höhn A. and Grune T. (2013). Lipofuscin: formation, effects and role of macroautophagy. Redox Biol. 1, 140–144;
- Zahn J.M., Sonu R., Vogel H., Crane E., Mazan-Mamczarz K., Rabkin R. et al. (2006). Transcriptional profiling of aging in human muscle reveals a common aging signature. PLoS Genet. 2 (7), e115. doi: 10.1371/journal.pgen.0020115;
- биомолекула: «Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить»;
- Loram J. and Bodnar A. (2012). Age-related changes in gene expression in tissues of the sea urchin Strongylocentrotus purpuratus. Mech. Ageing Dev. 133, 338–347;
- Ungvari Z., Sosnowska D., Mason J.B., Gruber H., Lee S.W., Schwartz T.S. et al. (2013). Resistance to genotoxic stresses in Arctica islandica, the longest living noncolonial animal: is extreme longevity associated with a multistress resistance phenotype? J. Gerontol. A Biol. Sci. Med. Sci. 68, 521–529;
- Seim I., Fang X., Xiong Z., Lobanov A.V., Huang Z., Ma S. et al. (2013). Genome analysis reveals insights into physiology and longevity of the Brandt’s bat Myotis brandtii. Nat. Commun. 4, 2212. doi: 10.1038/ncomms3212;
- Davies K.T., Tsagkogeorga G., Bennett N.C., Dávalos L.M., Faulkes C.G., Rossiter S.J. (2014). Molecular evolution of growth hormone and insulin-like growth factor 1 receptors in long-lived, small-bodied mammals. Gene. 549, 228–236;
- Munshi-South J. and Wilkinson G.S. (2010). Bats and birds: Exceptional longevity despite high metabolic rates. Ageing Res. Rev. 9, 12–9;
- Szwergold B.S. and Miller C.B. (2014). Potential of birds to serve as pathology-free models of type 2 diabetes, part 2: do high levels of carbonyl-scavenging amino acids (e.g., taurine) and low concentrations of methylglyoxal limit the production of advanced glycation end-products? Rejuvenation Res. 17, 347–358;
- Keane M., Semeiks J., Webb A.E., Li Y., Quesada V., Craig T. et al. (2015). Insights into the evolution of longevity from the bowhead whale genome. Cell Rep. 10, 112–122;
- Федичев П. Математика старения. Лекция на портале «Постнаука»;
- Федичев П. Лечение старости. Монолог на портале «Постнаука»;
- Proshkina E.N., Shaposhnikov M.V., Sadritdinova A.F., Kudryavtseva A.V., Moskalev A.A. (2015). Basic mechanisms of longevity: A case study of Drosophila pro-longevity genes. Ageing Res. Rev. doi: 10.1016/j.arr.2015.08.005;
- биомолекула: «Часы старения: обнулить, замедлить, обратить вспять?»;
- Rose M.R., Burke M.K., Shahrestani P., Mueller L.D. (2008). Evolution of ageing since Darwin. J. Genet. 87, 363–371;
- Научные тренды продления жизни. Обзор исследований в области биологии старения. Сайт фонда «Наука за продление жизни»;
- Cohen J. (2015). Death-defying experiments. Science. 350 (6265), 1186–1187;
- Bartke A. and Brown-Borg H. (2004). Life extension in the dwarf mouse. Curr. Top. Dev. Biol. 63, 189–225;
- A Reimagined research strategy for aging. Сайт фонда SENS Research Foundation;
- Еремеевский порог. Сайт Беломорской биологической станции МГУ имени М.В. Ломоносова.








































































