Иллюстрация: Sébastien Thibault
Мощная технология генного редактирования – это наиболее крупное открытие со времени ПЦР. Но с её огромным потенциалом приходят и вызывающие тревогу вопросы.
Автор: Heidi Ledford
Три года назад Брюс Конклин (Bruce Conklin) случайно обнаружил метод, который заставил поменять направление работы его лаборатории.
Конклин, генетик Глэдстоунского Института в Сан-Франциско, пытался понять, как вариации в ДНК влияют на различные заболевания человека, но его методики были очень неудобными. Когда он работал с клетками пациентов, было сложно понять, какие из последовательностей были важными для развития болезни, а какие – всего лишь фоновым шумом. И внесение мутаций внутри клеток было весьма дорогой и трудоемкой работой. «Это было предметом целой студенческой дипломной работы – изменить всего один ген», — рассказывает он.
После этого в 2012 году он наткнулся на описание новой технологии CRISPR, которая позволит исследователям быстро менять ДНК любого организма – включая человека. Немного позже Конклин забросил свой прежний подход к моделированию заболевания и позаимствовал новый. Теперь его лаборатория лихорадочно меняет гены, ассоциированные с различными болезнями сердца. «CRISPR переворачивает всё с ног на голову», — говорит он.
Эта «CRISPR-лихорадка» распространилась и на других: CRISPR вызывает серьезное потрясение в сфере биомедицинских исследований. В отличие от других методов редактирования генов, он дёшев, быстр и прост в использовании, и поэтому он и разошёлся по лабораториям всего мира. Исследователи надеются использовать его для корректировки человеческих генов в целях избавления от болезней, создания выносливых растений, уничтожения патогенов и многого другого. «Я увидел два действительно значимых события с тех пор, как вступил в науку: CRISPR и ПЦР (Полимеразная Цепная Реакция – прим. пер.)», — говорит Джон Шименти (John Schimenti), генетик из Корнельского университета (Итака, Нью-Йорк). Как и ПЦР, метод амплификации генов, совершивший революцию в генетической инженерии после его открытия в 1985 г., «CRISPR влияет на естественные науки во многих отношениях», — говорит он.
Но, несмотря на то, что CRISPR может многое предложить, некоторые учёные обеспокоены головокружительным темпом развития этой области, что оставляет мало времени для решения проблем этики и безопасности, которые могут вызвать такие эксперименты. Проблема оказалась в центре внимания в апреле, когда новостные ленты оповестили общественность об использовании учёными CRISPR в целях генетического модифицирования человеческих эмбрионов. Использованные эмбрионы уже не имели шансов родиться на свет, но сообщение стало причиной жарких дебатов по поводу того, как следует использовать технологию CRISPR для создания наследуемых изменений в геноме человека. Есть и другие опасения. Некоторые учёные хотят видеть больше исследований, которые бы показали, генерирует ли данная методика случайные и потенциально рискованные изменения в геноме; другие опасаются, что модифицированные организмы способны разрушить целые экосистемы.
«Эта мощь легкодоступна для лабораторий – теперь вам не нужно очень дорогое оборудование и людям не обязательно проходить длительную подготовку для овладения этой методикой», — говорит Стэнли Ки (Stanley Qi), системный биолог из Стэнфордского университета в Калифорнии. «Нам следует осторожно обдумывать то, как мы собираемся использовать такую мощь».
Революция в исследовании
Биологи уже долгое время могли редактировать геном при помощи молекулярных инструментов. Примерно десять лет назад они заинтересовались особыми ферментами — нуклеазами «цинковые пальцы», которые обещали редактировать геном аккуратно и эффективно. Но «цинковые пальцы», стоившие $5,000 и больше, были не очень широко распространены из-за своей дороговизны и неудобством в создании – так считает Джеймс Хэйбер (James Haber), молекулярный биолог из Брандейского университета в городе Уолтем, штат Массачусетс. CRISPR работает по-другому: фермент Cas9, используя РНК, манипулирует с целевыми ДНК, расщепляя их или встраивая нужные последовательности в них. Исследователям зачастую нужно заказать только фрагменты РНК; остальные компоненты можно купить самому. Итоговая цена: около $30. «Это сделало технологию гораздо более доступной, потому все её и используют», — делится своими мыслями Хэйбер. «Это большой прогресс».
Методология CRISPR быстро затмила собой нуклеазы «цинковые пальцы» и другие инструменты по редактированию (см. «Возвышение CRISPR»). Для некоторых это означает отказ от техник, на которые были потрачены годы для их улучшения. «Я подавлен», — говорит Билл Скарнес (Bill Skarnes), генетик из Хинкстона (Великобритания), — «но в то же время взволнован». Скарнес потратил немалую часть своей карьеры, используя технологию, внедрённую в середине 1980-х: встраивание ДНК в эмбриональные стволовые клетки и последующее использование этих клеток для создания генетически модифицированных мышей. Техника стала в лаборатории главенствующей, но она также была трудоемкой и дорогостоящей. CRISPR требует гораздо меньше времени, и, в конце концов, Скарнес принял эту технологию два года назад.
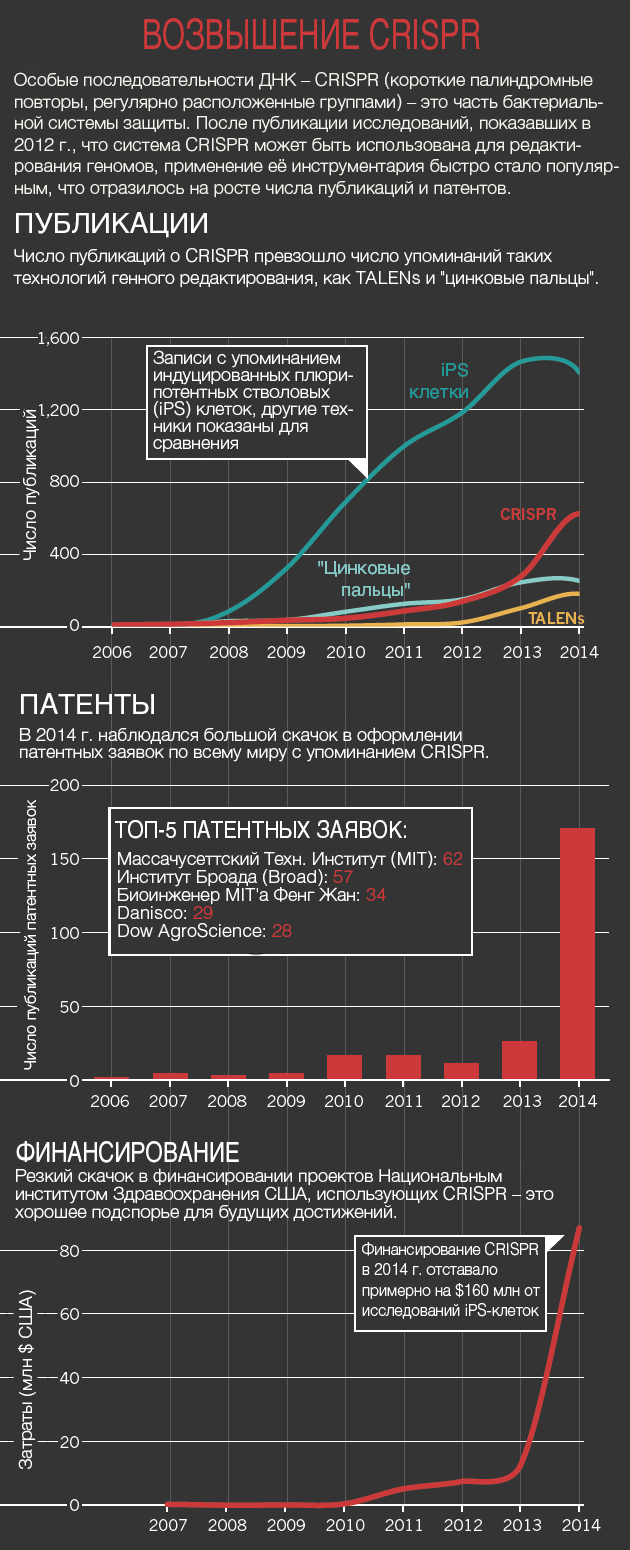
Публикации: Scopus; Patents: The Lens; Funding: NIH RePORTER.
Исследователи традиционно полагались на такие модельные организмы, как мыши и дрозофилы, частично потому что они были одними из немногих видов, которые хорошо подходили к набору инструментов для генетических манипуляций. Сейчас CRISPR делает возможным редактировать гены во многих других организмах. Например, в апреле исследователи Уайтхэдовского института доложили об использовании CRISPR для изучения Candida albicans, гриба, который является особенно смертельным для людей с ослабленной иммунной системой, но с которым было тяжело проводить генетические манипуляции в лаборатории. Дженнифер Доудна (Jennifer Doudna), первопроходец в изучении CRISPR, ведёт список CRISPR-модифицированных существ. На данный момент у неё есть записи о трёх дюжинах, включая вызывающих заболевания паразитов трипаносом и дрожжей, используемых для создания биотоплива.
Тем не менее, быстрый прогресс имеет и свои недостатки. «Люди просто лишены времени оценить некоторые базовые параметры этой системы», — говорит Бо Хуанг (Bo Huang), биофизик Калифорнийского университета. «Существует мнение, что до тех пор, пока это работает, мы не должны понимать, как и почему это работает». Это означает, что исследователи иногда наталкиваются на внезапную «аварию». Хуанг и его лаборатория два месяца боролись за то, чтобы адаптировать CRISPR для изучения изображений.
Он подозревает, что задержка была бы короче, если бы было больше известно о том, как оптимизировать конструкцию направляющих РНК (guide RNA) – базовый, но важный нюанс.
В общем и целом исследователи смотрят на эти пробелы как на небольшую цену за мощнейшую технологию. Но у Доудны начались более серьёзные беспокойства по поводу безопасности. Её опасения начались на встрече в 2014 г., когда она увидела презентацию работы одного пост-дока, в которой был спроектирован вирус для внесения компонентов CRISPR в мышь. Мышь вдохнула вирус, что позволило системе CRISPR индуцировать мутации и создать модель человеческого рака лёгких. Доудну хватила дрожь; небольшая ошибка в дизайне направляющей РНК могла повлиять на то, что CRISPR-система сработала бы и на человеческих лёгких, причём так же хорошо. «Мне показалось невероятно пугающим, что вы могли иметь студентов, которые работали с подобными вещами», — говорит она. «Очень важно понимать, что эта технология может совершить»
Андре Вентура (Andrea Ventura), онколог из Нью-Йорка и главный автор этой работы говорит, что его лаборатория тщательно рассмотрела вопросы безопасности: направляющие последовательности спроектированы для нацеливания именно тех областей генома, которые уникальны для мышей, а вирус был ослаблен, благодаря чему не мог реплицироваться. Он согласился, что очень важно предвидеть даже отдалённые риски. «Просто необходимо, чтобы всё было учтено».
Вычёркивая заболевания
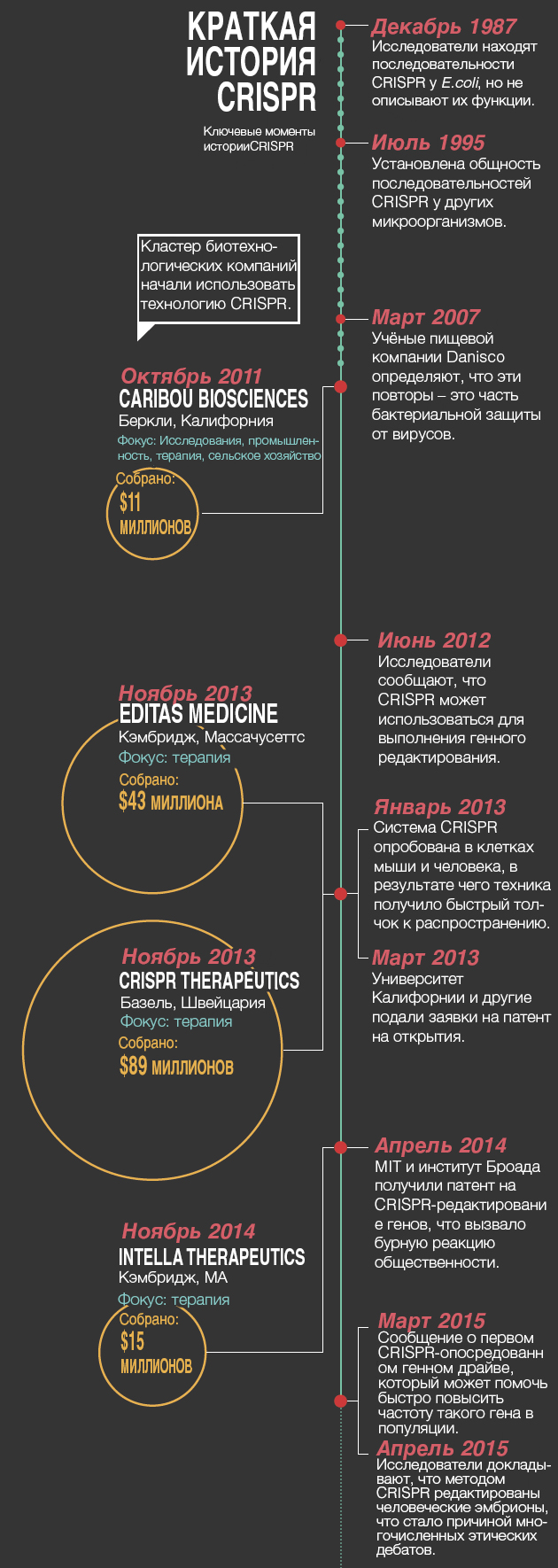
В прошлом году биотехнолог Дэниель Андерсон (Daniel Anderson) из MIT и его коллеги использовали CRISPR на мышах для корректирования мутации, ассоциированной с метаболическим заболеванием человека – тирозинемией. Это был первый случай применения CRISPR для закрепления вызывающей болезнь мутации во взрослом животном – и важный шаг в направлении использования данной методики для генной терапии человека (см. «Краткая история CRISPR»).
Идея о том, что метод CRISPR мог бы стимулировать сферу генной терапии – это главный источник волнения в научных и биотехнологических кругах. Но в дополнение к освещению его потенциала, исследование Андерсона показало, как далеко ещё надо плыть. Для доставки фермента Cas9 и её направляющей РНК в орган-мишень – печень – команде пришлось накачать большие объёмы жидкости в кровеносные сосуды, что обычно не представляется возможным для людей. И эксперименты исправили мутацию всего лишь у 0,4% клеток, что недостаточно, чтобы повлиять на многие заболевания.
За последние два года возникло несколько компаний, цель которых состояла в развитии основанной на CRISPR генной терапии, и Андерсон и другие сказали, что первое клиническое испытание подобного лечения может пройти в следующие год или два. Эти первые испытания, скорее всего, будут основаны на сценарии, при котором компоненты CRISPR будут инъецированы прямо в ткани, или же можно было бы выделить клетки из организма и после их модификации вернуть обратно. К примеру, стволовые клетки крови могут быть скорректированы при лечении серповидно-клеточной анемии или бета-талассемии. Было бы огромным успехом доставка ферментов и направляющих РНК внутрь многих тканей, но исследователи надеются, что техника в один прекрасный день будет использована для лечения более широкого спектра генетических заболеваний.
Многие учёные предупреждают, что ещё многое предстоит сделать, прежде чем CRISPR можно будет полностью безопасно и эффективно использовать. Учёным нужно повысить эффективность редактирования, но в то же время необходимо удостовериться, что это не вызовет изменения в любом другом регионе генома, связанного со здоровьем.
«Эти ферменты будут разрезать не в тех местах, для которых Вы их сконструировали, и это будет иметь последствия», — говорит Хэйбер. — «Если вы соберетесь заменить чей-то ген серповидно-клеточности в стволовой клетке, то вам следует спросить себя: ‘Какое повреждение ты можешь нанести в каком-либо другом сайте генома?»
Кит Янг (Keith Joung), изучающий способы редактирование генов в Бостоне, разрабатывает методы выслеживания off-target (мимо) разрезаний, осуществляемых белком Cas9. Он говорит, что частота таких разрезаний очень сильно варьируется от клетки к клетке и от одной последовательности к другой: его лаборатория наблюдала мимо разрезанные сайты с частотами мутации от 0,1% до более 60%. Даже события с низкой частотой появления могут быть потенциально опасными, если они ускоряют клеточный рост и ведут к канцерогенезу.
Учитывая такое количество вопросов без ответов, очень важно держать ожидания насчёт CRISPR под контролем, как считает Кэтрин Босли (Katrine Bosley), исполнительный директор Editas, компании в Кэмбридже, разрабатывающей методы CRISPR-опосредованной генной терапии. Босли – опытный специалист по коммерциализации новых технологий — говорит, что обычно наиболее тяжелая часть состоит в убеждении остальных в работоспособности какого-то подхода. «С помощью CRISPR всё почти наоборот», — говорит она. – «Сейчас столько азарта и поддержки, но мы должны оставаться реалистами по поводу требуемых ресурсов для достижения цели».
CRISPR на ферме

Иллюстрация: Sébastien Thibault
Пока Андерсон и остальные пытаются модифицировать ДНК в клетках человека, другие нацеливаются на сельские культуры и скот. До принятия техник генного редактирования довольствовались вставкой гена в геном в случайных позициях, вместе с последовательностями из бактерий, вирусов или других организмов, которые управляли экспрессией этого гена. Но такой процесс был неэффективен, и к тому же всегда находились критики, кому приходилось не по нраву смешивание ДНК от различных видов или у кого возникали опасения насчёт возможного нарушения работы других генов вследствие дефектного встраивания. Более того, получение генетически модифицированных культур, утверждённых для употребления, – это такая сложная и дорогостоящая процедура, что большинство из них – это такие значительные в рыночном отношении культуры, как кукуруза и соевые бобы.
Благодаря CRISPR можно ожидать изменения ситуации: простота и низкая стоимость могут сделать редактирование генома пригодной опцией для более мелких, особых культур, а также для животных. В последние несколько лет исследователи применяли этот метод для выведения маленьких хрюшек и пшеницы с рисом, устойчивых к болезням. Также они достигли прогресса в создании безрогого скота, резистентных к заболеваниям коз и обогащённых витаминами сладких апельсинов. Доудна считает, что её список CRISPR-модифицированных организмов продолжит пополняться. «У нас есть прекрасная возможность рассмотреть проводящиеся эксперименты или технические методики на тех растениях, которые не так важны с коммерческой точки зрения, но очень интересны для научной перспективы – или для овощных садов», — говорит она.
Способность CRISPR достаточно точно редактировать существующие ДНК-последовательности способствует более точным модификациям, но в то же время мешает орган контроля, надзора и регулирования и фермерам идентифицировать модифицированный организм после его выпуска. «Из-за генного редактирования у нас больше нет возможности отслеживать генно-инженерные продукты», — говорит Дженнифер Казма (Jennifer Kuzma) из университета штата Северная Каролина. «Будет непросто выявить, мутировало ли что-то естественным путём или с применением технологии».
Это настоящий звонок тревоги для противников генной модификации сельскохозяйственных культур, и это непростая проблема для стран, пытающихся разработать методы регулирования генного редактирования растений и животных.
В Соединённых Штатах Управлению по контролю качества пищевых продуктов и лекарственных препаратов (FDA) ещё только предстоит утвердить список всех генетически модифицированных животных, разрешённых для потребления человеком, и пока ещё неясно, как именно будут обращаться с такими животными.
Согласно действующим законам не все культуры, созданные путём геномного редактирования, потребуют регулирования со стороны Министерства сельского хозяйства США (см. Nature). Но в мае Министерство начало искать возможные пути улучшения методов регулирования генетически модифицированных культур – это шаг, который многие восприняли как знак того, что агентство проводит переоценку своих законов в свете таких технологий, как CRISPR. «Окно разбито», — говорит Казма. — «Всё, что проходит через окно, остаётся на виду. Но сам факт того, что оно именно разбито, весьма интересен».
Спроектированные экосистемы
Посмотрим, как обстоит дело за пределами ферм: исследователи пытаются решить, как можно или следовало бы применять CRISPR на организмах в дикой среде. Большое внимание сейчас заострено на методе под названием «генный драйв» [gene drive] (не путать с генетическим драйвом и, тем более, дрейфом – прим. пер.), который может способствовать быстрому распространению редактированного гена в популяции. Работа пока находится на своём начальном этапе, но такая технология может быть использована для уничтожения переносящих заболевания москитов, ликвидации инвазивных растений или искоренения устойчивости к гербицидам у сорняков, которые отравляют жизнь многим американским фермерам.
Обычно генетическое изменение в одном организме требует очень много времени для распространения во всей популяции. Это происходит из-за того, что мутация, расположенная на одной хромосоме из пары, наследуется только половиной потомков. Но генный драйв позволяет мутации, созданной благодаря CRISPR на одной хромосоме, копировать себя на гомологичную в каждом поколении, и в результате почти всё потомство унаследует изменение. Это означает, что его распространение в популяции будет экспоненциальным по сравнению с нормой (см. ‘Генный драйв’) – мутация, внесённая в москита, могла бы разойтись в большой популяции за один сезон. Если эта мутация уменьшала бы количество потомства комаров, то популяция, несущая в себе различных малярийных паразитов, могла бы быть уничтожена вместе с самими паразитами.

Но многие исследователи глубоко обеспокоены тем, что сведение на нет целой популяции может иметь неизвестные и даже радикальные последствия для экосистемы: например, могут появиться другие вредители, или же это может повлиять на хищников, стоящих выше по пищевой цепочке. Также учёные помнят и о том, что направляющая РНК может мутировать со временем так, что станет нацеливаться на другие части генома. Такая мутация может разойтись в популяции с непредсказуемыми эффектами.
«Метод должен иметь достаточно высокую отдачу, так как есть риск необратимости – и риск непреднамеренных и трудно просчитываемых последствий для других видов», — говорит Джордж Чёрч (George Church), биоинженер из Гарвардской медицинской школы в Бостоне. В апреле 2014 г. Чёрч и его команда учёных вместе с юристами написали комментарий в Science, предупреждая исследователей о рисках и предлагая пути защиты от случайного высвобождения экспериментальных организмов с генным драйвом.
В то же время генный драйв рассматривался в отдалённой перспективе. Но меньше, чем через год специалист по биологии развития Этан Бьер (Ethan Bier) из университета Калифорнии и его студент Валентино Ганц (Valentino Gantz) доложили о создании такой системы в дрозофилах. Бьер и Ганц использовали три уровня ящиков для содержания их мух и приняли необходимые меры безопасности, обычно используемые для комаров-переносчиков малярии. Но они не стали следовать всем указаниям, к которым призывали авторы комментария, таким как разработка метода для возвращения изменения в первоначальное состояние. Бьер отмечает, что они просто проводили свою первую проверку действенности эксперимента и хотели узнать, работает ли система вообще, прежде чем делать её более усложнённой.
Для Чёрча и остальных это было ясным предупреждением того, что доступность редактирования генома с помощью CRISPR может иметь неожиданные и нежелательные результаты. «Очень важно, чтобы национальные регулирующие органы и международные организации вязли это под контроль – действительно вязли под контроль», — говорит Кеннет (Kenneth Oye), политолог из Массачусетского технологического института и главный автор комментария в Science. «Нужно больше действий». Национальный исследовательский совет США создал комиссию для обсуждения генного драйва, начались также и другие обсуждения на высшем уровне. Но Кеннет обеспокоен тем, что наука движется со скоростью света, а эти нормативные изменения могут произойти лишь после полного испытания генного драйва.
Эта тема не очень простая и ясная . Микки Эвбанкс (Micky Eubanks), эколог насекомых из Техасского университета A&M, утверждает, что идея этой методики сначала его шокировала. «Моя первая инстинктивная реакция была: ‘О Боже, это ведь ужасно!’» – говорит он. – «Но когда подумаешь об этом немного дольше и взвесишь это вместе с изменениями окружающей среды, которые по нашей вине уже произошли и продолжают происходить, то это кажется каплей в море».
Некоторые исследователи видят уроки для CRISPR в других новых технологиях, что вызвали сильное волнение, беспокойство, а затем и разочарование, когда становятся заметны все начальные проблемы. Медицинский генетик Джеймс Уилсон (James Wilson) из университета Пенсильвании в Филадельфии был в центре растущего энтузиазма вокруг генной терапии в 1990-х — вот только свидетелем её падения, когда клиническое испытание пошло не так, как нужно, и в результате чего погиб молодой человек. Вся область исследований тогда вошла в штопор и лишь недавно начала восстанавливаться. Поле CRISPR ещё очень молодое. Уилсон говорит, что могут пройти годы, прежде чем весь потенциал метода будет реализован. «Технология находится на стадии разведки. Эти идеи должны побродить для начала».
Впрочем, и сам Уилсон подвергся «CRISPR-лихорадке». Он говорит, что скептически относился ко всем обещаниям, сделанным об этом до тех пор, пока его собственная лаборатория не начала пользоваться этой техникой. «В конечном счёте, это сыграет свою роль в терапии человека», — считает он. «Это невероятно захватывающе».
Источник: medach.pro
Перевод: Азат Муртазин
Редакция: Станислав Груздев
Картинки: Георгий Борисов









































































