Как лейкоциты с химерными рецепторами помогли добиться реальных успехов в лечении рака
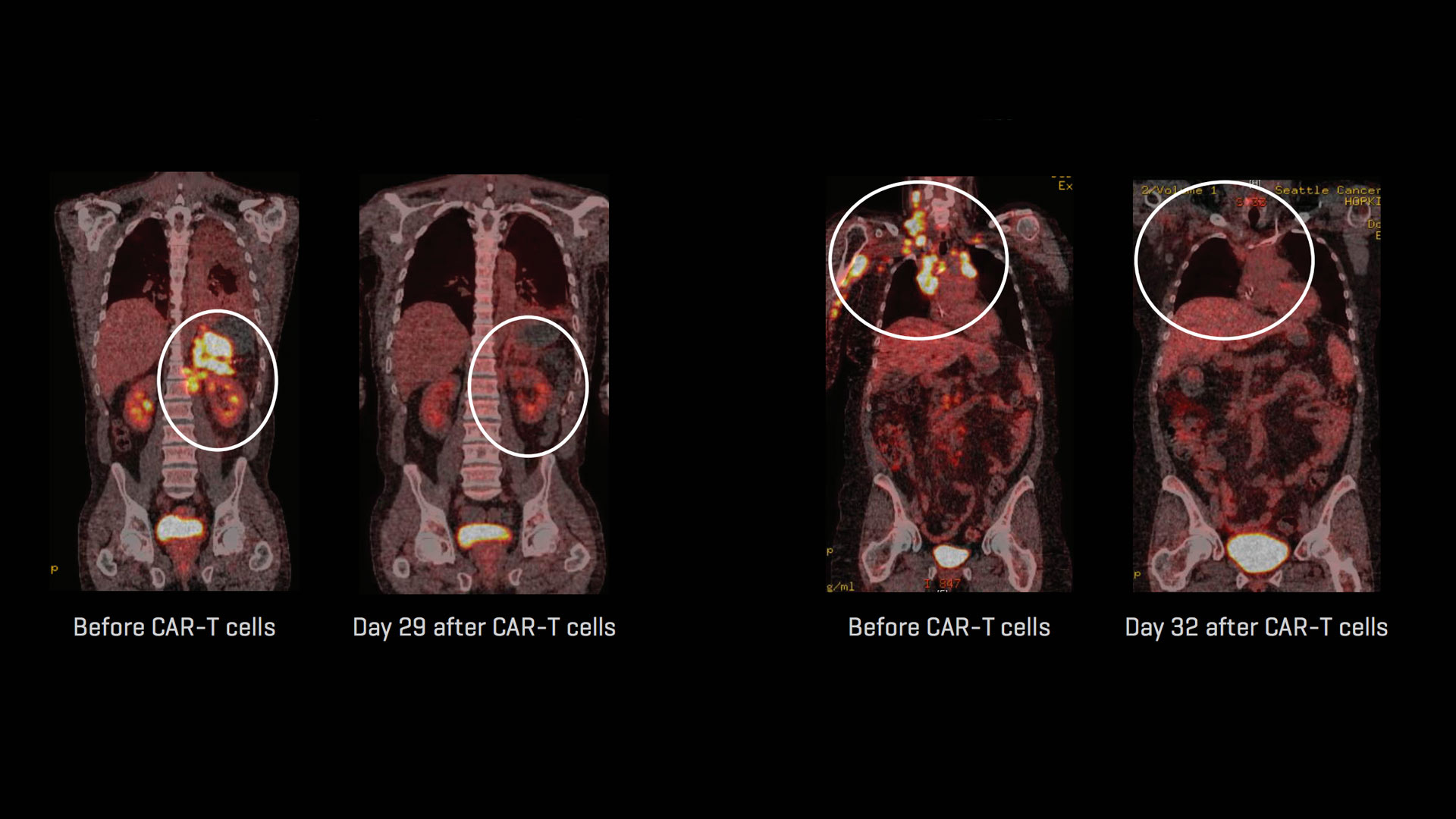
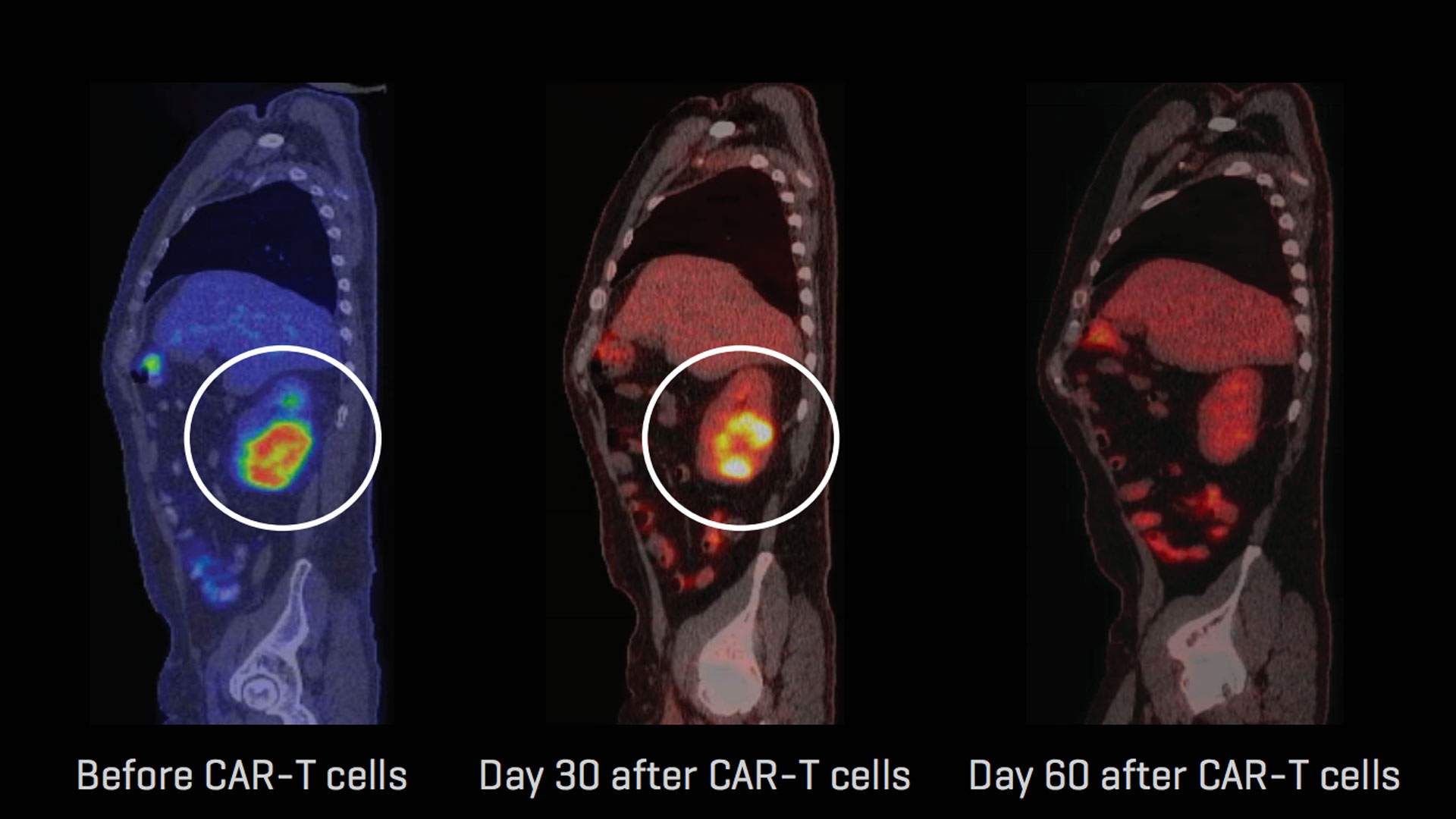
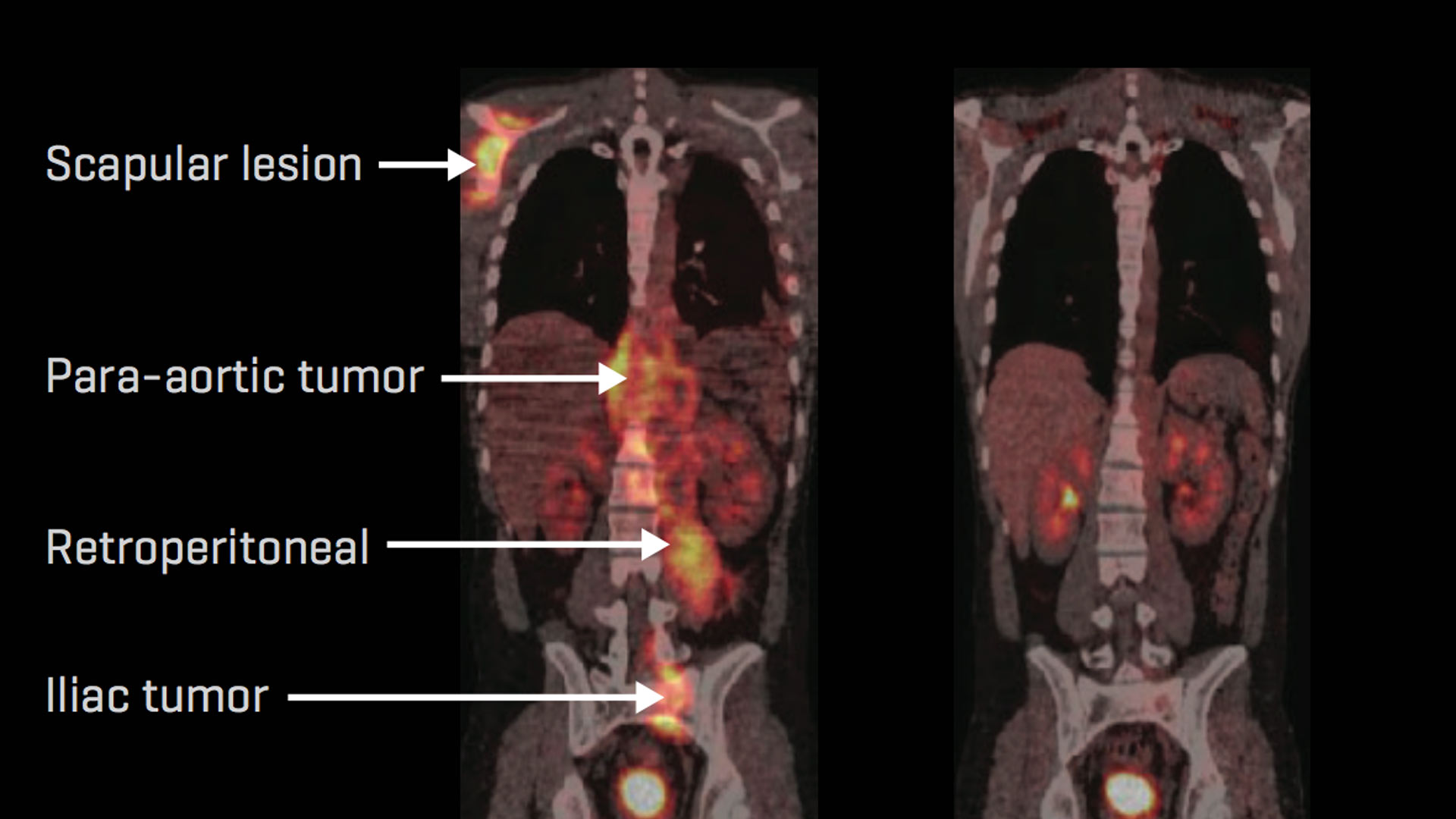
Медицина начала достигать реальных успехов в одной из самых сложных своих областей — лечении рака. В последнее время опубликованы результаты сразу нескольких клинических исследований, в которых удалось добиться полного излечения пациентов со злокачественными новообразованиями. Так, например, сотрудники Центра исследований рака имени Фреда Хатчинсона в Сиэтле сообщили , что в ходе эксперимента им удалось вылечить более половины пациентов с лейкозами, причем у некоторых из них полностью рассосались опухоли. Добиться таких результатов помогла технология химерных антигенных рецепторов. О том, что это такое, и стал ли рак наконец-то излечимым заболеванием, читайте в нашем партнерском материале с биотехнологической компанией BIOCAD.
Так что, можно говорить о настоящем прорыве в лечении рака?
Результаты испытаний впечатляют, но для того, чтобы их добиться, потребовалась многолетняя работа научных коллективов по всему миру. Идея создания химерных антигенных рецепторов (CAR, от англ. сhimeric antigen receptor) принадлежит химику и иммунологу Зелигу Эшхару из Института наук имени Вейцмана в израильском Реховоте. В его же лаборатории в 1989 году были получены первые трансгенные Т-лимфоциты с этими рецепторами.
Впервые их применили в небольших клинических испытаниях при раке яичника уже в 1996 году, правда, с весьма скромными результатами. Совершенствование технологии CAR длится десятилетиями, и число лабораторных, доклинических и клинических испытаний в настоящее время растет экспоненциально. По состоянию на конец 2014 года в мире было зарегистрировано 91 клиническое исследование с применением CAR-лимфоцитов, из них 58 — для лечения различных видов рака крови.
Как видно из новостей, нескольким исследовательским коллективам уже удалось добиться успехов на ранних стадиях испытаний. Растущий интерес к технологии CAR позволяет ожидать, что таких новостей будет становиться все больше и больше.
В чем суть такого лечения?
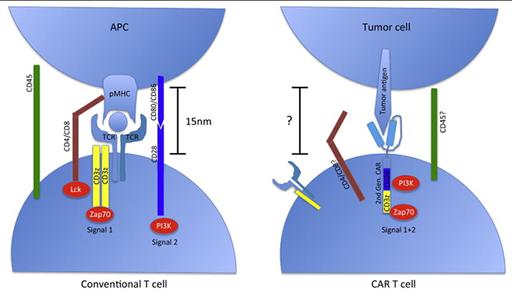
Главная особенность лечения с помощью трансгенных Т-лимфоцитов с CAR — это его специфичность. Химерный рецептор позволяет лимфоциту точно распознавать только опухолевые клетки, подлежащие уничтожению. Но просто распознать их — это мало, лимфоцит при этом должен активироваться, чтобы атаковать клетку-мишень. Для этого CAR содержит фрагмент, который активирует Т-лимфоцит при контакте с заданным типом клеток.
Что такое химерные рецепторы? Как вообще это работает?
Чтобы понять, как работают трансгенные лимфоциты, нужно сказать несколько слов об обычных. Природный Т-лимфоцит имеет на поверхности рецепторные комплексы, которые состоят из собственно Т-клеточного рецептора (TCR), связанного с сигнальным модулем CD3 (он состоит из трех частей: CD3δε, CD3γε и CD3ζζ, она же CD247). Все клетки организма имеют на поверхности белки главного комплекса гистосовместимости (МНС), которые «демонстрируют» иммунным клеткам фрагменты своих белков (антигенов). TCR распознает эти антигены, и если они чужеродны для организма, активирует лимфоцит посредством CD3. Активированный лимфоцит убивает зараженную клетку, или выделяет цитокины, привлекающие другие иммунные клетки.
Трансгенные лимфоциты вместо обычных рецепторных комплексов синтезируют искусственно созданные CAR. Химерными они называются, поскольку «собраны» в единую молекулу из разных по происхождению модулей. В самом простом случае их набор таков.
Внеклеточный антигенраспознающий домен представляет собой одноцепочечный изменяемый фрагмент моноклонального антитела (scFv). Он отвечает за связывание со специфичным антигеном на поверхности клеток-мишеней.
Гибкая шарнирная область (чаще всего используется шарнир иммуноглобулина G1). Необходима для отклонения антигенраспознающего фрагмента в стороны для облегчения его связывания с антигеном.
Трансмембранный участок служит для закрепления CAR на мембране лимфоцита и контакта внеклеточной и внутриклеточной частей рецептора. Как правило, является частью внутриклеточного домена.
Внутриклеточный сигнальный домен берется из T-рецепторного комплекса — это одна из цепей CD247 (CD3ζ). Его функция — активировать лимфоцит при связывании антигенраспознающего фрагмента с антигеном на поверхности искомой клетки.
Все эти модули собраны в одну аминокислотную последовательность, то есть кодируются одним геном. Такая конструкция рецептора позволяет целенаправленно активировать цитотоксические лимфоциты при контакте с клетками-мишенями (например, опухолевыми), не зависит от МНС и может распознавать любые антигены (не только пептидные).
Если это самый простой случай, какие тогда сложные?
Описанную структуру имеют так называемые CAR первого поколения. Во многих случаях одного CD3ζ для активации трансгенного лимфоцита недостаточно. Для этого к внутриклеточному домену химерного рецептора добавляют ко-стимулирующий фактор. Им может быть рецептор, индуцирующий выработку интерлейкинов, представители надсемейства рецепторов к фактору некроза опухоли, обеспечивающие пролиферацию и выживание T-лимфоцитов и продукцию ими цитокинов, и другие. Рецепторы с ко-активатором относятся к CAR второго поколения. CAR третьего поколения содержат несколько ко-активаторов одновременно.
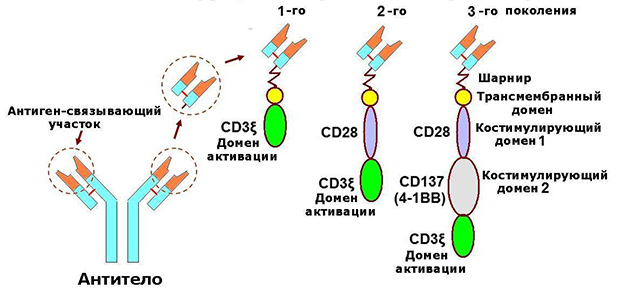
Строение CAR разных поколений
Такие рецепторы обеспечивают более эффективную и стабильную активацию лимфоцитов, усиливают и пролонгируют их цитотоксическое действие, а следовательно, производят более выраженный терапевтический эффект.
Кроме того, в лимфоциты можно вводить дополнительные трансгены, помимо кодирующих CAR, для придания им дополнительных свойств. Так, например, в работе сотрудников Центра Фреда Хатчинсона для лечения различных форм В-клеточных лейкозов использовались Т-лимфоциты, в которых помимо CAR, распознающего универсальный антиген В-лимфоцитов, экспрессировался ген укороченной формы рецептора эпидермального фактора роста человека (EGFRt), лишенного сигнального внутриклеточного домена, но сохранившего область связывания терапевтического антитела —цетуксимаба. Такая модификация позволяет легко отсортировать и сконцентрировать модифицированные CAR-лимфоциты на стадии подготовки клеточного препарата для инфузии, а при необходимости позволит уже из организма пациента быстро и специфично убрать CAR-T в случае возникновения побочных эффектов клеточной терапии.
А откуда берутся эти клетки? Их прямо в крови модифицируют?
Конечно, нет. У пациента забирают образец крови и с помощью приборов-сортеров выделяют из него нужную популяцию цитотоксических Т-лимфоцитов. Их культивируют на питательной среде, после чего добавляют в нее обезвреженный вирус (вектор), содержащий ген CAR, который специфичен для клеток опухоли пациента. В редких случаях используют другие способы доставки гена. Полученные клетки, экспрессирующие CAR, проходят дальнейшую культивацию, после чего их «включают» набором цитокинов и вводят пациенту. Такие индивидуально произведенные ex vivo CAR-T-лимфоциты называются аутологичными. Именно их используют в текущих клинических испытаниях.
В настоящее время ведутся работы по получению аллогенных клеток. Это те же Т-лимфоциты, но забранные от здорового донора. У них выключают собственный Т-клеточный рецептор, что снижает риск их атаки на клетки пациента, несущие на себе молекулы МНС, к которым этот рецептор может быть специфичен. Перед процедурой пациенту делают лимфодеплецию — устранение собственных клеток, способных снижать активность CAR-T-лимфоцитов. Она помогает на время избавиться от риска неэффективности терапии из-за атаки донорских клеток иммунной системой хозяина. Такой подход позволяет не изготавливать клетки индивидуально для каждого пациента, а иметь готовый клеточный препарат, что гораздо проще и удобнее.
Для введения трансгенов и в ауто- и в аллогенные клетки в подавляющем большинстве случаев используют лишенные вирулентности лентивирусы, к которым относится, например, ВИЧ. Они удобны тем, что имеют большую емкость (гены CAR весьма велики), способны встраивать трансгены в ДНК клеток, хорошо работают ex vivo и обеспечивает длительную экспрессию CAR. Кроме того, их относительно просто создавать, производить и очищать.
Лентивирусы? ВИЧ? Это, наверное, опасно?
Любой метод лечения сопряжен с риском, и задача разработчиков — свести его к минимуму. При создании вектора вирус модифицируют так, чтобы он не мог вызвать заболевание. Лимфоциты обрабатывают им вне организма, и когда их вводят пациенту, трансген уже встроен в ДНК. Он не может служить для синтеза вирусных белков и нуклеиновых кислот, то есть для продукции вирусных частиц, способных инфицировать другие клетки.
Неужели лечение с помощью CAR совсем безвредно?
По итогам проведенных и проводимых клинических испытаний можно сказать, что терапия CAR-T-лимфоцитами в целом переносится хорошо. Однако не обходилось и без серьезных побочных эффектов, основные их которых — синдром выброса цитокинов и нетаргетный эффект.
Синдром выброса цитокинов («цитокиновый шторм») — это одновременное выделение большого количества медиаторов иммунитета в ответ на введение трансгенных клеток. Он проявляется резким повышением температуры, ознобом, рвотой и диареей. Это состояние требует интенсивной терапии, но в условиях клиники, как правило, излечимо.
Нетаргетный эффект заключается в атаке CAR-T-лимфоцитов на здоровые клетки. Он возникает из-за того, что антигены опухолей могут в той или иной степени экспрессироваться другими тканями организма. Для преодоления этого эффекта разработано несколько подходов, о которых рассказала заведующая лабораторией генной терапии BIOCAD Наталья Белозерова.
Один из них — использование мультиспецифичных CAR-клеток. Они экспрессируют не один химерный рецептор, а два или более, которые связываются с разными антигенами опухоли. Активация лимфоцита происходит только в том случае, если клетка-мишень обладает полным набором таких антигенов. Возможен и обратный вариант — если антиген основного CAR присутствует и у опухоли, и у какой-либо разновидности здоровых клеток, дополнительный рецептор (в этом случае он называется ингибиторным) распознает белок — маркер нормальной ткани и блокирует активацию лимфоцита.
Еще одна технология снижения нетаргетной цитотоксичности — создание CAR, активация которых приводит не к непосредственной его атаке на клетку, а к экспрессии трансгенных цитокинов, привлекающего в опухолевую ткань различные иммунные клетки организма .
Также снизить риск при лечении CAR-T-лимфоцитами можно, встроив в ген рецептора регулятор экспрессии (промотор), который активируется только в присутствии определенного низкомолекулярного вещества (чаще всего лекарственного препарата) или оптического излучения с заданной длиной волны.
Кроме того, существуют технологии «аварийного отключения» трансгенных лимфоцитов в случае развития побочных эффектов. К примеру, введение в них дополнительного трансгена, экспрессирующего белок апоптоза — каспазу, вызывающую гибель клетки при введении пациенту низкомолекулярного активатора.
Разрабатываются и другие технологии повышения эффективности и снижения риска терапии CAR-T-лимфоцитами.
И что, в перспективе такими клетками можно будет вылечить любую злокачественную опухоль?
Теоретически, технологию CAR можно применить для лечения любой формы рака. Главная задача — найти высокоспецифичные мишени, то есть антигены, присущие только заданной разновидности опухолевых клеток. Поиск таких мишеней продолжается постоянно.
В настоящее время большинство CAR создается и испытывается для лечения разных форм рака крови. Это связано с тем, что лейкоциты имеют сравнительно небольшое количество высокоспецифичных антигенов, то есть разработать для них эффективный и безопасный химерный рецептор проще. В-лимфоциты, к примеру, экспрессируют различные маркеры на разных стадиях развития, что позволяет сделать терапию еще более прицельной.
С различными видами рака других тканей сложнее — антигенов у них больше, и многие из них присутствуют на здоровых клетках. Кроме того, такие опухоли часто неоднородны по антигенному составу из-за высокого уровня мутаций клеток. Тем не менее, создаются CAR и для них (меланомы, опухолей молочной железы, легких, мозга и других органов), причем многие из них уже проходят доклинические и клинические испытания.
По мнению руководителя отдела перспективных исследований биофармацевтической компании BIOCAD Александра Карабельского, лечение негематологических опухолей, скорее всего, будет комбинированным — помимо CAR потребуется как минимум использовать дополнительные трансгены или антитела.
Ну хорошо, трансгенные лимфоциты уничтожили опухоль, а что они будут делать дальше?
То же, что и обычные лимфоциты — находиться в организме и ждать своего часа. Часть их, конечно, со временем погибнет, но, судя по текущим наблюдениям, они обнаруживаются у пациентов через десятки лет после введения. А пока они есть, человек той формой рака, от которой он излечился, больше не заболеет.
Отлично, и когда лечить с помощью CAR будут в каждой больнице?
К сожалению, нескоро. Технология, хотя и бурно развивается, пока находится в стадии ранних экспериментов и нуждается в дальнейшем совершенствовании с последующими длительными испытаниями.
Нельзя забывать и то, что технология CAR защищена целым рядом патентов. Причем составлены они так, что пока не очень ясно, как вообще можно будет продавать разработки на ее основе. Как отметил Александр Карабельский, вполне вероятно, что правомочность столь широкого действия патентов многие крупные биофармацевтические компании будут оспаривать в суде.
Немаловажно и то, что пока применение CAR очень дорого. Лечение одного пациента аутологичными клетками обходится более чем в 100 тысяч долларов. Разумеется, с развитием технологии и увеличением масштабов ее применения она будет дешеветь, но широко доступной в ближайшее время она точно не станет.
20.04.2016 Источник: nplus1.ru