Биологи из США, Швеции и Китая создали новую версию популярного геномного редактора CRISPR/Cas9, которая позволяет фактически безошибочно удалять мутации длиной всего в одну "букву" ДНК и исправлять ошибки в генах.
Молекулярные биологи из США, Швеции и Китая создали новую версию популярного геномного редактора CRISPR/Cas9, которая позволяет фактически безошибочно удалять мутации длиной всего в одну «букву» ДНК и точечно исправлять ошибки в генах, говорится в серии статей, опубликованных в журнале Nature.
«Эти белки можно назвать самым продвинутым, острым и точным генетическим скальпелем, который позволит нам проводить самые деликатные геномные «операции» в самых труднодоступных клетках. Он станет незаменимым помощником для биоинженеров и ученых и, возможно, в конечном итоге войдет в клиническую практику и позволит нам собирать уникальные «авторские» геномы, в том числе и в клетках человека», – прокомментировал открытие Крис Саха (Chris Saha) из университета штата Висконсин в Мэдисоне (США).
Геномный редактор CRISPR/Cas9, названный главным научным прорывом 2015 года, был создан американским ученым Фэнем Чжаном (Feng Zhang) и рядом других молекулярных биологов примерно три года назад, и с тех пор он пережил несколько модернизаций, которые позволяют ученым использовать его для редактирования генома со стопроцентной точностью.
Главным недостатком этой системы модификации генома, как пишут участники сразу трех научных групп, являлось то, что CRISPR/Cas9 позволяет редактировать участки ДНК длиной в несколько десяток «букв». Подобный «блоковый» характер редактирования не мешает опытам по созданию новых трансгенных организмов, но он избыточен и даже вреден для медицинских целей – зачастую исправление того или иного гена требует точечного удаления или замены всего одной «буквы»-нуклеотида.
Дэвид Лиу (David Liu) из Гарвардского университета, Эммануэль Шарпентье (Emmanuelle Charpentier) из университета Умеа (Швеция) и Чживей Хуан (Zhiwei Huang) из Технологического института Китая (Харбин) нашли два способа избавить CRISPR от этого недостатка.
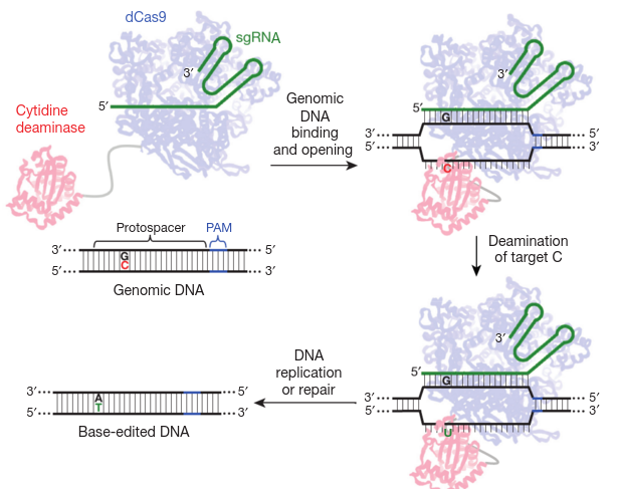
Первый из них заключается в том, что ученые «приклеили» белок CRISPR к другому ферменту, который преобразует один тип нуклеотидов в другой (цитозин в тимин в данном случае), благодаря чему, используя обычные «шаблоны» участка с неправильным нуклеотидом, его можно использовать для исправления единичных опечаток (Komor et al., Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage).
Второй способ состоит в том, что вместо Cas9 используется другой бактериальный белок Cpf1, который Шарпентье (Fonfara et al., The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA) и Хуан (Dong et al., The crystal structure of Cpf1 in complex with CRISPR RNA) независимо друг от друга выделили из организма двух разных микробов – внутриклеточного паразита Francisella novicida и бактерии микрофлоры Lachnospiraceae. Он особым образом взаимодействует с РНК-«шаблонами», по которым осуществляется редактирование генома, позволяя им содержать минимальное число букв. Пока ученые не приспособили этот белок для редактирования генома, но они уверены, что у них это получится сделать.
Главной особенностью обоих методов является то, что применение подобных вариаций CRISPR не приводит к появлению двухнитевых разрывов в спирали ДНК после удаления неправильной «буквы», что обычно провоцирует появление еще большего числа мутаций. Это дает надежду на то, что в ближайшее время человечество получит медицинский инструмент, способный удалять точечные мутации из генома человека, часто являющиеся причиной развития рака и целого ряда тяжелых врожденных болезней.
Редактирование генома добралось до точечных мутаций
Биологи из Гарвардского Университета модифицировали метод редактирования генома с помощью системы CRISPR/Cas9 таким образом, что теперь точечные изменения в ДНК можно вводить без разрезания ее нитей, которое может быть опасно само по себе. Новая методика подразумевает исправление точечных мутаций гораздо более прямым путем, чем это делалось до сих пор. Работа опубликована в журнале Nature.
Ранее схема редактирования генома как в случае точечных мутаций, так и при внесении больших вставок или делеций, была одной и той же. Ученые вводили в клетку направляющую последовательность РНК, которая должна была найти ген-мишень, а также фермент-ножницы, способный разрезать ДНК в том месте, где укажет направляющая последовательность.
Появление разрыва стимулирует клетки как можно быстрее от него избавится. Если после разрыва у клеточных ферментов нет «под рукой» подходящего образца для восстановления цельной последовательности, то происходит простое скрепление разорванных концов нити ДНК (путь non-homologous end joining). Такой путь опасен тем, что ферменты могут случайно вводить лишние основания, сбивая аминокислотную рамку считывания гена.
Если задача исследователей заключается в том, чтобы просто «сломать» ген — такая неаккуратность ферментов работает в пользу ученых. Но если цель в том, чтобы точечно заменить один нуклеотид на другой (как в случае многих наследственных заболеваний), или ввести новую последовательность, то необходимо снабжать клетки правильной последовательностью-образцом. Такая последовательность, если она достаточно похожа на разорванную, заменяет ее собой — этот процесс называется гомологичной рекомбинацией. Снабжая клетки одновременно ферментом-ножницами с направляющей РНК и последовательностью-образцом с нужной мутацией, можно вводить в геном точечные или любые другие изменения.
Проблема в том, что реальная эффективность рекомбинации невелика (не более десятка процентов) и для точечных мутаций сильно избыточна и переусложнена. Поэтому авторы статьи изобрели новый подход к внесению точечных мутаций. Он, как и классический CRISPR/Cas9, на первом этапе включает поиск геномной мишени за счет направляющей РНК, но разрыва в нее не вносится. Вместо этого один нуклеотид прямо заменяется на другой с помощью прикрепленного к Cas9 специального фермента.
В своей работе авторы приводят такую схему. Один из нуклеотидов пары GC сначала лишается аминной группы — цитозин превращается в урацил (C→U). Образуется неправильная пара GU. Такие пары может находить система точечной репарации (это отдельная клеточная система, не связанная с репарацией разрывов), и вырезать один из нуклеотидов. Если из «неспаренной пары» вырезается G, а не U, то в конце концов мы получаем ген, где на месте исходной пары GC появился новый AU (или AT, в генетическом смысле это одно и то же).
Из двух оснований «неспаренной пары» одно, предназначенное к удалению, выбирается ферментами случайно, если только речь не идет о свежесинтезированной ДНК. Однако ученые смогли сдвинуть случайность в нужную сторону, внеся одноцепочечные разрывы только в одну из двух цепей ДНК за счет остаточной активности Cas9. В результате ученые добились замены последовательности у 15-75 процентов клеток в культуре на нужную. При этом уровень ошибок (когда разрыв в ДНК все-таки происходил и он заканчивался простым склеиванием ДНК) составил менее одного процента случаев. Основным недостатком нового метода является то, что для каждого типа изменения, которое нужно ввести в ДНК, требуется подобрать свой собственный набор ферментов. Новый метод пока позволяет менять только пары CG на AT. Для того, чтобы ввести обратную мутацию, требуется использовать другие ферменты и, возможно, другой подход. Тем не менее, это потенциально позволяет лечить многие генетические болезни, очень большая доля которых связана как раз с такими точечными мутациями.
Источник: nplus1.ru