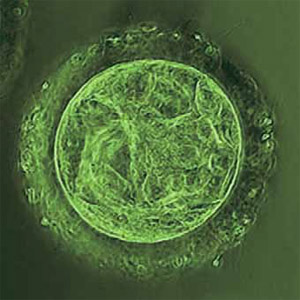
Наша жизнь – это бесценный дар. Как и сама способность подарить жизнь новому человеку, продолжить свой род. Однако сейчас в мире живет около пятидесяти миллионов семейных пар, которым природа отказала в возможности стать родителями. «Оспорить» этот приговор и дать возможность тысячам людей познать радость отцовства и материнства могут новые репродуктивные технологии, основанные на последних достижениях генетики, молекулярной биологии, иммунологии и других смежных наук.
Всемирная организация здравоохранения определяет бесплодие как неспособность пары репродуктивного возраста к зачатию и вынашиванию плода в течение года или более регулярных незащищенных сексуальных отношений. Абсолютно достоверную оценку уровня бесплодия в отдельных странах и регионах нельзя получить по вполне понятным причинам, однако по данным ВОЗ этот показатель составляет около 5% репродуктивной человеческой популяции. Таким образом, сегодня только в России должно жить не менее 3 млн человек, бесплодных по объективным медицинским показателям, т. е. в силу анатомических, генетических, эндокринных, иммунологических и других факторов. Эти цифры подтверждаются данными мониторинга, проведенного в 2011 г. совместными усилиями Росстата, Минздрава РФ, Фонда ООН в области народонаселения и ряда других организаций, согласно которому почти 5% респонденток, когда-либо состоявших в браке, сообщили, что им или их партнерам ставился диагноз «бесплодие» (Сакевич, 2013).
Значимого роста уровня бесплодия в мире и в нашей стране не выявлено, однако для каждой отдельно взятой семейной пары оно остается трагедией. Неудивительно, что число обращений в медицинские учреждения по этому поводу увеличивается, что связано, с одной стороны, с ростом уровня образования и благосостояния, а с другой – с быстрым развитием так называемых вспомогательных репродуктивных технологий (ВРТ), призванных помочь бесплодным парам справиться с проблемой. Однако зарождение жизни – процесс гораздо более сокровенный и фундаментальный, нежели простое выполнение инструкций в рутинной последовательности методик, что делает искусственное оплодотворение непростой задачей.
Простая тайна жизни
В норме у каждой женщины за один месяц созревает одна, максимум две яйцеклетки. Каждая яйцеклетка окружена оболочкой и слоем питающих ее кумулюсных клеток, в промежутках между которыми расположено межклеточное вещество, состоящее в основном из гиалуроновой кислоты. На поверхности каждого нормального сперматозоида находится специальная клеточная структура – акросома, которая содержит фермент гиалуронидазу, разрушающий гиалуроновую кислоту.
Как известно, для оплодотворения яйцеклетки нужен только один сперматозоид, но чтобы оплодотворение стало возможным, в процессе обязательно должны участвовать сотни мужских половых клеток. Когда сперматозоиды достигают яйцеклетки, они совместными усилиями сначала растворяют то самое межклеточное вещество оболочки яйцеклетки. Множество сперматозоидов опустошают свои акросомы, содержащие гиалуронидазу, усердно старясь пробуравить защитный слой яйцеклетки с помощью поступательных движений хвоста.
В итоге остается совсем тоненькая оболочка, которую и прорывает случайным образом оказавшийся в нужное время и в нужном месте один из сперматозоидов. Этот самый удачливый сперматозоид и оплодотворяет яйцеклетку. Одновременно с проникновением сперматозоида в яйцеклетке формируется оболочка, которая препятствует проникновению других сперматозоидов. Всё, процесс оплодотворения завершен. Дальше начинается развитие эмбриона, который примерно через семь дней должен прикрепиться к поверхности маточной полости матери.
Редактируя природу
Мужское и женское бесплодие отмечается примерно в равном числе случаев. У женщин его причинами чаще всего становится нарушение процесса овуляции – формирования зрелых яйцеклеток, непроходимость маточных труб, а также такое заболевание как эндометриоз. Самая распространенная причина мужского бесплодия – нарушение сперматогенеза: снижение концентрации, активности понижение качества сперматозоидов. Показательный факт: по данным специалистов ВРТ Москвы, уже сейчас подавляющее большинство мужчин российской столицы имеют отклонения в показателях спермы, и эта тенденция справедлива для любого крупного города. Более того, снижение качества спермы относительно минимальных критериев, установленных ВОЗ, зафиксировано во многих регионах России, в том числе и удаленных от мегаполисов (Осадчук и др., 2012).
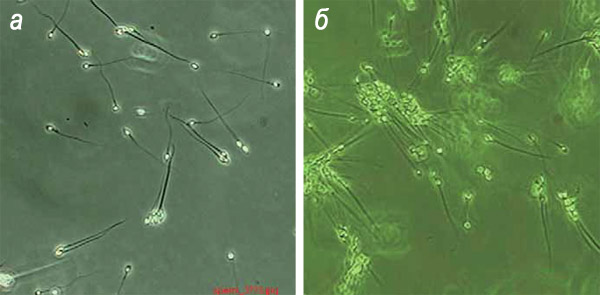
Так выглядят сперматозоиды человека перед отбором для искусственного оплодотворения: а – нормальные; б – с отклонениями (явление агглютинации – головки слипаются между собой)
В последние годы заметно выросло и число молодых пациентов, обращающихся за помощью к специалистам ВРТ. К сожалению, в перспективе проблема бесплодного брака будет только молодеть, что в первую очередь связано с образом жизни подрастающего поколения. Стремление к получению всех благ современной жизни неизбежно оказывает влияние на здоровье молодых парней и девушек, что в последующем отражается и на их репродуктивной системе. Неправильный характер питания, алкоголь и курение, малоподвижный образ жизни, урбанизация и связанное с ней ухудшение экологической обстановки – все эти негативные факторы не могут не отражаться на здоровье, в том числе репродуктивной системе потенциальных мам и пап.
Какие же методы есть в медицинском арсенале для преодоления бесплодия? Специалисты ВРТ сегодня способны получить сперматозоиды и яйцеклетки от бесплодной пары, добиться оплодотворения, провести культивирование эмбрионов, выбрать лучших из них и перенести их для имплантации в полость матки будущей матери. При этом как половые клетки, так и эмбрионы можно заморозить, и в таком состоянии они могут храниться годами до последующего размораживания. Более того, после оплодотворения яйцеклетки можно сделать биопсию клеточного материала эмбриона и провести так называемую предимплантационную генетическую диагностику (ПГД), которая даст информацию о наличии или отсутствии тех или иных генных аномалий.
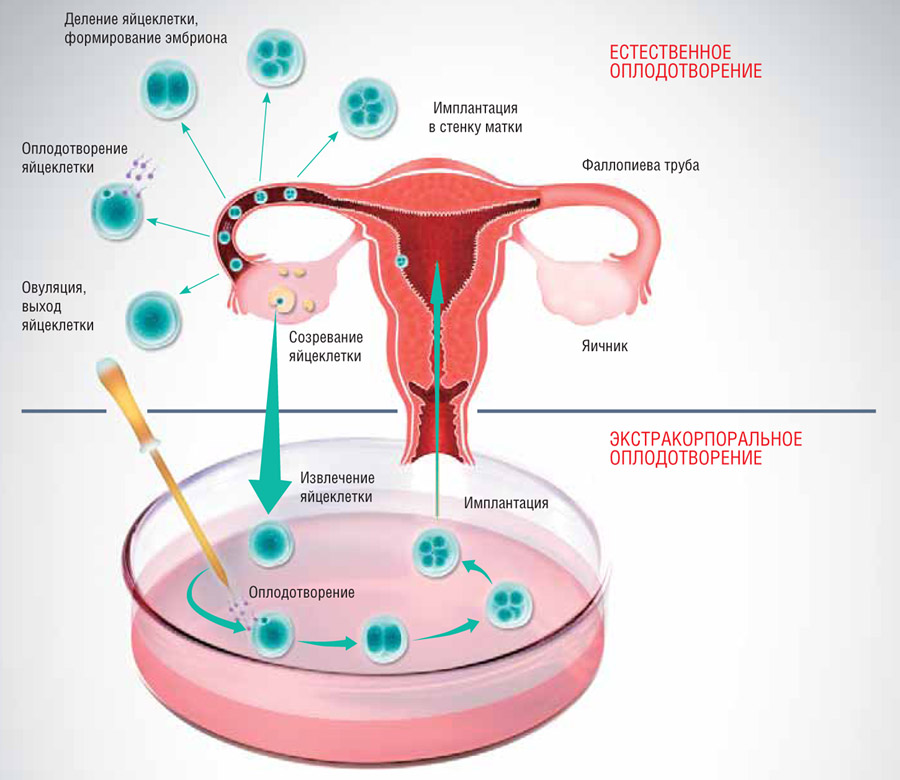
Самый простой в плане реализации метод ВРТ – это «внутриматочная инсеминация», которая не требует извлечения яйцеклеток из организма будущей матери. Все остальные методы подразумевают оплодотворение яйцеклеток вне организма женщины.
Такое экстракорпоральное оплодотворение (ЭКО) можно проводить двумя принципиально различными способами: смешиванием выделенных яйцеклеток с суспензией сперматозоидов («классическое ЭКО», IVF, In Vitro Fertilization) или инъекцией единичного сперматозоида в цитоплазму яйцеклетки (ИКСИ, ICSI, Intra Cellular Sperm Injection).
Путь к победе
При внутриматочной инсеминации сперму мужа или донора вводят в полость матки женщины. В норме, при естественном зачатии сперматозоиды прежде, чем добраться до яйцеклетки, преодолевают большой путь: сначала сквозь агрессивную (с высокой кислотностью) среду влагалища, затем наполненный слизью цервикальный канал (канал шейки матки), по поверхности маточной полости и, наконец, по маточным (фаллопиевым) трубам – органу, по которому яйцеклетка транспортируется из яичника. На пути к заветной цели из множества сперматозоидов многие не справляются с задачей, и до маточных труб доходят только самые отборные в прямом смысле этого слова мужские клетки. И здесь возникает вопрос: как провести искусственным образом тот самый отбор сперматозоидов, чтобы в оплодотворении участвовали только самые лучшие?
Для этого была разработана система очистки спермы от семенной плазмы (неклеточной части спермы, образующейся из секрета предстательной железы) и система отбора сперматозоидов по принципу центрифугирования в градиенте плотности. Самые зрелые и подходящие для оплодотворения сперматозоиды обладают тяжелым, компактным и плотным клеточным ядром. Поэтому самые тяжелые и, стало быть, самые лучшие из них окажутся в результате центрифугирования на дне.
Такие сперматозоиды отбираются, повторно очищаются, и в итоге получается суспензия наиболее качественных из имеющихся у пациента сперматозоидов, которые могут быть использованы в любом из методов ВРТ, в том числе для внутриматочной инсеминации. Если эту суспензию набрать в катетер и подвести сразу в маточную полость, то можно преодолеть такие факторы бесплодия, как непроходимый для спермы цервикальный канал, несовместимость спермы с цервикальной слизью. Кроме того, специальная очистка оказывает активирующий эффект на сперматозоиды и при легких факторах мужского бесплодия может также решить проблему.
Суть таинства
Как упоминалось выше, существуют лишь два различных метода оплодотворения вне тела будущей матери, не способной к зачатию естественным путем. Если у пациентки нет маточных труб, и миграция яйцеклетки из яичника в матку невозможна, то единственным путем реализации репродуктивной функции является классическое ЭКО. При классическом ЭКО яйцеклетки вместе со своим естественном окружением – питающими клетками, смешиваются с суспензией обработанных сперматозоидов. При этом сам процесс проникновения сперматозоидов в яйцеклетку происходит в каком-то смысле естественным путем.
Если же у семейной пары есть проблемы с качеством спермы или яйцеклеток, то это служит показанием для ИКСИ. В этом случае яйцеклетки предварительно очищают от окружающих их питающих клеток с помощью фермента гиалуронидазы, что дает возможность провести селекцию зрелых и качественных ооцитов, невозможную при оплодотворении методом классического ЭКО. Сама процедура ИКСИ проводится в крайне сжатые сроки, так как нахождение яйцеклеток вне инкубатора пагубным образом влияет на их способность к оплодотворению и дальнейшему правильному развитию эмбрионов.
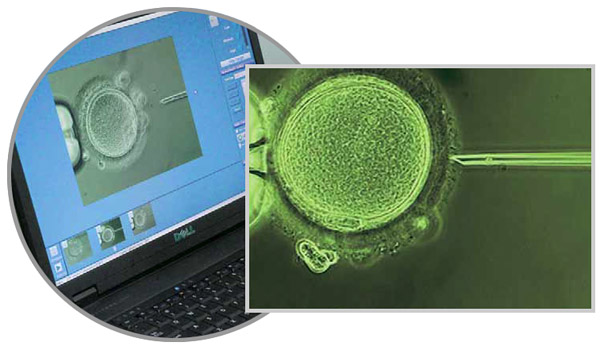
При методике ИКСИ яйцеклетку оплодотворяет путем инъекции в нее единственного сперматозоида. С помощью микроманипулятора капилляр прокалывает оболочку яйцеклетки, и сперматозоид вводится в цитоплазму. Процесс визуализируется с помощью цифровой камеры, передающей изображение на экран компьютера.
Но откуда же берутся яйцеклетки, необходимые для любой методики ЭКО? Их получают пункцией (проколом) фолликулов яичника пациентки – эта операция чаще всего проводится под общей анестезией и контролем УЗИ. Чтобы повысить результативность экстракорпорального оплодотворения, вызывают рост сразу нескольких фолликулов, что позволяет получить сразу несколько яйцеклеток, а каждый дополнительный эмбрион повышает шансы наступления беременности.
Для стимуляции роста фолликулов используются гормональные препараты гипофиза человека, необходимые для нормального созревания фолликулов и яйцеклеток – фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ), а также хорионический гонадотропин человека (ХГЧ), который секретируется плацентой после успешной имплантации яйцеклетки в матку и играет важную роль в развитии беременности.
Сегодня благодаря достижениям современной генной инженерии для получения этих гормонов используют культуру клеток яичника китайского хомячка. Благодаря использованию таких рекомбинантных технологий целевой продукт нарабатывается в больших количествах и гораздо легче очищается, нежели природный гормон. Доступность гормонов позволила существенно повысить результативность циклов ЭКО.
После стимуляции роста фолликулов и хирургического получения яйцеклеток наступает один из важнейших моментов ЭКО – оплодотворение. Через определенный промежуток времени эмбриолог просматривает клетки в микроскоп и определяет, произошло ли оплодотворение. Заметим, что само выражение «ребенок из пробирки» появилось именно потому, что после оплодотворения яйцеклеток получившиеся эмбрионы какое-то время находятся в культуральной посуде. Хотя, если быть точными, то специалисты ЭКО используют не пробирки, а лабораторные стеклянные чашки (чашки Петри). Так что, строго говоря, дети появляются «из чашек».
Полученные тем или иным методом эмбрионы затем культивируются в течение максимум 5–6 дней в инкубаторах при температуре 36,9–37,0°С в специальных средах (Lane, Gardner, 2007).
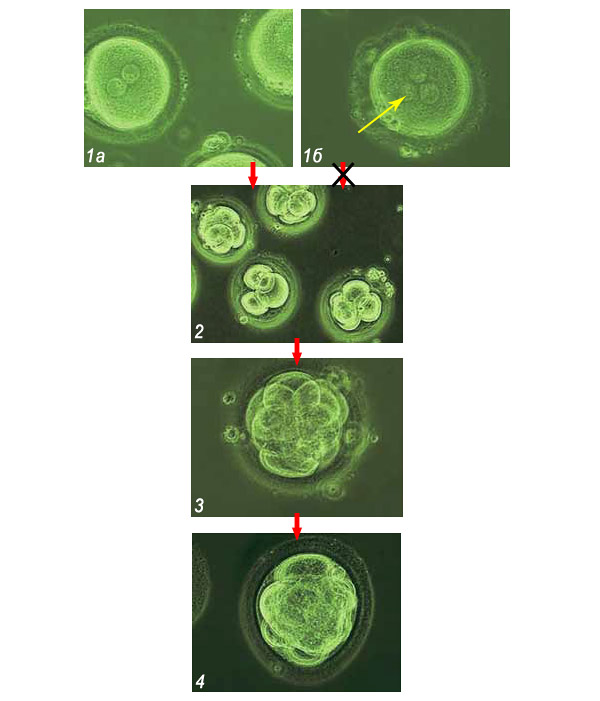
Эмбрионы человека на 1-е сутки развития (1): 1а – с двумя пронуклеусами, свидетельством правильного оплодотворения; 1б – аномальный эмбрион с тремя пронуклеусами, не пригодный для переноса в матку. Желтая стрелка указывает на пронуклеус.
После искусственного оплодотворения яйцеклетка начинает дробиться, и эмбрион проходит «в пробирке» первые стадии своего развития: 2-е сутки – начало дробления яйцеклетки (2), 3-и сутки – формирование клеточной массы (3), 4-е сутки – рост клеточной массы (4). Эмбрионы с аномальным развитием отбраковываются после микроскопического исследования. Перенос эмбриона в полость матки обычно проводится на 5-й день его «жизни» после генной диагностики
Как диагностировать эмбрион?
Перенос эмбриона в полость матки обычно проводится на пятый день его «жизни», после проведения генетической диагностики. Необходимость этой процедуры обусловлена тем, что около 10–15% беременностей, полученных с помощью ЭКО, не завершаются родами по причине замирания развития плода или выкидышей, обусловленных генетическими аномалиями. Нужно добавить, что эта цифра не так уж и велика: считается, что в России каждая пятая обычная беременность не завершается родами, при этом остановка развития эмбриона происходит зачастую на сроке не более двух недель, поэтому женщина может вообще оставаться в неведении, что была беременна. Но поскольку, в отличие от естественного способа оплодотворения, процедура ЭКО трудоемка и затратна, в том числе и в эмоциональном плане, неудачу стараются исключить заранее.
Определение пола эмбриона на территории Российской Федерации запрещено законом, однако такую диагностику можно проводить одновременно с выявлением генетических аномалий. А в США, напротив, именно определение пола будущего ребенка является самым востребованным среди всех генетических анализов. Поэтому в этой стране генетической диагностике подвергается гораздо больше эмбрионов, чем в других странах.
Для определения генетического статуса эмбриона проводят биопсию его клеточного материала – ткани в случае эмбриона или полярного тельца яйцеклетки. Современные технические возможности позволяют осуществлять такую процедуру на третьи, четвертые или пятые сутки после оплодотворения.
Так выглядит эмбрион человека на 5-е сутки после классического ЭКО. Вокруг эмбриона видна толстая неклеточная оболочка и прилипшие к ней сперматозоиды, не проникшие внутрь.
Самые информативные и достоверные результаты дает биопсия клеточной массы пятидневного эмбриона. Отбор материала именно в этот период развития значительно уменьшает риск получения неверных данных из-за возможного явления мозаицизма эмбриона, когда разные клетки несут разный набор генов.
Дело в том, что у эмбриона на третий день развития можно взять для анализа лишь одну-две клетки из десятка имеющихся и не обнаружить в них никаких генетических отклонений. Однако если среди оставшихся клеток хотя бы одна будет содержать мутацию ДНК или хромосомную аномалию, то эмбрион в дальнейшем будет развиваться с отклонениями. На пятые сутки развития эмбриона число его клеток значительно увеличивается, а клеточная масса объединяется, поэтому в это время можно взять для анализа относительно большой участок ткани, которая даст более точную информацию о генетическом статусе эмбриона.
Генетический анализ клеточного материала эмбриона можно провести с помощью нескольких методов: флюоресцентной in situ гибридизацией с использованием меченых флюоресцентной меткой ДНК-зондов; сравнительной геномной гибридизацией, основанной на сравнении с контрольной ДНК, а также секвенированием, т. е. определением первичной структуры последовательности ДНК.
Полногеномное генетическое исследование эмбрионов сейчас повсеместно применяется в американской практике ЭКО и получает все большее распространение в европейских странах. Наиболее перспективной является сравнительная геномная гибридизация, позволяющая диагностировать анеуплоидию (неправильное число хромосом) и микроструктурные хромосомные аномалии сразу во всех хромосомах (Глинкина и др., 2014). При выявлении генетических аномалий среди полученных эмбрионов проводится отбор, и в организм матери переносятся лишь те из них, которые дадут начало нормальной беременности и приведут к рождению здорового ребенка.
На сегодняшний день в мире живет уже более четырех миллионов людей, зачатых с помощью экстракорпорального оплодотворения, и миллионы женщин познали счастье материнства, в котором им отказала природа или обстоятельства. В области вторичных репродуктивных технологий ежегодно совершаются десятки открытий, благодаря которым результативность методик ЭКО постоянно возрастает. И все же специалисты надеются, что в будущем ВРТ все-таки не станут всеобщей практикой, но останутся спасительным выходом для немногих. Для этого каждому из нас уже сейчас нужно заботиться о собственном здоровье, здоровье своих детей и близких.
В публикации использованы фото ЦНМТ ИХБФМ СО РАН. Все фото сделаны на фазово-контрастных микроскопах, которые позволяют наблюдать клетки, не повреждая их.
Литература:
1. Глинкина Ж. И., Махмудова Г. М., Кибанов М. В. Преимплантационная генетическая диагностика методом сравнительной геномной гибридизации – новый подход к профилактике рождения детей с врожденной и наследственной патологией в рамках программы ВРТ // Проблемы репродукции. 2014. № 4. C. 68–72.
2. Дедов И. И., Макарова Н. П., Витязева И. И., Боголюбов С. В. Морфологические структуры сперматозоида, влияющие на эффективность оплодотворения методом ИКСИ // Проблемы репродукции. 2010. № 3. C. 64–67.
3. Осадчук Л. В., Клещев М. А., Гуторова Н. В. и др. Гормональный профиль и качество спермы у мужчин Восточной Сибири // Вестник РАМН. 2012. № 3. C. 50–55.
4. Lane M., Gardner D. K. Embryo culture medium: which is the best? // Best Pract. Res. Clin. Obstet Gynaecol. 2007. V. 21. № 1. P. 83–100.
Об авторах
Никифоров Дмитрий Владимирович – инженер лаборатории проблем репродукции Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Лауреат Премии Президента РФ по поддержке талантливой молодежи (2008).
Рябчикова Елена Ивановна – доктор биологических наук, профессор, руководитель группы микроскопических исследований Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), доцент кафедры биомедицинской физики физического факультета НГУ, доцент кафедры молекулярной биологии факультета естественных наук НГУ.
Овсянникова Татьяна Викторовна – доктор медицинских наук, заведующая лабораторией проблем репродукции Института химической биологии и фундаментальной медицины СО РАН (Новосибирск).
Попова Жанна Юрьевна – врач-репродуктолог Центра репродуктивного здоровья Центра новых медицинских технологий (Новосибирск).
Источник: elementy.ru