Продолжительность жизни и количество людей старше 60 лет неуклонно растет во всем мире. Вместе с этим возрастает и уровень возрастных заболеваний. Однако система сбалансированного питания, позволяющая отсрочить развитие болезней и замедлить старение, до сих пор не разработана. Стоп. А разве при помощи пищи можно повлиять на процессы старения? Этими вопросами и занимается нутригеронтология. Ну а о нутригеномике шла речь в первой части этой статьи.

Введение
Старение проявляется как постепенное ухудшение физиологических функций: ослабляется защита иммунной системы, уменьшается мышечная масса, возникают нарушения работы мозга и сердечно-сосудистой системы. До недавнего времени казалось, что процесс старения не поддается контролю. Однако, в последние десятилетия в биогеронтологии — науке о старении — был сделан ряд важных открытий. Ученые давно догадывались, что доступные глазу признаки старения — это последствия незаметных изменений на уровне клеток и молекул, но выяснить, какие же это молекулярные изменения, удалось совсем недавно [1]. На данный момент выделяют девять клеточно-молекулярных признаков старения, общих для различных организмов. К этим признакам относят (рис. 1):
- повышение нестабильности генома;
- укорочение теломер [2–4];
- эпигенетические изменения [5];
- изменения в межклеточной коммуникации;
- нарушение белкового гомеостаза;
- истощение стволовых клеток;
- клеточное старение [6];
- митохондриальные нарушения;
- разрегулирование клеточных сигнальных путей, чувствующих уровень питательных веществ.

Рисунок 1. Молекулярные признаки старения. Рисунок из [7], адаптирован.
Эксперименты в области биогеронтологии и анализ человеческих популяций долгожителей выявили любопытные взаимосвязи между типом питания и продолжительностью жизни. И сейчас по всему миру проводятся исследования, нацеленные на подбор оптимального рациона, который мог бы замедлить процессы старения и развитие возрастных болезней. В связи с этим возникла новая отрасль в науке — нутригеронтология. Давайте подробнее остановимся на молекулярных механизмах старения и рассмотрим, как пища и ее биоактивные компоненты воздействуют на эти процессы. Ну, в более общем виде вопрос связи питания с нашим здоровьем и — более того, с работой генов — затронут в первой части этой статьи: «Нутригеномика: питание vs. заболевания» [8].
Молекулярные признаки старения и пища
Сигнальные пути энергетического баланса
В биогеронтологии широко известны два клеточных сигнальных пути, ослабление которых приводит к удлинению жизни у многих организмов [9]: сигнальный путь инсулина/инсулиноподобного фактора роста (IIS) и сигнальный путь mTOR*. Эти сигнальные пути тесно переплетены между собой и «зондируют» уровень питательных веществ в клетке (рис. 2). Пути mTOR и IIS активируются компонентами пищи: углеводами (активируют в большей степени IIS путь) и аминокислотами (запускают mTOR-сигналинг). Ослабление сигналов от этих путей на различных стадиях продлевает жизнь самым разным модельным организмам, и на настоящий момент не осталось сомнений, что регуляция именно этих путей — главный рычаг воздействия рациона на здоровье и долголетие.
* — О практических аспектах изучения таких сигнальных путей как mTOR, а также веществ, потенциально продлевающих жизнь, можно будет прочитать в книге-стратегии Longevity Cookbook, готовящейся при содействии фонда «Наука за продление жизни». Первая глава книги уже опубликована в интернете (правда, пока только на английском языке): «Longevity Cookbook: Pharmacological Extension of Lifespan». — Ред.
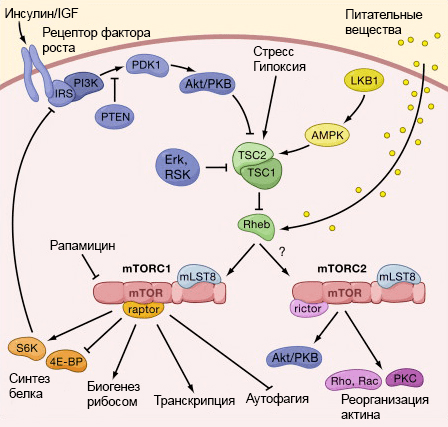
Рисунок 2. Взаимосвязь IIS- и mTOR-сигнальных путей. Сигнал от инсулинового рецептора (он же рецептор фактора роста) распространяется по клетке и активирует белок mTOR, что приводит к сборке двух функциональных комплексов: mTORC1 и mTORC2. В свою очередь комплекс mTORC1 может ингибировать субстрат инсулинового рецептора (insulin receptor substrate, IRS). mTOR также активируется аминокислотами, поэтому высокая концентрация аминокислот в крови снижает чувствительность клеток к инсулину. Рисунок с сайта www.the-scientist.com.
Сигнальный путь IIS (insulin and IGF-1 signaling) информирует клетку о наличии глюкозы через уровень инсулина в крови. Путь IIS берет начало от мембранного рецептора*, распознающего инсулин или инсулиноподобный фактор роста (IGF1), и затем распространяется по клетке, стимулируя ее рост и деление и инактивируя транскрипционные факторы FOXO (регулируют стресс-ответ, репарацию ДНК, клеточную смерть, аутофагию [10] и др). Углеводы, содержащиеся в пище, в зависимости от строения, по-разному влияют на уровень инсулина в крови. Чем проще структура углевода, тем быстрее он переваривается и поступает в кровь, инициируя выработку инсулина.
* — Забавно, что родственный ему рецептор играет совсем другую роль — чувствует щелочь в окружающей среде: «Рецептор „нетрадиционной ориентации“» [11]. — Ред.
Сложные углеводы (клетчатка, крахмал) перевариваются постепенно, не вызывая сильного роста уровня сахара в крови и резких выбросов инсулина, в то время как простые углеводы (сахароза, глюкоза) приводят к скачку сахара в крови уже через 10–15 минут после употребления, что провоцирует выработку инсулина. Для того, чтобы оценить насколько возрастает уровень сахара в крови после потребления того или иного продукта, были введены такие параметры как гликемический индекс и гликемическая нагрузка. Например, выпечка и сладости имеют высокий гликемический индекс, так как содержат большое количество простых сахаров. Рацион с высокой гликемической нагрузкой стимулирует сигнальные пути IIS и mTOR, что в долгосрочной перспективе неблагоприятно сказывается на здоровье. Согласно исследованиям, питание с высоким гликемическим индексом/нагрузкой повышает риск таких возрастных заболеваний как диабет II типа и сердечные приступы [12]. В то время как соблюдение диеты с низкой гликемической нагрузкой (например, диеты, основанной на овощах), наоборот, благотворно сказывается на здоровье и даже способно обратить диабет II типа. А ограничение калорийности в течение долгого времени (при сохранении на нормальном уровне всех необходимых организму веществ) значительно замедляет старение сердечно-сосудистой системы и скелетной мускулатуры у людей [13].
Белок mTOR — ключевой регулятор клеточного роста и метаболизма. mTOR расположен в цитоплазме, активируется он аминокислотами и функционирует в двух различных комплексах: mTORC1 (mTOR complex 1) и mTORC2 (mTOR complex 2). Комплекс mTORC1 хорошо изучен, он собирается при поступлении сигналов от питательных веществ и рецепторов инсулина, факторов роста. mTORC1 способствует синтезу белков, подавляет аутофагию и регулирует метаболизм глюкозы (рис. 3). mTORC2 также собирается при запуске IIS и mTOR, но приводит к ингибированию транскрипционного фактора FOXO3. Поскольку mTOR активируется аминокислотами, то их невысокое содержание в пище способно увеличить продолжительность жизни. Например, мыши, содержащиеся на низкобелковой диете, живут гораздо дольше мышей с высокобелковой диетой (150 недель против 100 недель) [12].
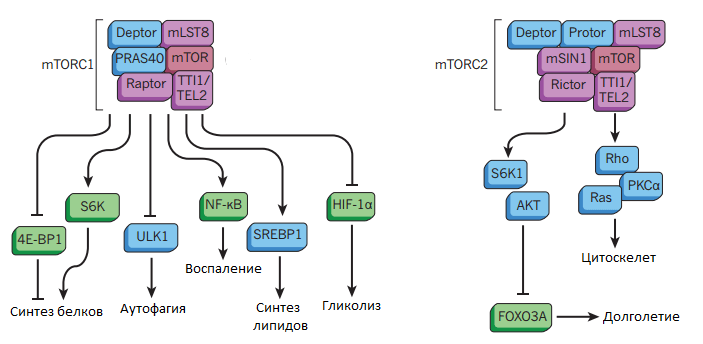
Рисунок 3. Схема комплексов mTORC1 и mTORC2 и их функции в клетке. Рисунок из [52] адаптирован.
Ограничение в употреблении только незаменимых аминокислот тоже сказывается на долголетии. Так, у крыс ограничение по метионину увеличивает срок жизни, а рацион с высокой концентрацией этой аминокислоты ускоряет старение сосудов. Как же можно использовать эти знания по отношению к людям? Во многих культурах красное мясо — важный источник белков в рационе. Недавние исследования показали, что существует зависимость между степенью употребления мяса и уровнем сердечно-сосудистых заболеваний, диабета II-го типа, рака и смертности от всех случаев. Однако следует признать, что вклад в повышенный уровень смертности от потребления мяса вносит не только белковая составляющая. Дело в том, что мясо, особенно жареное или копченое, содержит достаточно большое количество различных веществ, негативно влияющих на здоровье. А вот корреляции между употреблением растительных белков и уровнем смертности найдено не было, что обусловлено аминокислотным составом растительных белков, которые содержат меньше метионина и цистеина [12]. Исследования выявили также, что люди, употребляющие мало белков (менее 10% от суточных калорий), имеют низкий уровень IGF1 и сниженный риск развития рака и смерти от всех случаев [12]. Однако пожилым людям старше 65 лет рекомендуется повысить количество белка в пище, чтобы предотвратить потерю массы и чрезмерного снижения уровня IGF1 и других важных факторов [14].
Каким же образом активация путей IIS и mTOR вносит вклад в фенотип старения? Постоянная стимуляция IIS и mTOR ведет к сокращению жизни и высокому риску возраст-зависимых заболеваний через снижение аутофагии, нарушения в функционировании митохондрий, повышение агрегации белков (так как TOR ведет к образованию белков) и уровня воспаления (рис. 4) [12]. Поэтому излишек углеводов и белков в рационе способствует атеросклерозу, остеопорозу, нейродегенеративным заболеваниям, раку, нечувствительности к инсулину. Подобные механизмы вписываются в парадигму, согласно которой процесс старения — это следствие чрезмерной стимуляции клеток во взрослом организме посредством постоянной «бомбардировки» питательными веществами, ростовыми факторами и митогенными стимулами.
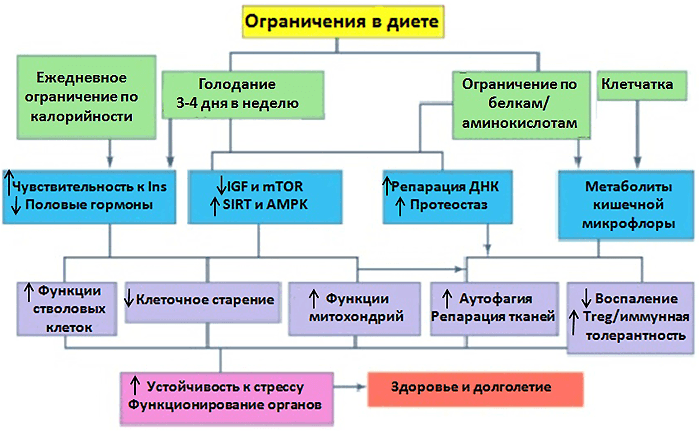
Рисунок 4. Влияние ограничения калорий и белков в рационе на физиологию клеток и организма. Рисунок из [13], адаптирован.
Утрата белкового гомеостаза
Белковый гомеостаз в клетке поддерживается за счет двух разнонаправленных процессов: механизмов корректной сборки белков (и их последующей стабилизации) и механизмов деградации белков с нарушенной структурой (протеолиз). Если в данных процессах происходит сбой, то белки агрегируются, что приводит к развитию нейродегенеративных заболеваний [15]. Белки теплового шока (БТШ) восстанавливают нарушенную структуру белков, и при стрессе (тепловом или химическом) уровень БТШ в клетке возрастает (рис. 5). Синтез БТШ, индуцируемый стрессом, с возрастом значительно снижается [16], и это сказывается на продолжительности жизни. Белок SIRT1 в клетках млекопитающих инициирует синтез БТШ [17], а активность SIRT1 повышает ресвератрол, содержащийся в клюкве и винограде.
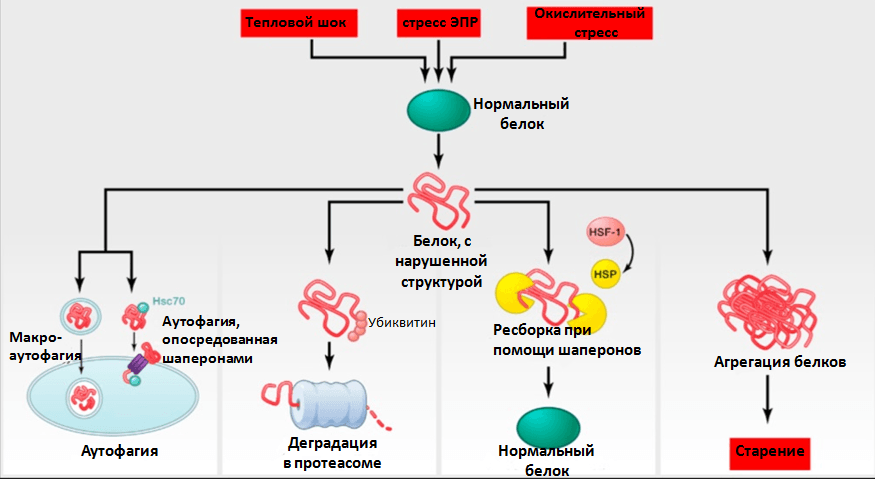
Рисунок 5. Поддержание белкового гомеостаза. Стресс в клетке (тепловой или химический) приводит к нарушениям в структуре белков. В норме такие «поломанные» белки либо восстанавливают утраченную структуру при помощи белков шаперонов, либо утилизируются в протеасомах/аутофагосомах. Но если в системах утилизации-сборки происходит сбой, то белки агрегируются и ухудшают работу клетки. Это способствует старению и развитию нейродегенеративных заболеваний. Рисунок из [7], адаптирован.
Эффективность двух основных протеолитических систем — аутофагосомной (или лизосомальной) и протеасомной — также падает с возрастом. Активация аутофагосом замедляет клеточное старение и продлевает жизнь у ряда модельных организмов. Спермидин, содержащийся в грибах, цельных зернах и бобовых, запускает процессы аутофагии, и его добавление в пищу способствует долголетию у червей, мушек и мышей [18, 19].
Нарушение белкового гомеостаза и усиление провоспалительных процессов провоцируют конечные продукты гликирования (неферментативной реакции присоединения углеводов к аминокислотам в составе белка). Высокий уровень конечных продуктов гликирования (advanced glycolation products, AGEs) в тканях вызывает окислительный стресс и воспалительные процессы, так как AGEs связываются с поверхностными клеточными рецепторами, запускают воспалительный NF-kB-сигнальный путь, а также изменяют структуру и функции белков [20, 21]. Полученные данные показывают, что снижение количества AGEs в пище замедляет развитие хронических болезней и старения у животных и, видимо, у человека. Овощи, фрукты, зерновые, бобовые, молоко и хлеб содержат мало AGEs, в то время как в твердых сырах, говядине, свинине и птице количество AGEs высоко [21].
Стабильность генома
Накопленные повреждения в ДНК в течение жизни — один из базовых признаков старения. Целостность и стабильность генома постоянно находятся под угрозой из-за воздействия как внешних (химических и биологических агентов), так и внутренних факторов (ошибок при удвоении ДНК, активных форм кислорода). Генетические повреждения могут затрагивать важные биохимические пути в клетке и нарушать их работу, что особенно критично в случае стволовых клеток. В поддержании геномной стабильности рацион играет более существенную роль, чем считалось ранее. Витамины группы B (B3, B9, В12), цинк и магний необходимы для нормального синтеза ДНК, ее метилирования и коррекции ошибок, поэтому даже незначительный недостаток этих веществ в организме сказывается на геномной стабильности и приводит к повышению уровня спонтанных хромосомных повреждений [22]. Однако современные нормы для витаминов и минералов установлены для профилактики дефицитов, а не для минимизации повреждений в ДНК [22]. Употребление этих витаминов особенно важно при дефектах в их абсорбции/метаболизме, которые обычно наблюдаются в пожилом возрасте. Поэтому после пятидесяти лет рекомендовано употреблять пищу с повышенным содержанием B12 и B9 [22]. Людям, соблюдающим веганскую диету, также необходимы специальные витаминные добавки, так как B12 содержится только в продуктах животного происхождения.
Длина теломер
Теломеры — концевые участки хромосом, длина которых сокращается при каждом делении клетки. Теломеры связаны с мультибелковым комплексом — шелтерином, который препятствует их слипанию. Шелтерин не даёт доступ к ДНК системам репарации, которые распознавали бы концы хромосом как разрывы в ДНК и соединяли бы их друг с другом. Из-за ограниченной репарации, произошедшие в теломерах повреждения относительно устойчивы и способны индуцировать остановку клеточного деления и/или апоптоз клетки [23, 24]. Для предотвращения повреждений и поддержания нормальной длины теломер необходимы витамины B3 и B9 [25]. С длиной теломер положительно коррелирует употребление омега-3-полиненасыщенных жирных кислот [25, 26].
Эпигенетические изменения
В течение жизни в клетках нашего организма происходят эпигенетические изменения*, которые затрагивают метилирование ДНК, модификации гистонов и перестройку структуры хроматина (рис. 6) [7]. Это приводит к ослаблению репарации ДНК и повышению хромосомной нестабильности. Но в отличие от мутаций эпигенетические процессы обратимы: активность ферментов, участвующих в создании и поддержании эпигенетических меток, можно регулировать. При помощи изменений в модификациях гистонов ученые увеличили продолжительность жизни прогероидных мышей (мышей, с ускоренных старением) [27] и восстановили когнитивные способности у старых мышей [28]. Во фруктах, овощах и зелени найдено множество веществ, влияющих на активность ферментов, задействованных в эпигенетическом реконструировании [29].
* — Эти изменения могут передаваться следующим поколениям и влиять на фенотипы детей и внуков. Подробнее о том, что такое эпигенетика, какие бывают эпигенетические модификации и существуют ли препараты для лечения эпигенома, рассказано в статьях: «Старение и долголетие: эпигеном раскрывает тайны», «Эпигенетика: невидимый командир генома» и «Пилюли для эпигенома» [5, 30, 31]. — Ред.
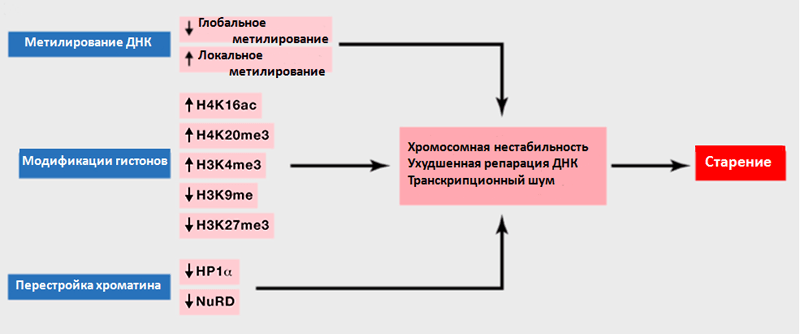
Рисунок 6. Эпигенетические изменения, происходящие с возрастом. Рисунок из [7], адаптирован.
Генистеин, выделенный из сои, индуцирует установление определенных гистоновых модификаций (метилирование H3K27 и H3K9), уровень которых с возрастом падает [29]. А один из эффектов ресвератрола, содержащегося в клюкве, голубике, винограде и красном вине, — повышение активности белка SIRT1, участвующего в модифицировании гистонов. Белки сиртуины, которые относятся к семейству НАД-зависимых деацетилаз (т.е. снимают ацетильную метку с гистонов), широко изучаются как потенциальные факторы, препятствующие старению. Повышенная экспрессия SIRT1 у млекопитающих улучшает показатели здоровья в старческом возрасте (продолжительность жизни при этом не возрастает) [32]. Помимо этого, для SIRT6 были получены убедительные доказательства его активности на длину жизни у млекопитающих [33]. И недавние эксперименты показали, что свободные жирные кислоты (олеиновая, линоленовая, миристиновая) в физиологических концентрациях повышают активность SIRT6 [34].
Митохондриальные нарушения
Митохондрии — главные энергетические станции клетки, они окисляют поступающие питательные вещества, преобразуя их в энергию в виде АТФ [35]. При окислении веществ в митохондриях неизбежно образуются кислородные радикалы (активные формы кислорода — АФК), которые повреждают клеточные структуры [36, 37]. Ранее считалось, что митохондриальные повреждения способствуют старению именно из-за повышенной продукции АФК. Однако данные последних лет ставят эту гипотезу под сомнение. Нарушения в митохондриях, независимо от уровня АФК, приводят к апоптозу клеток и повышению воспалительных реакций [38]. Дисфункция митохондрий с возрастом возникает по нескольким причинам. Во-первых, снижается образование новых митохондрий (митохондриогенез) из-за повреждений в ДНК и укорочении теломер. Кроме того, в митохондриальной ДНК накапливаются мутации из-за богатого АФК окружения и ограниченной эффективности систем репарации в митохондриях (по сравнению с ядром) [7]. Все тот же белок SIRT1 активирует митохондриогенез, увеличивает антиоксидантную защиту клетки [39] и способствует удалению поврежденных митохондрий через процесс аутофагии [40]. Существует и другой способ улучшения работы митохондрий. Известно, что мягкие токсины провоцируют в клетке защитные реакции, из-за чего она менее подвержена воздействию различных неблагоприятных факторов. В ответ на слабые митохондриальные яды, к числу которых принадлежит и ресвератрол [41] (содержащийся, напомним, в винограде, голубике и клюкве), в клетке активируются гены митохондриального контроля, обеспечивающие целостность митохондрий и их функциональность [42].
Клеточное старение, изменения в межклеточной коммуникации и истощение стволовых клеток
Истощение стволовых клеток и изменения в межклеточной коммуникации — главные «виновники» фенотипа старения: хрупкости костей, сокращения мышечной массы, ослабления иммунной системы и пр. Одна из причин развития данных признаков старения — клеточное старение или остановка деления. Клеточное старение индуцируется укорочением теломер, повреждениями в ДНК или нарушениями в сигналах клеточного деления. При этом стареющие клетки секретируют специфические молекулы (провоспалительные цитокины и металлопротеиназы), которые ускоряют старение окружающих клеток, а также инициируют воспалительные реакции [43, 44]. Из-за истощения стволовых клеток падает уровень иммунных клеток и наблюдаются дефекты в их активации [45]. В сумме это приводит к ослаблению иммунной защиты, усилению провоспалительных реакций и запуску воспалительного сигнального пути NF-kB.
Но некоторые функции иммунной системы можно восстановить при помощи питания. Так, повышенные дозы витамина E способны усилить функции Т-клеток у пожилых людей; поступление вместе с пищей аминокислоты триптофана и клетчатки благоприятно воздействует на структуру и функции кишечной микрофлоры и, соответственно, на секрецию ей факторов, которые регулируют множество воспалительных и метаболических путей (рис. 7) [13]. Кишечная микрофлора вырабатывает особые молекулы, помогающие делению и дифференциации регуляторных T-клеток (а регуляторные Т-клетки играют важную роль в контроле воспаления и аутоиммунных реакций) [46, 47]. Анализ популяций выявил сильную взаимосвязь между диетой и составом микрофлоры, и между составом микрофлоры и заболеваемостью, а также уровнем воспаления у пожилых людей [48]. Манипуляции с составом кишечной микрофлоры представляются еще одним эффективным способом увеличения продолжительности жизни и улучшения самочувствия в старости [48, 49].
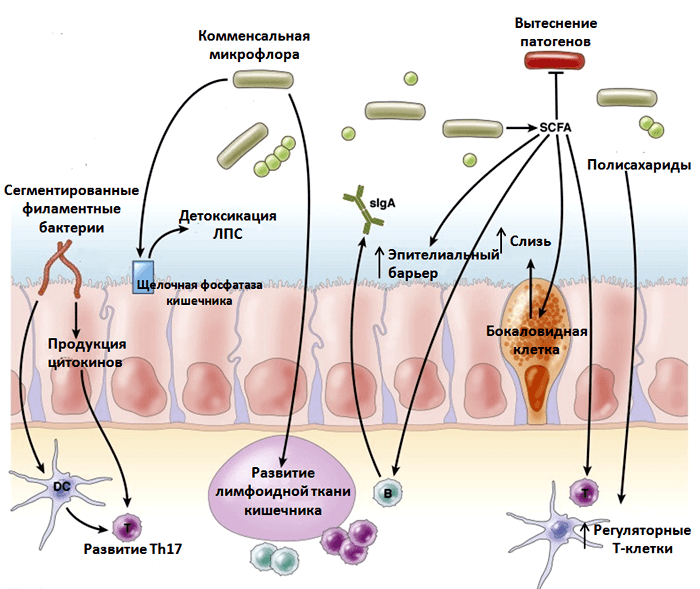
Рисунок 7. Влияние микрофлоры на иммунитет и воспаление. Микрофлора снижает уровень воспаления несколькими способами. Во-первых, кишечная микробиота продуцирует короткие жирные кислоты (short-chain fatty acid, SCFA), которые способствуют делению и поддержанию регуляторных Т-клеток. SCFA также стимулируют выработку слизи бокаловидными клетками; усиливают целостность эпителиального барьера. Во-вторых, нормальная микрофлора вытесняет патогенные бактерии, не давая им размножаться. В-третьих, сегментированные филаментные бактерии способствуют развитию T-хелперов 17, участвующих в защите от внеклеточных патогенов. Рисунок из [53], адаптирован.
Вывод
Дальнейшие исследования в области биогеронтологии помогут в будущем разработать комплексную систему мер, направленную на увеличение продолжительности жизни и продление молодости. Важным пунктом такой стратегии, несомненно, будет составление адекватных рекомендаций по питанию. Возможно, в будущей диете «Мафусаил» углеводы, белки и жиры будут доставляться в организм в форме, минимально активирующей пути IIS и mTOR, или найдут вещества, «симулирующие» эффект голодания. Но на сегодняшний день первоначальные причины старения до сих пор не ясны, и наиболее зарекомендовавшими себя типами питания являются средиземноморская и окинавская диеты [26]. Общие аспекты данных диет таковы: высокое потребление цельных зерновых, бобовых, рыбы и морепродуктов, фруктов и овощей; умеренное потребление молочных продуктов (в основном, сыр и йогурт) и вина; низкое потребление красного мяса, мяса птицы и сладостей (рис. 8). Множество исследований подтвердило взаимосвязь между соблюдением средиземноморской диеты и долголетием, а также сниженным риском развития патологий [50, 51], а жители острова Окинавы отличаются наивысшей продолжительностью жизни.
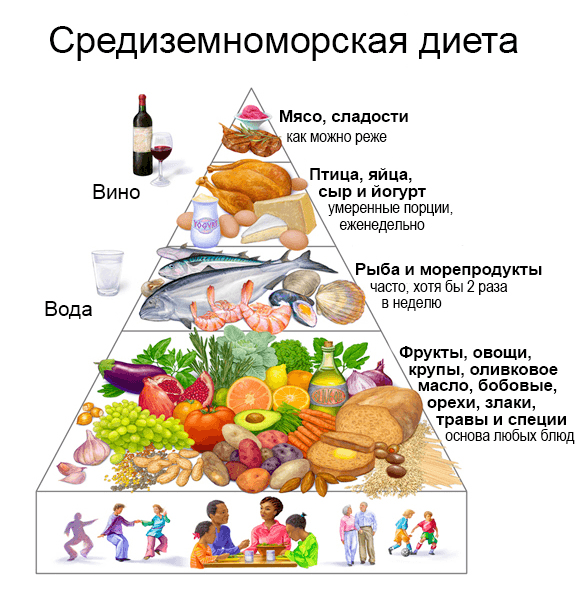
Рисунок 8. Средиземноморская диета. Крупы, бобовые, овощи, оливковое масло и морепродукты — главные составляющие средиземноморского рациона. Не менее важным аспектом является наслаждение прогулками и трапезой с друзьями. Рисунок с сайта eatalia.ru.
4.03.2016 Источник: biomolecula.ru








































































