
Исследования механизмов эпигенетики, активно проводившиеся во второй половине 20-го и начале 21-го века выявили однозначную их связь с возрастом организма, старением его отдельных органов и всего человека в целом.
прочитать подробнее о метилировании ДНК, эпигенетике и их связи с со старением
Эпигенетический биологический возраст
С развитием методов секвенирования появилась возможность не просто констатировать факт возрастного изменения метилирования ДНК, но и детально разобраться в том, где и на каких участках ДНК происходят эти изменения.
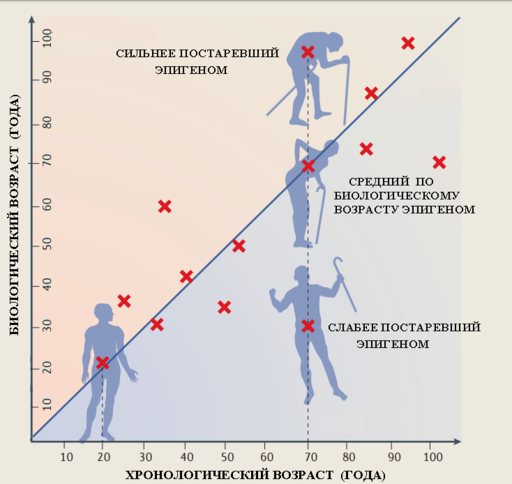
По статье ([11] ). Люди одного и того же хронологического возраста могут иметь разные по биологическому возрасту геномы. Одни люди моложе своего паспортного возраста, другие наоборот старше.
Выяснилось, что для ряда участков ДНК уровень метилирования линейно зависит от возраста организма. Это позволило построить модель, которая могла предсказывать возраст субъекта на основе уровня метилирования всего двух молекул цитозина в геноме ([[1]]). Использование 353 таких участков позволило построить универсальную и точную модель эпигенетических часов. Эта модель позволяет не только определять биологический возраст донора ткани, но также сравнивать возраст разных тканей человеческого тела ([[2]]). Использование этого метода позволило приоткрыть тайну «нестареющих детей». Выяснилось, что, хотя по данным антропологического обследования и внешне эти люди, выглядевшие детьми, не старели, их возраст по данным эпигенетических часов оказался не моложе их хронологического «паспортного» возраста ([[3]]). Зато у людей, которые доживают до почтенного возраста в 105 – 109 лет, их эпигенетический биологический возраст, как оказалось, примерно на 8 – 9 лет моложе паспортного возраста. Замедленным старением по сравнению со сверстниками нередко отличаются и их потомки ([4]).
Использование эпигенетических часов позволяет довольно точно предсказывать риск смерти от старческих заболеваний ([[5]],[[6]],[[7]]) и, в частности, вероятность заболеть раком ([[8]],[[9]]). В проведенном 18-тью исследовательскими группами в Европе, Азии и Америке исследовании точности эпигенетические тестов, основанных на метилировании ДНК, было признано что «эпигенетические часы» пригодны для применения в клинических исследованиях ([[10]]). На сегодняшний день эпигенетический метод является наиболее точным для определения «биологического» возраста и считается эталонным для сравнительной оценки других методов. Сдерживающим фактором для широкого применения данного метода является его высокая стоимость.
Омоложение организма через воздействие на эпигенетику
В связи с вышеизложенным возникает вопрос: «Если длительность нашей жизни определяется часиками «записанными» в нашем эпигеноме, нельзя ли подправить эти записи, подобно тому, как это делают иногда с записями в паспорте. Стереть запись о прожитых годах и вместо неё вписать данные о молодом возрасте?» Поскольку, как показано выше, эпигенетические часы, основанные на анализе ДНК, позволяют предсказывать риск смерти от старческих заболеваний, логично предположить, что заменив эти соответствующие старению и смерти «записи» на те, что свидетельствуют о здоровье, можно перепрограммировать организм на состояние здоровья. (При этом необходимо учесть, что некоторые из подобных «записей» это лишь маркер адаптации организма к патологическому состоянию.)
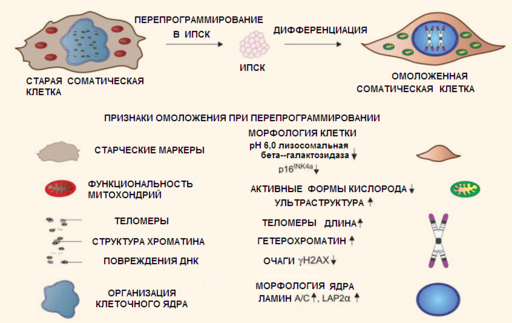
По материалам ([12]). ИПСК, полученные перепрограммированием из соматических клеток тканей старых людей, при дифференциации обратно в соматические клетки, не возвращаются в старческое состояние, а превращаются в молодые соматические клетки
Эксперименты по клеточному перепрограммированию показали, что многочисленные отличительные черты старения могут быть обращены вспять в более молодое состояние, а это доказывает обратимость, пластичность старения ([[13]],[[14]],[[15]],[[16]]). Индуцированные плюрипотентные стволовые клетки (ИПСК), даже от очень старых людей, в основном неотличимы от эмбриональных стволовых клеток (ЭСК) по уровню экспрессии таких связанных с возрастом маркеров как длина теломер, или функции митохондрий. Клетки дифференцированные из ИПСК не возвращаются в старческое состояние, а превращаются в молодые соматические клетки ([[17]). Однако, несмотря на то что в опытах с генетически модифицированными мышками удается непосредственно в живой мышке осуществлять клеточное перепрограммирование до плюрипотентности в самых разных её тканях ([[18]]), в том числе в тканях желудка, кишечника, поджелудочной железы, сердца, головного мозга, печени и почек, продлить жизнь животного с помощью этого метода не удается из-за склонности этих клеток к образованию тератом — опухолей эмбрионального типа ([[19]],[[20]],[[21]]). Поэтому необходима разработка методов прямой трансдифференцировки, без предварительного прохождения клеток через стадии плюрипотентного состояния, но так чтобы клетки при этом становились сравнительно молодыми. Даже используя препараты малых молекул, которые влияют на метилирование ДНК не избирательно, удаётся при некоторых условиях добиться сравнительного омоложения клеток, не доводя их до ИПСК. Так, например, путём непродолжительной обработки стволовых клеток костного мозга и жировых клеток комбинацией тромбоцитарного фактора роста PDGF-AB и ингибитора метилирования ДНК — 5-азацитидина, удается получить так называемые, индуцированные мультипотентные стволовые клетки, которые по утверждению авторов, способны непосредственно участвовать в процессах регенерации тканей и при этом не образуют опухолей ([[22]]). Воздействуя на стволовые клетки костного мозга другим ингибитором ДНК метилтрансферазы (RG108), удалось вызвать у них процессы омоложения ([[23]]). В недавно проведённом исследования репрограммирования удалось достичь с помощью активатора транскрипции, на основе CRISPR-dCas9 соединенного с двумя VP64 эффекторами, направленного на эндогенный ген Myod1 ([24]). Эти превращения происходят «в одну стадию» — путём прямой трансдифференцировки, без каких-либо промежуточных стадий дедифференцировки поэтому более безопасны. Такие исследования доказали что для перепрограммирования вовсе не обязательно «танцевать от печки» и получать сперва ИПСК, а уже потом из них дифференцировать необходимые соматические клетки.
Основным препятствием на пути к такому перепрограммированию клеток из старых и больных в молодые и здоровые в живом организме является необходимость одновременно воздействовать на несколько сотен генов во всех его клетках. Эта кажущаяся неразрешимой задача, на самом деле уже по плечу исследователям. Разработка различных ферментов на базе CRISPR-Cas9 позволяет с помощью подобранной библиотеки направляющих РНК (sgRNA) проводить правку эпигенома и воздействовать одновременно на десятки, выбранных для модификации генах ([[25]],[[26]]). В стадии разработки находятся способы доставки таких достаточно громоздких ферментных комплексов. Поскольку они не умещаются в обычные вирусные частицы, использовавшиеся до настоящего времени, идет разработка способов доставки их с помощью внеклеточных везикул, вроде микросом и экзосом ([27]).
Конечно, несмотря на обнадёживающие результаты, лечение старения и перепрограммирование такими не избирательными препаратами напоминает ремонт будильника с помощью молотка и клещей. Нужны препараты более целенаправленного действия подобные тем, что используют растения для омоложения при вегетативном размножении черенками. И подобные препараты стали появляться
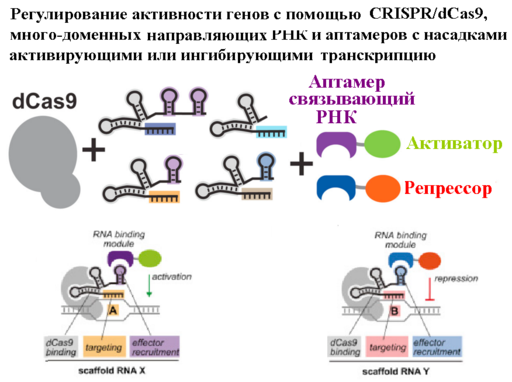
По ([28]). Универсальные системы для избирательной активации и репрессии генов. Избирательность достигается за счет направляющих РНК с разными узнающими уникальные участки ДНК последовательностями («гребешок» окрашенный в разные цвета), а также узнающие разные аптамеры: активаторы (фиолетовая петля) и репрессоры (синяя петля).
Созданы системы для избирательной активации и репрессии генов. Насильно активируя или наоборот, подавляя активность определённых генов можно воздействовать и на эпигеном, поскольку обнаружено, что изменения в транскрипционной активности косвенно регулируют локальные H3K27me3 модификации гистонов хроматина ([29]). Там, где такой способ не пройдет можно будет использовать эпигенетический активатор на основе белка dCas9, соединенного с каталитическим доменом человеческой ацетилтрансферазы p300 ([30]). Ацетилируя гистон H3 этот фермент избирательно (по наводке направляющей РНК) переводит инактивированные участки хроматина в активные.
Недавние разработки показали, что избирательно воздействовать можно и на метилирование ДНК. Например, с помощью dCas9 соединенного с каталитическим доменом метилтрансферазы Dnmt3a, осуществляющей de novo метилирование ДНК ([31]). Причем такое насильное метилирование ДНК держится, по меньшей мере, 8 дней. Аналогичным образом, используя другой искусственный фермент на основе dCas9, но уже присоединенный к каталитическому домену TET1, инициирующему деметилирование ДНК ([32]), можно избирательно удалять вызванное гиперметилированием ингибирование отдельных генов. В том числе тех, которые предопределяют старение. Там где описанные выше методы изменения уровня метилирования ДНК не помогут, можно использовать более радикальный способ — вырезать участки метилирования и заменять их на аналогичные, но неметилированные участки и наоборот неметилированные заменять на метилированные.
Поскольку ферменты на базе dCas9, воздействующие на эпигеном, разработаны лишь совсем недавно (в основном в 2016 году), их применения для воздействия на эпигенетику старения следует ожидать не ранее 2017 года.
Литературу смотрите в первоисточнике: rlegroup.net
Автор: Дмитрий Джагаров, специально для RLEgroup








































































