Ученые из Университета Калифорнии испытали на мышах метод генетической терапии серповидноклеточной анемии, использующий технологию CRISPR/Cas9. Результаты испытаний говорят о том, что внесенные в геном изменения действительно сохраняются на протяжении длительного времени. Однако пока эффективность внесения генетических «поправок» достаточно низкая, а безопасность терапии даже не исследовалась. Работа опубликована в журнале Science Translation Medicine.
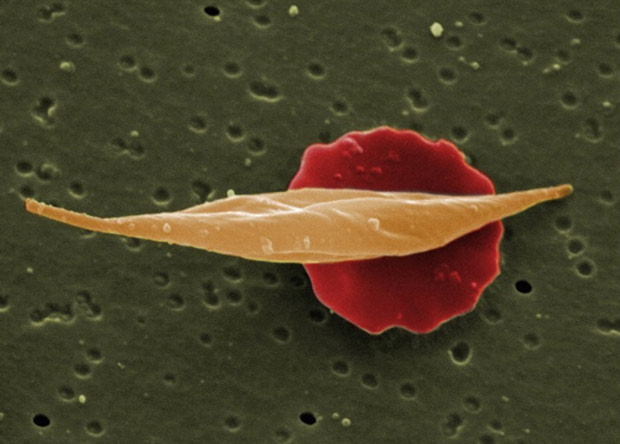
Серповидно-клеточная анемия — одно из наиболее хорошо изученных генетических заболеваний. Она вызывается одиночной мутацией в последовательности одного из белков, входящих в состав гемоглобина — бета-глобина (обычный гемоглобин это тетрамер из двух альфа- и двух бета-глобинов, каждый из которых снабжен небелковым кофактором, гемом). Замена аминокислоты глутамата на валин в первичной последовательности бета-глобина приводит к тому, что получившийся гемоглобин становится «липким» и начинает образовывать агрегаты внутри красных кровяных телец. Это приводит к тому, что эритроциты приобретают вытянутую форму, благодаря которой болезнь и получила свое название.
Серповидные эритроциты часто скапливаются в местах разветвления кровеносных сосудов и могут формировать тромбы, приводящие к остановке кровоснабжения и даже отмиранию тканей. Кроме того, такие эритроциты чаще разрушаются, что вызывает анемию и приводит к проблемам с иммунитетом. В целом серповидноклеточная анемия снижает ожидаемую продолжительность жизни человека примерно на 30 лет. Несмотря на то, что патологические процессы, связанные с развитием этого заболевания, хорошо изучены, у медиков сейчас нет почти никаких механизмов ее реальной терапии. Единственным сколько-нибудь эффективным методом вмешательства является пересадка кроветворных клеток от донора вместе с костным мозгом, однако она сама по себе опасна для иммунной системы, не говоря уже о проблемах поиска подходящего донора.
|
|
Серповидноклеточная анемия, однако, является удобной мишенью для генетической терапии. Дело в том, что в данном случае не требуется замены мутантной последовательности во всех клетках организма пациента (как, например, при попытке удаления ВИЧ из генома). Достаточно точечного воздействия на стволовые кроветворные клетки, причем не обязательно на все 100 процентов их популяции. Даже если часть из них станет производить нормальный бета-глобин, эритроциты, получившиеся из таких клеток, за счет повышенного времени своей жизни должны купировать основные симптомы болезни.
Некоторые исследовательские группы уже пробовали применять генетическую терапию для лечения этого заболевания. Так, о первых успехах в прошлом году заявили ученые в журнале Blood. Однако тогда для внесения «правильных» мутаций авторы статьи использовали так называемые нуклеазы на цинковых пальцах, или ZFN-белки (их специально разрабатывают in silico под каждую исследуемую мутацию). И эффективность процесса была невелика: в костном мозгу мышей сохранялось всего около одного процента «правильных» кровяных клеток. В новой работе исследователи обратились к более современной технологии CRISPR/Cas9, которая сейчас начинает активно испытываться в медицине.
Кратко эксперимент выглядел следующим образом. Ученые взяли линию клеток, напоминающих стволовые клетки крови (гемобластоцисты), и ввели в них с помощью электрического тока специальный препарат. Он представлял собой рибонуклеопротеин: комплекс белка-нуклеазы Cas9, направляющей РНК и правильной версии гена. Проникая в клетку, нуклеаза разрезала ген бета-глобина недалеко от патогенной мутации, а затем собственные ферменты клетки залечивали разрыв, используя образец ДНК из препарата. Эффективность процесса редактирования зависит от множества факторов: не только конкретной направляющей РНК и мишени, но и от ДНК-образца. И значительная часть описываемой работы была посвящена как раз подбору условий максимально эффективного внесения мутаций. В результате авторам удалось добиться того, что около трети от обработанных клеток были «исправлены» на генетическом уровне. Однако основная часть работы заключалась в том, что эти клетки инъецировали в кровоток мышей и следили за тем, как они себя ведут и насколько долго могут сохраниться (использовались мыши специальной линии, которые не вырабатывают иммунную реакцию на человеческие клетки).
Главный положительный результат работы заключается в том, что кроветворные клетки с измененным геномом обнаруживались в костном мозге мышей даже спустя несколько месяцев после терапии. Для грызунов, которые живут не более двух лет, этот результат можно считать очень хорошим. С другой стороны, «правильные» кроветворные клетки составляли всего два процента от общей популяции. По словам авторов, даже этого достаточно, чтобы привести к значимому терапевтическому эффекту (и это в два раза больше, чем в предыдущей работе с ZFN-нуклеазами). Однако до начала клинических испытаний ученые планируют поднять эту долю хотя бы до пяти процентов. После этого планируется исследовать побочную активность нуклеаз, т. е. возможность внесения разрывов в других участках генома. Опасность таких разрывов в терапевтических применениях CRISPR/Cas9 пока практически не исследована. Только после завершения двух этих этапов можно будет говорить о клинических испытаниях технологии.
Серповидноклеточная анемия — только один из примеров ближайших целей генетической терапии с помощью CRISPR/Cas9. Так, уже ведутся исследования возможности терапии другого наследственного заболевания, талассемии (которая также связана с мутацией в бета-глобине). Именно это заболевание было мишенью при редактировании первого эмбрионального генома китайской группой в начале прошлого года. Другой пример — диодистрофия Дюшена, терапия которой уже испытана на мышах. Большие надежды биоинженеры возлагают на сочетание технологии CRISPR/Cas9 и метода химерных антигенных рецепторов — эти исследования стали первыми исследованиями такого рода, одобренными американским регулятором FDA. Более сложной целью можно считать применение CRISPR для удаления ВИЧ, интегрированного в клеточный геном хозяина. Это, скорее всего, потребует существенного прогресса в эффективности генетического редактирования, однако такие эксперименты уже проводятся, в том числе на лабораторных животных. Об основах метода генетического редактирования CRISPR/Cas9 можно прочитать здесь, о последних трендах в этой области — здесь.
13.10.2016 Источник: nplus1.rur Александр Ершов








































































