Кора головного мозга человека культивируется в чашке Петри. Заболевания глаз лечатся с помощью клеток сетчатки, полученных из собственных клеток кожи пациента. Новые препараты тестируются на человеческих клетках вместо животных моделей.
Эти и другие экспериментальные исследования и методы лечения берут начало от всколыхнувшего научный мир открытия, сделанного 10 лет назад доктором Шинья Яманака (Shinya Yamanaka) и его аспирантом доктором Казутоши Такахаши (Kazutoshi Takahashi), разработавшими метод репрограммирования взрослых клеток мышей и возвращения их в состояние эмбриональных клеток. Получающиеся в результате этих манипуляций клетки сейчас известны как индуцированные плюрипотентные стволовые клетки (иПСК).
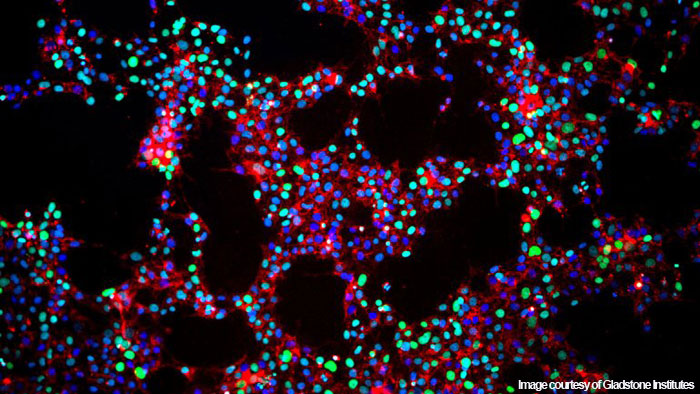
Индуцированные плюрипотентные стволовые клетки,
репрограммированные из нормальных клеток взрослого человека
и еще не подвергнутые дифференцировке.
Через год им удалось воспроизвести свой подход на человеческих клетках. За это революционное исследование и активную деятельность по продвижению исследований в области стволовых клеток Яманака, в настоящее время сотрудничающий университетом Киото и университетом Калифорнии в Сан-Франциско, в 2012 году стал одним из лауреатов Нобелевской премии по медицине и физиологии.
Индуцированные плюрипотентные стволовые клетки
Согласно определению Национальных институтов здравоохранения США, индуцированные плюрипотентные стволовые клетки являются соматическими (взрослыми) клетками, репрограммированными на вступление в состояние, подобное состоянию эмбриональных клеток, путем принудительной индукции экспрессии факторов, важных для поддержания «стволовости» эмбриональных стволовых клеток.
Совершённый Яманака прорыв предоставил исследователям неиссякаемый источник индуцированных плюрипотентных стволовых клеток, которые можно направленно дифференцировать в любые специфичные типы клеток взрослого организма, начиная от клеток кожи и заканчивая клетками сердца и нейронами, для дальнейшего применения базовых исследованиях, разработке лекарственных препаратов и лечении заболеваний.
Это открытие открыло практический, а в некоторых критических случаях и единственный метод непосредственного изучения человеческих «заболеваний в пробирке», а также отслеживания ранних стадий как нормального, так и аномального развития. Оно также позволило специалистам проводить скрининг новых препаратов непосредственно на клетках человека вместо животных моделей, что в большем количестве случаев позволяет точно прогнозировать влияние новых препаратов на человека.
Появление индуцированных плюрипотентных стволовых клеток обеспечило быстрый прогресс в одних сферах и появление серьезных затруднений в других. Уже совершенно очевидно, что эти клетки являются находкой для базовых исследований, однако применение новой технологии в терапии заболеваний остается весьма сомнительной перспективой. Некоторые типы клеток оказались сложными для репрограммирования и даже протоколы этих методов на сегодняшней день находятся на стадии постоянной доработки, так как данная сфера в целом еще очень молода.
Индуцированные плюрипотентные стволовые клетки в базовых биомедицинских исследованиях
По словам доктора Арнольда Кригшейна (Arnold Kriegstein), директора центра регенеративной медицины и изучения стволовых клеток Эли и Эдит Броад университета Калифорнии в Сан-Франциско, для многих ученых, работающих в области биомедицинских исследований, возможности, предоставленные технологией создания индуцированных плюрипотентных стволовых клеток, являются претворением мечты в реальность. Он поясняет, что индуцированные плюрипотентные стволовые клетки предоставили нам беспрецедентную возможность взглянуть на развитие человека. Занимающийся изучением раннего развития коры головного мозга Кригшейн отмечает, что никогда раньше не имел неограниченного доступа к живым клеткам человеческого мозга, тогда как сейчас он может взять клетки кожи и вырастить модель коры головного мозга в лаборатории. Таким образом появление индуцированных плюрипотентных стволовых клеток кардинально изменило условия игры в области изучения раннего развития человека.
Кригшейн полон энтузиазма в отношении того, что исследователи могут почерпнуть из изучения «органоидов» – выращиваемых и индуцированных плюрипотентных стволовых клеток моделей развивающихся органов размером с горошину. На современном уровне ученым удается получать скопления клеток, начинающих высвобождать молекулярные сигналы и дифференцироваться в то, что в будущем должно превратиться во взрослый орган.
Подобные модели очень близки к происходящему в реальности. Недавно Кригшейн и его коллеги продемонстрировали, что даже на ранней стадии органоиды способны формировать сложную внутреннюю организацию, в том числе передне-заднюю ориентацию, при этом их различные регионы начинают приобретать черты, свойственные регионам эмбрионального мозга.
Данные, опубликованные в ряде научных работ, свидетельствуют в пользу того, что органоиды позволяют моделировать заболевания, развивающиеся во взрослом возрасте, в том числе характерные для позднего возраста, такие как болезнь Альцгеймера.
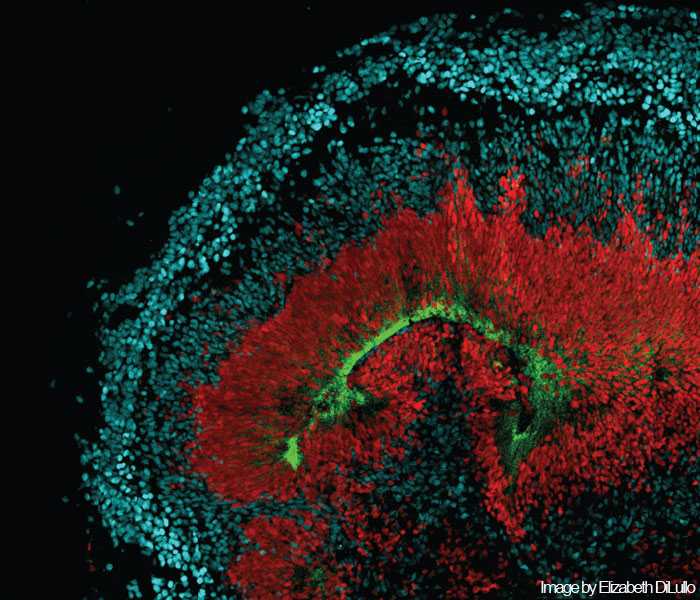
Органоид коры головного мозга человека, культивируемая в лабораторных условиях.
Кригштейн высказывает беспокойство, что даже несмотря на то, что органоиды предоставляют беспрецедентную возможность наблюдения за этапами развития, некоторые исследователи слишком забегают вперед.
Он подчеркивает, что речь идет об эмбриональном мозге. Наиболее продолжительный период роста, который мы можем моделировать, соответствует полному развитию зародыша. Насколько вероятно, что экспрессия генов, клеточные сигнальные механизмы и мириады других взаимодействий на этой органоидной стадии будет с точностью отражать развитие болезни Альцгеймера – заболевания, поражающего людей в возрасте 60-70 лет.
Кригштейн считает, что к подобным исследованиям следует подходить скептически. В настоящее время технология стволовых клеток настолько быстро изменяется, что воспроизведение результатов является очень сложной задачей. Ученым следует разработать протоколы, позволяющие осуществлять достоверное сопоставление различных методов, и впоследствии использовать такие стандартизованные методологии для продвижения исследований и методов лечения. Однако он на 100% уверен, что со временем это станет реальностью.
Отталкиваясь от исходного открытия
В настоящее время Яманака руководит центром изучения и применения индуцированных плюриротентных стволовых клеток в университете Киото со штатом из 500 сотрудников, а также исследовательской лабораторией в институте сердечно-сосудистых заболеваний Гладстоуна в Сан-Франциско. Помимо этого он занимает должность профессора анатомии в университете Калифорнии в Сан-Франциско, тогда как Такахаши является приглашенным ученым в институтах Гладстоуна и координирует работу лаборатории Яманаки. Оба продолжают свою работу с индуцированными плюрипотентными стволовыми клетками, также как и другие исследователи.
В своей знаковой работе Яманака и Такахаши использовали четыре генетических фактора для индукции возвращения взрослых клеток в плюрипотентное состояние. Вскоре после прорыва с индуцированными плюрипотентными стволовыми клетками доктора Шен Дин (Sheng Ding), руководящий лабораторией в институтах Гладстоуна и являющийся профессором на кафедре фармацевтической химии в университете Калифорнии в Сан-Франциско, начал работу над усовершенствованием репрограммирующего коктейля.
В конечном итоге Дин смог заменить генетические факторы транскрипции молекулами, подобными лекарственным препаратам, что устраняет риски, ассоциированные с введением нового генетического материала в клетки. В настоящее время лаборатории по всему миру разрабатывают и публикуют различные химические рецепты, во многих случаях зависящие от типа клеток, которые подлежат репрограммированию.
Другие недавние достижения в области индукции плюрипотентности основаны на использовании различных типов белков, оказывающих влияние на активность генов в клеточном ядре. Доктор Робер Блеллох (Robert Blelloch) из центра Броада университета Калифорнии в Сан-Франциско продемонстрировал, что некоторые малые молекулы РНК, известные как микроРНК, стимулируют «де-дифференцировку» взрослых клеток, тогда как другие стимулируют обратное – способность стволовых клеток дифференцироваться во взрослые клетки. Путем воздействия на активность микроРНК сотрудники его лаборатории смогли стократно повысить выход клеток при репрограммировании.
Блеллоха и его коллег заинтриговала роль так называемых эпигенетических факторов – возникающих естественным образом или вводимых извне молекул, модифицирующих белки внутри ядра. Манипуляции над этими молекулами также могут оказывать влияние на эффективность индукции плюрипотентыных клеток.
Перспективы терапии
Через шесть лет после того, как Яманака открыл индуцированные плюрипотентные стволовые клетки, работающие в совершенно другой сфере исследователи разработали новую технологию редактирования генов, обладающую беспрецедентной скоростью и точностью и получившую название CRISPR-Cas9. Новый мощный инструмент совершил радикально изменил подходы к изменению генов методом «вырезания и вставки» и был очень быстро адаптирован тысячами исследователей, работающих в сферах общей биологии и разработки лекарственных препаратов.
По словам Кригштейна, технология CRISPR предоставила специалистам новые экстраординарные возможности. Она позволяет устранять генетические причины или факторы, способствующие развитию заболеваний. Помимо этого исследователи могут редактировать мутации для того чтобы определить их критичность в появлении ранних дефектов развития.
Скорость и точность CRISPR однажды может помочь занимающимся стволовыми клетками ученым достичь своей наиболее амбициозной цели: репрограммирования генетически аномальных клеток пациентов с наследственными заболеваниями, такими как серповидноклеточная анемия и болезнь Гентингтона, в плюрипотентное состояние, редактирование их генетических дефектов в лабораторных условиях и их последующая дифференцировка в здоровые взрослые клетки. Такие клетки можно будет трансплантировать пациентам для восстановления нормальной функции.
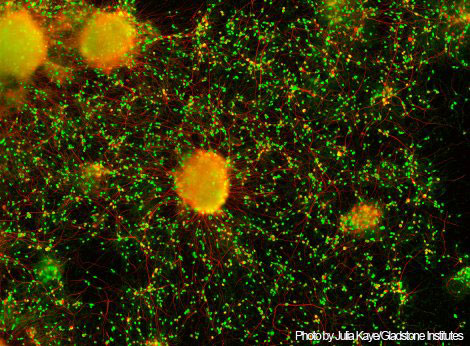
Дифференцированные из индуцированных стволовых клеток нейроны,
полученные из ткани пациентов с болезнью Гентингтона.
Тогда как до достижения этой цели еще очень далеко, в настоящее время уже проводится несколько ранних стадий клинических исследований методов лечения различных заболеваний, начиная от сахарного диабета и болезней сердца и заканчивая болезнью Паркинсона, с помощью индуцированных плюрипотентных стволовых клеток.
В рамках одного из таких исследований первый пациент уже прошел терапию. В 2014 году японские исследователи выделили индуцированные плюрипотентные стволовые клетки из клеток кожи женщины с макулярной дегенерацией и дифференцировали их во взрослые клетки сетчатки. Хирурги трансплантировали полученные клетки в глаза пациентки с целью избавить пациентку от заболевания. Эта женщина стала первым пациентом, перенесшим терапию индуцированными плюрипотентными стволовыми клетками.
Исследователи посвятили свою работу заболеванию глаз отчасти потому, что дифференцировка стволовых клеток в клетки сетчатки достаточно проста по сравнению с дифференировкой в другие типы клеток. Помимо этого относительно простой является процедура трансплантации клеток в ткани глаза.
Подготовку к проведению процедуры второму пациенту пришлось остановить, так как исследователи обнаружили мутацию в одном из генов индуцированных плюрипотентных стволовых клеток, полученных из собственных клеток пациента. Не существует данных, свидетельствующих о взаимосвязи между этим геном и развитием рака, однако они решили не использовать эти клетки для того, чтобы устранить любые потенциальные риски.
Успех лечения отчасти зависит от высокой скорости пролиферации стволовых клеток. В некоторых случаях для трансплантации могут понадобиться сотни миллиардов клеток. Однако даже если несколько стволовых клеток не смогут дифференцироваться во взрослые клетки-мишени, после трансплантации они могут начать очень быстро делиться и в конечном итоге сформировать опухоль.
Яманака отмечает, что на сегодняшний день одной из основных задач данной области является разработка методов, обеспечивающих дифференцировку всех стволовых клеток до трансплантации.
Для устранения риска развития рака исследователи проводят «глубокое секвенирование» генетического профиля каждой из линий стволовых клеток, потенциально пригодных к клиническому применению. Они также решили использовать донорские клетки, а не собственные клетки пациента. Это позволяет избежать больших финансовых затрат на проведение контроля качества, такого как глубокое секвенирование, для линий плюрипотентных клеток каждого пациента.
Применение иПСК в скрининге препаратов
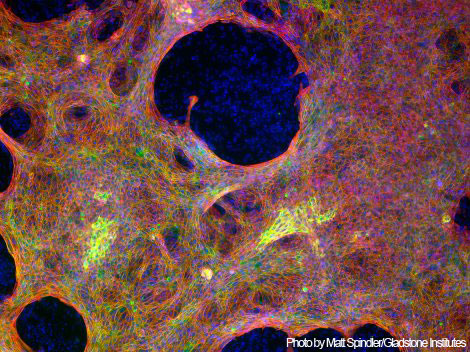
Кардиомиоциты, полученные путем репрограммирования
из клеток нормальной кожи взрослого человека.
Перспективы использования стволовых клеток распространяются и на тестирование лекарственных препаратов на индуцированных плюрипотентных стволовых клетках, полученных из взрослых клеток человека, вместо животных моделей.
Одним недавним примером является работа Катерины Маммери (Catherine Mummery), невролога из Национальной клиники неврологии и нейрохирургии Великобритании, использовавшей полученные из индуцированных плюрипотентных стволовых клеток человека зрелые кардиомиоциты – клетки сердца, сокращающиеся в чашке Петри, – для тестирования двух коммерческих доступных препаратов для лечения заболеваний сердечно-сосудистой системы. Она продемонстрировала, что оба препарата запускали такие же терапевтические эффекты при применении в одной дозировке и такие же токсические реакции в другой дозировке, как было показано в клинических исследованиях.
По словам Кригштейна, это впечатляющая работы послужила доказательством того, что применение в тестировании препаратов вместо животных моделей взрослых человеческих клеток, полученных из индуцированных плюрипотентных стволовых клеток, обеспечивает получение достоверных результатов, более актуальных для пациентов.
Другие источники, старые и новые
Исследования с использованием стволовых клеток не ограничены индуцированными плюрипотентными стволовыми клетками. В некоторых отношениях золотым стандартом остаются эмбриональные стволовые клетки (ЭСК). Специалист в клеточной биологии из университета Калифорнии в Сан-Франциско доктор Сюзан Фишер (Susan Fisher) сравнивает находящиеся на ранней стадии развития эмбриональные стволовые клетки с чистой доской. Она поясняет, что они имеют «более короткую историю и меньше багажа», чем индуцированные плюрипотентные стволовые клетки. Однако также как Яманака и Кригштейн она признает, что область изучения стволовых клеток еще слишком молода для того, чтобы заявлять о превосходстве одной стратегии над другой.
Сильная поддержка идеи применения эмбриональных стволовых клеток в трансплантационной медицине возникла два года назад, когда групп исследователей из Гарвардского университета продемонстрировала, что клеточные линии, полученные из эмбриональных стволовых клеток, могут продуцировать неограниченное количество инсулинпродуцирующих островковых клеток поджелудочной железы. В настоящее время проводится клинические исследования ранней стадии, целью которых является тестирование безопасности и эффективности трансплантации островковых клеток пациентам с целью лечения сахарного диабета 1 типа.
На 2014 год в разных странах проводились сотни клинических исследований, основной задачей которых являлось тестирование безопасности и эффективности методов лечения различных заболеваний, начиная от сердечной недостаточности и заканчивая болезнью Паркинсона.
К двум хорошо известным стратегиям получения стволовых клеток недавно добавилась третья, получившая название прямое репрограммирование или трансдифференцировка клеток. Данный метод подразумевает непосредственное превращение клеток кожи в клетки-мишени – клетки головного мозга, сердца, поджелудочной железы, – исключая предварительного этапа их возвращения в полностью плюрипотентное состояние. Этот метод позволяет избежать риска развития рака, являющегося неотъемлемой часть дифференцировки истинно плюрипотентных клеток.
В этом году Дипак Сривастава (Deepak Srivastava), руководитель исследований в области сердечно-сосудистых заболеваний и стволовых клеток в институтах Гладстоуна и профессор педиатрии, биохимии и биофизики в университете Калифорнии в Сан-Франциско, и группа, работающая под руководством доктора Шена Дина, эффективно трансформировали мышиные клетки кожи в клетки мозга, а также сокращающиеся клетки сердца с помощью комбинации химических соединений. Этот подход может стать эффективным методом регенерации отмирающих или пораженных заболеванием клеток и тканей.
Этические вопросы и общественное восприятие
По мере научного прогресса во многих областях Яманака пришел к выводу, что наука очень сильно опережает попытки рассмотрения этических вопросов некоторых исследовательских направлений.
Когда Яманака и его коллеги создавали плюрипотентные стволовые клетки их целью было преодоление этических вопросов, связанных с эмбриональными стволовыми клетками. Сейчас эта работа порождает новые этические вопросы. Исследователи могут создавать сперматозоиды или яйцеклетки из индуцированных плюрипотентных стволовых клеток, по крайней мере, из мышиных. Также теоретически существует возможность выращивания человеческих органов организме свиней или других животных путем введения человеческих индуцированных плюрипотентных стволовых клеток в эмбрионы животных, создавая так называемые химеры.
Помимо этого он выражает беспокойство по поводу общественного восприятия, согласно которому скорость прогресса может быть меньше ожидаемой. Яманака отмечает, что он «восхищен тем, насколько быстро развивается наука. Это просто поразительно. Однако большей частью разработка новых методов терапии – проведение научных исследований, тестирование безопасности и эффективности новых методов лечения – требует больших финансовых и временных затрат. Разработка новых методов лечения может растянуться на 10, 30 и 30 лет. Это мы и пытаемся объяснить нашим пациентам: мы делаем большие успехи, поэтому не теряйте надежды. Однако на это требуется много времени».
17.10.2016 Источник: Евгения Рябцева
Портал «Вечная молодость» http://vechnayamolodost.ru по материалам University of California: Despite Major Progress Toward Disease Therapies, Some Technical and Ethical Challenges Still Lie Ahead.








































































