 Сотрудники лаборатории фундаментальных исследований Международного научно-исследовательского клинико-образовательного центра регенеративной медицины.
Сотрудники лаборатории фундаментальных исследований Международного научно-исследовательского клинико-образовательного центра регенеративной медицины.
Регенеративная медицина находится в зачаточном состоянии. Но мечту вырастить орган «в пробирке» лелеют сотни учёных и медиков по всему миру, ради неё они работают практически круглосуточно, в том числе и в России. Один из значимых центров исследований в области регенеративной медицины находится в Краснодаре. Там мы поговорили о тенденциях и перспективах развития выращивания органов с заведующей лабораторией фундаментальных исследований в области регенеративной медицины, руководителем фундаментального направления исследований Международного научно-исследовательского клинико-образовательного центра регенеративной медицины Еленой Александровной Губаревой.
XX2 ВЕК. Одно время про Центр регенеративной медицины в Краснодаре говорили многие СМИ, включая федеральные каналы. Журналисты в основном заявляли, что в России создаются искусственные органы, но если отбросить громкие заголовки, над чем вы работаете сейчас?
Е. А. Губарева Мы ведём несколько параллельных исследований, направленных на изучение регенерации интраторакальных органов и тканей. Дальше всего мы продвинулись в исследовании регенерации тканей диафрагмы и пищевода. В начале года нам удалось провести успешные операции по пересадке крысам тканеинженерной диафрагмы. Заместили им более 80% левого купола диафрагмы и уже на 21 сутки получили потрясающий результат. Новая ткань не только полностью интегрировалась в окружающую, но ещё и стала сокращаться при отсутствии нарушений физиологических функций у животных.
Сейчас животные находятся в хроническом эксперименте и чувствуют себя хорошо. Мы наблюдаем за тем, как ведёт себя тканеинженерная конструкция. Главное, чтобы диафрагма не утратила свою сократительную функцию, то есть не заместилась соединительной тканью. Это основное коварство нашего организма — любая повреждённая ткань замещается соединительной. А наша цель — это стопроцентная регенерация. Поэтому мы сейчас наблюдаем за системным ответом организма на трансплантацию диафрагмы.
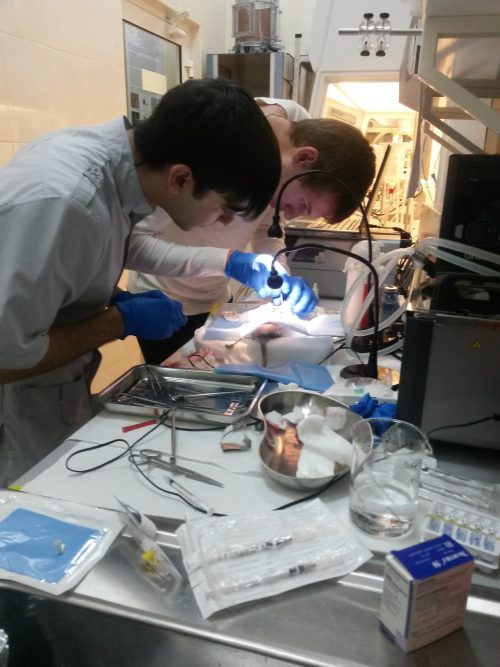 Трансплантация диафрагмы крысе.
Трансплантация диафрагмы крысе.
XX2 ВЕК. На каком этапе другие исследования?
Е. Г. Изначально, в рамках Мегагранта Правительства РФ, по которому мы работали до декабря 2015 г., мы изучали интраторакальные органы, то есть те, которые находятся в грудной клетке. Одновременно мы начали заниматься созданием тканеинженерных матриксов сердца, лёгких, диафрагмы и пищевода. С органами планарной (плоской) пространственной организации, типа диафрагмы, всё оказалось немного проще, чем с такими сложно организованными, как сердце и лёгкие, но и здесь у нас есть некоторые успехи. Мы получили децеллюляризированные (бесклеточные) матриксы и научились стерилизовать каркасы, не разрушая внеклеточный матрикс. Следующий этап для нас — это поиск клеточной линии, которая при засеивании каркасов могла бы дать полноценную тканеиженерную конструкцию.
В случае сердца и лёгких это очень сложная задача, так как эти органы представляют комплексные системы, состоящие из огромного количества различных клеток, и было бы наивно полагать, что за 1—2 года можно создать полноценный тканеинженерный орган. Сейчас речь идёт скорее о создании элементов органов, так называемых patch, то есть заплаток. Как только мы найдём наиболее подходящие клеточные линии, мы продвинемся в исследовании сердца и лёгких дальше.
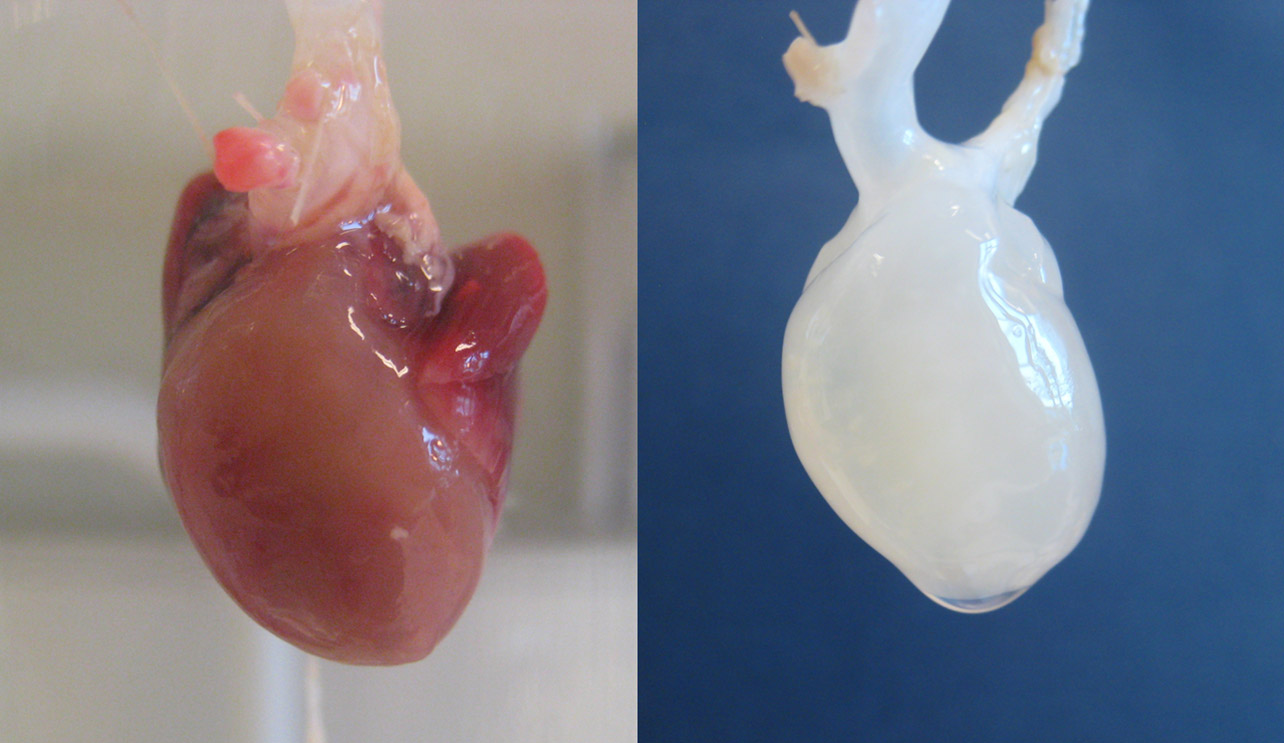 Децеллюляризация сердца.
Децеллюляризация сердца.
XX2 ВЕК. Какова главная сложность при выделении клеточных линий? Что вы использовали для создания диафрагмы?
Е. Г. Сложность заключается в том, что стволовые клетки потенциально могут превращаться в злокачественные при нарушении процессов контроля организма за делением клеток и клеточной гибелью. Разные клетки имеют разную степень риска превращения в злокачественные. Есть проверенные клеточные линии, есть высокоопасные. Мы работаем с мезенхимальными клетками, получаемыми из костного мозга. В обычных физиологических условиях они обеспечивают регенерацию. Кроме того, мы используем и мононуклеарные клетки, выделяемые из периферической крови. Данные типы клеток мы использовали при трансплантации диафрагмы крысам в 2015 году. Необходимо понимать, что клеткой сложно научиться манипулировать, но наука пытается научиться отбирать те ресурсы, которые менее опасны.
XX2 ВЕК. Расскажите про технологию создания каркасов. Я так понимаю, вы работаете с биологическими каркасами, но весь смысл регенеративной медицины состоит в том, чтобы прийти к искусственным каркасам, ведь это и будет, по сути, означать «вырастить орган в пробирке».
Е. Г. Умение создавать целые органы на основе даже биологических каркасов станет большим прорывом, хотя, безусловно, проблему донорства не решит. Понимаете, пациенты, которым были пересажены тканеинженерные конструкции, в отличие от пациентов с донорскими органами, не нуждаются в иммуносупрессивной терапии. Человек, которому трансплантировали чужой орган, всю свою жизнь вынужден получать данную терапию. Это значительно снижает его качество жизни. Такие пациенты зачастую погибают от оппортунистических инфекций, им нельзя болеть. И потому регенеративная медицина так важна, ведь тканеинженерная конструкция не содержит в себе чужеродный генный материал и не атакуется иммунными клетками реципиента.
Но вы правы, существует два варианта, рассматриваемых регенеративной медициной. Это использование биологических каркасов, созданных на основе донорских органов, и синтетических каркасов из полимеров. Мы работаем и с теми, и с другими, но большие успехи мы получили именно при использовании биологических каркасов.
XX2 ВЕК. Где создаются эти каркасы?
Е. Г. Биологические каркасы мы создаём здесь, в лаборатории. Берём донорский орган лабораторного животного и подбираем для него способ удаления клеточного материала (децеллюляризации). Если орган имеет развитую сосудистую сеть, то воздействуем через неё перфузией растворов, если это плоскостной орган (с планарной пространственной организацией), типа диафрагмы, кожи или хряща, мы помещаем его в специальные растворы на ротирующую платформу. Весь процесс децеллюляризации происходит в специальном биореакторе под воздействием растворов ферментов и детергентов различной концентрации. Они действуют как ПАВ, разрушают клеточную мембрану, она лопается, и всё содержимое, грубо говоря, вымывается, остаются только компоненты внеклеточного матрикса. В итоге орган при сохранении трёхмерной формы, становится полностью обесклеточенным и состоит на этом этапе из коллагенов, эластина, фибронектина и других компонентов внеклеточного матрикса.
 Децеллюляризация диафрагмы.
Децеллюляризация диафрагмы.
Затем мы оцениваем качество децеллюляризации, тестируем каркас на содержание компонентов внеклеточного матрикса, таких как коллагены и эластины, определяем количество остаточного ДНК. Обязательно подсаживаем эти матриксы на холку животных подкожно, чтобы посмотреть, вызовут ли они иммунный ответ, будет ли матрикс прорастать сосудами, будут ли к нему прикрепляться клетки, будут ли они при этом жизнеспособны. Это серьёзный подход, требующий много времени. На отработку каждого матрикса ушло почти полтора года в случае с диафрагмой. Это без учёта времени, которое требуется, чтобы заселить матрикс клетками. В общей сложности на отработку методики одного несложного органа уходит до 5 лет.
Что касается синтетических каркасов, для нас их делают наши коллабораторы из НИЦ «Курчатовский институт». Эти каркасы создаются из различных полимерных материалов, в том числе естественных полимеров с помощью технологии электроспиннинга. Также развивается 3D-принтинг, но эта технология в области регенеративной медицины делает только первые шаги. К сожалению, при нынешнем уровне развития технологий придумать что-то удачнее биологического каркаса очень сложно. Чрезвычайно непросто повторить созданное природой: сталкиваешься с огромным количеством проблем…
XX2 ВЕК. Инженерных или фундаментальных?
Е. Г. Фундаментальных. Наши коллеги-физики и инженеры говорят, что готовы сделать для нас всё что угодно, если мы объясним, что именно надо получить в итоге. Им важно понимать, какой диаметр полимерного волокна должен быть, какие размеры конструкции. Но дело не только в этих параметрах. Биологические каркасы задуманы природой так, что в них заложена развитая сосудистая сеть, и это основа для прорастания каркаса новыми сосудами. Наша диафрагма ведь вся проросла ими. И даже если тех клеток, которые мы засеяли, недостаточно, чтобы вызвать регенерацию, то по сосудистому руслу к этой структуре будут направлены собственные стволовые клетки костномозгового происхождения. А искусственно сосудистую сеть пока создать невозможно. Может быть, выход в том, чтобы насытить материал активатором ангиогенеза. Но даже если синтетическая конструкция прорастает сосудами, это не значит, что всё в порядке, в организме может развиться хронический воспалительный процесс. Поэтому синтетические материалы требуют тщательной научной проверки.
XX2 ВЕК. То есть вы не трансплантировали ещё искусственные каркасы?
Е. Г. Коллеги из Курчатовского института сейчас создают для нас каркасы для исследований in vitro («в пробирке»). Мы заселяем их клетками и смотрим, что с ними происходит: прикрепились ли они к материалу, сохраняют ли жизнеспособность при длительном культивировании, есть ли пролиферация, сохранен ли дифференцировочный потенциал. Это скорее лоскуты, а не органы. Пока мы протестировали несколько материалов, они зашифрованы, и тест ведётся двойным слепым методом, чтобы ни коллеги из Курчатовского института, ни мы не могли повлиять на результаты. Мы часто общаемся, по скайпу и лично, обсуждаем результаты работы.
Вживляли мы полимерные каркасы только на холку крысам подкожно, чтобы посмотреть вызывают ли они какую-то реакцию. Некоторые вызывают. Это зависит от того, чем они обрабатываются. И вообще, история поведения клеток «в пробирке» и внутри организма — это разные истории. Наличие хороших результатов in vitro не означает, что клеткам будет так же хорошо в организме.
XX2 ВЕК. Полимерные каркасы позволяют органу расти внутри организма? Вообще, как себя ведут каркасы со временем?
Е. Г. Мы как раз за этим наблюдаем на примере диафрагмы. Крысам сейчас 6 месяцев, эти животные живут в среднем 2 года, и самое интересное для нас начнётся через год. Мы увидим, не будет ли натяжений диафрагмы. В принципе, она должна расти вместе с организмом.
И полимерные каркасы не препятствуют росту органа, если они созданы из биодеградируемых материалов, которые рассасываются со временем.
 Для тестирования матриксы подсаживают подкожно на холку крысе. На фото — крыса в индивидуальном приспособлении для фиксации электродов из термопластического полимера.
Для тестирования матриксы подсаживают подкожно на холку крысе. На фото — крыса в индивидуальном приспособлении для фиксации электродов из термопластического полимера.
XX2 ВЕК. Вы считаете, что медицина дойдёт до использования исключительно полимерных каркасов?
Е. Г. Это мечта любого врача — открыть шкаф и достать новый орган для пациента. Но пока это нереально. Особенно, если говорить о целом органе. Скажем, сердце необходимо не просто создать — его надо научить биться. Проводящая система сердца ведь закладывается в эмбриональном периоде. Если мы говорим о лёгких, то, есть такие клетки — альвеолоциты — которые вырабатывают сурфактант — вещество, позволяющее альвеолам не спадаться при дыхании. Это тоже закладывается на этапе эмбрионального развития. То есть создание целого работоспособного органа — это сверхзадача. Сложно говорить сейчас о том, когда мы сможем этого добиться. Но об этом очень хочется мечтать. В этом есть немного романтики, все мы верим, что это возможно, хотя и понимаем, что наших жизней на это не хватит.
 Децеллюляризированные лёгкие примата.
Децеллюляризированные лёгкие примата.
XX2 ВЕК. Вы упомянули сотрудничество с Курчатовским институтом. С кем ещё вы сотрудничаете или ведёте совместные проекты?
Е. Г. Мы открыты всему миру. Сотрудничаем с факультетом фундаментальной медицины МГУ и надеемся на совместную работу с ними по созданию тканеинженерного сердца. Также у нас существует коллаборация с Первым Московским государственным медицинским университетом имени И. М. Сеченова, и мы начинаем проект по созданию тканеинженерной почки. Отрабатываем технологию создания искусственной кожи с Приволжским федеральным медицинским исследовательским центром.
XX2 ВЕК. А на международном уровне?
Е. Г. Мы продолжаем сотрудничество с Каролинским институтом, надеемся на совместные проекты с коллегами из Германии.
XX2 ВЕК. То есть в области регенеративной медицины Россия развивается на уровне остального мира?
Е. Г. Мы идём в ногу с европейцами и американцами.
XX2 ВЕК. А какие страны в лидерах?
Е. Г. Страны Азии, особенно Китай. У них нет острых этических проблем, как на Западе. В Китае, например, нет строгих ограничений на использование эмбриональных стволовых клеток. Но до поставленных на поток клинических исследований не дошёл ещё никто. Все проходят доклинические исследования на животных. Перспективным направлением для применения в регенеративной медицине является создание кожи.
Кстати, в этом направлении мы планируем начать проект с коллегами из Нижнего Новгорода. Кожа очень нужна, все ждут эту технологию для лечения пациентов в ожоговых центрах.
XX2 ВЕК. Вы планировали работать над органами приматов. Эти планы в силе?
Е. Г. Мы отрабатываем протоколы получения децеллюляризированных матриксов интраторакальных органов и тканей на нечеловекообразных приматах в сотрудничестве с институтом приматологии в Сочи. Это огромный центр федерального значения, единственный в России. Мы понимаем моральную ответственность работы с приматами и ещё далеки от in vivo («на живом») исследований. Весь донорский материал мы получаем от обезьян, которые умерли своей смертью. Я думаю, что через 1,5—2 года мы подойдём к пересадке диафрагмы приматам, сейчас мы отработали процедуру по созданию матрикса и подошли к отбору клеточных линий.
XX2 ВЕК. Сколько человек работает сегодня в лаборатории?
Е. Г. В лаборатории работает 10 человек, все они выпускники КубГМУ. У нас в команде патологоанатомы, хирурги, патофизиологи, есть даже стоматолог, который занимается созданием математических моделей по полученным данным. Есть биохимики, физики, инженеры. Кроме того, как я сказала, мы не закрыты от мировой науки, нам помогают коллаборации с другими исследовательскими институтами.
XX2 ВЕК. Работы Центра публиковались в международных научных рецензируемых журналах?
Е. Г. Мы публиковали статьи в таких рейтинговых журналах как Biomaterials, Mayo Clinic Proceedings, Nature Communications. Три года подряд участвуем в международных конференциях по регенеративной медицине, и наши доклады высоко оцениваются коллегами. Доклад по тканевой инженерии лёгкого на Всемирной конференции по регенеративной медицине в Лейпциге (Германия) в прошлом году занял 1 место в номинации «Лучший постерный доклад среди работ, направленных на изучение регенерации внутренних органов». Такое признание говорит о том, что мы идём в верном направлении. Но для этого каждый день надо работать над собой, что-то в себе преодолевать. Свою лень, свою закрытость, например, выучить наконец-то английский язык, который раскрывает огромные перспективы по взаимодействию со всем научным сообществом. В нашей лаборатории высокие требования к владению английским языком на профессиональном уровне.
XX2 ВЕК. Сколько стоит выращивание диафрагмы для крысы? Испытываете трудности с финансированием после окончания Мегагранта?
Е. Г. С учётом того, что создание тканеинженерной конструкции — это комплексный подход, включающий в себя получение клеток, матрикса, длительное культивирование и т. д., то для одной крысы стоимость порядка 300—400 тыс. рублей. Проблема обостряется тем, что, к сожалению, в России нет необходимых для работы реагентов. Многие позиции необходимо заказывать за рубежом. Кстати, в проекте по диафрагме нами был создан и запатентован не имеющий аналогов, уникальный биореактор для децеллюляризации и последующего засеивания клетками.
Значительных проблем с финансированием мы не испытываем. В 2016 году мы начали работать в другом режиме. 25 декабря 2015 г. у нас закончился Мегагрант на 150 млн. руб., и мы перешли на финансирование от университета. Это уникальный пример поддержки, созданной в рамках Мегагранта лаборатории после его окончания. Мы бесконечно благодарны руководству и коллективу КубГМУ за доверие и возможность продолжать ту работу, которую начали в рамках Мегагранта. В год университет тратит на исследования около 5 млн руб. Конечно, если количество проектов будет увеличиваться, я думаю, сумма может меняться. Нас не лимитируют, для нас очень важно ежедневно доказывать, что это того стоит, доказывать результатами и публикациями, не снижать темпы.
XX2 ВЕК. Чего лично Вы хотите достичь в своей работе?
Е. Г. Регенеративная медицина, при всей её перспективности и быстроте развития, требует очень серьёзного горизонтального планирования. Я очень надеюсь, что мы сумеем через какое-то время замещать хотя бы маленькие участки органов, например, участки сердца пострадавшего от инфаркта миокарда, лёгкого при хронической патологии дыхательной системы или диафрагмы при врождённых грыжах у новорождённых. Это уже спасёт очень много жизней и сделает нашу работу не бесполезной.








































































