Экскурс в историю
С давних времен люди мечтали победить старость и вернуть себе молодость.
В «Метаморфозах» древнеримского поэта Овидия было описано, как мифическая колхидская царевна-волшебница Медея омолодила Эсона престарелого отца ее мужа. Усыпив старика травами она перерезала ему горло и выпустила его старую кровь, а затем влила в его тело волшебное зелье. «И — о, чудо! — волосы старика прежде белые, как снег, потемнели, пропали морщины и старческая худоба, на щеках вновь заиграл румянец. Проснулся Эсон и вновь увидал себя молодым, сильным и бодрым».
Поиски средства от старения, заложившие основы современной биогеронтологии начались, наверное, ещё в 1889 году, когда 72 летний французский ученый Броун-Секар сообщил о положительных результатах проведенного им на себе эксперимента. Он обнаружил, что подкожное впрыскивание человеку водного настоя свежих яичек морских свинок и собак приводит к увеличению общей мышечной силы и усилению умственной деятельности. Позднее правда выяснилось, что за периодом усиления физиологической деятельности, вызванной этим препаратом, названным эликсиром молодости Броун-Секара, наступает период упадка. Тем не менее, открытие Броун-Секара вдохновило многих исследователей на поиски путей омоложения.
Более 100 лет тому назад выходец из России, ставший впоследствии знаменитым благодаря разработанному им способу возвращения молодости путем трансплантации семенных желез Серж Воронофф (Сергей (Самуил) Воронов), наблюдая за кастратами евнухами, обнаружил, что у этих несчастных очень рано появлялись присущие старикам признаки старения и умирали они значительно раньше. Это привело его к мысли продлить состояние молодости с помощью трансплантации в старый организм молодых половых желез. Опыты на животных показали ошеломляющие результаты – старые козлы, овцы и быки начинали резвиться как молодые и спариваться. Вдохновлённый этими опытами, он приступил к омоложению пациентов. Операция заключалась в добавлении к человеческим яичкам тонкого среза взятого из яичек молодой обезьяны (среди людей доноров готовых расстаться со своими половыми железами, даже за крупное вознаграждение, было очень мало). Пересадки стоили громадных денег, но желающих омолодиться это не смущало. За короткий срок Воронов стал сказочно богат. В написанных Вороновым книгах, таких как «Омоложение прививанием» он хвастался, что его операции увеличивают у пожилых сексуальное влечение, слух, память, зрение, а также повышают физическую выносливость и работоспособность. Тем не менее, пациенты Воронова отнюдь не отличались долгожительством. Да и сам он, по воле случая, дожил только до 85 лет, успев правда жениться в 70 лет на красавице, которая была на 49 лет моложе его.
Идеи Воронова и Броун-Секара об омоложении путем гормональной стимуляции используются врачами-геронтологами и в наше время.
Родоначальником современных подходов к продлению жизни путём трансплантации следует считать ещё одного исследователя. В начале 1930 х годов швейцарский врач Поль Ниханс разработал способ борьбы со старостью с помощью клеточной терапии. Он использовал клетки, полученные из эмбриональных тканей овец. Введение таких клеток в стареющий организм активировало в нем процессы регенерации. Разумеется, клетки животных не способны встроиться в организм пациента, однако они снабжают его гуморальными факторами, способствующими оздоровлению, и активируют его иммунную систему. Эта терапия, которую практикуют в Германии и Швейцарии и по сей день, связана с определенным риском заразиться от животных некоторыми инфекционными заболеваниями. Но туристов со всего мира это не останавливает.
Доказательства обратимости старения. Перепрограммирование соматических клеток. Получение ИПСК.
Следующим важным шагом на пути к методам омоложения, теперь уже радикальным, стали опыты Бриггса и Кинга, которые в 1952 году пересадили ядро из клеток эмбриона в лишенную ядра яйцеклетку лягушки Rana pipiens и сумели получить нормальных плавающих головастиков.
Таким образом было получено первое доказательство того, что ядро дифференцированной клетки может быть использовано вместо ядра нормально оплодотворенных яиц, а следовательно процессы развития на клеточном уровне обратимы, их можно повернуть вспять.
Следует отметить, что еще в 1948 году российским эмбриологом Г. В. Лопашовым был разработан метод пересадки (трансплантации) ядер в яйцеклетку тритона. Однако его статья, отправленная в «Журнал общей биологии», так и не была опубликована из-за гонений на генетиков.
В 1962 году Джону Гёрдону впервые удалось пересадить ядро, взятое из эпителиальных клеток кишечника головастиков Шпорцевой лягушки, то есть из полностью дифференцированных клеток, и получить из них взрослое животное. Таким образом, было доказано, что в ядре эпителиальной клетки есть вся необходимая информация для образования всех клеток взрослого организма. Вместе с тем, для того чтобы получить все эти клетки, ядро эпителиальной клетки необходимо сперва омолодить перепрограммированием обратно в «эмбриональное» состояние, а сделать это может цитоплазма яйцеклетки, активируя в нём генетическую программу, необходимую для эмбрионального развития.
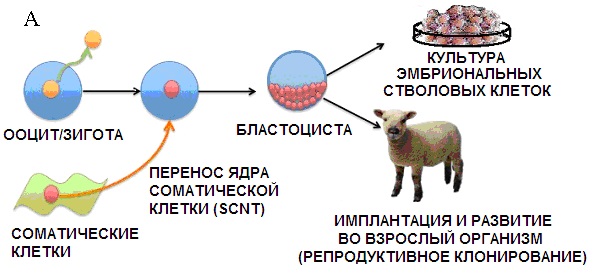

Рис. 1. А. Схема метода перепрограммирования соматических клеток путём переноса ядер соматических клеток (Somatic cell nuclear transfer — SCNT) в ооциты-реципиенты; Б. Клон самцов альбиносов лягушки полученный путем пересадки ядра из клеток эмбриона лягушек альбиносов в энуклеированные яйца самки дикого типа (не являющейся альбиносом) . Слайд в свободном доступе [[1]].
Развитие этого метода пересадки ядра из взрослых соматических клеток в яйцеклетку с удаленным или инактивированным ядром, названного SCNT (somatic cell nuclear transfer), позволило клонировать животных (всем известен триумфальный опыт с овечкой Долли), а также получать индуцированные плюрипотентные стволовые клетки (сокращенно ИПСК) [[2]]. Но, что, пожалуй, самое главное, этот метод заложил основу для так называемого терапевтического клонирования, которое позволит в ближайшем будущем не только излечивать такие ранее неподдающиеся лечению дегенеративные заболевания как амилотрофический склероз или Болезнь Паркинсона, но и лечить от старости.
Важно отметить, что для перепрограммирования методом SCNT используется натуральный природный механизм, а не вирусные векторы или химические препараты.
На основе этого метода был создан препарат BQ-A, который по утверждению его авторов позволяет в 1.7 раза продлить жизнь мышкам (что при пересчете на среднюю продолжительность человека в 72 года означало бы повышение средней продолжительности жизни до 122 лет) и в 2.2 раза жизнь плодовым мушкам – дрозофилам.
К сожалению, метод пересадки ядер на сегодняшний день не может использоваться в широкой медицинской практике, так как процедура трансплантации ядер очень трудоемкая и ненадёжная, а необходимые для её использования яйцеклетки можно получить только от доноров (впрочем, в 2016 году ооциты удалось получить из клеток кожи, правда пока только мыши [[3]]).
Тем не менее, в 2006 году японским исследователям Такахаши и Яманака удалось найти способ обходиться для омоложения без яйцеклеток. С помощью разработанной ими системы селекции удалось отобрать из числа 92 белков, синтез которых возрастал на начальных стадиях эмбриогенеза, те факторы, которые позволяют воспроизвести процесс омоложения соматической клетки без участия яйцеклетки, вместо которой они использовали ретровирусы, каждый из которых нес уникальную кольцевую ДНК кодирующую тот или иной фактор [[4]]. Поочередным исключением одного из кандидатов удалось сначала сократить список этих факторов до 10, а затем до всего четырех: Oct3/4, Sox2, c-Myc и Klf4, впоследствии названных факторами Яманаки.
К числу подобных факторов сейчас относят также Nanog – белок, образующий димеры, необходимые для блокировки дифференцировки плюрипотентных клеток, Lin28 участвующий в регуляции микро РНК let-7, её мишень — белок Nr6a1, а также Sall4, поскольку именно комплекс Oct4-Sox2-Sall4 действует на клетку подобно ластику, удаляющему весь предыдущий опыт клетки [[5]], а значит и «записи» о старении. Оооциты млекопитающих также содержат особый линкерный гистон H1foo, способствующий перепрограммированию и получению более качественных ИПСК, «разрыхляя» хроматин и таким образом делая его более доступным для транскрипции [[6]]. За доказательство того факта, что взрослые дифференцированные клетки могут быть возвращены обратно в состояние, когда из них снова, причем неоднократно, можно получить полноценный взрослый организм с нормальной продолжительностью жизни [[7]], Джон Гёрдон и Синья Яманаки в 2012 году получили Нобелевскую премию.
В результате перепрограммирования в ИПСК возвращаются к показателям эмбриональной ткани все маркеры старения [[8] [9] ]: восстанавливается длина теломеров [[10]], профиль метилирования ДНК и гистонов [[11]], резко снижается уровень p16INK4A и p21CIP1. Омолаживаются и митохондрии клетки [[12] [13]] при этом восстанавливается количество митохондрий, их морфология и клеточный метаболизм [[14] [15]], подавляются связанные со старением пути митохондриального окислительного стресса [[16] [17]], за счет чего восстанавливается характерный для молодых клеток уровень дыхания, хотя при этом остаются некоторые из накопленных за время жизни мутаций в митохондриальной ДНК [[18]]. Причем, что самое главное — показатели омоложения сохраняются и в полученных из ИПСК соматических клетках [[19]].
Доказано что ИПСК могут быть получены путем омоложения клеток даже от столетних людей [[20]]. Поэтому ИПСК, которые можно неограниченно размножать культивированием, могут стать удобным источником омоложенных клеток для клеточной терапии и различных способов получения миниатюрных органов – органоидов.
В отличие от перепрограммирования до ИПСК, при других способах перепрограммирования – при, так называемом, прямом перепрограммировании и трансдифференцировке омоложения клеток не происходит [[21]], поэтому мы их здесь не рассматриваем.
Клеточные технологии на основе ИПСК – источник возможностей омоложения.
Мы не будем здесь рассматривать те случаи, когда из-за генетических нарушений происходит преждевременное старение – прогерия. Хотя пациенты с прогерией обычно умирают от болезней характерных для пожилых людей (инсульта, инфаркта миокарда, злокачественных новообразований) [[22]], технология перепрограммирования в ИПСК не позволяет лечить эти болезни, так как хотя полученные в этом случае ИПСК и становятся вновь молодыми [[23]], полученные из них соматические клетки очень быстро вновь становятся старыми [[24] [25]]. Помочь в этом случае смогут фармакологические препараты вроде JH4 (при старении, вызванном прогерином [[26]]) или такие ингибиторы фарнезилтрансферразы (farnesyltransferase) как ABT-100 (при старении вызванном преламином А [[27]]), а также методы генной терапии.
Широкому внедрению способов омоложения с помощью тканей и органов, полученных из ИПСК, препятствует трудоемкость их получения [[28]]. По словам Синья Яманаки для того, чтобы сделать клеточную линию ИПСК удовлетворяющую стандартам необходимым для её использования в клинике, требуется два года работы группы из 50 человек. В то же время подобрать подходящие готовые ИПСК, которые не будут отторгнуты организмом пациента, также сложно, как найти орган для трансплантации. Поэтому в Японии и США, чтобы удешевить и ускорить использование ИПСК для клеточной терапии и выращивания органов для трансплантации, создаются банки ИПСК, взятых от универсальных доноров, которые гомозиготны по антигенам тканевой совместимости человека HLA (Human Leukocyte Antigens). Это как группы крови. Люди с группой 0(I)Rh- считаются «универсальными донорами», и их кровь может быть перелита почти любому за редким исключением. Подсчитано что ИПСК полученных от 200-250 универсальных доноров достаточно, чтобы обеспечить совместимым материалом для трансплантации 95% населения США. В отличие от крови, однажды полученную линию ИПСК можно поддерживать и размножать неопределённо долго – они остаются молодыми.
Альтернативой банкам ИПСК является создание универсально совместимых ИПСК, однако их использование сопряжено с серьёзным риском болезней от вирусных инфекций и опухолей, перед которыми организм, в этом случае становится бессилен [[29]].
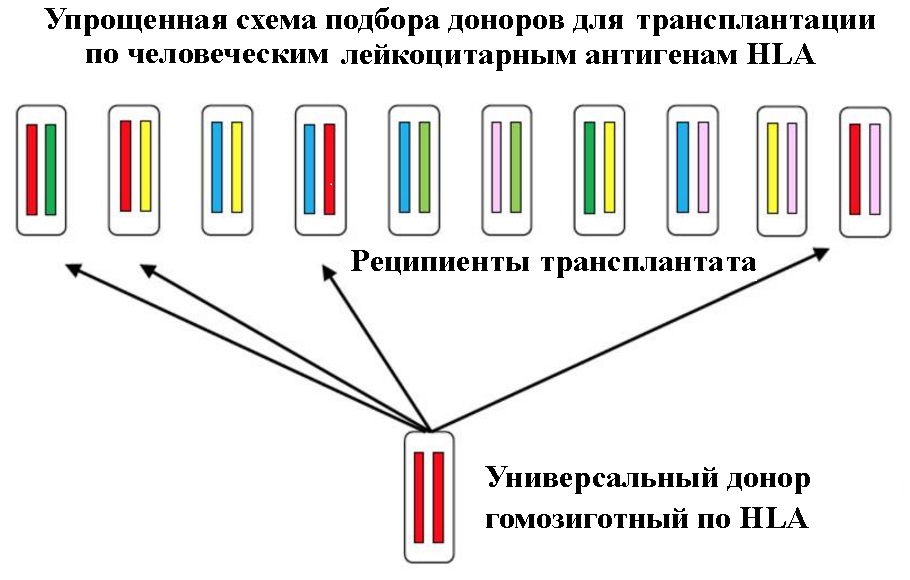
К счастью не все ткани организма обязательно должны быть подобраны по соответствию донора и пациента, для того чтобы избежать иммунного ответа, приводящего к отторжению трансплантата.
Приятным исключением является хрящевая ткань. Она состоит из хондроцитов и внеклеточного матрикса. При пересадке внеклеточный матрикс защищает хондроциты от иммунных клеток хозяина, предотвращая тем самым иммунный ответ. Кроме того, на клеточной поверхности хондроцитов мало антигенов HLA, которые ответственны за запуск иммунной реакции. Поэтому для выращивания хрящей необходимых для трансплантации пациентам можно использовать любой человеческий источник ИПСК [[30]].
ИПСК — неиссякаемый источник для получения омоложенных ММСК
Одним из важнейших условий функционирования человеческого организма и поддержания его здоровья является постоянное обновление тканей и органов в котором участвуют взрослые стволовые клетки и в том числе мультипотентные мезенхимальные стволовые клетки (ММСК). С возрастом всё больше этих клеток утрачивает свою способность поддерживать регенерацию, что связано с изменениями в активности более 5000 генов [[31]].
Большинство заболеваний, характерных для пожилых людей, таких как анемия (недостаточное производство эритроцитов), саркопения (потеря мышечной массы), и остеопороз (снижение плотности и прочности костей), имеют в своей основе дисбаланс между потерей клеток и их обновлением. Первопричиной такого дисбаланса главным образом является понижение в процессе старения числа и качества стволовых клеток [[32]].
Поэтому важнейшим подходом к омоложению организма является восстановление или хотя бы регулярное возмещение численности этих клеток в организме.
Для восполнения стволовых клеток и реабилитации процессов регенерации, пожилым пациентам требуются различные виды клеточной терапии [[33]]. Есть, к примеру, свидетельства того, что по сравнению с людьми, получившими стандартное лечение хронической ишемической болезни сердца и сердечной недостаточности, получатели терапии стволовыми клетками с меньшей вероятностью снова попадают в больницу или умирают в течение года или более после лечения [[34] [35]].
Фактором, сдерживающим развитие методов клеточной терапии, являлась сложность и болезненность процедур по выделению стволовых клеток из человеческого организма и отсутствие качественных методов их размножения культивированием.
Между тем для производства мультипотентных мезенхимальных стволовых клеток (ММСК), поскольку они являются иммунопривилегированными клетками [[36]], можно использовать любой человеческий источник ИПСК. Особенно если предполагается использовать ММСК для лечения паракринными факторами, которые они секретируют, а сами ММСК вводить в виде инкапсулированных клеток, защищённых от иммунной системы организма оболочкой [[37] [38]], которая к тому же способна создать благоприятную искусственную нишу (микроокружение) способную подпитывать клетки и стимулировать их активность [[39] [40]].
Воздействием на ИПСК человека препаратом SB431542 (ингибитор TGFB (Transforming growth factor beta)) можно достаточно быстро получить однородную культуру индуцированных мультипотентных мезенхимальных стволовых клеток (иММСК), которые по свойствам мало чем отличаются от молодых ММСК [[41]]. Есть правда сведения о том, что омоложенные иММСК, по сравнению с изначально молодыми ММСК, иногда утрачивают способность подавлять пролиферацию Т-клеток [[42]]. Это очевидно связано с источником получения ИПСК, так как иММСК, полученные из ткани дёсен, обладали мощными иммуносупрессивными свойствами, демонстрируя способность подавлять Т-клетки эффекторных клеток, популяции Th1 / Th2 / Th17, а также повышенные уровни клеток Treg [[43]]. По сравнению с ММСК полученными от людей среднего и пожилого возраста, иММСК демонстрируют превосходную способность стимулировать заживление ран и проангиогенные свойства (способствовать развитию сети сосудистых капилляров). Поэтому использование ИПСК для получения иММСК открывает возможность широко использовать методы клеточной терапии для лечения различных болезней старческого возраста [[44] [45]]. К примеру, полученные из ИПСК и модифицированные невирусной трансфекцией для гиперэкспрессии гена BMP6 человеческие иММСК способны более эффективно, чем ММСК полученные из костного мозга человека регенерировать не сраставшиеся костные дефекты у мышей [[46]]. Пригодятся иММСК и для терапии при ишемическом инсульте, поскольку в доклинических испытаниях на моделях инсульта они оказывали нейропротекторное действие, способствовали регенерации, развитию кровеносных сосудов, снижали воспаление [[47]]. Помогут и для борьбы с фиброзом печени [[48]], а также с такими болезнями старческого возраста как остеопороз и остеоартрит [[49]].
Помимо методов получения иММСК разработаны и методы получения других клеток [[50]]. Наиболее важными из них являются методы получения из ИПСК эндотелиальных клеток [[51] [52]]. Их можно будет использовать для лечения таких возрастных заболеваний как ишемическая ретинопатия [[53]], инсульт [[54]], регенерации сосудов для лечения ишемии конечностей, диабетической ангиопатии и нефропатии [[55]]. Кроме того, с их помощью можно будет выращивать органоиды, обладающие кровеносной сетью, а значит более пригодные для трансплантации [[56]].
иММСК — «фабрика» по производству омолаживающих факторов и экзосом
Было неоднократно показано, что терапевтическая эффективность мезенхимальных стволовых клеток обычно опосредована не их дифференцировкой и включением в ткань мишень, а секретируемыми ими трофическими факторами.
Поэтому еще одно перспективное направление использования иММСК — это производство омолаживающих факторов. Известно, что молодые клетки ММСК способны продлить жизнь старым животным [[57]]. Японскими исследователями был идентифицирован фактор, стимулирующий регенерацию тканей. Этот фактор известный как Gdf6 (growth differentiation factor 6) секретируют молодые ММСК. Но с возрастом синтез этого фактора падает, что связано со снижением синтеза микроРНК-17 [[58]]. Гиперэкспрессия Gdf6 in vivo смягчала такие проявления патологий, связанных со старением как снижение лимфопоэза, недостаточная репарация мышц, снижение количества нервных клеток-предшественников в головном мозге и хроническое воспаление [[59]].
Ещё одним фактором терапевтического воздействия ММСК являются внеклеточные везикулы — крошечные внеклеточные пузырьки, которые выделяют клетки различных тканей и органов в окружающую их среду [[60]].
Внеклеточные везикулы, в том числе экзосомы и эктосомы, играют важнейшую роль в механизмах межклеточного общения и взаимной координации тканей, в том числе и в процессах старения [[61]]. Биологическая и терапевтическая активность, а также способность к секреции экзосом мезенхимальных стволовых клеток обратно коррелируют со стадией развития донора [[62]]. В обзоре Ден Сюй и Хидетоши Тахара [[63]] обоснована гипотеза о том, что, некоторые из переносимых ими микроРНК могут способствовать старению, запуская сигнальные пути, ведущие к одряхлению организма, другие наоборот защищают от этих процессов. Внеклеточные везикулы из состарившихся клеток с помощью своей микроРНК так изменяют микроокружение, что оно начинает благоприятствовать возрастным заболеваниям, понижению иммунитета, воспалению и нарушению функций различных органов. Экзосомы из молодых клеток наоборот способствуют процессам регенерации различных органов и уже взяты на вооружение для неклеточной терапии [[64]]. Важно также отметить, что экзосомы не содержат антигены тканевой совместимости, поэтому даже при применении экзосом от одних млекопитающих для лечения млекопитающих другого вида, обычно не наблюдается сильных иммунных реакций [[65]]. Это открывает широкие возможности для лечения от старости путем использования экзосом, полученных скажем от молодого слона, кита или гренландской полярной акулы. Кроме того, в отличие от клеток, экзосомы не могут сами размножаться и поэтому не могут выйти из-под контроля, не могут образовывать опухоли, а значит терапия экзосомами более безопасна, чем клеточная терапия. Благодаря липидной оболочке экзосомы предохраняют свое содержимое от разбавления и разрушения, что особенно важно, если лекарством является фермент или нуклеиновая кислота. Благодаря рецепторам на их поверхности они избирательно находят клетки-мишени, тем самым повышая эффективность переноса лекарственных препаратов, белков и РНК и снижая возможность побочных эффектов. Их можно использовать для перепрограммирования клеток организма in vivo, особенно в тех случаях, когда используется большая генно-инженерная конструкция, не вмещающаяся в оболочку вируса [[66]].
Далеко не полный список возможного терапевтического применения экзосом уже включает иммунотерапию, изготовление вакцин, модуляторы ангиогенеза, целевую доставку в ткани-мишени различных лекарственных препаратов (в том числе «скоропортящихся»: ферментов, препаратов на основе РНК: микроРНК, матричных РНК, малых интерферирующих РНК [[67] [68] [69] [70] [71] [72]]). Поэтому они безусловный кандидат на поставку в клетки организма омолаживающих микроРНК, способных инактивировать процессы старения, связываясь с теми длинными некодирующими РНК, которые подавляют активность генов регенерации, а также связываясь с 3 ‘нетранслируемым участком (UTR) мРНК определенных генов, могут предотвратить трансляцию синтеза определенных белков [[73] [74] [75]]. Возможно, что удаляя из кровотока старого организма экзосомы и заменяя их на экзосомы молодого растущего организма, можно будет перепрограммировать клетки, так что они станут моложе?
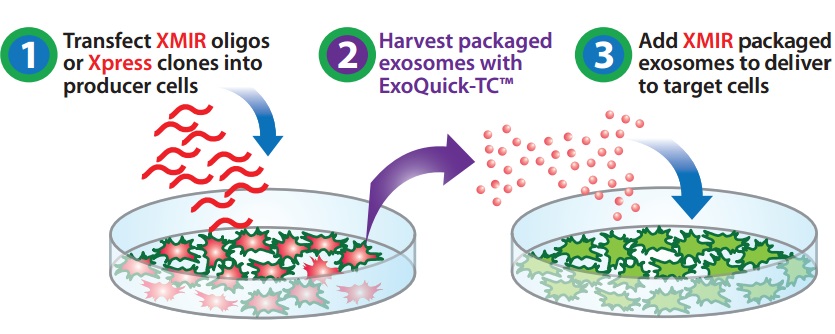
Разработана уникальная технология Exo-Fect™ позволяющая с помощью экзосом переносить РНК в клетки мишени. Более того с помощью технологии XMIR™ можно заставить культуру клеток избирательно производить и упаковывать в секретируемые экзосомы выбранные исследователем определенные микроРНК. Система XMIR™, разработанная фирмой SBI, использует уникальную последовательность «XMotif», которая будучи присоединена к какой-либо микроРНК или анти-микроРНК, заставляет инфицированную ею клетку транспортировать и упаковывать эту РНК в экзосому
Комбинация технологий Exo-Fect™ и XMIR™ позволяет превратить культуру клеток в фабрику по производству лечебных экзосом.
Такую «фабрику» можно культивировать in vitro, а можно доставить прямо в организм в виде инкапсулированных иММСК и использовать in vivo.
По материалам http://www.genetimes.com.cn/news/showother.aspx?Did=73203285154070528
В тех случаях когда нет возможности культивировать клетки, но есть выделенные экзосомы, микроРНК можно загрузить прямо в экзосомы, используя модифицированный метод трансфекции с хлоридом кальция, вместо того, чтобы инфицировать ими клетки [[76]].
«Выращивание» крови
Ещё один путь использования ИПСК — это производство молодой крови для трансфузии.
Известно, что даже одноразовое переливание молодым мышкам крови от старых животных приводит к тому, что у них быстро снижается нейрогенез в гиппокампе, а также наблюдаются некоторые другие дегенеративные изменения и активация воспалительных процессов [[77]]. Это свидетельствует о том, что в старой крови присутствуют факторы, способствующие старению, тогда как молодая кровь омолаживающее действует на мозг (см. рис ниже). Известно также, что терапия с использованием обогащенной тромбоцитами плазмы крови от молодых доноров позволяет восстановить менструальный цикл у женщин, у которых до этого не было месячных уже в течение пяти лет [[78]]. Помогали внутрисуставные инъекции обогащенной тромбоцитами плазмы лечить также остеоартрит коленного сустава. Но только если пациенты были не старше 80 лет [[79]].
Предполагается использовать плазму крови от молодых доноров и для лечения такого старческого недуга как болезнь Альцгеймера [[80]].
Зная, какие белковые факторы способствуют омоложению организма, можно организовать их производство с помощью клеточных культур CAP-Go фирмы CEVEC, которые легко размножаются и способны продуцировать рекомбинантные гликозилированные белки плазмы крови [[81]]. Вместе с тем, зная какие факторы старой крови вызывают старение у молодых, можно разработать способы очистки крови от этих неблагоприятных факторов.
Например, от таких токсичных белков как хемокин CCL11(C–C motif chemokine 11), также известный как эотаксин [[82]]. Уровень этого белка в плазме крови коррелирует со снижением нейрогенеза у старых мышей. Повышение уровня CCL11 у молодых мышей in vivo ведет к снижению нейрогенеза и нарушениям памяти, а также способности к обучению. Увеличен уровень хемокина CCL11 и в плазме крови и спинномозговой жидкости у пожилых людей [ [83]]. Кроме того, этот хемокин – аттрактант избирательно привлекающий эозинофилы, участвует в механизмах развития таких эозинофильных воспалительных заболеваний как атопический дерматит, аллергический ринит, астма и паразитарные инфекции. Некоторые изоформы этого белка являются фактором риска ишемического и гемморагического инсульта [[84]].
Очистить кровь от подобных токсинов может помочь проточный магнитный сепаратор и покрытые моноклональными антителами магнитые микрошарики [[85]].
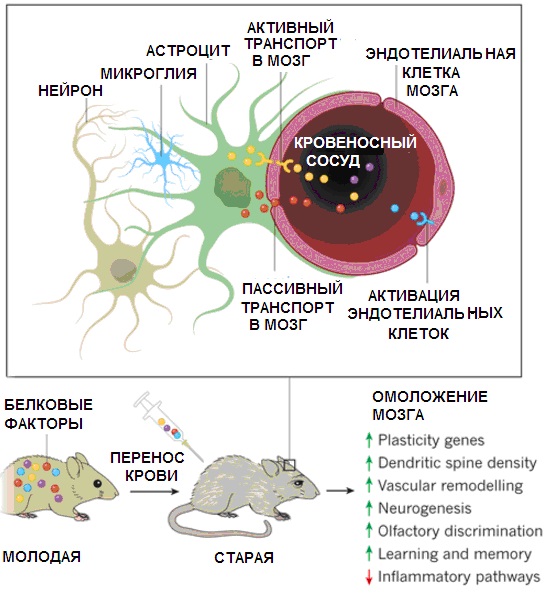
Омоложение мозга старого животного молодой плазмой крови, обогащенной тромбоцитами [[86]]
Следует однако заметить, что вышеописанные технологии получения омолаживающих факторов культивированием клеточных культур и получения омолаживающих факторов культивированием клеточных культур и получение моноклональных антител, используемых для очистки крови с помощью сепаратора, очень дорогостоящее занятие. Поэтому куда дешевле использовать молодую донорскую кровь. Только вот где взять столько доноров, согласных поделиться своей кровью?
Острая нехватка донорской крови побуждает исследователей искать альтернативную замену.
В будущем одним из источников молодой человеческой донорской крови может стать кровь человека, выращенная в организме крупного одомашненного животного, такого как слон, верблюд, корова, лошадь или свинья. Пока для опытов по выращиванию человеческой крови используют гуманизированных мышей с функциональной иммунной системой человека. Для получения гуманизированных мышей лабораторным мышкам линии с иммунодефицитом трансплантируют ткань человеческого тимуса, а также гемопоэтические стволовые клетки, взятые от одного и того же донора. Кроме того, для достижения оптимального приживления трансплантированных человеческих кроветворных стволовых клеток этим мышкам дополнительно внедряют природную мутацию рецептора Kit, в результате которой они теряют способность производить собственные предшественники гемопоэтических стволовых клеток [[87] [88]].
Опыты с гуманизированными мышками линии NSGW41 показали, что эритро-мегакариоцитарные клетки человека хорошо приживаются в организме этих мышей; факторы роста, ответственные за пути дифференциации человеческих клеток, совместимы между видами и позволяют достичь in vivo полного созревания тромбоцитов человека, а также получить содержащие ядро клетки-предшественники человеческих эритроцитов. В крови животного, однако, эти клетки не накапливались, поскольку их тут же уничтожали макрофаги [[89]]. Очевидно, необходимо модифицировать и макрофаги. Аналогичные эксперименты вскоре можно будет воспроизвести на мутантных поросятах, у которых либо нет тимуса, либо он не развит [[90]]. C мутантными поросятами, однако сложность в том, что они в случае иммунодефицита, теряют способность к воспроизводству потомства и крайне подвержены вирусным инфекциям, которые трудно лечить. Одна надежда на слонов, но их пока никто не исследует на предмет модификации их иммунной системы для «гуманизации» и толерантности к клеткам человека – слишком дорогой объект для опытов, пусть и жизненно необходимых человечеству.
Упростить трансплантацию человеческих гемопоэтических клеток может новый способ «расчистки» ниши для этих клеток в организме животного. Оказалось, что если продержать животное 1-2 недели на диете без незаменимой аминокислоты – валина, то его гемопоэтические клетки гибнут, высвобождая место для человеческих гемопоэтических клеток [[91]].
Создание новых органов – альтернатива использованию донорских.
Удлинение продолжительности жизни людей в развитых странах привело к увеличению количества пациентов, страдающих от хронических заболеваний и недостаточности органов в терминальной стадии. Единственным способом вылечить больного с полностью изношенным органом является его замена. Кроме того, нередко отказ органа наблюдается также и у новорожденных детей.
К сожалению, острый дефицит донорских органов существенно ограничивают возможности излечения многих больных (далеко не все пациенты доживают до операции по трансплантации. Этот дефицит также порождает множество этических и даже криминальных проблем: разрешение на изъятие органа и оплата его стоимости; трансплантологический туризм в страны, где люди вынуждены или их принуждают продать свой орган; траффикинг органов (продажа людей с целью изъятия человеческих органов).
Выращивание органов из клеток универсальных доноров или, что ещё лучше, из клеток самих пациентов позволило бы избавиться от проблем поиска доноров и опасности отторжения чужеродного органа, а также позволило бы успешно лечить функциональные расстройства и многие болезни, вызванные старческим дряхлением [[92] [93]].
Какие подходы сегодня существуют для преодоления дефицита органов для трансплантации?
Есть четыре основных пути преодоления нехватки органов с помощью биоинженерии [[94] [95]]:
- Биопринтинг (3D печать) органов и тканей;
- Рецеллюларизация (т.е. посев) новых клеток на очищенный от клеток донора межклеточный матрикс органов и тканей;
- Репарация клеток и регенерация тканей;
- Ксенотрансплантация.
Биопринтинг (3D печать) органов и тканей
Биопринтинг или 3D печать органов и тканей представляет собой процесс, при котором клетки и межклеточная среда наноятся послойно в виде биочернил [[96]], также как пластмассы в 3D печати [[97]]. Цель биопринтинга — создание функционирующей ткани или органа. Эту живую конструкцию предполагается затем имплантировать пациенту, с тем, чтобы заменить утраченные функциональные возможности изношенного или повреждённого органа.
Несмотря на кажущуюся простоту решения задачи воссоздания органа, эта технология пока не преодолела ряд трудностей:
- как заставить клетки в напечатанных тканях действовать коллективно, как единый «оркестр», а не вразброд;
- как руководить развитием органа с помощью межклеточной матрицы [[98]];
- как создать функциональные сосудистые сети и интерактивную микросреду (нишу) [[99]].
Главное требование, чтобы орган исправно на протяжении многих лет выполнял свои функции.
В настоящее время созданы технологии, позволяющие успешно напечатать такие разные ткани как кости нижней челюсти и свода черепа, всевозможные хрящи (носа, уха и т.д.) и даже скелетные мышцы [[100]]. Безусловным достижением, вселяющим надежды, является биоинженерная конструкция уретры, которая работает у 5 больных уже свыше 6 лет.
Рецеллюларизация (посев) новых клеток на очищенный от клеток донора межклеточный матрикс органов и тканей
С какой бы точностью не воспроизводил биопринтинг структуры органов, ему все равно пока далеко по разрешению и составу внеклеточного матрикса до тех подложек которые можно получить из естественных, но лишенных клеток донора (децеллюларизованных) тканей и органов. Во время децеллюларизации, наряду с удалением клеток и некоторых других компонентов ткани, которые могут вызывать иммунную реакцию, тем не менее стараются сохранить трехмерную архитектуру органа и микро-сосудистую сеть, необходимую в дальнейшем для снабжения кислородом и питания новых клеток (теперь уже клеток пациента, а не донора), которые будут посеяны при рецеллюларизации.
Технологии децеллюларизации позволяют получить внеклеточный матрикс, содержащий такие ростовые факторы как: васкулярный эндотелиальный ростовой фактор (VEGF), необходимый для роста сосудов; основной ростовой фактор фибробластов (bFGF), также необходимый для роста сосудов и процессов регенерации; трансформирующий ростовой фактор, бета (TGF-β), контролирующий множество различных процессов, таких как секреция нового матрикса, пролиферация, дифференциация и т.д. Помимо вышеперечисленных факторов есть ещё множество других менее изученных молекул.
К сожалению, децеллюларизация, как показано масс-спектрометрией, все же ведет к потере некоторых компонентов внеклеточного матрикса и связанных с ним факторов роста [[101]].
Основная роль природных подложек не в том, чтобы создать должные биомеханические структуры (с этим прекрасно справляется и биопринтинг), а в том, чтобы создать посеянным при рецеллюларизации клеткам реципиента условия для наиболее соответствующего для данной ткани характера роста [[102]].
Описаны примеры изготовления на базе децеллюларизованной природной подложки искусственной печени, легких, искусственной поджелудочной железы и даже сердца, способного ритмически сокращаться [[103]]. Тем не менее рецеллюларизация — это длительный и дорогостоящий процесс, для которого необходимо правильно подбирать клетки для восстановления паренхимы, клетки для восстановления сосудов, способы их посева и методики инкубации и восстановления функций [[104] [105]]. Пока, к сожалению, ни одного случая полного восстановления функций комплексных органов, таких как сердце, почки, печень не наблюдалось.
Основными проблемами, которые необходимо решить для использования децеллюларизованных органов полученных от животных (овец, коз, свиней) для посева на них клеток человека являются:
- Неизвестно насколько соответствуют белки межклеточного матрикса животных запросам человеческих клеток, не вызовет ли такой матрикс оттожение из-за иммунной реакции;
- Нет ли инфекций, которые могут передаваться человеку от животных при таком использовании; и самое главное насколько функциональным будет орган после рецеллюларизации, будет ли он достаточно качественным, чтобы подсадить его пациенту.
Иногда нет необходимости использовать в качестве матрикса цельную ткань. Для восстановления костей и хрящей вполне подходит фрагментированная ткань. А чтобы её способность стимулировать заживление переломов или поврежденных хрящей была как можно выше, клетки не удаляют, а только делают безжизненными. Такой матрикс, обладающий повышенными способностями активировать образование хондроцитов и механически более стойкий, используют для восстановления хрящей – ткани, которая обладает низкой имунногенностью [[106]], а при очистке от клеточного материала и для стимуляции процессов регенерации мышц [[107]].
Репарация клеток и регенерация тканей
Некоторые, так называемые «бессмертные» животные вроде гидры и вегетативных форм планарии обладают удивительной способностью восстанавливать утраченные части тела. Что самое главное, после такого восстановления утраченных частей тела, весь организм, включая и неповрежденные участки тела животного, перестраивается и омолаживается. Иначе работает механизм омоложения у некоторых медуз (Turritopsis dohrnii), которые способны достигнув старости, осуществить трансдифференцировку своих клеток в более молодые [[108]]. Как, каким путем достигается это омоложение пока не ясно. Жуки кожееды также при голодании способны переходить к более молодым фазам развития [[109]]. Ещё более впечатляющее долголетие наблюдается у растений, размножающихся вегетативным клонированием. Так, например, ель «Старый Тикко» достигла возраста в 9550 лет. Каким образом подобные организмы регулярно удаляют мутации в ДНК их генома и в ДНК их митохондрий без участия полового процесса, остается загадкой. Например, матка (царица) у муравьёв Lasius niger живет до 29 лет, тогда как имеющие тот же геном рабочие живут только до одного или двух лет, причём даже в лабораторных условиях. Связано это с процессами репарации, которые идут значительно интенсивнее у маток, но не у рабочих [[110]].
Знание механизмов регенерации и механизмов, регулирующих гены, связанные с этими процессами, могло бы помочь при создании технологий радикального продления жизни.
Говоря о возможностях воздействия на процессы регенерации тканей нельзя не упомянуть о возможностях терапевтического использования технологии прямого репрограммирования in vivo. Так, например, при фиброзе печени образуется рубцовая ткань, состоящая из миофибробластов, которая замещает гепатоциты, что приводит к функциональной недостаточности печени [[111]]. До настоящего времени единственным способом излечения от этого смертельного заболевания была пересадка печени. Технология прямого перепрограммирования in vivo дает надежду, что этих больных можно будет спасать и без пересадки печени. Rezvani с соавторами [[112]], а также Song с соавторами [[113]] описали способы получения индуцированных гепатоцитов из фибробластов рубцовой соединительной ткани непосредственно в печени мышки. Для этого Song с соавт. использовали перенесенный аденовирусом вектор с транскрипционными факторами FOXA3, GATA4, HNF1A, и HNF4A. По утверждению авторов исследования, это позволило значительно снизить фиброз печени. Развитие этого метода может помочь в будущем лечить без пересадки такие неизлечимые заболевания печени как цирроз [[114]].
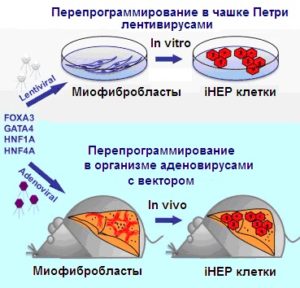
Достижения современной медицины нередко позволяют сохранить жизнь людям и пережить инфаркт миокарда. Однако эта болезнь приводит к инвалидности человека, поскольку через 1-2 недели после инфаркта некротический участок начинает замещаться рубцовой тканью и развивается сердечная недостаточность вследствие необратимой потери функциональных кардиомиоцитов. Большие перспективы в качестве новой терапии для лечения сердечной недостаточности сулит метод прямого перепрограммирования in vivo фибробластов рубцовой ткани в индуцированные кардиомиоциты (иКМЦ). В опытах на модели острого инфаркта миокарда у мышек, доставка ретровирусом вектора, кодирующего три фактора транскрипции, Gata4, Mef2c и Tbx5 превращала эндогенные фибробласты сердца в функциональные иКМЦ. Эти иКМЦ были электрически и механически интегрированы в ткани миокарда, и способствовали уменьшению размера рубца и улучшению функции сердца. К сожалению, эффективность этой технологии пока ещё недостаточно высока чтобы уже начать её применение в клинике [[115]]. Кроме того попытки применить этот метод для получения человеческих кардиомиоцитов оказались безуспешными.
Новые возможности для регенеративной терапии сердечной мышцы сулит метод без использования каких-либо генетических манипуляций, разработанный китайскими исследователями. Они идентифицировали комбинацию из девяти небольших молекул, которые могут эпигенетически перепрограммировать фибробласты человека в химически индуцированные кардиомиоциты (хиКМЦ). При трансплантации фибробластов человека, обработанных коктейлем из этих молекул, в пораженное инфарктом сердце мыши они ритмично сокращались и напоминали человеческие кардиомиоциты [[116]]. Важную роль в процессе перепрограммирования играл ингибитор H3K4 метилтрансферазы Mll1, называемый MM408. Обработка клеток MM408 значительно повышала биения хиКМЦ [[117]]. Этот препарат, действующий на эпигеном, может помочь и при перепрограммировании других клеток.
Чешским исследователям с помощью транскрипционного фактора MafA и матричных РНК, кодирующих транскрипционные факторы Pdx1 и Ngn3 удалось превратить экзокринные панкреатические клетки в инсулин-продуцирующие клетки. Причем предварительная обработка клеток ингибитором метилирования ДНК 5-аза-2′-дезоксицитидином дополнительно повышала образование инсулин-продуцирующих клеток с 3,5 ± 0,9 до 14,3 ± 1,9%. Кроме того, 5-аза-2′-дезоксицитидин повышал способность этих клеток к секреции инсулина в ответ на нагрузку глюкозой [[118]].
Альтернативный и более эффективный способ получения зрелых, функциональных и клинически значимых бета-клеток из экзокринной части поджелудочной железы человека основан на гиперэкспресси экзогенного транскрипционного фактора Pax4 и ингибировании экспрессии эндогенного транскрипционного фактора ARX (Aristaless related homeobox). Важно отметить, что эти бета-клетки, при трансплантации мышкам с экспериментальным диабетом секретировали в кровоток инсулин и смогли нормализовать уровень глюкозы в крови [[119]]. Развитие подобных методов может помочь борьбе с диабетом.
К сожалению, пока нет методов, которые бы позволяли перепрограммировать соматические клетки in vivo в более молодые, но не плюрипотентные соматические клетки. Изучение механизмов омоложения старых клеток у планарий и у гидры (в неповрежденной части тела) после регенерации могло бы помочь. К сожалению, подобный механизм не задействован у млекопитающих и успешное продление жизни мышей с помощью сенолитиков связано только с удалением источников SASP (senescence-associated secretory phenotype) [[120]], но не с активацией процессов регенерации, активность которых наоборот падает [[121]] из-за того, что понижается способность соматических клеток к дедифференцировке [[122]]. Очевидно необходимо найти и использовать такую стратегию, при которой удаление старых клеток сочеталось бы с замещением освободившейся ниши молоденькими клетками.
Ксенотрансплантация
Под ксенотрансплантацией здесь подразумевается выращивание человеческих органов в организме животного. Выращивать орган можно из предварительно созданного ex vivo органоида или же из ИПСК подсаженных в бластоцисту в которой выключены гены необходимые для образования соответствующего органа.
Выращивание органоидов
Органоиды – это культивируемые в лабораторных условиях, трехмерные скопления клеток, которые благодаря процессам самосборки образуют анатомические структуры, моделирующие в миниатюре орган и по возможности его физиологию [[123] [124]].
Большинство разработанных на сегодняшний день органоидов выращены на Матригеле (Matrigel) – трехмерной (3D) подложке позволяющей проводить культивирование в трехмерном пространстве. Благодаря тому, что они имеют очень небольшие размеры проблема с обеспечением их питательными веществами и кислородом решается с помощью проточной системы смены среды для инкубации или простого перемешивания.
Иногда вместо Матригеля используют другие подложки, например, очень легко приготовляемую смесь желатина с наночастицами [[125]], (обычно 2% желатина и 1,5% наночастиц). Вырастить на такой подложке органоиды, продуцирующие антитела, можно всего за неделю. Чтобы отделить органоиды от этой подложки достаточно разрушить ее коллагеназой.
Такэбэ с соавт. разработали обобщенный метод для формирования зачатков органов из различных тканей путем объединения тканеспецифических клеток-предшественников, получаемых из плюрипотентных стволовых клеток, с эндотелиальными и мезенхимальными стволовыми клетками (МСК). Они обнаружили, что менее зрелые ткани или органоиды, генерируемые с помощью принципа самоорганизующейся конденсации более эффективно восстанавливают функции зрелых органов после трансплантации, чем конденсаты, полученные от клеток более продвинутой стадии [[126]].
На сегодняшний день, благодаря удивительной способности клеток к самоорганизации, получены: кардиоваскулярные органоиды, способные к сокращению [[127] [128]], органоиды печени [[129] [130]], почек [[131] [132]], поджелудочной железы [[133]], тканей кишечника [[134]] с криптами и ворсинками из саморганизованного из кишечной клетки Lgr5+ кишечного эпителия [[135]], легочной ткани [[136]], простаты [[137]], глазной чаши со слоем инервированной сетчатки [[138]], головного мозга с четко сформированными кортикальными зонами [[139] [140]], тимуса [[141]]. И это далеко не полный список, усиленно пополнявшийся в течение этого, прошлого и позапрошлого года [[142]].
Выращивание органов в лимфатическом узле
В тех случаях, когда требуется не заменить больной орган сразу, а подсадить к нему на подмогу молоденький и еще не достаточно физиологически функциональный орган, которому предстоит еще «дозреть», удобно поместить этот орган в лимфатический узел [[143]].
Лимфатические узлы располагаются по ходу лимфатических сосудов обычно гроздьями, поблизости от кровеносных сосудов. Притекающая лимфа приносит в лимфатический узел чужеродные антигены, что приводит к развитию в них реакции иммунного ответа в виде активации деления Т клеток и увеличения лимфоузла чтобы вместить возросшее число клеток. При образовании метастазов рака обычно раковые клетки мигрируют в лимфатические узлы и образуют в них колонии [[144]]. Тот же принцип можно использовать для выращивания органа, поместив его «затравку» в лимфатический узел пациента или суррогатного донора, которым может стать гуманизированное (толерантное к человеческим клеткам) животное. Важно отметить, что кровеносные сосуды в ближайшем окружении лимфатического узла при этом обычно способствуют неоваскуляризации и функциональному созреванию такого эктопического органа. По мере развития такие эктопические органы должны компенсировать ослабевшую функцию поврежденного или больного нативного органа [[145] [146]]. Подобные малоинвазивные методы могут позволить осуществлять лечение пациентов, которым из-за сопутствующих заболеваний, противопоказаны более инвазивные хирургические методы терапии, а также в случаях, когда подобрать донорский орган не представляется возможным [[147] [148] [149]].
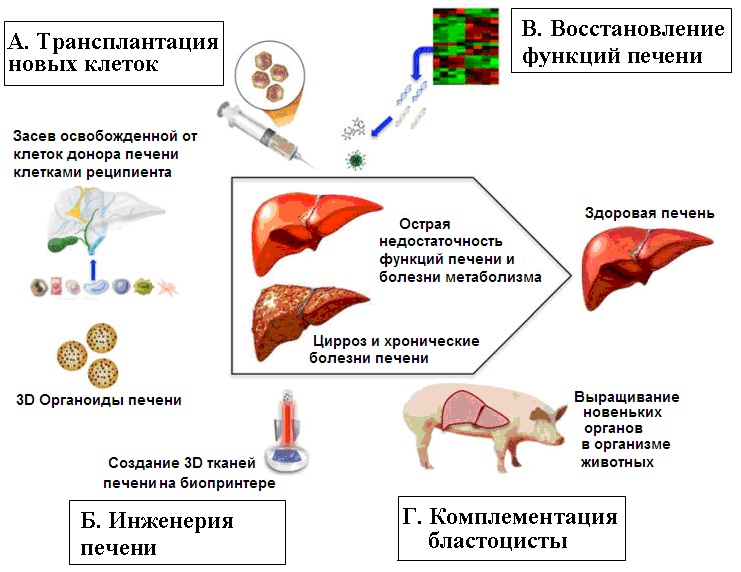
Схематическое представление различных новых подходов к лечению печени. По [[150]].
А. Получаемые из ИПСК омоложенные гепатоциты и другие клетки печени можно использовать для : 1. инъекций с целью заместительной терапии; 2. их можно заселять в печень донора (например, взятую у животного) и освобожденную от клеток децеллюляризацией; 3. можно из омоложенных гепатоцитов и других необходимых для этого клеток выращивать органоиды, а затем эти органоиды либо непосредственно трансплантировать пациенту, либо сперва выращивать их дальше в организме животного; 4. можно использовать их для создания тканей с помощью биопринтера. В случае необратимых морфологических изменений печени и при биопринтинге не обойтись без пункта Б – инженерии печени. В.- для восстановления функций печени могут понадобиться методы генной инженерии – если болезнь связана с мутациями и наследственными нарушениями генома, а также препараты, влияющие на эпигеном.
Г — Метод комплементации бластоцисты смотри подробнее в следующем рисунке.
Иммунная система человека распознает ткани свиней, так как они вырабатывают характерный сахар называемый альфа 1,3 галактозой. Этот сахар метит поверхность свиных клеток. Методами генной инженерии созданы свиньи, у которых этот сахар не попадает на поверхность клеток.
Генетически модифицированные поросята считаются наиболее подходящими донорами органов для трансплантации, поскольку они во многом имеют анатомические и физиологические параметры (такие как артериальное давление) похожие на аналогичные показатели человека. Кроме того их легко скрещивать и размножать, причем они имеют многочисленное потомство. Разработаны методы получения подобных животных [[151] [152] [153] [154] [155] [156]]. Однако чтобы клетки животного-донора не попали в организм пациента все они должны содержать индуцируемый малой молекулой ген активатор апоптоза. Тогда перед трансплантацией органа пациенту можно провести очистку его от клеток животного, проведя перфузию органа средой содержащей активатор апоптоза клеток животного-донора.
Метод комплиментации бластоцисты
Инъекция плюрипотентных стволовых клеток в бластоцисту, на самых ранних стадиях развития после оплодотворения, позволяет получить комбинированную химерную бластоцисту. Если при этом бластоциста взята от животного, не имеющего какого-то гена (например, гена RAG-2, который необходим для образования зрелых B и T лимфоцитов: или гена Pdx1, без которого мышки не способны к образованию и развитию панкреатической железы; или гена Sal1, без которого не может происходить генез почек; или гена Nkx2.5 необходимого для формирования сердца; или гена Fah, необходимого для дифференцировки гепатоцитов печени), то соответственно дефицит будет восполнен за счет образования клеток происходящих от плюрипотентных стволовых клеток [[157] [158]].
Такая система дополнения бластоцисты была использована для восполнения дефицита эпителия тимуса [[159]], сердца [[160]], поджелудочной железы [[161] [162]], почек [[163]] .
Выращивание органов путём успешного создания химер требует преодоления ряда препятствий, связанных с тем, что свиньи довольно далекий от человека вид и правильнее, хотя не так удобно, было бы использовать для этих целей обезьян. Известно, что факторы участвующие в регуляции построения органа далеко не всегда эволюционно консервативны, поэтому межвидовая комплементация бластоцисты не всегда успешна. Например, неудачной оказалась попытка вырастить в организме мыши почки из ИПСК клеток крысы, хотя использование ИПСК мыши (внутривидовой химеризм) получить почки позволял [[164]]. Кроме того, сложности связаны с тем что необходимо согласовывать сроки развития донора и акцептора клеток, поскольку это имеет решающее значение для успешного приживления плюрипотентных и мультипотентных стволовых клеток и их способности участвовать в образовании межвидовых химер. Также, часть клеток животного попадает в выращиваемый человеческий орган, а их удаление может привести к гибели органа. Есть и другие сложности [[165]]. Например, ксенотрансплантация может сопровождаться переносом от свиней различных микроорганизмов включая вирусы, бактерии, грибки и паразиты. Учитывая тот факт, что после пересадки реципиенту трансплантанта может понадобиться курс подавления иммунитета, проблема инфекции может быть очень серьезной. Заражение большинством микроорганизмов может быть предотвращено скринингом (отбором) и скрещиванием линий животных чистых от микроорганизмов. Исключение составляют вирусы, в частности ретровирусы PERV (porcine endogenous retroviruses) которые безопасны для свиней, но не для человека. PERV представляют особый риск, так как они присутствуют в геноме всех свиней и способны инфицировать человеческие клетки. Чтобы предотвратить подобный риск, исследователи инактивировали в свиных эмбрионах 62 свиных эндогенных ретровируса PERV [[166]].
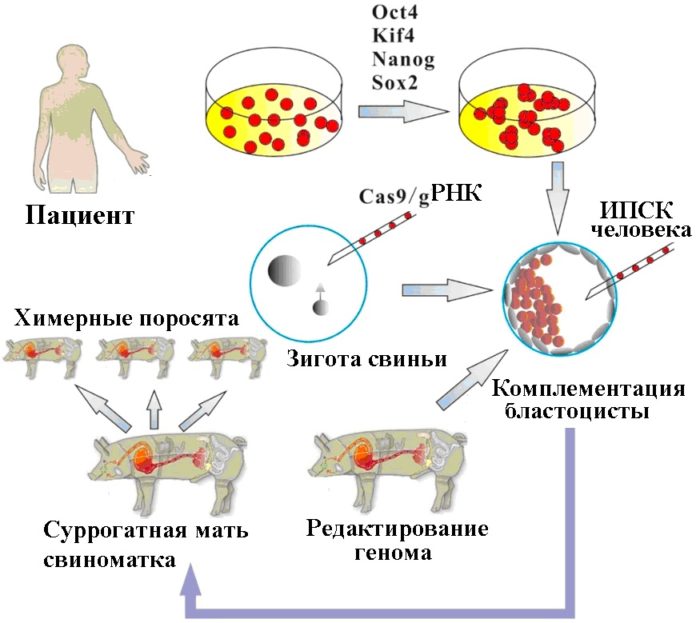
Технология получения человеческих органов методом комплементации бластоцисты, с использованием редактирования свиного генома с помощью CRISPR/Cas9 (для того чтобы отключить у свиньи образование собственных клеток, необходимых для данного органа [[167]]) и человеческих ИПСК для замещения (комплементации) этих клеток в свиной зиготе [[168]]. Химерную зиготу затем подсаживают суррогатной свиноматке для получения химерных поросят с человеческим органом. По материалу [[169]].
Справедливости ради следует отметить, что практических шагов по воплощению в жизнь этой технологии, кроме опытов по редактированию генома свиньи, никто не предпринимал. И дело не только в этических запретах на создание химер человек-свинья, а в том, что попытки подсадить человеческие ИПСК в бластоцисту свиньи не были успешными из-за того, что человеческие ИПСК недостаточно «наивны» и механика формирования бластоцисты у человека отличается от таковой у животных [[170]]
Заключение
Из всего вышеописанного наиболее близкими к практическому применению для лечения здоровых людей от старости мне кажутся технологии профилактической очистки крови от токсинов, вызывающих воспалительные процессы (таких как хемокин CCL11 (C–C motif chemokine 11) известный как эотаксин), а также экзосом старого организма, и обогащение её терапевтическими экзосомами с РНК продлевающими жизнь. Появление таких технологий следует ожидать в ближайшие 5-10 лет. Также почти готовы к практическому применению технологии типа «искусственная печень» с органоидами, работающими вне организма, в проточном устройстве. Можно ожидать также скорого появления технологий с инкапсулированными генмодифицированными ММСК, подсаживаемыми в организм в качестве «фабрики по производству омолаживающих факторов и экзосом».
Уже применяются на практике технологии с использованием ИПСК для лечения некоторых старческих глазных болезней.
Что касается остальных вышеописанных технологий таких как комплиментация бластоцисты и выращивание органов в организме животных, то внедрения их на практике следует ожидать не ранее чем через 30-50 лет, если только не будут сделаны какие-то новые открытия, которые позволят преодолеть межвидовые барьеры.
01.01.2017 Источник: rlegroup.net
Подробнее о регенерации организма читайте на нашем сайте в главе: РЕГЕНЕРАТИВНАЯ МЕДИЦИНА