 В центре – обычная крыса, слева – крыса, которая во время эмбрионального развития получила порцию мышиных стволовых клеток, справа – мышь, которая «предоставила» свои клетки для инъекции крысиному эмбриону. (Фото Tomoyuki Yamaguchi / University of Tokyo.)
В центре – обычная крыса, слева – крыса, которая во время эмбрионального развития получила порцию мышиных стволовых клеток, справа – мышь, которая «предоставила» свои клетки для инъекции крысиному эмбриону. (Фото Tomoyuki Yamaguchi / University of Tokyo.)
Специалисты из Японии, представляющие Токийский университет, вырастили из стволовых клеток мыши здоровую поджелудочную железу в теле крысы. Как сообщается, это первый успешный эксперимент, в ходе которого полноценный орган удалось вырастить в организме представителя другого биологического вида.
Как сообщают исследователи, после пересадки в тело мыши поджелудочная железа полностью функционировала. Более того, это позволило улучшить состояние грызуна, страдавшего диабетом — уровень глюкозы в его крови после пересадки стал регулироваться более эффективно. В перспективе учёные рассчитывают схожим образом вырастить органы обезьяны в теле свиньи.
Недавно сообщалось, что в Японии из эмбриональных стволовых клеток был создан полностью функционирующий кишечник длиной около сантиметра. А до этого специалисты из России разработали технологию выращивания сетчатки глаза из перепрограммированных клеток — клеток кожи, сначала превращённых в стволовые, а уже затем — в необходимые.
В середине прошлого года группа учёных, представляющих Калифорнийский университет, заявила о планах вырастить поджелудочную железу человека в организме свиньи. По словам специалистов, в случае, если эксперимент пройдёт успешно, орган будет полностью пригоден для пересадки человека. Такие эксперименты официально разрешено проводить в США, а с начала 2016 года — и в Великобритании. Хотя подобная практика может оказаться способом решить проблему нехватки донорских органов, некоторые общественные деятели относятся к ней крайне настороженно. По их мнению, технология, которую уже прозвали frankenscience (от Frankenstein – Франкенштейн и science – наука) опасна и аморальна. Впрочем, многие сходятся во мнении, что пока в качестве выращиваемого в чужом теле органа не выступает мозг человека, эксперименты такого рода всё же можно считать приемлемыми с этической точки зрения.
26.01.2017 Источник: mk.ru
Колыбель для поджелудочной железы
Гормон инсулин синтезируют особые клетки поджелудочной железы. Если они по какой-то причине гибнут, начинается диабет первого типа: из-за недостатка инсулина наши органы и ткани не могут правильно усваивать глюкозу, уровень сахара в крови повышается, и вслед за нарушенным обменом веществ развиваются серьёзные проблемы со здоровьем. И даже если мы устраним причину, по которой погибли инсулиновые клетки, их нужно как-то восстановить.
Само собой напрашивается, что их можно пересадить, либо вместе с целой поджелудочной железой, либо только сами эти клетки, которые образуют в железе характерные скопления под названием островки Лангерганса. Однако, как и при всякой трансплантации, здесь неизбежно возникают две проблемы: во-первых, нужен донор, во-вторых, нужно постоянно быть готовым к отторжению пересаженной ткани. С отторжением обычно борются, подавляя активность иммунитета специальными препаратами, но тут уже надо быть готовым к тому, что «сонная» иммунная система пропустит инфекцию или рак.
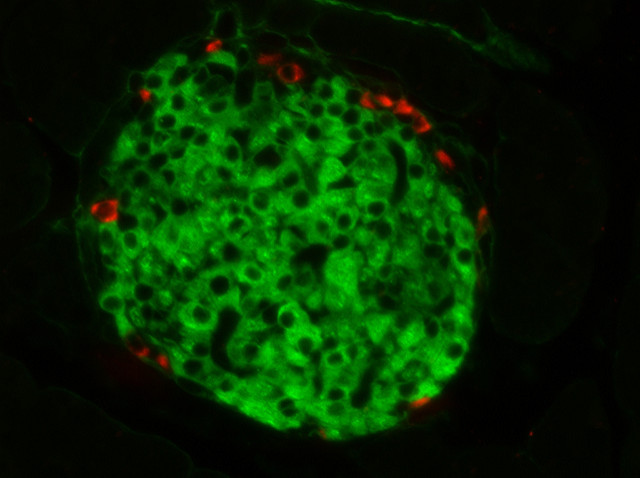 Островок Лангерганса – скопление инсулинпроизводящих клеток в тканях поджелудочной железы.
Островок Лангерганса – скопление инсулинпроизводящих клеток в тканях поджелудочной железы.
Проблемы отторжения удалось бы избежать, если бы пересаживаемый орган или клетки генетически совпадали с организмом, в который их пересаживают. Откуда же взять такую «вторую копию»? Очевидно, тут нужны стволовые клетки, причём не натуральные эмбриональные, а индуцированные, которые получают искусственным образом при перепрограммировании каких-нибудь зрелых, специализированных клеток. Например, взяв у больного клетки кожи, их можно перепрограммировать в стволовые, чтобы потом из них вырастить орган или ткань на замену испорченной. Однако во многих случаях невозможно сделать то, что требуется, просто на лабораторном столе – чтобы орган или его фрагмент сформировались так, как надо, он должен развиваться в естественной среде, то есть в целом организме.
Некоторое время назад исследователи из Токийского университета вместе с коллегами из Стэнфорда сумели вырастить крысиную поджелудочную железу в организме мыши: мышиные стволовые клетки пересаживали крысам, после чего внутри у крыс вырастал орган, который по генетике был мышиным (см. пресс-релиз Rat-grown mouse pancreases help reverse diabetes in mice). Но как удалось избежать отторжения? Дело в том, что иммунной системе в ходе эмбрионального развития нужно время, чтобы научиться отличать «своих» от «чужих». Стволовые клетки пересаживали крысиным эмбрионам, у которых иммунитет ещё только развивался – всё, что иммунная система «видела» вокруг себя в зародыше, она считала «своими», и чужие стволовые клетки, из которых потом получалась поджелудочная, тоже становились для неё «своими».
Железа в итоге получалась крысиная во всём, кроме размера – по величине она была мышиной, и инсулиновых клеток в ней не хватало, чтобы полностью восполнить их недостачу у крысы с диабетом. Тогда исследователи поменяли животных ролями, и таким же способом вырастили в крысе поджелудочную железу мыши. Крыс модифицировали так, чтобы собственная поджелудочная у них не формировалась и не мешала той, что будет расти из мышиных стволовых клеток. В результате в крысах получали железу, которая генетически соответствовала мышам, но по размеру при этом была крысиной – то есть материала для пересадки в ней было более чем достаточно.
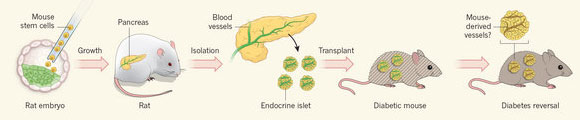 Рисунок из статьи в Nature
Рисунок из статьи в Nature
В статье в Nature (Yamaguchi et al., Interspecies organogenesis generates autologous functional islets) говорится, что после пересадки скоплений инсулиновых клеток (а таких скоплений пересадили более сотни) мышам с диабетом уровень сахара в крови у них приходил в норму и оставался в норме в течение 370 дней. Поскольку при трансплантации в организм мыши так или иначе попадали крысиные клетки, мышам пять дней после операции давали иммуносупрессоры, чтобы иммунитет, который неизбежно должен был отреагировать на «чужаков», не вышел из-под контроля. Однако потом иммуносупрессоры давать переставали, и никакого отторжения не случалось. Когда в конце эксперимента инсулиновые островки Лангерганса извлекали для анализа, то крысиных клеток там не было: иммунитет их выедал, и, выполнив свою задачу, успокаивался – атаковать сами инсулиновые клетки ему резонов не было, так как они генетически не отличались от самой мыши.
Обычно, когда речь идёт о манипуляциях со стволовыми клетками, то непременно упоминают про опасность рака: если такая клетка испортится, она легко может начать формировать злокачественную опухоль. Однако в данном случае никаких признаков онкологических процессов у мышей не было – вероятно, потому, что железа и инсулиновые клетки развивались в эмбрионе (пусть и крысином), то есть в более подходящей для них среде.
Итак, как мы видим, в принципе для выращивания органов можно использовать вообще представителей другого биологического вида. Реально ли проделать ту же процедуру с человеческими клетками и, к примеру, со свиньёй или овцой? Наверно, вполне реально: введя стволовые клетки человека в эмбрион свиньи, мы получим прекрасный материал для пересадки, которые не будет раздражать нашу иммунную систему. Однако прежде чем такой метод войдёт в медицинскую практику, здесь, кроме множества необходимых экспериментов, потребуется уладить ещё и ряд этических вопросов, которые, разумеется, у кого-нибудь неизбежно возникнут.
27.01.2017 Источник: nkj.ru








































































