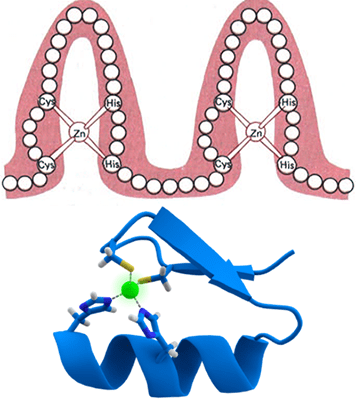
 Схема строения типичных белковых мотивов «цинковые пальцы». Чаще всего цинковый палец состоит из 20 аминокислот. Ион цинка связан с двумя гистидинами и двумя цистеинами. Рисунки с сайта studopedia.su и из «Википедии».
Схема строения типичных белковых мотивов «цинковые пальцы». Чаще всего цинковый палец состоит из 20 аминокислот. Ион цинка связан с двумя гистидинами и двумя цистеинами. Рисунки с сайта studopedia.su и из «Википедии».
Белковый комплекс под названием шелтерин связывается с теломерными повторами и защищает их от деградации. Однако недавно обнаружили, что у него есть конкурент с менее мягким характером: белок TZAP с одиннадцатью цинковыми пальцами способен специфически связываться с теломерами хромосом, но не оберегать, а обрезать их. В нормальных условиях он клетке помогает, но если дать волю его пальцам, TZAP основательно «пощиплет» теломеры, а это может довести клетку до самоубийства.
Для нормального функционирования клеток эукариот очень важна длина теломер — концевых участков хромосом. Теломеры состоят из коротких повторов ДНК (TTAGGG) и почти 200 белков, выполняющих множество важных функций — от синтеза ДНК до защиты теломеры [1].
До января 2017 года был известен лишь один белковый комплекс, специфически взаимодействующий с ДНК-повторами теломеры, — шелтерин. Но теперь ученые обнаружили еще один белок, обладающий сродством к участкам TTAGGG. Благодаря особым ДНК-связывающим мотивам (см. заглавную картинку) этот белок в зависимости от условий может убить клетку, а может и спасти [1].
Теломеры и теломераза
У эукариот на концах хромосом формируются специальные структуры, называемые теломерами. Они защищают ДНК хромосом от деградации нуклеазами и различных аберраций. ДНК теломер состоит из коротких консервативных тандемных повторов (рис. 1). У позвоночных, например, тысячи раз повторяется шестинуклеотидный мотив TTAGGG, у насекомых — TTAGG, у большинства растений — TTTAGGG, у грибов длина мотива сильно варьирует [2].
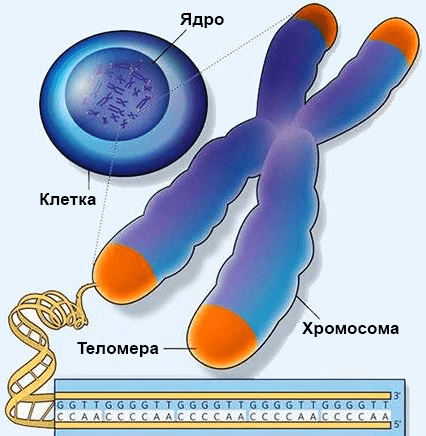 Рисунок 1. Хромосома и теломера. Показана последовательность теломерных повторов инфузории. Рисунок с сайта www.gazeta.ru, адаптирован.
Рисунок 1. Хромосома и теломера. Показана последовательность теломерных повторов инфузории. Рисунок с сайта www.gazeta.ru, адаптирован.
К сожалению, при удвоении генетического материала клетка не в силах обеспечить полную репликацию теломер. Поэтому после каждого деления у дочерней клетки оказываются хромосомы с чуть более короткими теломерами. Это называется концевой недорепликацией, которую наряду с другими механизмами укорочения теломер, рассматривают в качестве одной из причин старения [3]. Насколько весомую роль играет сокращение теломер в старении человека, пока не ясно, зато очевидно, что оно ведет к репликативному старению клеток и их переходу в сенесцентное состояние. Клетка при этом утрачивает способность к делению и секретирует особый набор веществ, формирующий провоспалительную микросреду, неблагоприятную для соседок и организма в целом.
У млекопитающих средняя длина теломер в молодой клетке — 8–12 т.п.н. А критическая (минимально допустимая) длина человеческой теломеры — 77 нуклеотидов. Дальнейшие деления клетки могут вести к крайне неблагоприятным для нее событиям, включая слияние концов разных хромосом [4].
У большинства эукариот необходимая длина теломер поддерживается теломеразой, которая восполняет потерянные при репликации повторы на 3’-конце ДНК*. Комплементарную цепь при этом достраивает ДНК-полимераза [3].
* — За открытие механизма, защищающего хромосомы от концевой недорепликации с помощью теломер и теломеразы, в 2009 году была присуждена Нобелевская премия по физиологии и медицине Элизабет Блэкберн, Кэрол Грейдер и Джеку Шостаку: «„Нестареющая“ Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе» [5]. Занимательную информацию по самόй теломерной проблеме можно найти в статьях «Старение — плата за подавление раковых опухолей?» и «Теломеры и новые мишени протоонкогенной терапии» [6, 7]. Интересны также исследования, например, об изменении длины теломер в связи с временем года у растений или в сезон дождей у жителей Коста-Рики: «Длина теломер и времена года» [8]. — Ред.
Теломераза — рибонуклеопротеиновый комплекс, состоящий из фермента теломеразной обратной транскриптазы (TERT) и теломеразного РНК-компонента (TERC), который содержит матричную последовательность для удлинения теломеры — 3’-AAUCCC-5’. За один «присест» теломераза может добавлять не один, а сразу несколько теломерных повторов (рис. 2). При последовательном переходе фермента из состояния 1 через состояния 2 и 3 в состояние 4 теломераза добавляет к праймеру один теломерный повтор. Переход 4→2 соответствует добавлению нескольких теломерных повторов без отделения от теломеры (переход 4→1) [3].
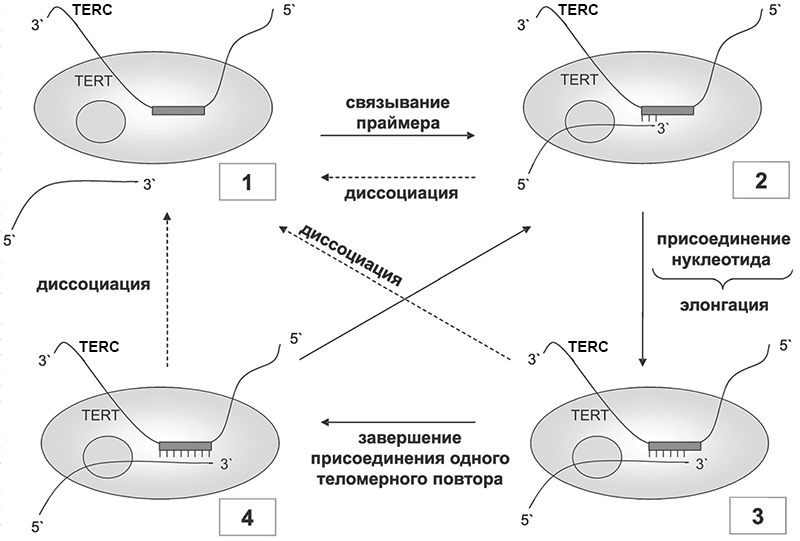 Рисунок 2. Работа теломеразы. Цифры в рамках обозначают положение теломеразы по отношению к праймеру (3’-концу ДНК теломеры) на различных стадиях: 1 — фермент не связан с праймером; 2 — отжиг праймера; 3 — стадия элонгации; 4 — завершение присоединения одного теломерного повтора. Пунктирными стрелками показаны возможные процессы диссоциации праймера при работе фермента. Условные обозначения: TERT — белковая субъединица с сайтом «заякоривания» теломерной ДНК (серый кружок), TERC — теломеразная РНК с матричным участком (серый прямоугольник). Рисунок из [3].
Рисунок 2. Работа теломеразы. Цифры в рамках обозначают положение теломеразы по отношению к праймеру (3’-концу ДНК теломеры) на различных стадиях: 1 — фермент не связан с праймером; 2 — отжиг праймера; 3 — стадия элонгации; 4 — завершение присоединения одного теломерного повтора. Пунктирными стрелками показаны возможные процессы диссоциации праймера при работе фермента. Условные обозначения: TERT — белковая субъединица с сайтом «заякоривания» теломерной ДНК (серый кружок), TERC — теломеразная РНК с матричным участком (серый прямоугольник). Рисунок из [3].
Теломераза не активна в большинстве соматических клеток человека. Хотя РНК-компонент транскрибируется на постоянном уровне почти во всех клетках, в соматических не синтезируется белковая часть — обратная транскриптаза. При искусственной активации экспрессии ее генов культура соматических клеток избегает репликативного старения, то есть клетки приобретают способность делиться неограниченно долго. Теломераза собирается и работает в стволовых, половых и некоторых других типах клеток, которым нужно делиться постоянно (например, клетках эпителия кишечника) [9, 10].
Считается, что активация этого фермента связана с развитием рака: теломераза активна в 85% раковых опухолей, в остальных 15% действуют альтернативные механизмы поддержания длины теломер, основанные на рекомбинации [11, 12].
|
|
Шелтерин
Шелтерин, или телосома — комплекс из шести белков, регулирующий активность теломеразы и защищающий теломеры млекопитающих от систем репарации ДНК (рис. 3). Связываясь с повторами TTAGGG на теломерной ДНК, шелтерин способствует образованию на ее конце t-петли — своеобразного «колпачка», прячущего свободный конец хромосомы от репарационных ферментов. Отсутствие или критический недостаток шелтерина в клетке «распечатывает» теломеры, и они становятся доступными нуклеазам и прочим ферментам, подвергаются деструкции и сливаются с концами других хромосом, что в итоге приводит к клеточной сенесценции или апоптозу [13, 14].
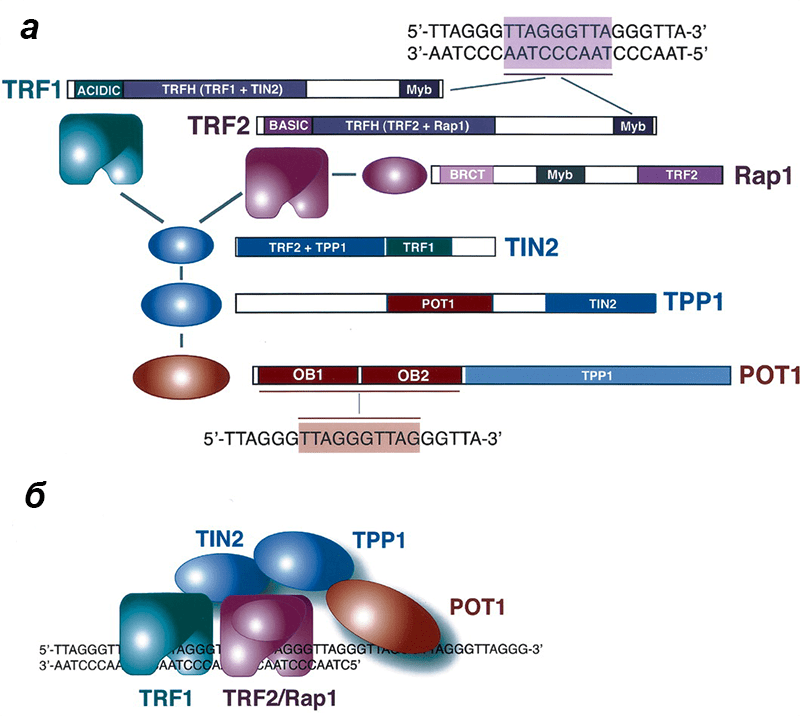 Рисунок 4. Работа телосомы. а — Структура t-петли. Нависающий 3’-конец заводится между двумя цепями ДНК, формируя D-петлю («петлю замещения», где одна из двух основных цепей ДНК вытесняется вторгшейся цепью, комплементарной второй основной цепи). Размер петли переменный. б — Модель формирования петли шелтерином. TRF1 и TRF2 сгибают теломеру и закрепляют t-петлю. POT1 удерживает одноцепочечные участки ДНК. в — Модель регуляции длины теломеры шелтерином. Пока теломера достаточно длинная, шелтерин закрывает к ней доступ теломеразе. Как только теломера укорачивается до определенной длины и присоединенных шелтеринов становится недостаточно для образования t-петли, теломераза получает доступ к открытому 3’-концу. Рисунок из [15], адаптирован.
Рисунок 4. Работа телосомы. а — Структура t-петли. Нависающий 3’-конец заводится между двумя цепями ДНК, формируя D-петлю («петлю замещения», где одна из двух основных цепей ДНК вытесняется вторгшейся цепью, комплементарной второй основной цепи). Размер петли переменный. б — Модель формирования петли шелтерином. TRF1 и TRF2 сгибают теломеру и закрепляют t-петлю. POT1 удерживает одноцепочечные участки ДНК. в — Модель регуляции длины теломеры шелтерином. Пока теломера достаточно длинная, шелтерин закрывает к ней доступ теломеразе. Как только теломера укорачивается до определенной длины и присоединенных шелтеринов становится недостаточно для образования t-петли, теломераза получает доступ к открытому 3’-концу. Рисунок из [15], адаптирован.
Если концы теломерных ДНК остаются свободными, активируются системы репарации, которые распознают такие концы как двухцепочечные разрывы. К «оголению» концов может вести, например, недостаток в клетке шелтериновой субъединицы TRF2. Но в то же время в таком открытом состоянии теломеры — отличный субстрат для работы теломеразы, которая достраивает их до необходимой, стабилизирующей длины [14].
Новый белок, открытый Эросом Лаццерини Денчи и Джулией Су Джоу Ли (рис. 5) — учеными из Исследовательского института Скриппс в США, — наряду с шелтерином играет важную роль в гомеостазе хромосомных теломер. Ученые назвали его теломерным белком с цинковыми пальцами (TZAP, telomeric zinc-finger associated protein).
 Рисунок 5. Профессор Денчи и студентка Ли. Фотография с сайта www.scripps.edu.
Рисунок 5. Профессор Денчи и студентка Ли. Фотография с сайта www.scripps.edu.
Отличительная черта TZAP — 11 цинковых пальцев, которыми он «хватается» за TTAGGG-повторы теломер. При этом оказалось, что для эффективного взаимодействия с ДНК белку необходимы только три последних пальца, Znf9—11 (рис. 6). Связываясь с ДНК, TZAP инициирует «стрижку» теломер: из них вырезаются шестинуклеотидные повторы [1].
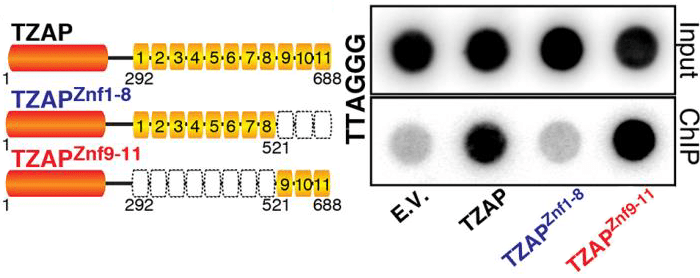 Рисунок 6. Три последних пальца требуются TZAP для присоединения к теломерной ДНК. Слева —Варианты белка TZAP: целый, с восемью первыми пальцами (Znf1—8) и с тремя последними (Znf9—11). Справа — Эксперимент по взаимодействию трех вариантов TZAP с теломерой. С ДНК связывается лишь целый белок и белок с тремя последними пальцами. Рисунок из [1].
Рисунок 6. Три последних пальца требуются TZAP для присоединения к теломерной ДНК. Слева —Варианты белка TZAP: целый, с восемью первыми пальцами (Znf1—8) и с тремя последними (Znf9—11). Справа — Эксперимент по взаимодействию трех вариантов TZAP с теломерой. С ДНК связывается лишь целый белок и белок с тремя последними пальцами. Рисунок из [1].
TZAP присоединяется к теломерам как в клетках с работающей теломеразой, так и в клетках без нее. При этом белок не нуждается во взаимодействии с компонентами шелтерина [1].
TZAP предпочитает присоединяться к длинным теломерам. Это показали в эксперименте с клетками HeLa: одна их линия содержала теломеры длиной 5 т.п.н., вторая — 20 т.п.н. TZAP соединялся с теломерами второй линии и совсем не проявлял интереса к теломерам из первой. Оказалось, что количество шелтерина (в том числе и его субъединицы TRF2) в клетке постоянно и не зависит от длины теломер. Поэтому на длинных теломерах могут «обнажаться» повторы TTAGGG, свободные от TRF2. К ним-то и тянется своими пальцами TZAP. Причем конкурирует за субстрат он именно с TRF2, а не с TRF1. При повышенной экспрессии гена TRF2 количество присоединенного к ДНК TZAP сокращается [1].
В то же время в клетках с повышенной экспрессией гена TZAP, лишенных теломеразы (как в обычных соматических клетках), хромосомы быстро теряли теломеры (рис. 7). В итоге появлялись клетки с хромосомами вообще без теломер. Видимо, при высокой концентрации TZAP теснит в конкурентной борьбе TRF2, получая возможность ухватиться пальцами за повторы и «подстричь» теломеру «под ноль». А это приводит к печальным последствиям: хромосомным аберрациям, сенесценции клеток и апоптозу [1].
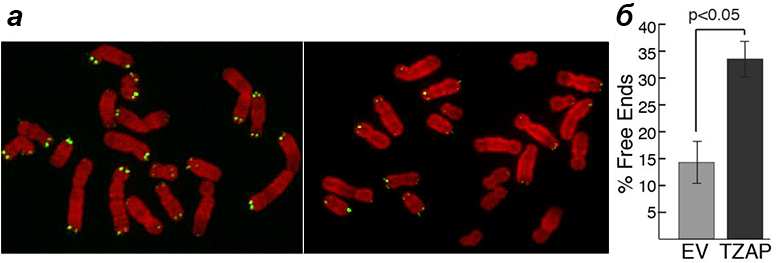 Рисунок 7. Эксперимент с гиперэкспрессией TZAP в клетках без теломеразы. а — Хромосомы в обычной клетке (слева) и в клетке с повышенной экспрессией TZAP (справа). Зелеными точками помечены теломеры. б — Процентное соотношение количества хромосом с лишенными теломер концами в обоих вариантах. Рисунок из [1].
Рисунок 7. Эксперимент с гиперэкспрессией TZAP в клетках без теломеразы. а — Хромосомы в обычной клетке (слева) и в клетке с повышенной экспрессией TZAP (справа). Зелеными точками помечены теломеры. б — Процентное соотношение количества хромосом с лишенными теломер концами в обоих вариантах. Рисунок из [1].
В клетках с нормальным балансом TRF2/TZAP последнему позволено лишь следить за тем, чтобы теломера не стала слишком длинной. Эту функцию TZAP выполняет и в эмбриональных стволовых клетках: при экспериментальной делеции генов TZAP теломеры в стволовых клетках существенно удлинялись, а после введения экзогенного TZAP возвращались к норме [1].
Известно, что слишком длинные теломеры могут способствовать трансформации клетки в раковую, разрешая ей бóльшее количество делений, чем положено. Получается, что TZAP, регулируя максимальную длину теломер, участвует в защите организма от возникновения опухолей [1]. Но если синтез TRF2 вдруг нарушится, крючковатые пальцы TZAP тут же потянутся к теломерам, чтобы резать, резать и резать... До самой клеточной смерти.
«Эти клеточные часы должны быть очень точно настроены, чтобы позволять клеткам делиться достаточное количество раз, развивая дифференцированные ткани организма и поддерживая возобновляемые, и в то же самое время препятствовать появлению злокачественных клеток» (профессор Денчи) [16].
30.01.2017 Источник: biomolecula.ru








































































