Открытие индуцированных плюрипотентных стволовых клеток (ИПСК) стало одним из самых громких и многообещающих достижений в научном мире за последние годы. Казалось бы, как только у каждого человека появятся свои собственные плюрипотентные стволовые клетки, разрешится огромное количество медицинских проблем. Тем не менее прошло уже почти десять лет, а применение ИПСК в реальной практической медицине толком еще и не начиналось. По-прежнему между открытием ИПСК и спасением мира от всех недугов стоит основная проблема – методы индукции плюрипотентности в клетках. Способом преодолеть эту пропасть может быть поиск клеточных типов, легче поддающихся перепрограммированию. Один из этих типов лежит буквально «на поверхности» – клетки дермальной папиллы (ниже поясняется, что это соединительнотканный сосочек в волосяной луковице – ВМ).
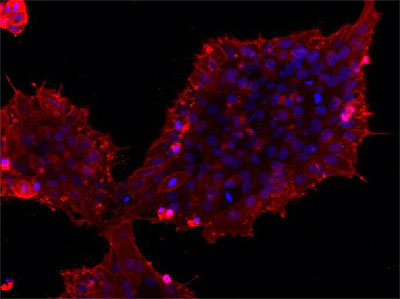
ИПСК, полученные из клеток дермальной папиллы человека, окрашенные на маркер плюрипотентности SSEA4 (красный цвет). Рисунок из диплома автора статьи [16].
Стволовые клетки – панацея XXI века
Индуцированные плюрипотентные стволовые клетки (ИПСК) произвели невероятный фурор в научном сообществе [1]*. Представить только – для каждого человека могут быть получены ИПСК его же собственного генотипа. Это открытие предоставляет целый спектр новых возможностей: например, в момент решает любые вопросы, связанные с донорством. Полученные ИПСК можно направить в любую сторону клеточной дифференцировки и создать донорский материал, который не нужно искать. Самое важное, что ткани и органы, полученные таким образом, будут обладать полной иммунологической совместимостью с тканями пациента, так как будут созданы из его собственных клеток**.
* – Стволовые клетки можно получать и другими способами: ими может безо всякого ущерба для развития поделиться эмбрион («Щадящие стволовые клетки» [2]) или... его обиталище («Эндометрий как альтернативный источник стволовых клеток» [3]). – Ред.
** – О ситуации в области создания искусственных органов и технологиях их получения рассказывает статья «Органы из лаборатории» [4]. – Ред.
Помимо этого, впервые открываются возможности лечения генетических заболеваний. Молекулярная биология также не стоит на месте: разрабатывается огромное количество методов, позволяющих редактировать геном*, исправлять в нём «ошибки» или вносить дополнительные элементы. Но все эти методы малоэффективны применительно ко взрослому организму – дифференцировка его клеток, формирование органов и тканей происходили под влиянием причинных мутации. Чем же могут помочь ИПСК? Эти клетки представляют собой начальную форму клеточного развития. При коррекции генома на данной стадии последующая дифференцировка пройдет без отклонений.
* – Сейчас при разработке генотерапевтических подходов особые надежды возлагают на системы редактирования ZFN, TALEN и CRISPR/Cas9, основанные на сайт-специфическом действии нуклеаз in vivo. Эти системы обычно состоят из двух модулей, один из которых распознает нужную олигонуклеотидную последовательность, а другой режет цепи ДНК: «А не замахнуться ли нам на... изменение генома?» [5], «CRISPR-системы: иммунизация прокариот» [6]. И некоторые из подходов уже вполне «осязаемы», раз громче звучат голоса биоэтиков: «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [7]. – Ред.
Какие могут быть проблемы?
Несмотря на активное изучение ИПСК, существует ряд проблем, затрудняющих их использование непосредственно для лечения человека. Эти проблемы связаны со способом индукции плюрипотентности («перепрограммированием») клеток. Надо сказать, еще совсем недавно даже мысль о существовании таких способов относилась к категории еретических, ведь дифференцировка считалась процессом необратимым – до «нобелевских» работ Джона Гёрдона и Синьи Яманаки [8]. Как установила группа Яманаки, для перепрограммирования терминально дифференцированных клеток необходимо всего четыре транскрипционных фактора: Oct4, Sox2, c-Myc и Klf4 [9]. Транскрипционные факторы (ТФ) – это белки, способные регулировать работу генов. При работе этих четырех ТФ геном клетки перестраивается в плюрипотентное состояние. На данный момент единственным эффективным способом получения ИПСК является внесение генов ТФ в клетку с помощью лентивирусных векторных конструкций. Такой метод приводит к интеграции вектора в геном клетки, что может вызвать непредвиденные модификации его структуры и привести к развитию злокачественных образований. Кроме этого, сами вирусные конструкции являются антигенами для человека, что также небезопасно и ограничивает возможности практического применения ИПСК [10].
Тем не менее...
Тем не менее некоторые ИПСК всё же добрались до применения на практике. Например, с их помощью начали лечить серповидноклеточную анемию*. ИПСК получали из клеток пациента и с помощью специализированных генетических методов исправляли мутацию, приводящую к этому заболеванию [11]. В конечном итоге ИПСК дифференцировали в здоровые эритроциты и вводили пациенту. Дело в том, что эритроциты – это тот редкий случай, когда непредсказуемая интеграция генов ТФ в клеточный геном не представляет никакой опасности, потому что в процессе дифференцировки эритроциты теряют ядро.
* – Генные и клеточные инженеры вообще неравнодушны к заболеваниям крови, и старания их приносят всё более ощутимые результаты – как по эффективности, так и по безопасности: «Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии» [12]. – Ред.
Что же делать?
Решать вышеперечисленные проблемы можно с помощью двух независимых стратегий. Первая стратегия заключается в поиске альтернативных безопасных способов введения транскрипционных факторов*. На сегодняшний день в этом направлении ведется множество работ. Например, в качестве поставщика генов ТФ используют аденовирусные конструкции, не встраивающиеся в клеточный геном. При другом подходе ТФ доставляют в клетку не в виде генов, а в виде РНК-матриц или готовых белков. Даже в рамках интегративных методов доставки транскрипционных факторов ведутся работы по снижению рисков их использования за счет встраивания всех четырех генов в одну рамку считывания. Вариантов доставки факторов транскрипции в клетку очень много, но все они проигрывают привычным лентивирусным конструкциям по двум параметрам – по эффективности и оптимальности материальных затрат и сил. Последнее тоже немаловажно, так как в перспективе перепрограммирование клеток будут производить не в лабораторных, а в медицинских масштабах.
* – Редкий человек не слышал о дурном поведении чужих и даже собственных по каким-то причинам слабо контролируемых стволовых клеток: «Ствол и ветки, стволовые клетки» [1]. Методология получения ИПСК ещё больше повышает градус онкологической настороженности: проблему представляет встраивание в геном не только векторной ДНК с активными промоторами, но и протоонкогенов – да, гены двух из четырех «магических» ТФ (c-Myc и Klf4) относятся к протоонкогенам. Поэтому стараются всеми способами найти баланс между эффективностью перепрограммирования и безопасностью, меняя спектр ТФ или вовсе исключая введение генно-инженерных конструкций – есть надежда, что в перспективе будет достаточно просто «похимичить»: «Снежный ком проблем с плюрипотентностью» [10], «Была клетка простая, стала стволовая» [9]. – Ред.
Вторая стратегия заключается в поиске оптимального типа клеток для перепрограммирования. Оказалось, что разные типы клеток могут значительно различаться по своей способности давать линии ИПСК. Эти различия проявляются в неодинаковых скорости и эффективности (из одного и того же количества клеток разных типов получается разное количество клонов ИПСК) перепрограммирования. Способность клеточного типа к перепрограммированию зависит от разных факторов. Некоторые клетки являются мультипотентными или просто активно обновляющимися, что ставит их ближе, чем терминально дифференцированные клетки, к плюрипотентному состоянию.
Кроме эффективности такого превращения, клетки отличаются числом транскрипционных факторов, необходимых для их перепрограммирования. Клетки, «откликающиеся» на меньшее число факторов транскрипции, не только значительно сокращают риски даже опасных способов введения ТФ, но и увеличивают эффективность уже найденных безопасных. К таким клеткам относятся, к примеру, нейроны, способные перепрограммироваться при введении не четырех, а всего лишь одного транскрипционного фактора [13]. Но нейроны не подходят для повсеместного создания ИПСК в медицине из-за сложности их выделения из организма. Помимо простоты получения оптимальный тип клеток должен быть в наименьшей степени подвержен агрессивному воздействию внешней среды, а значит, к таким клеткам нельзя отнести кожные фибробласты, наиболее часто используемые для перепрограммирования [14].
Клетки дермальной папиллы – возможный ключ к решению проблем
Рисунок 1. Строение волосяного фолликула. Дермальная папилла, или волосяной сосочек, находится в основании волосяной луковицы.
В 2011 году было показано, что клетки дермальной папиллы мыши также можно перепрограммировать с помощью всего лишь одного ТФ – Oct4 [15]. С тех пор идея перепрограммирования клеток дермальной папиллы больше не выдвигалась, что кажется весьма странным, поскольку эти клетки как нельзя лучше подходят на роль источника ИПСК. Дермальная папилла (ДП) – это соединительнотканный сосочек в волосяной луковице (рис. 1); он находится в глубоких слоях кожи и в меньшей мере подвержен агрессивным воздействиям окружающей среды. Кроме этого, клетки ДП удобны для выделения: для получения культуры клеток достаточно нескольких выдернутых волос. Но что самое главное, эти клетки легко поддаются перепрограммированию и требуют меньше вмешательств в транскриптом, что значительно безопаснее по сравнению с классическим перепрограммированием четырьмя транскрипционными факторами. К сожалению, работа проводилась на мышиных клетках [15], а на человеческих ее результаты проверены не были.
Как следствие, в 2014 году в лаборатории генетики развития Института общей генетики им. Н.И. Вавилова в рамках одной из дипломных работ была поставлена следующая задача: определить минимальный набор транскрипционных факторов, необходимых для перепрограммирования клеток дермальной папиллы. Для начала было проведено более детальное изучение экспрессии генов транскрипционных факторов в клетках дермальной папиллы человека. Оказалось, что в этом типе клеток в обычном состоянии экспрессируются гены трех из четырех ТФ Яманаки: SOX2, KLF4 и c-MYC (рис. 2).
Рисунок 2. Результат от-ПЦР-анализа клеток дермальной папиллы человека, терминально дифференцированных фибробластов и ИПСК на экспрессию факторов Яманаки. Можно видеть, что в клетках дермальной папиллы присутствуют три из четырех транскрипционных факторов. Рисунок из диплома автора статьи [16].
Факт экспрессии KLF4 и c-MYC не удивляет, так как их продукты участвуют в процессах пролиферации и регуляции клеточного цикла и присутствуют в дифференцированных клетках – например, в кожных фибробластах. Но Sox2 является фактором плюрипотентности и встречается в уже перепрограммированных ИПСК, где есть все ТФ; в этом клетки дермальной папиллы уникальны. Таким образом, если в этих клетках уже синтезируются три из четырех транскрипционных факторов, действительно есть основания полагать, что перепрограммирование клеток ДП человека с помощью одного лишь фактора Oct4 осуществимо.
При дальнейших исследованиях выяснилось, что клетки ДП человека хуже поддаются перепрограммированию, чем аналогичные клетки мыши – оно идет значительно дольше и с меньшей эффективностью. Это вполне логично, так как волосяной покров человека в процессе эволюции изменил свои физиологические функции по сравнению с покровом остальных млекопитающих. На данный момент удалось провести перепрограммирование только с помощью двух ТФ – Oct4 и Sox2 (рис. 3), – что уже является неплохим результатом, так как сокращает вдвое вышеописанные риски повреждения генома при использовании вирусных конструкций [16].
Рисунок 3. ИПСК, полученные из клеток дермальной папиллы человека. А – Характерная морфология плюрипотентных стволовых клеток: плотные колонии из мелких клеток с высоким ядерно-цитоплазматическим соотношением. Б – Окраска ИПСК на маркеры плюрипотентности Oct4, Nanog, Tra 1-60 и SSEA4, наличие которых доказывает завершение перепрограммирования. Рисунок из диплома автора статьи [16].
Встает закономерный вопрос: почему для перепрограммирования потребовалось более одного транскрипционного фактора, если в клетках и так присутствуют три из них? Видимо, естественной экспрессии генов ТФ в клетках дермальной папиллы оказалось недостаточно для перестройки генома в плюрипотентное состояние, и для перепрограммирования одним фактором транскрипции понадобятся вспомогательные низкомолекулярные агенты, облегчающие его работу. По некоторым данным, малые органические молекулы даже без прямого влияния на активность генов способны «катализировать» переведение клеток в плюрипотентное состояние, заменяя при этом часть ТФ [9].
Конечно, за один год дипломной работы пропасть между теорией и практикой автором этой статьи преодолена не была, однако дальнейшие пути исследований вырисовываются четче. Приведенные выше результаты показали, что клетки дермальной папиллы действительно находятся ближе к плюрипотентности, чем обычные терминально дифференцированные клетки, и исследования перепрограммирования клеток ДП человека одним транскрипционным фактором нужно продолжать. Вероятно, в ближайшее время в других лабораториях, где занимаются альтернативными безопасными способами введения факторов транскрипции, тоже найдется оптимальное решение, и, сложив два и два, мы таки придем к медицине будущего.
Литература
- биомолекула: «Ствол и ветки, стволовые клетки»;
- биомолекула: «Щадящие стволовые клетки»;
- биомолекула: «Эндометрий как альтернативный источник стволовых клеток»;
- биомолекула: «Органы из лаборатории»;
- биомолекула: «А не замахнуться ли нам на... изменение генома?»;
- биомолекула: «CRISPR-системы: иммунизация прокариот»;
- биомолекула: «Мутагенная цепная реакция: редактирование геномов на грани фантастики»;
- биомолекула: «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки»;
- биомолекула: «Была клетка простая, стала стволовая»;
- биомолекула: «Снежный ком проблем с плюрипотентностью»;
- Sebastiano V., Maeder M.L., Angstman J.F., Haddad B., Khayter C., Yeo D.T. et al. (2011). In situ genetic correction of the sickle cell anemia mutation in human induced pluripotent stem cells using engineered zinc finger nucleases. Stem Cells. 29, 1717–1726;
- биомолекула: «Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии»;
- Kim J.B., Zaehres H., Ara?zo-Bravo M.J., Sch?ler H.R. (2009). Generation of induced pluripotent stem cells from neural stem cells. Nat. Protoc. 4, 1464–1470;
- биомолекула: «Как сделать нейрон из фибробласта?»;
- Tsai S.-Y., Bouwman B.A., Ang Y.-S., Kim S.J., Lee D.-F., Lemischka I.R., Rendl M. (2011). Single transcription factor reprogramming of hair follicle dermal papilla cells to induced pluripotent stem cells. Stem Cells. 29, 964–971;
- Алексеева Е.И. Определение минимального набора транскрипционных факторов, достаточного для индукции плюрипотентности клеток дермальной папиллы человека: дипломная работа. – Москва, 2015 – 56 с.
06.10.2015