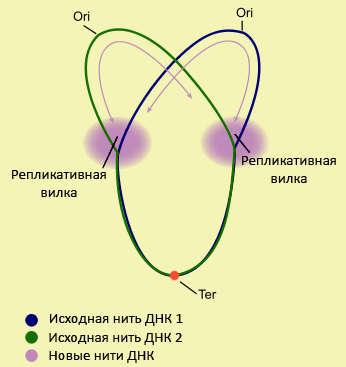
Разработан новый подход к предсказанию темпов роста численности бактерий, основанный на особенностях удвоения их генетического материала. Копирование кольцевого генома начинается с одной точки — ориджина репликации. Оказывается, отношение количества копий фрагментов ДНК рядом с ориждином к количеству копий максимально удаленных от него участков отлично коррелирует с темпами роста бактериальной популяции. Теперь можно предсказывать изменения численности представителей микробиоты человека, имея только одну пробу от донора и секвенатор.

Микробиом (или микробиота) — совокупность всех микробов, населяющих организм — влияет на жизнь и здоровье человека. Уже удалось показать связь микробиома со многими патологиями: ожирением, диабетом второго типа, аутоиммунными заболеваниями и даже раком. Активно используемые сейчас методы изучения микробиома позволяют рассматривать его только в «застывшем» виде — оценивать количество бактерий и структуру их популяций в организме в отдельно взятый момент времени. Минус подобных анализов в том, что они не отражают динамичную природу микробиологического сообщества и различий в активности его членов.
Ученые из Израиля и США задались вопросом, можно ли наперед оценить динамику размножения микробов человека, анализируя только последовательности их ДНК [1]. За исключением нескольких видов, генόм большинства бактерий состоит из единственной кольцевой хромосомы, которая реплицируется (удваивается) в двух направлениях, начиная с одной точки. Эта точка называется ориджином репликации. Заканчивается удвоение бактериального генома в терминальной точке (терминаторе). Во время копирования ДНК участки генома, находящиеся позади репликационной вилки, присутствуют в клетке в двух копиях, а те, что перед ней — в одной (рис. 1). Поэтому если исследовать популяцию бактерий целиком, число копий фрагментов ДНК, сближенных с ориджином, будет больше, чем тех, которые находятся вблизи от терминатора. Отношение числа копий участков ДНК рядом с ориджином к числу копий участков рядом с терминатором назвали PTR (peak-to-trough ratio). Это отношение будет тем больше, чем быстрее растет бактериальная популяция. Таким образом, используя PTR, можно количественно оценить скорость роста популяции [1].
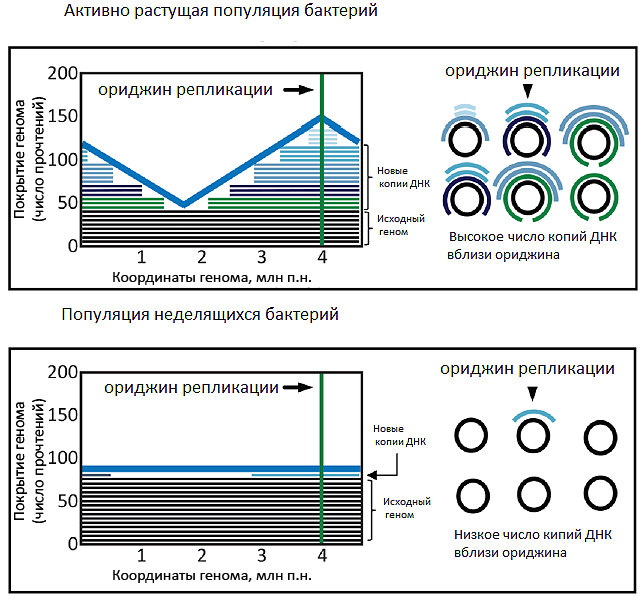
Для проверки этого подхода на практике ученые секвенировали ДНК кишечной палочки (Escherichia coli) в разные периоды роста колоний. В том случае, когда большинство клеток культуры не делилось и имело только одну копию генома, все участки ДНК прочитывались равномерно (и соотношение PTR было ≈1:1). Когда же колония находилась в стадии активного роста, некоторые участки — а именно сближенные с ориджином репликации — прочитывались чаще, и значение PTR возрастало (рис. 2). Но можно ли по PTR предсказывать динамику роста популяции? Оказалось, что можно: повышение PTR коррелирует с ростом численности кишечной палочки, опережая его на полчаса*. Ученые проверили другие виды бактерий (Lactobacillus gasseri и Enterococcus faecalis) и обнаружили те же закономерности.
* — Отметим, что польза открытия не в конкретном времени предсказания размножения бактерий. Важно то, что предсказание технически возможно. А значит, возможна количественная оценка динамики роста микробиоты после анализа одной пробы, а не цикла проб. Подход может оказаться полезным для диагностики бактериальных заболеваний человека.
Рисунок 2. Соотношение PTR отражает динамику численности популяции E. coli in vitro. Копирование генома предшествует делению клетки. У активно делящихся бактерий при секвенировании хромосом число прочтений генов вблизи ориджина будет больше, чем тех, что располагаются вдали от него (верхняя панель), а у неделящихся — нет (нижняя панель). В первом случае формируется типичная сиквенс-картина с пиком и впадиной, во втором — геномы читаются равномерно. Рисунок из [1], адаптирован.
Но особенно важно было оценить, представляет ли измерение PTR интерес для медицины. Чтобы понять, можно ли с помощью PTR уловить клинически значимые изменения в микробных популяциях при определенных воздействиях, провели эксперимент: растущие бактерии Citrobacter rodentium обработали эритромицином. Этот бактериостатический антибиотик блокирует синтез белков бактериальными рибосомами, микроорганизму становится так плохо, что необходимость в репликации ДНК отпадает. По логике, значение PTR при этом должно снизиться. Контрольных бактерий обработали бактерицидным антибиотиком канамицином или вообще никак на них не воздействовали. Как и ожидалось, эритромицин понизил PTR. Снижение PTR было зарегистрировано через 30 минут после обработки препаратом, при этом бактерии прекратили размножаться только через 60 минут. А когда бактериостатик убрали из среды, значение PTR возросло, предвещая возобновление роста численности микробов (чего не наблюдали в варианте с антибиотиком-убийцей).
Далее авторы перешли к экспериментам на животных. Для опыта использовали мышей, очищенных от собственных микробов с помощью многочисленных антибиотиков. Мышей заразили двумя вариантами C. rodentium — болезнетворным и безопасным. Затем секвенировали ДНК бактерий и сравнили их показатели PTR, которые, как оказалось, отличались. У болезнетворных бактерий в определенный момент развития в организме хозяина соотношение PTR возросло — их скорость роста увеличилась.
Проводили исследования и на людях-волонтерах. Они, например, резко меняли свою диету (переходили на варёный рис), а затем возвращались к привычному питанию. Оказывается, такие радикальные изменения в диете влияют на микробиом, а предсказывать динамику роста бактерий и в этом случае можно по PTR.
В ходе экспериментов обнаружили и другие интересные факты, например:
- PTR четко отражает то, что динамика роста бактерий зависит от генетики организма хозяина.
- У человека по PTR можно анализировать суточные колебания численности микробов в кишечнике.
- В разных частях тела человека бактерии растут с разной скоростью, а новый подход позволяет оценить это количественно.
- Анализ динамики микробиомов нескольких сотен человек выявил неизвестную ранее достоверную связь численности некоторых бактерий с заболеваниями. Например, рост популяции Bifidobacterium longum ассоциировали с развитием болезни Крона.
В процессе выполнения работы ученым приходилось секвенировать множество бактериальных геномов*. И параллельно с разработкой метода по предсказанию роста микробных популяций они обнаружили 55 ранее не охарактеризованных ориджинов репликации для разных видов бактерий.
* — О современных методах чтения ДНК рассказано в статьях [2, 3], а об инфраструктуре (в том числе отечественной), связанной с познанием человеческого генома — в обзоре «Код жизни: прочесть не значит понять» [4]. — Ред.
Таким образом, в биомедицинском арсенале появился новый тип анализа бактерий человека, который позволяет с высокой точностью количественно оценивать динамику численности их популяций в организме — при разных внешних и внутренних условиях. А для исследования нужна всего одна проба. Новый метод уже применяют в поиске взаимосвязи темпов размножения некоторых микробов и болезней человека.
Литература
- Korem T., Zeevi D., Suez J., Weinberger A., Avnit-Sagi T., Pompan-Lotan M. et al. (2015). Growth dynamics of gut microbiota in health and disease inferred from single metagenomic samples. Science. doi: 10.1126/science.aac4812;
- биомолекула: «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)»;
- биомолекула: «Секвенирование единичных клеток (версия — Metazoa)»;
- биомолекула: «Код жизни: прочесть не значит понять».