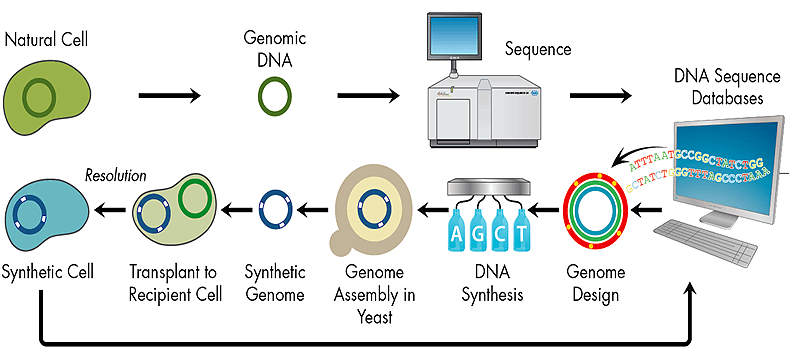
Научно-исследовательские и опытно-конструкторские разработки НИОКР

Еще совсем недавно рассуждения о возможности достижения физического бессмертия были уделом фантастов, дилетантов от науки или попросту аферистов. Научные прорывы последних лет и крупные инвестиции в исследования в этой области превратили радикальное продление жизни человека — до 150 лет — в практическую задачу, решение которой просматривается на горизонте ближайших 50–70 лет. Далее нас ждет возникновение «рынка бессмертия» с такими продуктами, как таблетки от старости, «запчасти» для организма в виде искусственно выращенных органов, киборгизация человека, протез тела. Как на фоне достижений современного биотеха в этой области смотрятся российские компании?
«Старение человека больше не является неразрешимой биологической проблемой», — заявил в 2007 году профессор анатомии Калифорнийского университета в Сан-Франциско Леонард Хейфлик. Научные достижения последних лет — прорыв в выявлении генетических механизмов старения, биопринтинг и биопротезирование, использование стволовых клеток и многие другие — позволяют говорить о том, что мир находится на пороге «антиэйджинговой революции».
Два года назад влиятельный журнал Time вышел с крупной надписью на обложке: «Сможет ли Google победить старение?» Внутри была история о новом стартапе поискового гиганта — компании Calico. Цель ее создания звучала до абсурда амбициозно: радикально увеличить продолжительность жизни человека, побороть старение, избавиться от смерти. Похоже на провокацию от компании, гонящейся за имиджем первопроходца футуристических технологий? Издание, опубликовавшее материал, так не считало. Аннотация на обложке была однозначной: «Эта идея безумна, но за ней стоит Google». О серьезности намерений высокотехнологичной корпорации свидетельствовали обещанные стартапу инвестиции в миллиард долларов и кадровые назначения. Руководителем (и одним из соинвесторов) Calico стал Артур Левинсон — глава совета директоров Apple и биотехнической корпорации Genentech, человек, предельно близкий как к науке, так и к высоким технологиям. Calico сосредоточилась на фундаментальных исследованиях в области старения и возрастзависимых заболеваний — нейродегенеративных (к их числу относят, например, болезнь Альцгеймера) и рака. О том, насколько успешным станет начинание Google, можно будет сказать через пару десятков лет. «Учитывая средние сроки, которые проходят в медицине от появления идеи до ее реализации на рынке, уже через 10–20 лет цели, которые мы ставим сегодня, могут быть достигнуты», — заявил сооснователь Google Ларри Пейдж в интервью Time. В сравнении с вечностью, которую сулит бессмертие, сроки мизерные.
До недавних пор радикальное продление жизни оставалось той областью медицины и биологии, которой побаивалась традиционная фармацевтика, — и, соответственно, избегали инвесторы. Даже в 2000‑х стартапы в ней образовывались редко, поскольку требовали обширных ресурсов, а «Большая Фарма» предпочитала не связываться с вероятными рисками.
Но теперь борьба за рынок бессмертия точно началась. И, судя по приходу на него столь сильных мультизадачных игроков, как Google, конкуренция будет разворачиваться отнюдь не только между фармацевтическими компаниями. Эта отрасль стремительно насыщается знаниями и деньгами. Станет ли поколение ныне живущих свидетелем того, как вечная жизнь поступит в продажу?
Такая вероятность существует. Американский физик Ричард Фейнман в прошлом веке утверждал: «Если бы человек вздумал соорудить вечный двигатель, он столкнулся бы с запретом в виде физического закона. В отличие от этой ситуации, в биологии нет закона, который утверждал бы обязательную конечность жизни индивида». Большинство ученых сходится в том, что в мире не существует никаких фундаментальных принципов, ограничивающих длительность жизни или запрещающих бессмертие. «Сегодня основными препятствиями с точки зрения биологии являются так называемый предел Хейфлика (ограниченное число делений клеток) и изнашивание коллагена, играющего роль «арматуры» внутри организма, — уточняет Владимир Миронов, научный руководитель компании 3D Bioprinting Solutions. — Но эти проблемы решаемы». По мнению консервативно настроенной части научного сообщества, радикальное продление жизни мы увидим в 2050–2070‑е годы. Однако есть и более смелые предположения.
Представители всемирного движения трансгуманистов-имморталистов, одним из идеологов которого является знаменитый футуролог Рэй Курцвайль, нацеливаются на 2045 год. К этому времени, по прогнозам Курцвайля, человечество достигнет точки «технологической сингулярности»: после ее прохождения технический прогресс станет настолько быстрым и сложным, что человеческий разум уже не сможет его понять. Курцвайль подробно расписал схему движения к сингулярности: в 2019 году носимая электроника избавит человечество от слепоты и глухоты, в 2026‑м будут созданы первые летающие автомобили, в 2045‑м появится искусственный интеллект, способный к самовоспроизводству. Дальнейшие предсказания напоминают сюжет «Терминатора». После восстания машин человек потеряет способность управлять миром. Чтобы догнать искусственный интеллект, нам придется радикально трансформировать свой биологический облик с помощью нанороботов и других устройств, которые будут вживлены в анатомию и ДНК человека. Заодно можно будет генетически запрограммировать стареющий мозг на бесконечную жизнь, а с сознания на всякий случай снять цифровую копию.
Сейчас ученых куда больше интересует первый шаг в сторону этого полуфантастического сценария — разгадка причин и механизмов старения.
Таблетка от старости
«Николай Карамзин был старше всех собравшихся. Ему было 34 года — возраст угасания», — писал Юрий Тынянов в романе «Пушкин». В начале XIX века, когда происходили события, описанные в произведении, записывать сорокалетних мужчин и женщин в «пожилые» было обычным делом. 25-летних девушек никто не считал молодыми, а люди старше 50 лет точно попадали в категорию стариков. За два столетия средняя продолжительность жизни выросла более чем вдвое. В развитых странах она сегодня составляет свыше 80 лет — и даже в Африке за последние полвека выросла с 26 до 58 лет. Благодарить в первую очередь стоит медиков: люди стали чаще доживать до старости, чем умирать от болезней. Но биологический предел продолжительности жизни еще не достигнут: возможности человеческого организма позволяют ему жить значительно дольше. Как это делают, например, десятки видов животных (главным образом морские обитатели: рыбы, черепахи, моллюски и другие), которые являют собой феномен «пренебрежимого старения» — то есть стареют так медленно, что зафиксировать какие-либо возрастные изменения у них практически невозможно. Некоторые из них живут более четырехсот лет и умирают, как правило, от голода. Феномен пренебрежимого старения статистически заметен и у людей-долгожителей: после достижения 90–100 лет вероятность умереть с каждым последующим годом у них не увеличивается, а сохраняется на одном уровне.
— Наше поколение может быть первым, которое проживет значительно дольше предков, или последним, которому уготована сравнительно короткая жизнь, — уверен ученый-геронтолог Александр Жаворонков, заведующий лабораторией биоинформатики ФНКЦ ДГОИ. — В ближайшие 20 лет произойдет революция в биогеронтологии: человечество сможет значительно отодвинуть начало старения и замедлить его процессы. Если не случится какого-либо серьезного экономического коллапса за рубежом или крупных войн, тридцатилетние люди уже сегодня могут оценивать горизонт собственной жизни примерно в 140–150 лет — принимая во внимание те технологии, которые скоро дойдут до клиники.
В 2014 году Жаворонков основал компанию InSilico Medicine, которая работает в области биоинформатики и специализируется на разработке «таблеток от старости». Она собирает и анализирует большие базы данных по так называемым сигнальным путям внутри клетки — последовательностям молекул, посредством которых передается информация. Нарушения в системе передачи сигналов приводят к различным заболеваниям, в том числе и к старению. Последовательности этих молекул у каждого человека уникальны — вот почему, в частности, лекарства действуют не на всех людей одинаково. В клетке имеются механизмы «ремонта» повреждений, однако с возрастом они дают сбой и накапливают ошибки. Но эти механизмы можно научиться «включать» и «выключать» по желанию, в том числе фармацевтически, чтобы замедлить процесс старения.
Именно так, по задумке ученых, станут работать геропротекторы — вещества, тормозящие старение и способствующие обновлению организма. На исследования сегодня отправлено около двух десятков таких веществ. До сих пор клинические испытания и лабораторные тесты геропротекторов проводились только на модельных животных — грызунах или круглых червях планариях, которые обладают малой продолжительностью жизни по сравнению с человеком. Однако с помощью математических алгоритмов, которые предлагает InSilico Medicine, можно подсчитать варианты активации сигнальных путей у здоровых и больных клеток. Иными словами, можно смоделировать реакцию организма на прием лекарства без фактического его приема. А заодно и подобрать верную дозировку, рассчитанную индивидуально для каждого пациента.
«Таблетки от старости» не обязательно придумывать с нуля. Возможно, они уже существуют и продаются в аптеках — по крайней мере ряд зарегистрированных и общедоступных препаратов демонстрирует определенную активность в замедлении процессов старения (например, аспирин). Задача фармкомпаний сегодня упрощается: им не нужно изобретать новые лекарства, достаточно провести соответствующие эксперименты и исследования, а затем перепозиционировать всем известные препараты в геропротекторы. «Фармацевтические компании предпочитают заявлять лекарство в качестве средства узкой направленности, против одной или ряда болезней. Это делается по экономическим и юридическим причинам, — поясняет Юрий Никольский, директор по науке кластера биомедицинских технологий «Сколково». — Однако лекарства — это биологически сложные вещества, которые влияют на многие процессы в клетках. Некоторые белковые мишени, на которые воздействуют препараты, могут участвовать и в процессах, связанных со старением». Осталось только разобраться, какие именно «мишени» отвечают за старение и каков механизм воздействия на них. «Большая Фарма» уже взялась за соответствующие исследования: свои программы в области борьбы со старением анонсировали, в частности, швейцарские фармацевтические гиганты Novartis и Hoffmann-La Roche.
Переключить программу
— Каждый человек — это программа: код ДНК, в котором три миллиарда букв, — разговор о причинах старения генеральный директор компании «Институт стволовых клеток человека» (ИСКЧ) Артур Исаев начинает с повторения азов генетики. — Этот код запускает разные «приложения» — белки, которые выполняют различные функции. Если какой-то ген сломан, то белок не синтезируется. В развитии человека возникают специфические особенности — поломки в ДНК. Они есть у всех, называются мутациями; некоторые из них приводят к болезням. Задача генной терапии — «починить» программу, скорректировать ее. Первые инструменты для этого были созданы еще 30 лет назад, но они оказались не очень эффективными. Затем биологи научились использовать для переноса генной информации плазмиды и вирусы. Сейчас появились технологии CRISPR/Cas9, TALEN и ZFN, которые позволяют работать с генами фокусно — в буквальном смысле вырезать конкретные участки ДНК, заменять их на другие. Точность действий генетиков увеличилась в сотни раз.
Если человек — это программа, то генная терапия — это механизм ее обновления и доработки. Один из первых в мире генно-терапевтических препаратов был создан в России, в лабораториях ИСКЧ: это «Неоваскулген», предназначенный для лечения ишемии нижних конечностей. При этом заболевании сосуды в ногах у человека забиты атеросклеротическими бляшками, из‑за чего нарушено кровообращение: в критических случаях приходится ампутировать конечности. Препарат, попадая в клетку, «включает» генетическую программу, она производит белок, который стимулирует рост сосудов.
«Это огромный рынок: в мире около 200 миллионов больных ишемией нижних конечностей, причем часть из них неоперабельные», — отмечает Исаев.
Пока вмешательство в геном нацелено главным образом на излечение заболеваний. Но как только с наследственными генетическими болезнями наука разберется, придет очередь возрастзависимых заболеваний — болезни Паркинсона, Альцгеймера, артрита, диабета второй степени. Человек станет менять свои гены так, чтобы его жизнь была более долгой и качественной. Во главе самого громкого проекта в этой области, калифорнийской компании Human Longevity, стоит одиозный генетик Крейг Вентор. В 1998 году он первым просеквенировал геном человека, а в 2010‑м синтезировал первый в мире искусственный организм, способный к размножению, — бактерию по имени Синтия. С тех пор Вентор демонстрирует уникальную способность привлекать деньги в «спорные» ниши науки, которые без него никогда бы не были профинансированы. Human Longevity занимается секвенированием огромной базы геномов — около миллиона штук — различных человеческих популяций: здоровых людей, больных, долгожителей. Компания планирует выявить все генетические изменения, которые происходят при старении, и в конечном счете понять принцип действия механизмов долголетия.
Свои соображения о том, кто виноват в старении и что с ним делать, имеются и у российских исследователей. Компания «Тартис-Старение», резидент «Сколкова», полагает, что источником «системного синдрома старения» являются сенесцентные клетки, с годами накапливающиеся в организме человека и создающие негативный фон для работы всего организма. Секреты, которые выделяют эти клетки, мешают работать здоровым соседям. Эти клетки могли бы «переродиться» в раковые, но не стали таковыми — однако все еще вызывают воспаления различных тканей. В итоге организм изнашивается и стареет. «Если запретить организму накапливать эти клетки, появится возможность отсрочить то состояние, которое люди привыкли называть старостью, — объяснял «Бизнес-журналу» генеральный директор «Тартис-Старения» Андрей Леонов в 2013 году. — Речь здесь, конечно, не идет о бессмертии: можно говорить лишь о новом качестве жизни, так называемой счастливой старости — без признаков дряхления организма». На разработку лекарства от старости — которое ради спокойствия общественности и регуляторов собираются выводить на рынок под видом препарата от возрастзависимых заболеваний, у компании уйдет около десяти лет. Получив от фонда «Биопроцесс Кэпитал Венчурс» грант в 150 млн рублей, «Тартис-Старение» перенесло все исследования сенесцентных клеток в США: у нас в стране соответствующей лабораторной базы, и в особенности биологических моделей, попросту нет. В Америке же компания работает в сотрудничестве с Cleveland Biolabs, основанной выходцами из России Яковом Коганом и Андреем Гудковым (последний выступает научным консультантом «Тартис-Старения»).
«Закамуфлировать» лекарство, предположительно предотвращающее старость, под рядовой препарат — не такое уж странное маркетинговое решение. Зарегистрировать его точно будет легче, а создать «правильный пиар» — задача второй важности. Точно так же пришлось поступить, к примеру, Владимиру Скулачёву — академику РАН, декану факультета биоинженерии и биоинформатики МГУ, создавшему нашумевшие «ионы Скулачёва». На основе разработанного им активного вещества SkQ был зарегистрирован не «эликсир молодости», а обычные капли против «синдрома сухого глаза». Правда, как утверждает академик, некоторые покупательницы пробуют растирать их по коже вместо того, чтобы капать жидкость в глаза, — и напрасно, потому что концентрация ионов в препарате крайне низкая для сколько-нибудь заметного омолаживающего эффекта.
Согласно гипотезе Скулачёва, с возрастом «энергетические станции клетки» — митохондрии — изнашиваются и перестают поставлять в мембраны антиоксиданты, замедляющие старение. Митохондрии являются самым уязвимым местом для ядовитых форм кислорода и свободных радикалов, но одновременно сами производят их. В 2004 году Владимир Скулачёв предложил формулу вещества, которое напрямую, с помощью катионов, доставляло бы в мембраны природные антиоксиданты — и таким образом отменяло программу «биохимического самоубийства человека». За десять лет Скулачёву и его сыну Максиму, который ныне возглавляет компанию «Митотех», занимающуюся коммерциализацией «ионов Скулачёва», удалось провести серию опытов на мышах, крысах и других животных как в России, так и за ее пределами — и зарегистрировать препарат на основе ионов в форме глазных капель.
В чудо-ионы поверили отечественные бизнес-ангелы, симпатизирующие идеям бессмертия. С 2005 по 2008 год $15 млн вложил в проект Олег Дерипаска, в 2009‑м еще около $10 млн добавил Александр Чикунов — бывший член правления РАО «ЕЭС России» и совладелец фонда «Русэнергоинвест». Правда, спустя год Чикунов вышел из правления, сославшись на то, что компания застопорилась в развитии. На его место пришла корпорация «Роснано»: она выделила 710 млн рублей на испытания, регистрацию и вывод на рынок лекарственного средства, основанного на SkQ. Сегодня в «Митотехе» строят планы по созданию препаратов для лечения возрастных офтальмологических заболеваний — глаукомы и катаракты, а также разрабатывают косметические средства для борьбы с признаками старения. Правда, убедительных доказательств эффективности «ионов Скулачёва» на людях пока так и не получено.
Покинув проект Скулачёва, Александр Чикунов и его группа компаний «Росток» так и не распрощались с мечтами о бессмертии. С 2010 года инвестор работает над собственным проектом «Скрининг» — тестирует несколько десятков химических соединений, которые предположительно могут являться геропротекторами и более чем на 30% увеличивать жизнь млекопитающих. В декабре 2014 года Чикунов заявил, что ему удалось не только обнаружить вещества, которые продлевают жизнь, но и установить, почему они это делают, а также открыть «самую важную систему, активация которой тормозит процессы старения». Дальнейшим шагом «Скрининга», по его словам, станет разработка биологически активной добавки — специального пробиотика. Препарат должен стимулировать рост бактерий, которые вырабатывают нужные метаболиты и в конечном счете способствуют увеличению продолжительности жизни. Необходимые инвестиции в создание препарата и вывод его на рынок Александр Чикунов оценивает всего в $2 млн.
Требуются тестировщики
Перспективы вмешательства генных инженеров в человеческий организм выглядят многообещающими, но реализация (и коммерциализация) этих разработок пока еще находится в зачаточном состоянии. Пожалуй, самым успешным примером монетизации генетического анализа стала калифорнийская компания 23andMe, основанная бывшей женой одного из основателей Google Сергея Брина Анной Войжицки и ее коллегой Линдой Эви. Компания берет $99 за «расшифровку генома» — исследование слюны клиента на предрасположенность к тем или иным заболеваниям — и присылает результат теста почтой. Правда, в 2013 году деятельность 23andMe на территории США приостановили из‑за того, что компания не смогла доказать научную состоятельность своих тестов. Позже проводить анализы разрешили снова — но не на предмет заболеваний, а на наличие родственных связей между людьми. Даже с учетом этих ограничений к июню 2015 года компания продала свыше миллиона тестов.
Свои успешные попытки в схожем направлении предприняла и отечественная компания «ИСКЧ». C 2013 года она запустила создание лаборатории и сети центров Genetico, которые специализируются на новых методах генетической диагностики. «В медицине, — объясняет гендиректор ИСКЧ Артур Исаев, — сегодня существуют прекрасные возможности для управления своим здоровьем: они связаны с предварительной диагностикой и постоянными проверками состояния организма. По генетике можно определить проблемные зоны, мониторить их и своевременно заниматься профилактикой — либо начинать раннее лечение. Это неминуемо будет приводить к увеличению продолжительности жизни — просто, возможно, эти технологии обыденные и не столь волнующие, как те, что обещают бессмертие уже завтра».
Панель генетического обследования, сопоставимая с той, которую предлагает 23andMe, в ИСКЧ стоит около 5 тыс. рублей, а полная расшифровка работающей части генома обойдется в сумму от 55 до 95 тысяч. По сравнению с $13 млрд, которые были потрачены всего 15 лет назад на расшифровку самого первого генома, это более чем доступно. В отличие от 23andMe и аналогичных компаний, которые продают тест напрямую пациенту, а тот не может разобраться в специализированной информации, результаты тестирования в ИСКЧ расшифровываются и трактуются врачом-генетиком. Наиболее перспективная ниша — скрининг носительства распространенных мутаций на этапе планирования семьи. «Больные дети рождаются в основном у здоровых родителей, — говорит Исаев. — Такое бывает, когда у обоих родителей в генах есть изменения — в одной из пары хромосом поломка, а вторая хромосома производит белок и компенсирует функцию. Однако когда встречаются два человека с одинаковой мутацией, которая связана с повреждением гена, велики шансы появления на свет ребенка с тяжелым заболеванием — например, с муковисцедозом, анемией Фанкони и другими. В России каждый год рождаются около 30 тысяч детей с наследственными заболеваниями». Как правило, к генетикам-репродуктологам обращаются, когда в семье уже есть один больной ребенок, но родители собираются завести второго. В этом случае можно, например, пройти процедуру ЭКО, оплодотворить несколько яйцеклеток, взять по одной клетке от каждого эмбриона и протестировать их на предмет мутаций и хромосомных аномалий. Для имплантации врач может выбрать не случайный эмбрион — растущий, на первый взгляд, лучше других, — а тот, у которого не будут обнаружены генетические заболевания и который не станет их носителем.
— Медицина наконец-то переходит от лечения болезни к лечению пациента и его проблемы, что требует принципиально иного подхода к диагностике и обработке медицинских данных, — резюмирует Ольга Бабкина, заместитель проректора по научной работе Томского государственного университета и руководитель трека BiotechMed акселератора GenerationS. — На первый план выходят своевременная диагностика заболеваний, персонифицированный подход к лечению пациента, постоянный доступ к медицинской помощи и базе данных о здоровье пациента. Причем в России у тест-систем есть неплохие шансы на развитие. То, что российские стартапы движутся в русле мировых трендов, можно отследить по проектам, которые проходят акселератор GenerationS: это гемотесты ключевых биомаркеров мозга для выявления поражений мозга, диагностические комплексы по раннему обнаружению онко‑ и сердечно-сосудистых заболеваний, тест-системы для выявления предрасположенности к развитию артроза и другие.
Органная партия
Даже исцелившись от старости и бесконечно продлив молодость, человек, скорее всего, не изменит хрупкости своего тела: оно по-прежнему будет подвержено травмам и внешним воздействиям. Не удивительно, что вместе с генной инженерией одной из самых «горячих» областей в биотехнологиях становится регенеративная медицина, отвечающая за восстановление тканей и органов. Сегодня ученым ясно: способность к регенерации заложена не только в животных. Теоретически ничто не мешает запустить в человеческом организме процесс «отращивания» утраченного органа или «омоложения» постаревшего. Сделать это можно с помощью трансплантации клеток или за счет активации эндогенных стволовых клеток. Эти технологии становятся массовыми и реализуются в виде коммерческих продуктов — препаратов в области лечения диабета, сердечно-сосудистых заболеваний, косметологии.
Лидер в области подобных исследований в России — все тот же ИСКЧ. Самое массовое его начинание — банк пуповинной крови. Как ясно из названия, это кровь, сохранившаяся в плаценте и пуповинной вене после рождения ребенка. В ней содержится некоторое количество стволовых клеток, которые в будущем могут быть использованы для трансплантации или лечения некоторых болезней как у самого новорожденного, так и у других людей. В последнее время возникают идеи использовать стволовые клетки из пуповинной крови для увеличения продолжительности жизни. «Одно из исследований показало, что у прожившей 105 лет женщины на протяжении всей ее жизни имелось два типа кроветворных клеток, — рассказывает Артур Исаев. — По всей видимости, очень важно, чтобы в организме постоянно содержался источник роста новых кроветворных клеток. И если он хранится в банке, из него можно воссоздать кроветворную иммунную систему. Правда, пока это только теория». В России сегодня существует 10 банков пуповинной крови, у ИСКЧ — половина рынка. Стандартная процедура забора материала стоит 50 тыс. рублей, годовое хранение образца крови — 5 тыс. Услуга приносит половину всей выручки компании: за прошлый год ИСКЧ заработал на хранении пуповинной крови 196 млн рублей.

Другой продукт ИСКЧ, связанный с клеточными технологиями, — так называемая SPRS-терапия, классический пример того, как можно заработать на одержимости людей молодостью и бессмертием. Это чистой воды эстетическая медицина — правда, предельно персонализированная. У каждого пациента берется кусочек кожи, из которого выращиваются десятки миллионов фибробластов — специализированных «клеток молодости» кожи, отвечающих за синтез эластина, коллагена и гиалуроновой кислоты. Клетки вводятся в кожу и в живой среде начинают активно функционировать; в результате микрорельеф кожи улучшается, она разглаживается, визуально молодеет. По словам Артура Исаева, Россия была пионером данной технологии: в США аналогичная терапия запустилась на год позже.
Стволовые клетки можно использовать и для более смелых задач — например, выращивать с их помощью «запчасти» для тела человека «в пробирке». Этим уже занимается российский ученый Владимир Миронов, основатель и научный руководитель компании 3D Bioprinting Solutions, созданной на деньги медицинского холдинга «ИНВИТРО». В марте 2015 года он первым в мире напечатал на сконструированном его же руками трехмерном биопринтере щитовидную железу. В перспективе лаборатория биопринтинга возьмется за органы посложнее — в частности почку. В теории, говорит Миронов, можно было бы напечатать и человека — но произвести его «естественным путем» пока дешевле. Технология биопринтинга схожа с обычным принтером, только вместо чернил используются стволовые клетки — так называемые тканевые сфероиды, «шарики» диаметром в 250 микрон, в которых содержится до тысячи живых клеток. Они в соответствии с заданной цифровой моделью наносятся на подложку — «биобумагу», специальный гель, закрепляющий слой сфероидов. Так продолжается слой за слоем, пока 3D-орган не будет готов.
— Сверхзадача наших исследований — построение человеческих органов, подходящих для имплантации, — говорит Владимир Миронов. — Мы создаем не трехмерные живые ткани, а скорее трехмерные части живых человеческих органов. Это следующий уровень сложности в иерархической структуре организации человеческого тела.
Кажется, время, когда выращивание и печать «запасных частей» к человеческому телу станет рядовым событием, не так уж отдалено: все предпосылки для этого существуют. Пока эксперименты проводятся на мышах; напечатанная Мироновым щитовидка предназначалась как раз лабораторной мыши. Однако есть и примеры успешной трансплантации искусственно созданного органа человеку. В России такими экспериментами занимается итальянский профессор Паоло Маккиарини: в 2012 году он вырастил и пересадил пациентке трахею, а сейчас готовится выращивать другие органы. Маккиарини работает в России по «мегагранту» — программе правительства РФ по привлечению ведущих ученых в российские вузы. На эти деньги он, в частности, обустроил лабораторию в Краснодаре.
Компания 3D Bioprinting Solutions четко представляет способы заработать на искусственных органах: продавать их не только пациентам, но и фармацевтическим компаниям для опытов, а также строить биопринтеры на заказ. Массовое клиническое применение продуктов и выход на IPO, согласно стратегии компании, запланированы на 2018–2020 годы. «Но мы уже сейчас переносим технологию биопринтинга из лаборатории в клинику», — заявляет исполнительный директор лаборатории Юсеф Хесуани. Кстати, в России постепенно может сложиться своеобразный «стволовой кластер»: так, ИСКЧ может начать поставлять компании Миронова индуцированные плюрипотентные стволовые клетки для биопечати (сейчас их приходится заказывать в Бельгии). Правда, для дальнейшего развития технологии в нашей стране потребуется принятие закона, регламентирующего врачебную практику с использованием стволовых клеток. Соответствующий законопроект будет рассматриваться во время осенней сессии в Госдуме.
Прекрасное далеко
— Продление жизни населения — не мечта или прихоть, а насущная проблема в развитых странах мира, — говорит Юрий Никольский («Сколково»). — Большинство пенсионных фондов в США — банкроты, поэтому многие ныне работающие американцы попросту не увидят своих пенсий. Следовательно, государство экономически заинтересовано в том, чтобы его граждане могли вести активную и здоровую трудовую жизнь как можно дольше». Вместе с правительствами развитых стран интерес к увеличению активной жизни (так концепция бессмертия звучит в максимально «смягченном» варианте) демонстрируют фармкомпании — а это, безусловно, повышает привлекательность отрасли для инвесторов. «Инвесторам ведь нужны гарантии выхода, — поясняет Никольский. — а они немыслимы без «Большой Фармы»: львиная доля стартапов в медицине поглощается корпорациями, а не выходит на IPO». Стоит ожидать бума инвестиций в бессмертие?
В России — вряд ли. Интерес к биотехнологиям бессмертия, безусловно, есть. По словам Ольги Бабкиной, ряд российских венчурных фондов и инвесторов — «Биопроцесс Кэпитал Венчурс», «КСИ-венчурс», Primer Capital, «ИНВИТРО» — уже ведет работы по выводу на рынок продуктов, создает и поддерживает стартапы. Заявляются на рынке и частные инвесторы — от бывшего совладельца «Евросети» Тимура Артемьева (он создал венчурный фонд «Вечный разум» и «Институт биологии старения») до фонда «ОНЭКСИМ» Михаила Прохорова (анонсировал проект в области спортивно-восстановительной медицины, связанный с выработкой «гормонов счастья»). Но бума «бизнеса на бессмертии» в России, скорее всего, не будет. Дело даже не в деньгах. «У нас очень мало лабораторий, сертифицированных по международным стандартам GLC и GLP, — а потому очень трудно проводить исследования мирового уровня, — фиксирует слабые места инфраструктуры отечественных «красных» (то есть медицинских) биотехнологий Евгений Кузнецов, заместитель председателя правления РВК. — Очень мало специализированных технопарков и инкубаторов, ориентированных на стартапы, которые занимаются биотехнологиями. Мало университетов, делающих на это серьезную ставку, и очень мало университетских лабораторий серьезного уровня по сравнению не только с Китаем, но и с Индией».
Эти обстоятельства способны нивелировать даже тот неплохой задел в области фармпрепаратов, геропротекторов, материалов для получения искусственных органов и тканей, который у нас имеется. В некоторых нишах — в частности в применении стволовых клеток — развитию отрасли мешает законодательный «затык», который уже затормозил ее на несколько лет. Не удивительно, что в таких случаях единственный вариант для ученых, производителей, предпринимателей — искать реализацию своих идей на других рынках.
Конечно, «антиэйджинговая революция» происходит не локально: научные биотехнологические процессы развиваются сразу по всему миру. Даже если Россия не доведет до рынка в конечном счете ни одной технологии, продлевающей жизнь, «таблетки от старости» все равно будут доступны потребителю — но бессмертие станет еще одной статьей «экспортозависимости» нашей страны. «Более того, — добавляет Ольга Бабкина, — нельзя забывать, что увеличение срока жизни человека принесет массу последствий: возникнут вопросы занятости и вовлеченности в жизнь общества «взрослого» населения (которому сильно за 70 лет), вопросы медицинского обслуживания, изменений в законодательстве… К этому нужно быть готовыми уже не на уровне человека, а на уровне государства».
Титаны бессмертия
Самые крупные частные инвесторы в продление жизни

Ларри Эллисон
основатель Oracle
C 1997 по 2013 год благотворительный фонд Ellison Medical Foundation раздал грантов в области биотехнологий на сумму свыше $430 млн. Около 80% этих средств было направлено на исследования в области предотвращения старения. Среди поддержанных проектов — исследование причин долгой жизни крыс (они живут в 9 раз дольше, чем мыши, и почти никогда не болеют раком), а также изучение процессов старения мозга. С 2013 года финансирование прекращено.

Питер Тил
основатель PayPal
В 2012 году в состав фонда Thiel Foundation вошла лаборатория Breakout Labs, задачей которой стало финансирование «смелых идей радикальной науки». Гранты на сумму $350 тыс. на данный момент получили 19 компаний, в числе которых проекты по выращиванию костей из стволовых клеток, а также поиск способов ликвидировать сбои в клеточных механизмах, проявляющиеся с возрастом.

Сергей Брин
основатель Google
В 2008 году у Сергея Брина была обнаружена генетическая мутация, которая с высокой степенью вероятности может привести к развитию болезни Паркинсона при достижении им 70-летнего возраста. С тех пор предприниматель пожертвовал $150 млн на исследовательские проекты, связанные с анализом больших баз данных человеческого генома.

Юрий Мильнер
совладелец Mail.ru Group и фонда Digital Sky Technologies
Вложил в 2012 году $50 млн в компанию генетического анализа 23andMe. Учредил в 2013 году вместе с Марком Цукербергом, Сергеем Брином и Анной Войжицки ежегодную премию «За прорыв в области медицины» (Breakthrough Prize in Life Sciences), ставшую крупнейшей научной премией в мире в сфере биологии и медицины. Размер премии составляет $3 млн каждому лауреату.
Наталья Югринова | Дата публикации: 27, Сен 2015 |http://b-mag.ru