В #36 выпуске Дайджеста "Новости аватар-технологий":
1) исследователи из MIT применили алгоритм тестирования IQ, используемый в школах, к современному искусственному интеллекту;
2) нейрофизиологи из проекта Blue Brain представили цифровую реконструкцию участка мозга крысы, содержащую 31 тысячу нейронов, 55 слоёв клеток и 207 различных подтипов нейронов;
3) канадские ученые разработали метод выращивания колбочек из эмбриональных стволовых клеток для лечения слепоты;
4) учёные изменили более 60 генов в эмбрионах свиней, что в будущем поможет выращивать для человека донорские органы;
5) и Нобелевская премия по химии в 2015 году дана за исследование механизмов репарации ДНК.
1) Исследователи из Масачуссетского технологического института применили алгоритм тестирования на IQ, используемый в школах, к современному искусственному интеллекту. Как показали результаты, несмотря на то, что компьютеры опережают людей в таких областях как арифметика, по человеческим меркам даже самый продвинутый искусственный разум находится на уровне четырехлетнего ребенка.
Тестированию подвергли нейронную сеть ConceptNet, которая считается одной из наиболее продвинутых версий искусственного интеллекта. Она представляет собой набор баз общеизвестных данных о предметах в окружающем мире и их взаимоотношениях.
Тест состоял из простых вопросов, например, "где живут пингвины?", и вопросов, требующих размышлений, например, "зачем люди пожимают друг другу руки?"
Последний вопрос вызвал у нейронной сети затруднение. Рукопожатие она сравнила с эпилептическим припадком. Самые плохие результаты программа показала в блоках, где требовалось ответить на вопрос «Почему?» или «догадаться» на основе трех наводящих подсказок, о каком объекте идет речь.
Лучшие результаты ConceptNet показала в блоках «Словарь», где требовалось объяснить значение слова, а также в блоках «Схожести», где требовалось указать на общие признаки или связь между двумя объектами.
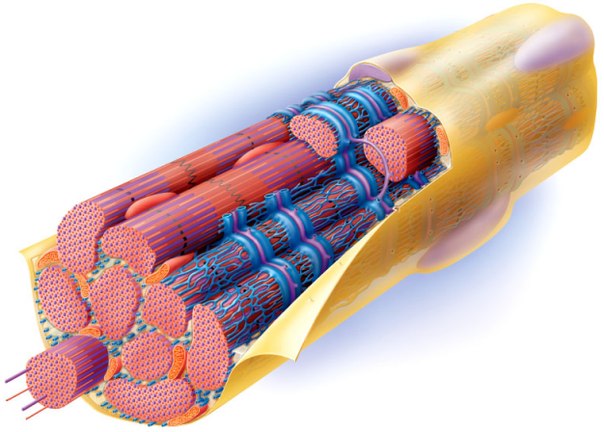
2) Программисты и нейрофизиологи из проекта Blue Brain представили цифровую реконструкцию участка мозга крысы, содержащую 31 тысячу нейронов, 55 слоёв клеток и 207 различных подтипов нейронов.
Генри Маркрам и его коллеги из Федеральной политехнической школы в Лозанне (Швейцария) уже 10 лет работают над созданием искусственного аналога мозга крысы, используя новейшие алгоритмы, имитирующие работу настоящих нервных клеток, со всеми химическими процессами и реакциями внутри них.
Наконец они создали виртуальную копию мозга, на которой можно увидеть различные типы нейронов, присутствующих в этой области, а также ключевые особенности их взаимодействия.
Для эмуляции работы даже столь небольшой части мозга, занимающей всего 0,29 кубических миллиметра по объему, требуются все мощности суперкомпьютера Blue Gene, чьи вычислительные способности приближаются к очень внушительным двум стам девяти терафлопсам.
Первый запуск этого кибер-мозга позволил ученым подсчитать количество связей между клетками коры – оказалось, что в столь небольшой части мозга сосредоточено 40 миллионов синапсов и 2 тысячи связей между каждым типом клеток головного мозга.
После того как реконструкция была завершена, исследователи использовали суперкомпьютер для моделирования поведения нейронов в различных условиях. Такая работа должна помочь ученым в том числе раскрыть корни расстройства психики, и понять, почему человек неадекватно ведет себя в разных ситуациях.
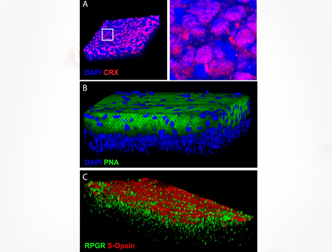
3) Канадские ученые разработали метод выращивания колбочек из эмбриональных стволовых клеток, который может быть использован для лечения дегенеративных заболеваний глаза. В качестве демонстрации восстановительных свойств метода исследователи вырастили у мышей 150 микрометров ткани сетчатки.
В основе метода лежит идея, что превращение эмбриональных стволовых клеток человека (ЭСК) в светочувствительные клетки ингибируется рядом белков. Используя белок Dand5, за пять недель исследователи добились превращения 80 процентов эмбриональных стволовых клеток в S-колбочки («синие»). Для подтверждения эффективности метода ученые вводили полученные клетки сетчатки в глаза здоровых мышей. Пересаженные фоторецепторы мигрировали естественным образом по сетчатке хозяев.
По словам авторов, ранее не существовало эффективных методов синтеза получения значительного количества человеческих колбочек. Пересадка колбочек может стать терапевтическим лечением дегенеративных патологий сетчатки, являющихся причиной ухудшения зрения вплоть до слепоты.
4) Учёные изменили более 60 генов в эмбрионах свиней. Таким образом они рассчитывают наконец начать выращивать подходящие для человека донорские органы.
Биотехнологическая компания под названием eGenesis во главе с генетиком Джорджем Чёрчем из Гарвардской медицинской школы в Бостоне планирует начать выращивание свиней для пересадки органов, а в настоящее время пытается сделать процесс как можно более дешёвым и доступным.
Черч использовал технологии генного редактирования CRISPR/Cas9 для дезактивации 62 эндогенных ретровирусов в эмбрионах свиней. Эти вирусы встроены в геном всех свиней, и их невозможно нейтрализовать: исследователи опасаются, что они могут стать причиной серьёзных заболеваний у человека после трансплантации органов.
Группа Чёрча также модифицировала более 20 генов в отдельной группе эмбрионов свиней. Это в том числе гены, кодирующие белки поверхности клеток свиньи, которые вызывают иммунный ответ человеческого организма и свёртывание крови. Пока Чёрч отказался называть конкретные гены, как минимум до публикации научной работы.
Разработки по генетическому редактированию могут быть использованы в синтетической биологии и в различных других медицинских приложениях, в том числе для лечения заболеваний с генетической составляющей.
5) И нельзя обойти вниманием новости о Нобелевской премии. Лауреатами Нобелевской премии по химии в 2015 году стали ученые, которым удалось на молекулярном уровне отобразить, как клетки восстанавливают поврежденную ДНК и сохраняют генетическую информацию. За исследование механизмов репарации ДНК награду получат швед Томас Линдаль, работающий в Великобритании, американец Пол Модрич и ученый турецкого происхождения Азиз Санкар, работающие в США.
Репарация — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, которые происходят при нормальном биосинтезе или в результате воздействия физических или химических агентов.
Томас Линдаль первым показал, что ДНК чрезвычайно подвержена различным повреждениям. Если бы она не исправлялась, то развитие жизни на Земле было бы невозможным. Это привело Линдаля к открытию механизма эксцизионной репарации, которая вырезает поврежденные участки и заменяет их нормальными.
Азиз Санкар обнаружил другой механизм — вырезание нуклеотидов. Клетки используют этот механизм для восстановления повреждений, наносимых ультрафиолетовым излучением (например, нашего Солнца). При нарушениях этого механизма может развиваться рак кожи.
Пол Модрич нашел способ, с помощью которого клетки исправляют ошибки в ДНК в процессе деления. Этот механизм — репарация ошибочно спаренных оснований — актуален, когда в одной цепи из двухцепочечной ДНК пропущено основание, а в другой — нет. Он уменьшает частоту ошибок в ДНК примерно в тысячу раз.