Штурм и натиск генной терапии старения

Автор: Анастасия Шубина Источник: geektimes.ru
Концепция генной терапии существует на протяжении последних двадцати-тридцати лет. Она заключатся в том, что наиболее радикальный способ борьбы с заболеваниями — это уничтожение самой генетической причины болезни, а не его следствий.
Причиной может быть нарушение определенного гена (мутация), которое передалось от родителей при наследственных заболеваниях, или мутация гена уже во взрослом организме, вызывающая, например, рак. Кроме того, причиной может являться просто слишком высокая (или, наоборот, низкая) активность нормального гена, которая увеличивает риск хронического заболевания, такого как диабет или атеросклероз.
Способ борьбы с этими изменениями заключается во введении в клетку новой генетической информации, призванной исправить ту, с которой связана болезнь.
Вначале немного углубимся в теорию. Молекула ДНК — дезоксирибонуклеиновая кислота — является носителем кода, который управляет развитием и функционированием всего живого. В ДНК содержится программа, которая обеспечивает превращение одной единственной исходной клетки в слаженно работающий организм, состоящий из многочисленных клеток, объединенных в разнообразные ткани и органы.

James Watson, Francis Crick, Maurice Wilkens, and Rosalind Franklin
Расшифровка структуры ДНК в 1953 году стала одним из поворотных моментов в истории биологии. За это открытие ученым Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия по физиологии и медицине 1962 года.
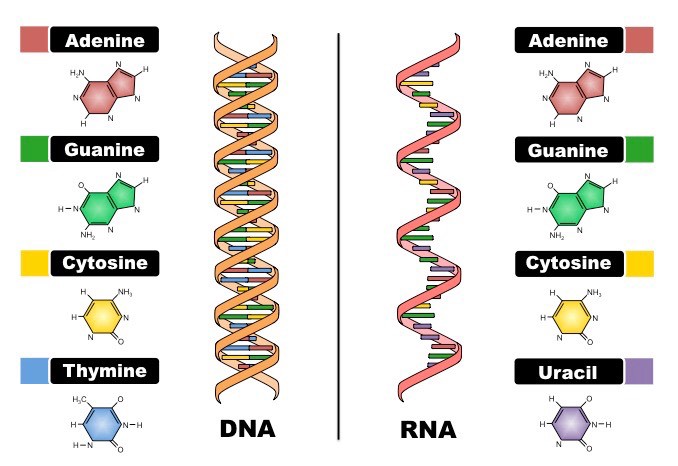
ДНК — огромная молекула, которая состоит из тысяч маленьких молекул — нуклеотидов, четырех разных типов: гуанин (G), цитозин (С), тимин (T) и аденин (A). Нуклеотиды соединяются друг с другом, образуя цепочку; молекула ДНК состоит из 2х таких цепочек, закрученных в двойную спираль.
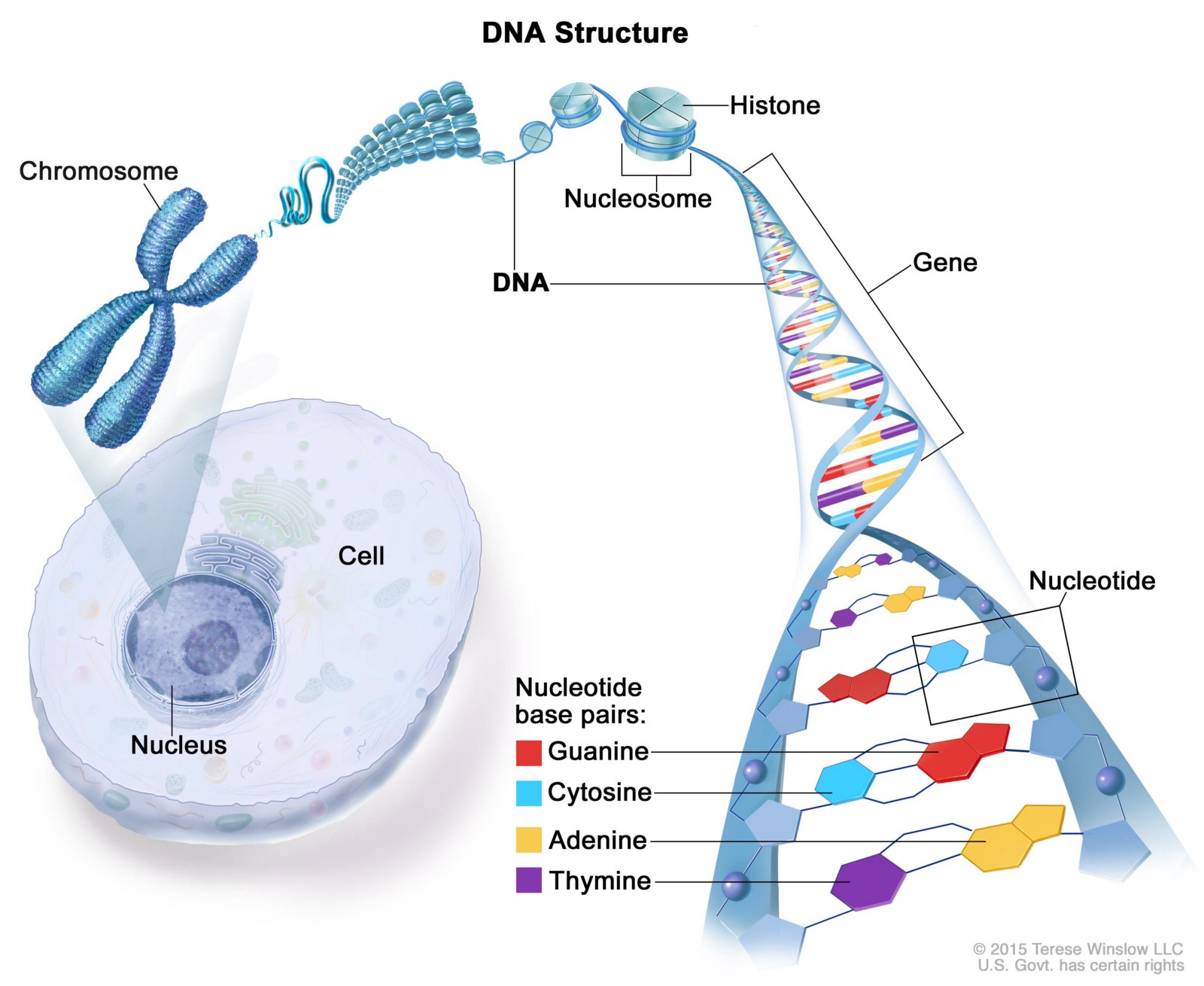
При соединении 2х цепей выполняются следующие правила: аденин всегда соединяется с тимином, а гуанин — с цитозином. Таким образом, напротив тимина из одной нити всегда будет находиться аденин из другой.
Такое расположение позволило объяснить механизмы копирования ДНК при делении клетки. Две нити спирали расходятся, а затем к каждой из них достраивается точная копия ее бывшей “партнерши” по спирали. По такому же принципу, как с негатива в фотографии печатают позитив.
Следующая революция в изучении ДНК произошла спустя 50 лет, в 2003 году, когда был завершен огромный проект «Геном человека». Он позволил расшифровать все 19 000 генов нашего организма и открыл небывалые возможности для медицины.
Ген — это участок молекулы ДНК, в котором закодирован полипептид (часть молекулы белка) или функциональная РНК. Длиной он, как правило, в несколько сотен нуклеотидов, но бывают и исключения. Самые маленькие гены человеческого генома — гены транспортных РНК — составляют всего 76 пар нуклеотидов, а самый большой ген — ген белка дистрофина — 2,4 млн.
У наиболее развитых организмов, в том числе и человека, гены часто бывают разделены фрагментами «бессмысленной», некодирующей ДНК. ДНК человека обвернута вокруг молекулярного остова из белков, вместе с которым она образует хромосому. Вся ДНК человека помещается в 46 хромосомах.
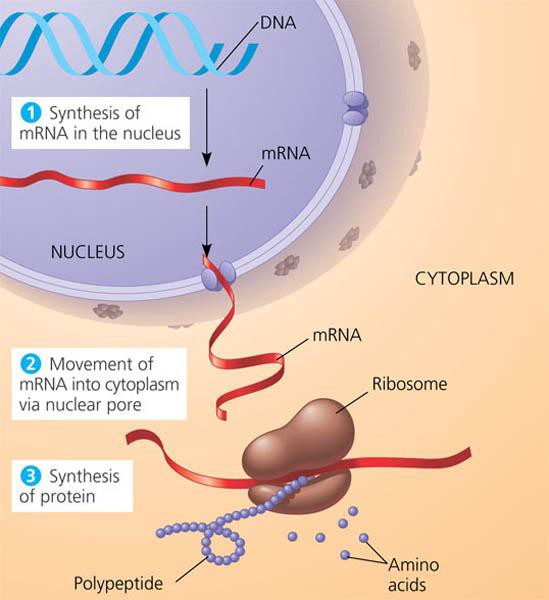
Если сравнить клетку с заводом, то ДНК будет чем-то вроде информации с жесткого диска, хранящейся в канцелярии завода. Чтобы завод начал работать, эту информацию необходимо транслировать на все устройства в цехах завода — эту роль в клетке выполняют рибонуклеиновые кислоты — РНК. И, наконец, продукция, которая начинает собираться в цехах завода по этой программе — это клеточные белки.
Процесс считывания информации с ДНК получил название «экспрессия генов».
Если ДНК — это закодированная информация обо всех процессах организма, то белки — основные исполнители и контроллеры этих процессов. Существует огромное количество разных классов белков, принимающих участие во всех важных для организма процессах.
Существуют белки, которые укоряют протекание химических реакций в организме; выполняют строительную функцию — как своего рода арматура придают форму клеткам и их частям; защищают организм, обезвреживая токсины, патогенных бактерий и вирусов; регулируют считывание информации с ДНК и синтез соответствующих белков.
Также есть белки, которые передают сигналы между клетками, тканями и о́рганами, транспортируют различные молекулы по клеткам и разным системам; в белках запасается энергия; белки являются рецепторами — запускают каскад клеточных событий в ответ на определенные сигналы из внешней среды или из внутренних систем организма; они могут выполнять моторную функцию — обеспечивают движения организма, например, сокращение мышц.
Генная терапия — это вмешательство в работу клеточного «завода» по производству белков. Она позволяет, как активировать работу нужных генов, так и «выключать» вредные. В первом случае в клетку доставляют ген, с которого начинает считываться белок, необходимый для терапии заболевания. А во втором — в клетку вводятся регуляторные РНК, которые блокируют экспрессию «вредного» гена.
Чаще всего блокировка генов достигается за счет того, что в клетку доставляют малые интерферирующие РНК (миРНК), которые связываются с РНК гена, который нужно «выключить». Связывание миРНК и РНК блокирует синтез белка и в конечном итоге приводит к деградации РНК.

Эндрю Файер и Крейг Мелло
Этот процесс носит название интерференции РНК. Он был открыт в 1998 году американскими учеными Эндрю Файер и Крейг Мелло и был признан настолько важным, что уже в 2006 году была вручена Нобелевская премия в области физиологии и медицины за его открытие.
Генная терапия: успехи и тенденции
Генная терапия возникла более 25 лет назад. Первое успешное клиническое исследование (на людях) было проведено в 1989 по генной терапии тяжелого комбинированного иммунодефицита. В настоящий момент генная терапия бурно развивается.
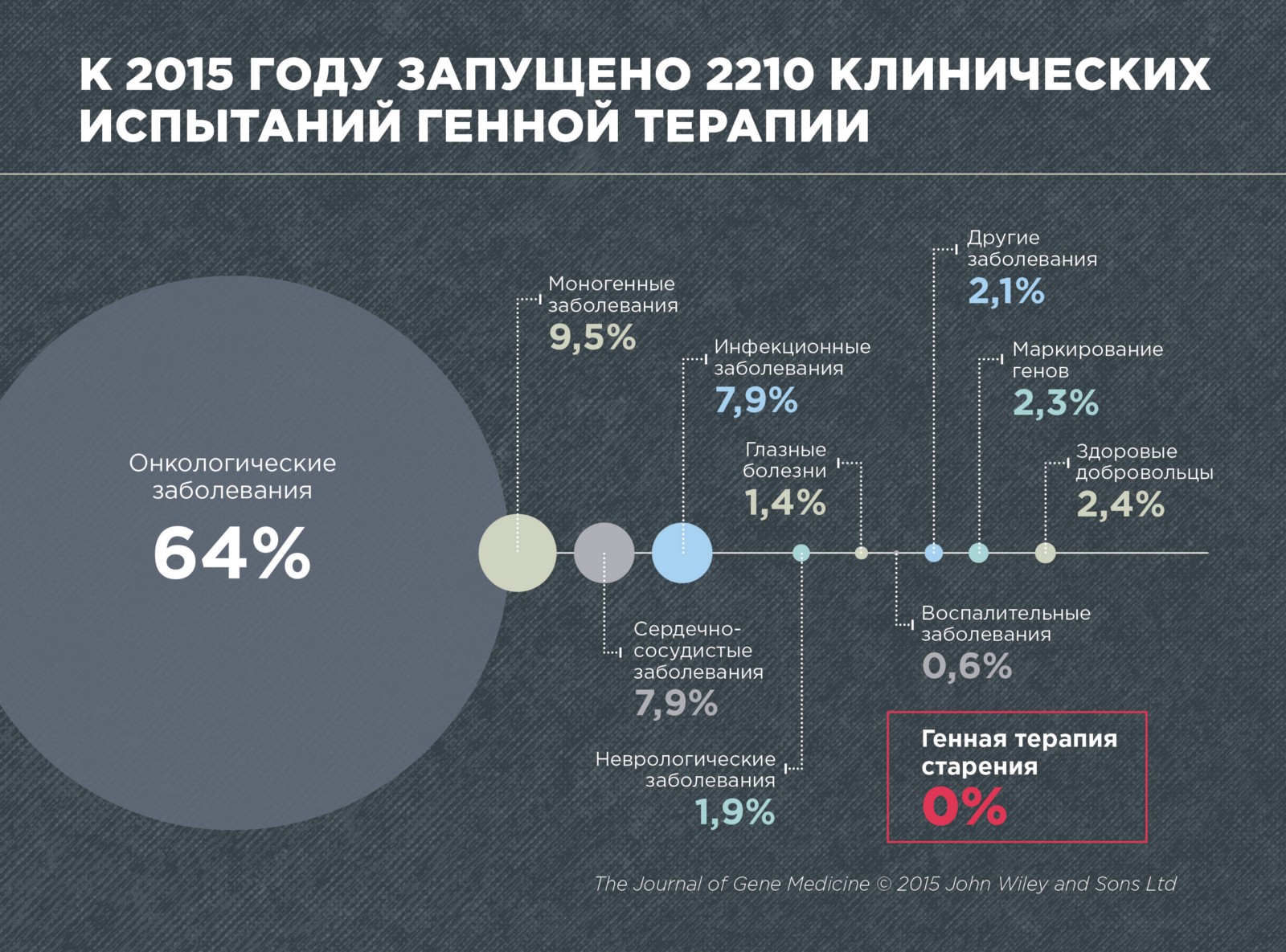
По данным журнала Gene Medicine, в 2015 году было проведено 2210 клинических испытаний по генной терапии различных болезней. Это, преимущественно рак (64%), моногенные заболевания, вызванные мутацией в одном гене (9,5%), сердечно-сосудистые (7,9%) и инфекционные (7,9%).
По генной терапии старения не проведено ни одного клинического испытания, что неудивительно, поскольку старение до сих пор не признано болезнью. Кроме того, генная терапия старения пока еще очень молодая и развивающаяся область.
Для ряда заболеваний генная терапия оказалась вполне успешной. Среди них наследственные заболевания иммунной системы — тяжелый комбинированный иммунодефицит, синдром Вискотта-Олдрича и хроническая гранулематозная болезнь; наследственная болезнь, связанная с нарушением обмена веществ — адренолейкодистрофия; наследственное заболевание сетчатки — амавроз Лебера и некоторые формы рака.
К настоящему времени уже 4 генотерапевтических лекарства допущены к продаже. В Китае в 2003 году выпущен «Гендицин» (Gendicine) — препарат для лечения плоскоклеточного рака головы и шеи на основе гена p53, а в 2006 — «Онкорин» (Oncorine) — онколитический вирус для лечения назофарингеальной карциномы. В Европе в 2012 году запущено производство препарата «Глибера» (Glybera), предназначенного для терапии наследственного дефицита липопротеинлипазы (ЛПЛ) путем доставки одноименного гена. А в России допущен к продаже препарат «Неоваскулген» для лечения заболеваний периферических артерий. Он представляет собой ген VEGF (фактора роста эндотелия сосудов).
Неоваскулген, Гендицин и Глибера.
Основная проблема генной терапии — как доставить терапевтический ген (или РНК) в клетки-мишени. Обычно для этого используют векторы для доставки — переносчики генетических конструкций. Они не позволяют ДНК разрушиться в крови, обеспечивают выход ДНК из капилляров (мелких кровеносных сосудов) в ткани и проникновение внутрь клеток и в клеточное ядро.
Чаще всего в качестве векторов используют вирусы, поскольку они обладают очень эффективными — отточенными эволюцией — механизмами проникновения в клетки животных. Инфицируя клетку в природе, вирус доставляет свой генетический материал в ядро этой клетки и начинает воспроизводиться и нарабатывать свои белки, используя механизмы экспрессии генов клетки хозяина.
Ученые упростили вирусы, убрав из них гены, вовлеченные в патогенез и вызывающие иммунный ответ организма, и превратили в векторы для доставки генетического материала.

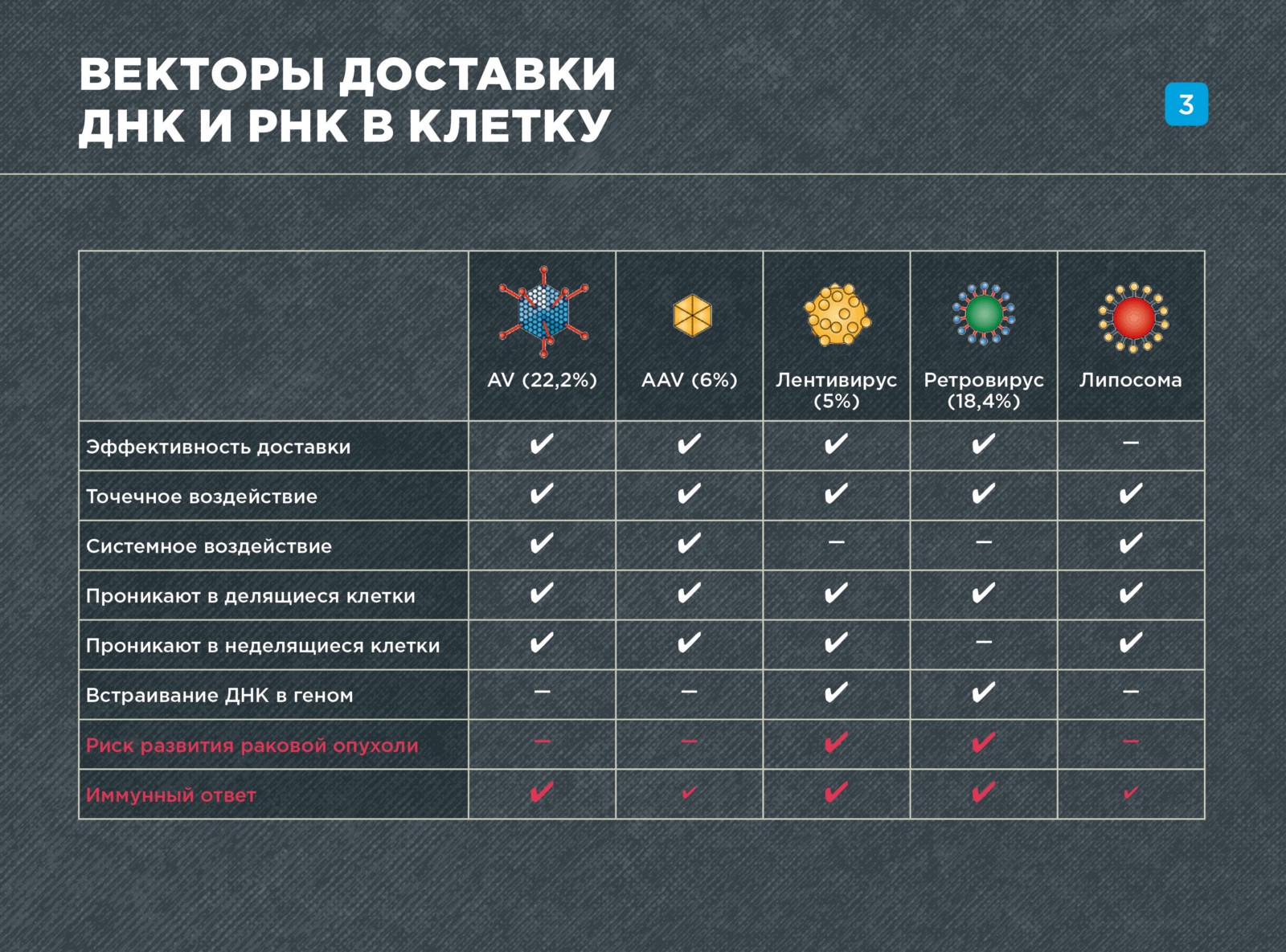
Наиболее популярными вирусами, используемыми в генной терапии, являются аденовирусы (их применяют в 22,2% клинических исследований), а также — ретровирусы (на их долю приходится 18,4% работ). Только набирают популярность более новые векторы — аденоассоциированные вирусы (6% клинических испытаний) и лентивирусы (5% исследований).
Самыми перспективными для генной терапии представляются аденоассоциированные (AAV) и лентивирусные векторы. Первые позволят доставить генетическую конструкцию в организм системно (то есть в ряд тканей и органов) без побочных эффектов. Правда, они не встраивают генетический материал в геном, так что доставленный ген со временем может теряться.
Если же необходимо обеспечить высокую эффективность доставки и встраивание доставляемой конструкции в геном, следует применять лентивирусные векторы. Однако они не подходят для системной доставки и применяются для локального введения в небольшой участок ткани или — в клетки в пробирке. Кроме того, они могут вызывать побочные эффекты из-за встраивания в нежелательные места генома (например, в протоонкогены и вызывать рак).

Использование технологии редактирования генома CRISPR/Cas9 открывает новые возможности в генной терапии. CRISPR/Cas9 позволяет очень точно и безопасно изменять ДНК клеток. И если совместить технологию CRISPR/Cas9 с доставкой при помощи аденоассоциированных вирусов, то это, по-видимому, позволит системно воздействовать на организм и совершенно безопасно изменять геном очень большого числа клеток. То есть ее использование позволяет совместить достоинства, как аденоассоциированных, так и лентивирусных векторов.
В природе эта система имеется у бактерий и архей. Она используется для защиты от бактериофагов (вирусов бактерий) или других чужеродных генетических элементов. В случае заражения клетки система CRISPR/Cas узнает последовательности чужеродной ДНК и разрезает ее. Впервые система CRISPR/Cas была обнаружена еще в 1987 году, однако ее функции стали активно изучаться, только начиная с 2005 года.
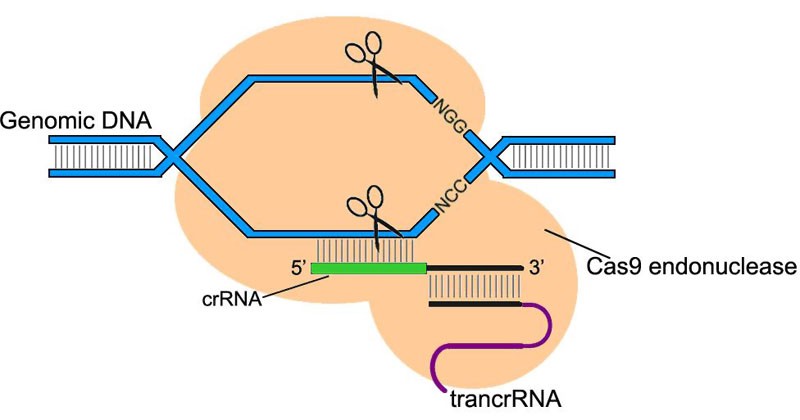
Поскольку CRISPR/Cas сверхточно узнает и разрезает ДНК, ученые решили приспособить ее для редактирования генома млекопитающих. Использование CRISPR/Cas превзошло все ожидания. Она позволила с минимальным числом ошибок как «выключать» нужные гены, так и встраивать новые гены в строго определенные участки генома.
Система CRISPR/Cas9 состоит из эндонуклеазы Cas9 — фермента разрезающего ДНК, и направляющей РНК, связывающаяся только со строго определенной геномной последовательностью. Такая система позволяет найти и разрезать участки генома в нужном месте, нацеливаясь на них направляющей РНК.
Направляющая РНК подбирается исследователями самостоятельно, так что можно нацелить систему CRISPR/Cas9 на любой нужный участок генома.

А совсем недавно, в декабре 2015 года научная группа Фенга Джанга видоизменила данную систему так, что она стала и вовсе безошибочной, что было опубликовано в ведущем научном журнале Science. Ученые заменили 3 аминокислоты («кирпичика», из которых состоит белок) в эндонуклеазе Cas9, после чего число ошибок такой системы свелось практически к нулю.
Использование CRISP/Cas9 особенно актуально для генной терапии старения, где требуется воздействовать на пути долголетия, общие для большинства клеток организма.
Врезка: «Типы векторов для доставки и их свойства»
Аденовирусы (AV) и аденоассоциированные вирусы (AAV) могут использоваться как для узконаправленной доставки генетического материала в определенные ткани, так и для системной доставки в организм (то есть — в большое число органов и тканей). Они доставляет генетический материал очень эффективно, проникая в ядра как делящихся, так и неделящихся клеток.
Важной особенностью этих вирусов является то, что они не встраивают доставляемые гены в геном. Правда, в случае аденоассоциированных векторов все же показано, что <1% случаев происходит встраивание (интеграция) в определенный район генома хозяина.
Отсутствие случайной интеграции гена в геном — большой плюс в плане безопасности этих векторов. В этом случае нет риска, что ген случайно встроится в последовательность протоонкогена и вызовет рак. С другой стороны, если ген не встроился в геном, он может со временем теряться, например, при делении клеток. Поэтому терапевтический эффект в случае использования таких векторов может быть временным.
Хотя аденовирусы пока применяются в генной терапии гораздо чаще, аденоассоциированные вирусы являются гораздо более перспективными, в связи с большей безопасностью. Дело в том, что при введении в организм — аденовирусы могут вызвать сильный иммунный ответ и воспалительную реакцию.
На ранних этапах развития генной терапии использование аденовирусных векторов даже привело к смерти пациента. Джесси Джелсинджер страдал от дефицита орнитин-транскарбамилазы — генетического заболевания печени. В 18-летнем возрасте он принял участие в клиническом испытании по генной терапии, и умер из-за системного воспалительного ответа в ответ на введение вирусной конструкции.
Напротив, введение аденоассоциированных вирусов в организм приводит только к незначительному иммунному ответу, поскольку в природе эти вирусы не вызывают болезней млекопитающих и почти не узнаются иммунной системой человека.
Другие вирусные векторы — ретровирусы и лентивирусы — встраивают генетический материал в геном и обеспечивают стабильный терапевтический эффект. Однако случайная интеграция в геном может привести к активации раковых механизмов, что уже произошло несколько раз в истории генной терапии.
Ретро- и лентивирусы используются почти исключительно для узконаправленной доставки в определенные ткани и их участки, или же — в клетки в пробирке, поскольку в отличие от AV и AAV они переносят материал на гораздо меньшие «расстояния». Недостатком ретровирусов является то, что они способны проникать только в делящиеся клетки. Поэтому гораздо более перспективны лентивирусы, так как они инфицируют и неделящиеся клетки тоже.
Кроме того, в генной терапии довольно часто используют невирусные способы доставки ДНК и РНК, например, липосомы. Они сильно уступают вирусным векторам по эффективности, однако более безопасны и дешевы.
Сравнительный анализ векторов доставки генетического материала в клетку.
В данный момент генная терапия старения бурно развивается, однако пока все еще находится на доклинической стадии развития (то есть, экспериментов на людях пока не проводилось). Среди 2210 клинических испытаний по генной терапии, запущенных к сегодняшнему дню, нет ни одного для лечения старения. Отчасти это связано с юридическими моментами: старение до сих пор не считается заболеванием. Но и сама эта область исследований возникла очень недавно. Первые работы по генной терапии старения на мышах были проведены менее 5 лет назад.
Сейчас все исследования по генной терапии старения проводятся на модельных мышах, крысах, обезьянах и клеточных культурах человека — клетках в пробирке.
Все подходы к генной терапии старения делятся на те, где в организм доставляется ген долголетия, и на те, где вводятся малые РНК, «выключающие» ген или путь старения. То есть в первом случае вводится нечто полезное для долголетия, а во втором — отключается вредное.
В строгом смысле исследований по генной терапии старения на млекопитающих было проведено только два. В этих работах мышам вводили терапевтический ген и смотрели, как это подействовало на старение и продолжительность жизни. Первая работа была проведена группой Марии Бласко в 2012 году, в которой удалось продлить жизнь мышам на 20%. А вторая — это терапия гипоталамуса геном ингибитора NF-kB, которую Доншенг Кай с коллегами провел в 2013-ом. В ней жизнь мышей увеличилась на 10%. Обе работы очень обнадеживают: терапия была очень эффективной и без каких-либо побочных эффектов.

Гораздо больше работ моделируют генную терапию на трансгенных мышах. В таких исследованиях терапевтический ген не доставляют в организм взрослой мыши, а при помощи генной инженерии создают мышей, геном которых изменен с рождения. Как и генная терапия, это позволяет исследовать, как увеличение или снижение активности разных генов влияет на продолжительность жизни и старение организма.
Есть очень много исследований, где генную терапию старения моделируют на клеточных линиях. В таких работах обычно смотрят, замедлит ли доставка терапевтического гена старение клеток в пробирке или нет. Но этот подход дает неоднозначные результаты, поскольку терапия, которая продлевает жизнь клеткам, далеко не всегда продлевает жизнь организму и наоборот. Например, повышенная активность гена долголетия и ответа на стресс FOXO продлевает жизнь модельным дрозофилам. А в экспериментах на стволовых клетках кожи клеточное старение замедлялось, когда ген FOXO3, наоборот, «выключали».
В настоящее время подходы генной терапии разрабатываются в отношении всех основных механизмов долголетия, известных на сегодняшний день: увеличение стабильности генома, омоложение гипоталамуса, уничтожение сенессентных клеток, увеличение устойчивости к стрессам, улучшение работы митохондрий и поддержание ниш стволовых клеток.
Однако гораздо больше исследований проводится по генной терапии отдельных возраст-зависимых патологий, например возрастное истощение мышц и ухудшение когнитивных способностей . Сами по себе они не являются заболеваниями, однако ухудшают качество жизни и могут приводить к тому, что увеличивается риск многих возрастных болезней.
Всего было проведено около 46 работ по генной терапии возраст-зависимых патологий на модельных крысах, мышах и даже обезьянах. Это работы по генной терапии в «классическом смысле»: модельным животным (чаще всего — старым) вводили ген в составе вектора для доставки. А после терапии анализировали, как это повлияло на возникновение возрастной патологии. К сожалению, в подавляющем большинстве таких работ не смотрели на побочные эффекты.
Больше всего исследований было посвящено патологиям центральной нервной системы — примерно 10 работ. На нарушения работы сердца и сосудов — приходится 6 исследований, на нарушения половой системы — 7, патологии хряща — 6, ожирение — 4, нарушения костной ткани — 7, зрения — 3, иммунной системы — 3 и мышц — 1 работа.
В заключение, хочу отметить, что, несмотря на то, что по генной терапии старения проведено сравнительно немного экспериментов с максимальным эффектом продления жизни — 20%, она уже обладает огромным преимуществом, по сравнению с другими подходами к продлению жизни (например, геропротекторами или ограничением питания, продлевающими жизнь до 30–50%). Генную терапию достаточно провести только один раз за всю жизнь!
Например, в работе Андржея Бартке 2001 года ограничение питания продлило жизнь мышам на 30%. Однако мыши употребляли низкокалорийную диету до 670 дней подряд — то есть каждый день, в течение половины своей жизни! А в эксперименте по генной терапии Марии Бласко 2012 года генная терапия теломеразой привела к немного меньшему эффекту — мыши стали жить дольше на 20%. Однако в этой работе мыши получили только 1 инъекцию лекарства в кровь за всю жизнь!

Тут нужно разобраться, где инженерия, где терапия.
Поэтому, если мы говорим о трансляции исследований по продлению жизни на человека, то генная терапия имеет абсолютное преимущество, поскольку не снижает качество жизни из-за необходимости постоянного лечения — соблюдать ежедневно определенную диету или же постоянно употреблять геропротекторы или другие лекарства.
Генная терапия теломеразой
Открытие теломеразы — революция в исследованиях старения
Идее использовать теломеразу для продления жизни уже больше 30 лет. Открытие теломеразы в 1985 году вызвало настоящий фурор среди исследователей старения, и было оценено так высоко, что за него Элизабет Блэкбёрн, Кэрол Грейдер и Джеку Шостаку в 2004 году дали Нобелевскую премию.

История исследований теломеразы уходит корнями еще в 1961 год. Американский исследователь Леонард Хейфлик культивировал фибробласты эмбриона человека в пробирке и заметил, что они способны поделиться не более 50 раз, после чего стареют. А если брать клетки более старых доноров, то делятся они и того меньше. Ученый предположил, что в клетках существует некий счетчик делений, ограничивающий их общее число.
Спустя 10 лет российским ученым Алексеем Оловниковых был предложен гипотетический механизм работы этого счетчика. Оловников предположил, что при делении клеток концы хромосом, называемые теломерами, немного сокращаются. А когда теломеры достигают критической длины, клетка перестает делиться и стареет. В нестареющих клетках (например, половых и эмбриональных стволовых), напротив, должен существовать фермент, который удлиняет теломеры, позволяя клеткам делиться практически до бесконечности.
Эта гипотеза полностью подтвердилась с открытием фермента — теломеразы в 1985 году. Стали накапливаться данные о роли теломер и теломеразы не только в старении клеток, но и старении целого организма. Кроме того, было показано, что повреждение гена теломеразы сильно сокращает жизнь модельных животных и приводит к возникновению синдрома преждевременного старения — прогерии.

После открытия теломеразы десятки ученых загорелись тем, чтобы сделать на ее основе лекарство от старости. Казалось бы «включение» теломеразы во всех клетках может сделать организм бессмертным.
Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации? Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломер. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что одной активации теломеразы может быть недостаточно для омоложения всего организма.
Несмотря на сомнения, которые вызывало терапевтическое применение теломеразы, начались эксперименты на клеточных линиях и модельных животных. Были проведены десятки исследований, и результаты превзошли все ожидания.
Генная терапия теломеразой на клеточных линиях
В ряде исследований работа теломеразы была активирована в человеческих клетках в пробирке (in vitro). Такие работы, с одной стороны, позволяют больше узнать о свойствах теломеразы, а с другой — являются первым шагом в разработке лекарства, продлевающего жизнь.
Для этого в ДНК клеток встраивают ген каталитической субъединицы теломеразы (TERT). Именно она осуществляет удлинение теломер в клетке.
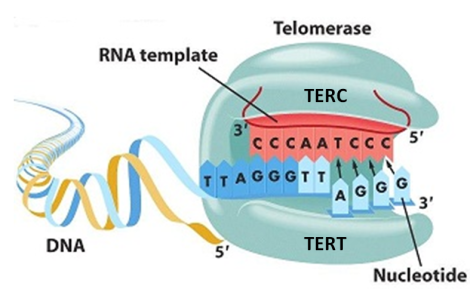
Первое успешное исследование по доставке гена TERT было проведено в 1998 году Андреай Боднар с коллегами. Оказалось, что при активации теломеразы фибробласты человека, которые в норме делятся не больше 75–80 раз, способны поделиться 280. При этом у них не возникает признаков старения, патологии или малигнизации (ракового перерождения). Даже если такие клетки пересадить бестимусным мышам — совершенно лишенным иммунитета и более подверженным раку — у них все равно не возникают опухоли.
В последующие годы были проведены десятки исследований, в которых ген теломеразы вводили в самые разные типы клеток человека. Доставка гена TERT в делящиеся клетки увеличивала их потенциал к пролиферации, а доставка в старые клетки — приводила к «омоложению» и возобновлению делений.
Успешные эксперименты были проведены на мезенхимальных стволовых клетках, стволовых клетках кости (остеобластах), миосателлитах (предшественниках мышечной ткани), суставных хондроцитах (предшественниках хрящевой ткани), а также — на клетках межпозвоночного диска, Т-лимфоцитах, гепатоцитах (клетках печени), клетках обонятельных луковиц и пр.
Важно отметить, что в подавляющем большинстве случаев доставка гена теломеразы была абсолютно безопасна. Клетки сохраняли свои функции, и не наблюдалось признаков опухолеобразования. Однако в некоторых работах введение гена TERT приводило к увеличению частоты хромосомных перестроек (разрывов хромосом, слипания, перемещения участков одной хромосомы на другую). Это, конечно, является фактором риска для возникновения рака, однако может не иметь негативных последствий.
В целом, результаты исследований говорят о том, что работа теломеразы в культуре клеток человека значительно замедляет старение и совсем не обязательно вызывает развитие рака. То есть теломераза лишена свойств онкогена, которые ей приписывали. Видимо, основным свойством теломеразы является регуляция клеточного деления, а для возникновения опухолевого роста необходимы дополнительные мутации и факторы.
* * *
Генная терапия теломеразой: от экспериментов на мышах к человеку
Впервые эксперименты по генной терапии старения были проведены в 2012 году испанской исследовательницей Марией Бласко с использованием гена теломеразы (TERT). Первые же полученные результаты были весьма и весьма впечатляющими. Генная терапия не только взрослых, но и старых мышей продлевала жизнь до 20%! Если представить, что подобных результатов можно будет достигнуть и на человеке — мы сбережем 14 лет человеческой жизни!
Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если «включить» ген TERT во всех клетках мыши, то продолжительность жизни увеличивается на 40%! Однако постоянная активность теломеразы увеличивала и риск рака.
Поэтому стал вопрос о том, как активировать работу теломеразы на более короткий срок.
Именно это было сделано в работе Марии Бласко 2012 года. Ген теломеразы доставлялся в организм мыши при помощи аденоассоциированного вируса (AAV9), способного обеспечивать системную доставку. Аденоассоциированные вирусы характеризуются высокой безопасностью: они не встраивают доставляемый ген в геном хозяина, и поэтому не приводят к мутагенезу. Кроме того, они почти не вызывают иммунный ответ.
Ген теломеразы был доставлен в широкий спектр тканей и органов, включая печень, почки, легкие, сердце, мозг и мышцы. Теломераза обнаруживалась в этих тканях даже спустя 8 месяцев после процедуры. У животных улучшился ряд возрастных параметров: чувствительность к инсулину возросла, улучшилась нервно-мышечная координация, снизился риск остеопороза (истощения костной ткани) и содержание молекулярных маркеров старения. Кроме того, терапия геном TERT оказалась совершенно безопасной: риск рака у мышей не увеличивался.
И, что самое важное, генная терапия существенно продлила мышам жизнь. Медианная продолжительность жизни (возраст, до которого доживает больше половины особей в группе) увеличилась у взрослых (1-летних) и старых (2х-летних) мышей на 24% и 13%, соответственно. Максимальная продолжительность жизни тоже возросла: на 13% у взрослых и на 20% у старых мышей.
В следующем исследовании Мария Бласко показала, что доставка гена TERT в сердце мышей после инфаркта миокарда значительно улучшает работу сердца и снижает риск сердечной недостаточности и смертность на 17%.
Благодаря этим экспериментам у генной терапии теломеразой сложилась блестящая репутация. И в сентябре 2015 года был проведен первый в мире эксперимент по генной терапии старения на человеке. Американка Элизабет Перриш ввела себе ген теломеразы в сочетании с геном ингибитора миостатина (для стимуляции роста мышц). Это исследование только началось, так что говорить о результатах пока рано, но пока Элизабет чувствует себя хорошо. Элизабет дала обещание предоставлять материал для анализов любым научно-медицинским учреждениям по запросу. Однако поскольку в этом эксперименте участвовал только один человек, его результаты не позволят сделать надежных, статистически значимых выводов.
Однако сам факт того, что начались испытания на людях, говорит о том, что лекарство на основе TERT уже на подходе. Оно без сомнения является кандидатом номер один для борьбы со старением при помощи генной терапии.
Генная терапия для омоложения гипоталамуса
Один из путей продления жизни — узконаправленное воздействие на структуры, регулирующие старение всего организма. Исследования последних лет показывают, что такой структурой является отдел мозга — гипоталамус.
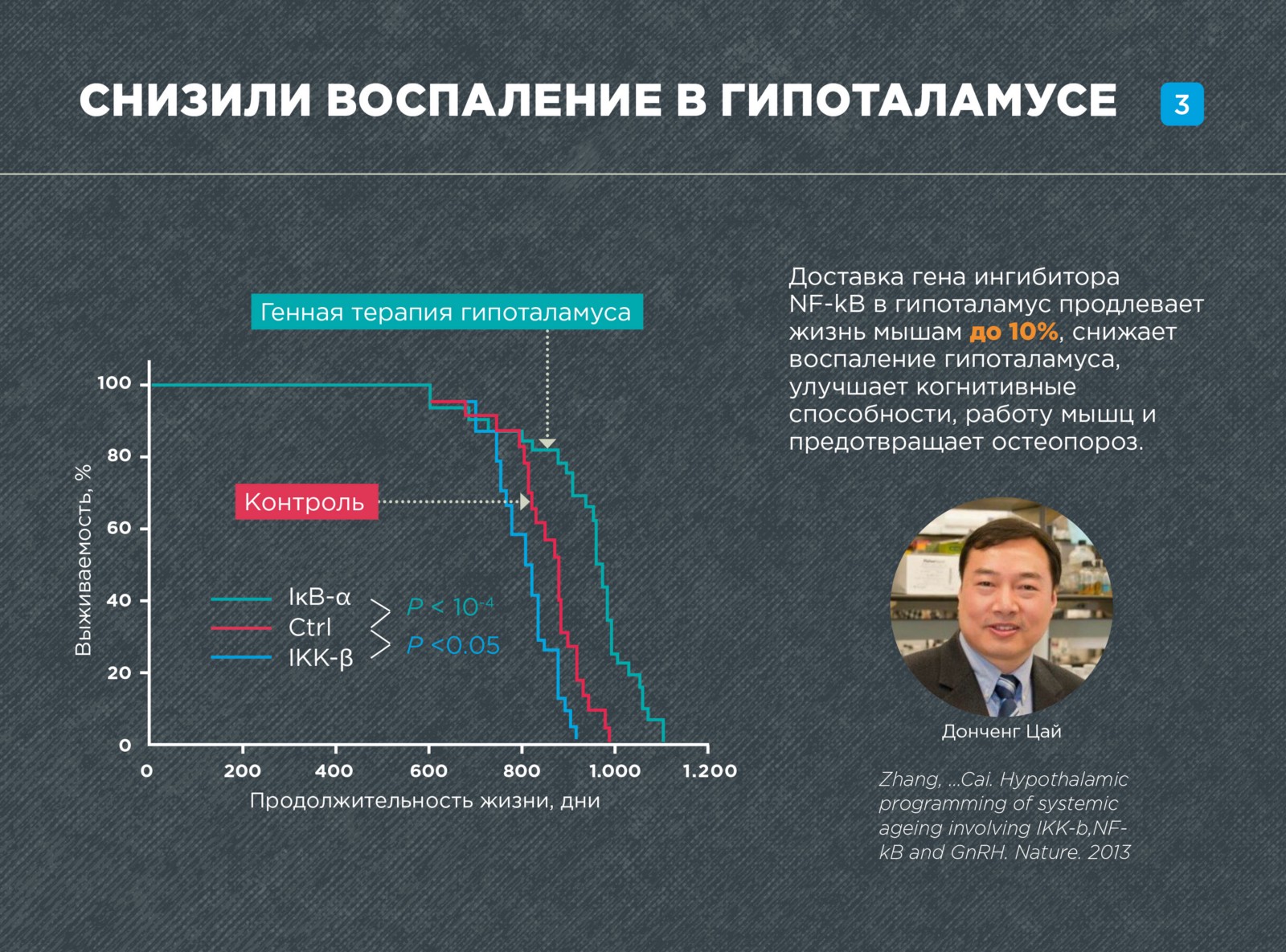
В 2013 году американские ученые под руководством Доншенга Кая существенно продлили жизнь мышам, омолаживая гипоталамус при помощи генной терапии. Исследователи подавляли возникающее с возрастом воспаление в гипоталамусе, в результате чего снизилось число возрастных патологий, а продолжительность жизни увеличилась на 10%.
Старение во многом связано с нарушением гомеостаза — саморегуляции организма, его способности сохранять свое внутреннее состояние. В «молодом» состоянии организм реагирует на нарушающее равновесие воздействие комплексом мер, которые успешно возвращают его в исходное, «здоровое» состояние. Например, при увеличении температуры тела организм запускает ряд процессов терморегуляции (например, потоотделение), в результате которых температура снижается до исходного уровня. Однако при старении способность поддерживать гомеостаз нарушается, что приводит к «разбалансировке» организма.
Гипоталамус — один из главных центров организма, регулирующих гомеостаз. Несмотря на то, что он составляет не больше 5% мозга, именно он связывает в единую систему нервные и гормональные механизмы поддержания гомеостаза.
С возрастом работа гипоталамуса сильно ухудшается, в частности, снижается выработка важнейшего гормона — гонадолиберина. «Классическая» функция этого гормона — регулировать половую функцию. Но для старения это играет второстепенную или даже третьестепенную роль. Важно то, что гонадолиберин еще и активирует нейрогенез — образование новых нервных клеток в гипоталамусе, а также в ряде других областей головного мозга.
Одной из главных причин возрастного ухудшения работы гипоталамуса — является воспаление. С возрастом в гипоталамусе активируются транскрипционные факторы NF-kB и IKK-b — регуляторные молекулы, которые запускают работу целого каскада генов, ответственных за воспаление.
Для омоложения и снижения воспаления в гипоталамусе Доншенг Кай с коллегами использовал ген, ингибирующий работу NF-kB — IkB-a. Ген IkB-a вводили взрослым мышам при помощи инъекции в гипоталамус. Для того чтобы ген проник в ядра клеток и встроился в геном использовали лентивирусные векторы.
Терапия оказала очень сильный эффект на старение. Максимальная продолжительность жизни мышей увеличилась на 10%! Здоровье мышей также значительно улучшилось. Даже через 6 месяцев после инъекции у мышей были лучше умственные показатели, лучше работали мышцы. Анализ структуры тканей также показал, что мышцы, кожа и кости мышей были в более «молодом» состоянии.
Таким образом, гипоталамус — важный центр регуляции системного старения. Его омоложение приводит к продлению жизни организма, по-видимому, как за счет улучшения собственных регуляторных функций гипоталамуса и выделения половых гормонов, так и за счет стимуляции нейрогенеза и, как следствие, улучшения работы других отделов мозга.
Генная терапия для увеличения устойчивости к стрессам
Среди путей продления жизни, изученных к сегодняшнему дню, самым мощным является увеличение стрессоустойчивости. Именно за счет воздействий на этот путь поставлены все нынешние рекорды продления жизни. Роберту Шмуклеру-Рису удалось продлить жизнь нематоды в 10 раз, а Андржею Бартке жизнь мыши — в 1,8.
На протяжении жизни организм постоянно сталкивается с самыми разными повреждающими факторами: голодом, жаждой, холодом, токсическими веществами, повреждающим излучением, психологическим напряжением. Устойчивость к этим факторам и получила название — стрессоустойчивости.
Увеличение стрессоустойчивости может происходить на всех уровнях: начиная от молекул, кончая целым организмом. Однако изучены преимущественно молекулярные механизмы. Повышение стрессоустойчивости сопровождается увеличением стабильности белков; если нарушения в структуре белковых молекул уже есть — то они исправляются, а от совсем разрушенных молекул и клетка избавляется — разбирает по кирпичикам и переваривает их.
Увеличения стрессоустойчивости можно добиться несколькими способами.
Первый, наиболее известный способ — это ограничение питания. При этом «выключается» работа комплекса мТОР. мТОР — это своего рода молекулярный «переключатель». Он переводит клетку в состояние активного роста и размножения. При этом энергозатратные механизмы стрессоустойчивости подавляются. Если же мТОР «выключить», то клетка, наоборот, перейдет в режим защиты от стресса.
Второй, тоже хорошо изученный путь увеличения стрессоустойчивости — это блокировать сигналинг инсулина и инсулиноподобного фактора роста 1 (IGF-1). Под сигналингом (или сигнальным путем) понимают каскад молекулярных процессов, происходящих в клетке в ответ на действие гормонов. Инсулин и IGF-1 сигнализируют клетке о наличии в крови питательного вещества глюкозы. В результате чего в клетке запускаются процессы роста, активируется путь мТОР, а процессы стрессоустойчивости — подавляются.
Ингибирование пути мТОР или инсулинового пути — запускает целый каскад генов ответа на стресс, которые одновременно оказались еще и генами долголетия: FOXO, NRF2, AMPK, HIF-1, SIRT1 и SIRT6 и др. Таким образом, третий путь увеличения стрессоустойчивости — это искусственная активация генов ответа на стресс.

Все эти подходы активно исследуются для генной терапии старения. В некоторых работах воздействуют отдельно на гипоталамус — структуру, регулирующую старение, в других — системно — на большинство клеток организма. Настоящих работ по генной терапии, где бы во взрослое животное доставали терапевтический ген, очень мало, точнее — всего одна. В большинстве работ генную терапию моделируют на трансгенных животных или клеточных линиях (на клетках в пробирке).
Активация гена нейропептида Y в гипоталамусе
Первая и единственная работа по генной терапии для увеличения стрессоустойчивости была проведена на мышах меньше года назад. В ней воздействовали на регулятор системного старения — гипоталамус.

Luís Pereira de Almeida, Janete Cunha Santos и Cláudia Cavadas
Группа португальских и немецких ученых под руководством Luís Pereira de Almeida и Cláudia Cavadas в 2015 году провела эксперимент, где активировала ген нейропептида Y (NPY) в гипоталамусе крыс.
Нейропептид Y — одна из важнейших сигнальных молекул гипоталамуса. В последние годы появилось много данных о роли этого вещества в старении. Например, работа гена NPY необходима для того, чтобы ограничение калорий продлевало жизнь. А у трансгенных крыс, которые вырабатывали больше этого нейропептида, даже увеличилась медианная продолжительность жизни (возраст, до которого доживает половина особей в группе).
Поразительно, что ещё несколько лет назад о роли NPY в старении не было известно ни слова. А упоминали нейропептид Y только в связи с его ролью в ожирении и способностью стимулировать чувство голода. Вызывает удивление, как эти его функции сочетаются со способностью продлевать жизнь!
Ученые доставляли ген NPY с помощью аденоассоциированного вируса в гипоталамус. В результате в клетках гипоталамуса стимулировался важнейший механизм стрессоустойчивости — аутофагия (процесс самоочищения клетки от поврежденных молекул и клеточных структур путем их переваривания).
Никакие другие эффекты терапии геном NPY на долголетие в этой работе не изучались, но исследователи собираются сделать это в будущем.
Однако уже можно предположить, что терапия, придуманная de Almeida и Cavadas, будет замедлять старение за счет омоложения гипоталамуса (регулятора системного старения). С другой стороны, возможно, что нейропептид Y стимулирует аутофагию не только в гипоталамусе, но и в других клетках организма, что также будет приводить к замедлению старения.
Активация гена UCP2 в гипоталамусе
В 2006 году американские ученые под руководством Tamás Bártfai провели другой элегантный эксперимент, где тоже воздействовали на гипоталамус. Воздействие приводило к небольшому снижению температуры тела и, неожиданно, увеличивало продолжительность жизни!
Это не был эксперимент по генной терапии — использовались трансгенные мыши, геном которых изменен с рождения. Но, учитывая эффективность нынешних методик по доставке генов в организм, трансляция этих исследований в генную терапию не представляет особых проблем.
Трансгенные мыши в экспериментах Tamás Bártfai-я вырабатывали повышенное количество разобщающего белка 2 (UCP2) в гипоталамусе. Это белок митохондрий, который при работе снижает эффективность синтеза АТФ и способствует выделению тепла. В результате, температура гипоталамуса немного повышалась. А увеличение температуры в главном организменном терморегуляторе приводило к тому, что общая температура тела немного падала — на 0.3° — 0.5°C.
Небольшое снижение температуры тела вызвало у мышей эффект, сходный с эффектом ограничения питания, несмотря на то, что мыши ели, сколько хотели. Более того, значительно увеличилась медианная продолжительность жизни мышей: у самцов на 12%, а у самок — на 20%.
В остальных работах стрессоустойчивость увеличивали, действуя системно на большинство клеток организма.
Инкативация пути старения мТОР
Торен Финкел с коллегами увеличил стрессоустойчивость и продолжительность жизни мышей, «выключив» самый известный путь старения мТОР.
В экспериментах использовались трансгенные мыши с мутацией в локусе мТОР (области на хромосоме, где располагаются соответствующие гены), у которых было на 75% меньше белка мТОР в клетках. Оказалось, что такие мыши живут на 20% дольше.
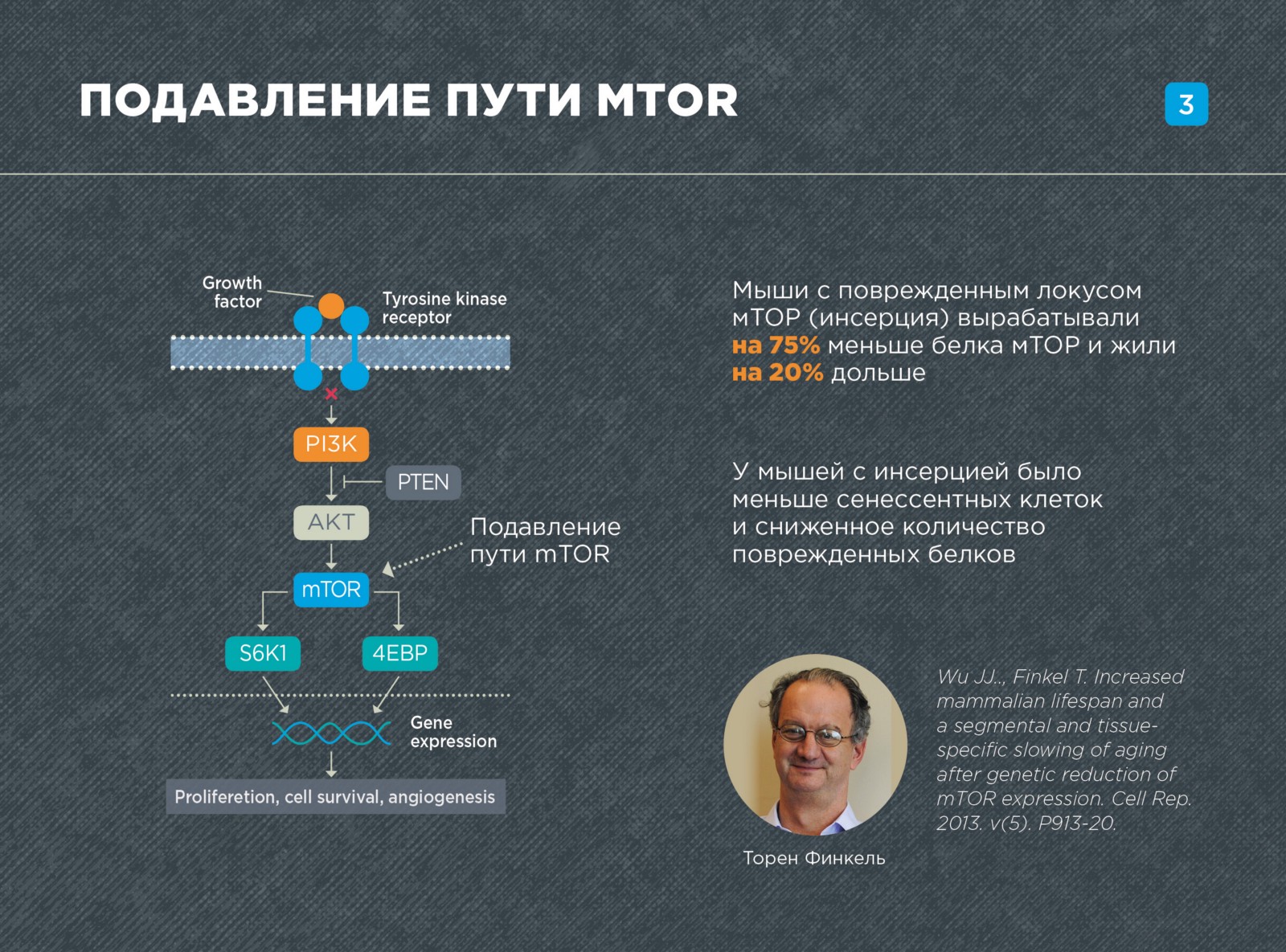
Кроме того, мутация в локусе мТОР значительно улучшила многие показатели здоровья мышей: ряд органов и тканей были в более «молодом» и хорошем состоянии, в тканях было меньше белковых агрегатов (слипшихся белков) и повреждений. Кроме того память, координация движений и пространственное мышление этих мышей работали лучше.
Однако «выключение» пути мТОР сопровождалось и побочными эффектами: ухудшилось состояние костей, мыши чаще страдали от инфекционных заболеваний рта, кожи и глаз. Кроме того, мыши были меньшего размера. Таким образом, длительное выключение генов комплекса мТОР, по-видимому, довольно травматично для организма, и следует либо сократить время инактивации мТОР, либо совместить его с другим воздействием, компенсирующим негативные побочные эффекты.
Активация гена PTEN
Другой перспективной мишенью генной терапии является ген PTEN — он «выключает» инсулиновый путь старения. PTEN ингибирует работу фосфатидилинозитол-3-киназы I типа (PI3K) — молекулы, необходимой для передачи инсулинового сигнала в клетку.
Испанские ученые во главе с Manuel Serrano исследовали трансгенных мышей со сверхэкспрессией (повышенной активностью) гена PTEN. Такие мыши были гораздо лучше защищены от рака, а их максимальная продолжительность жизни была на 16% больше. Трансгенные мыши были более чувствительны к инсулину, защищены от диабета и стеатоза — патологического накопления жира в печени, у них было меньше повреждений ДНК в старости.
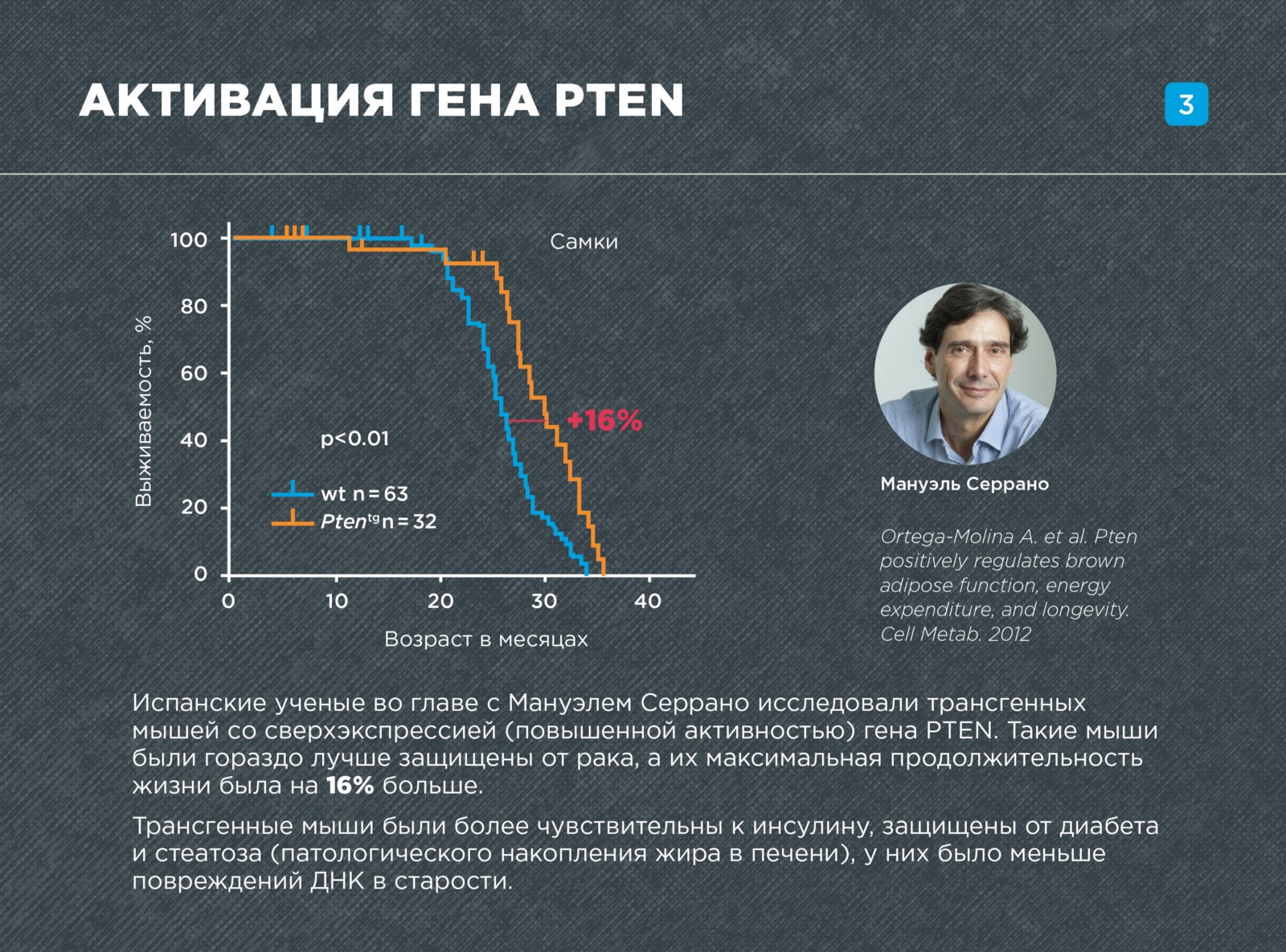
В работе был обнаружен еще один механизм (помимо инактивации инсулинового пути), посредством которого PTEN влияет на долголетие. Активация PTEN приводила к тому, что бурая жировая ткань начинала выделять очень много энергии в виде тепла, что вызывало повышенный расход энергии всего организма. А, как известно из более ранних работ, продолжительность жизни имеет прямую зависимость от интенсивности расхода энергии.
«Выключение» гена AC5
Другой, менее известный способ повысить стрессоустойчивость — это блокировать передачу сигнала от гормона стресса — адреналина в клетку. Адреналин — гормон, который вызывает реакцию бей-беги («flight or fight»); он начинает активно выделяться при ощущении опасности, страхе, травмах, ожогах, шоке и в пограничных ситуациях, мобилизуя организм для устранения угрозы. При этом адреналин очень мощный стресс гормон, при длительном воздействии он повреждает клетки и целые ткани, приводя к истощению организма.
Американский исследователь Stephen F. Vatner с коллегами создал трансгенных мышей с «выключенным» геном аденилатциклазы 5 типа (AC5) — молекулы, необходимой для передачи адреналинового сигнала в клетки через один из типов его рецепторов — β-адренорецепторы. Важно отметить, что такие рецепторы присутствуют почти на всех клетках организма.
«Выключение» гена AC5 неожиданно оказало очень сильный эффект на здоровье и долголетие. Трансгенные мыши жили дольше обычных мышей на целых 30% и были менее подвержены патологиям костей и сердца.
На молекулярном уровне эти эффекты были связаны с тем, что инактивация AC5 запускала путь стрессоустойчивости — Raf/MEK/ERK. В результате клетка вырабатывала целый набор защитных молекул, запускала механизмы выживания клеток.
Кроме того, из более ранних работ известно, что действие адреналина на клетку через β2 -адренорецепторы непосредственно вызывает повреждения ДНК. Таким образом, можно предположить, что «выключение» гена AC5 мышей способствовала еще и повышенной стабильности генома.
Активация генов сиртуинов
Другие важные участники механизмов стрессоустойчивости и долголетия — это сиртуины. В особенности изучены сиртуины 1 и 6 (SIRT1 и SIRT6). Сиртуины являются деацетилазами гистонов — они изменяют плотность упаковки ДНК и ингибируют экспрессию (снижают активность) генов.
Гистоны — молекулы, обеспечивающие пространственную упаковку ДНК: ДНК намотана на них, как нитка на катушку, а катушки плотно уложены. Если катушки уложены слишком плотно — считать с них генетическую информацию становится почти невозможно. Деацетилазы как раз увеличивают плотность упаковки ДНК, делая ее недоступной для считывания. В результате активации сиртуинов — ингибируется экспрессия целого набора генов.
Сиртуин 1
Сиртуин 1 регулирует целый ряд процессов долголетия: он подавляет воспаление, способствует выживанию клеток, запускает деление энергетических станций клеток — митохондрий и активирует важнейший ген стрессоустойчивости и долголетия — FOXO. В нескольких исследованиях на трансгенных мышах было показано, что активация гена SIRT1 положительно сказывается на здоровье. В первом исследовании 2010 года, проведенном испанскими учеными во главе с Manuel Serrano, ген SIRT1 активировали во всем теле мышей. В результате — у них медленнее старели клетки, было меньше повреждений ДНК и реже развивался рак.
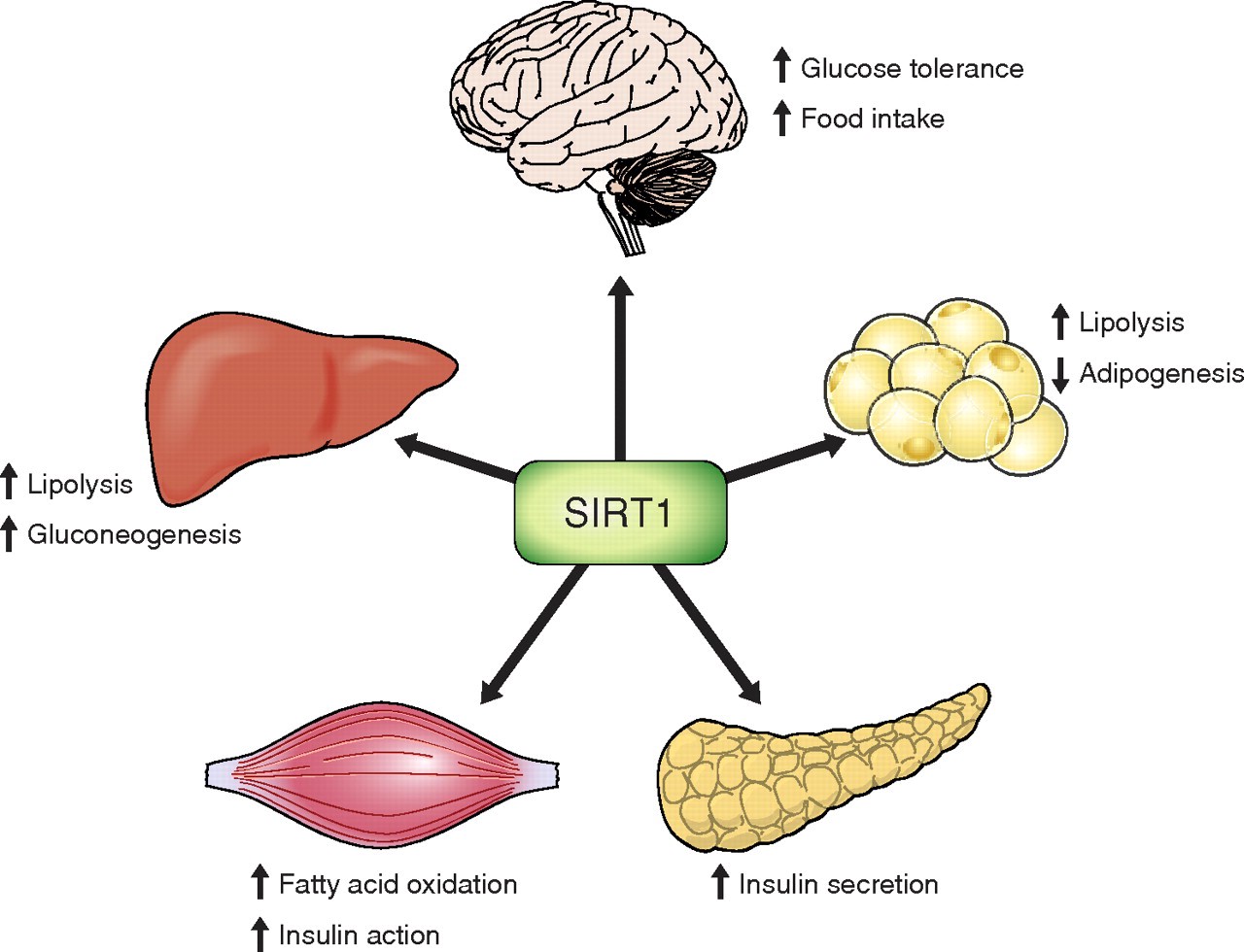
А через 3 года Shin-ichiro Imai из Вашингтонского Университета активировал ген SIRT1 не во всем теле, а только в мозге мышей, что привело к значительному продлению их жизни. Трансгенные самки жили на 16% дольше, а самцы — на 9%.
Кроме того, к сегодняшнему дню проведено много работ, где терапия геном SIRT1, моделировалась на клеточных линиях человека. Доставка гена SIRT1 омолаживала и стволовые и дифференцированные (специализированные по функциям) клетки человека — увеличивала увеличивало число делений и замедляло наступление клеточной старости.
Сиртуин 6
Другой важнейший участник процессов долголетия — сиртуин 6 (SIRT6). Он препятствует воспалению, модифицирует сигналы от инсулиноподобного фактора роста 1 IGF1, активизирует пути репарации ДНК и некоторые другие механизмы стабильности генома.
Увеличение экспрессии гена SIRT6 способствует долголетию, что было показано в 2х работах на трансгенных мышах.
В 2012 году американские и израильские ученые, возглавляемые Haim Y. Cohen, увеличили экспрессию SIRT6 во всем теле мышей, что продлило жизнь самцам (но не самкам) на 10–14,5%. Удивительно, что несмотря долголетие, у трансгенных мышей не стало меньше старческих болезней, однако даже с такими заболеваниями, как рак, трансгенные мыши жили гораздо дольше. А через несколько лет в работе тех же ученых (по неопубликованным данным) активация гена SIRT6 увеличила жизнь не только самцов, но и самок. Однако надо иметь в виду, что активация SIRT6 полезна далеко не во всех тканях. В мозге его повышенная продукция, наоборот, предрасполагает к нейродегенеративным болезням.
Проведен ряд успешных исследований по терапии геном SIRT6 на клеточных линиях человека. Показано, что его доставка омолаживает клетки выстилки бронхов и сосудов и хрящевой ткани.
Интересно, что терапию геном SIRT6 еще не используют для старения, но уже применяют для возрастной патологии хряща — остеоратроза. Проведены исследования по генной терапии и на клетках и на мышах. После введения гена SIRT6 в колено — хрящ гораздо лучше функционировал, и в нем возникало гораздо меньше патологических изменений.

Альтернативный подход к увеличению стрессоустойчивости — воздействовать на транскрипционный фактор NRF2. Этот путь высокоактивен в клетках животных-долгожителей: голого землекопа и карликовых мышей Snell.
NRF2 является транскрипционным фактором — молекулой, регулирующей активность сотен других генов. Он начинает работать в ответ на токсические воздействия и запускает работу более 200 генов, которые осуществляют защиту клетки от повреждений, воспаления и увеличивают стабильность белков.
Этот путь сразу взяли на вооружение ученые, занимающиеся лечением нейродегенеративных заболеваний (в особенности — болезни Альцгеймера), и уже провели несколько работ по генной и генно-клеточной терапии на мышах.
Многие исследователи склоняются к тому, чтобы лечить нейродегенеративные болезни при помощи доставки в мозг стволовых клеток. Однако при таких заболеваниях в головном мозге наблюдается высокий уровень окислительного стресса, и стволовые клетки гибнут при инъекции. А предварительная доставка гена NRF2 делает такие клетки более устойчивыми к стрессу, так что после введения в мозг они не погибают.
В других работах ген NRF2 доставляли непосредственно в мозг мышей с Альцгеймером. Введение гена NRF2 в гиппокамп (структуру мозга, отвечающую за память) — улучшало память и пространственное обучение. А в другой работе доставка гена NRF2 в мозг делала его более устойчивым к кислородному голоданию (гипоксии) и улучшала умственные способности мышей.
В целом, для увеличения стрессоустойчивости проводят больше всего научных исследований по генной терапии! Проверяются все основные участники сигнальных путей — молекулы, ингибирующие пути старения IGF-1 и мТОР, а также — участвующие в различных путях стрессоустойчивости. Именно увеличение устойчивости к стрессам приводит к максимальному эффекту продления жизни у трансгенных мышей — до 1,8 раза. Однако «классических» работ по генной терапии стрессоустойчивости (где в организм модельного животного доставляют терапевтический ген) пока крайне мало, а точнее — всего одна. Но когда от экспериментов на трансгенных животных — ученые перейдут к генной терапии, есть все шансы ожидать небывалых успехов в области продления жизни.
Генная терапия для уничтожения старых клеток
Еще одной стратегией продления жизни является уничтожение старых — сенессентных — клеток. Старые клетки накапливаются в организме с возрастом и способствуют старению всего организма. Особенно много сенессентных клеток обнаруживается в очагах возрастных патологий — язвах, атеросклеротических бляшках, больных суставах, мозге при болезни Альцгеймера.
Клетки становятся сенессентными, когда утрачивают способность делиться и выполнять свои функции. Став сенссентными, они начинают выделять целый букет вредных веществ (SASP), которые нарушают структуру и функции соседних тканей, а также — способствуют раковой трансформации клеток.
По-видимому, эволюционно образование таких клеток в организме возникло, как защитный механизм от рака. Чтобы не превратиться в раковые, поврежденные клетки утрачивают способность делиться, переходя в особое состояние, названное сенессенсом. А выделяемые ими вещества (SASP) сигнализируют другим клеткам о том, что произошло повреждение, и стимулируют репарацию тканей и заживление ран.
По мнению исследовательницы из Института Бака (Калифорния) Джуди Кампизи, клеточное старение — явление, полезное в молодости, однако весьма вредное в старости. В молодости возникновение небольшого числа таких клеток, защищает организм от рака, а выделяемые ими вещества способствуют изменению структуры и репарации тканей. Однако накопление большого количества таких клеток в старости приводит к тому, что выделяемых ими факторов становится слишком много. Это выливается в хроническое воспаление, которое, в свою очередь, способствует всем возрастным патологиям, начиная от нейродегенерации, кончая раком.
Впервые уничтожение сенессентных клеток для замедления старения применил американский исследователь Jan M. van Deursen. Исследование было опубликовано в 2011 году в лучшем мировом журнале Nature. Эксперименты проводились на трансгенных мышах с преждевременным старением. В геном таких мышей был встроен ген-самоубийца, который начинал работать только в старых клетках. В остальных клетках — он оставался неактивен. Вызвать гибель сенессентных клеток у таких мышей можно было в любой момент — введя мышам вещество AP20187. Фермент, закодированный в гене-самоубийце, делал это вещество токсическим, что и убивало сенессентные клетки.
Результаты показали, что если уничтожать сенессентные клетки всю жизнь по мере их возникновения, то возрастные патологии (жировой ткани, мышц, глаз и многих других органов) возникают у мышей гораздо позже. Однако можно начать уничтожать старые клетки и в старых организмах, когда все эти патологии уже возникли. В этом случае — патологическое состояние значительно облегчается.
С этого времени научная группа Jan M. van Deursen значительно продвинулась в своих исследованиях. В начале 2016 года они опубликовали статью, снова в журнале Nature, где показали, что уничтожение сенессентных клеток замедляет старение и у обычных мышей с нормальным (не ускоренным) старением. Терапия замедляла возникновение рака, препятствовала возникновению патологий сердца, почек и жировой ткани, и, более того, продлевала жизнь на 17–35%!
Генная терапия для улучшения работы митохондрий
С возрастом происходит сильное ухудшение работы митохондрий, что способствует старению клеток и всего организма.
Митохондрии — это клеточные электростанции, именно они обеспечивают клетку основной энергией. В них происходит «клеточное дыхание» — получение энергии за счет окисления питательных веществ и ее запасание в виде высокоэнергетических молекул АТФ.
Особенно интересно происхождение митохондрий. Они являются потомками бактерий, проглоченных примитивными клетками 1,5–2 миллиарда лет назад. За время существования внутри клетки митохондрии сильно упростились, стали зависимы от клетки, однако все равно сохранили черты самостоятельности. Например, в митохондриях есть собственная ДНК, а также собственные молекулярные «машины» для синтеза РНК и белка.
При старении снижается и количество митохондрий, и их качество. В процессе «клеточного дыхания» митохондрии начинают выделять гораздо больше побочного продукта — повреждающих клетку активных форм кислорода, а также производят значительно меньше энергии. В результате — клетке оказывается недостаточно энергии для того, чтобы осуществлять процессы репарации и регенерации.
На данный момент активно изучается только один подход по генной терапии митохондрий в старости — активация гена PGC-1. Этот ген — важнейший регулятор числа митохондрий у млекопитающих, а также — ген долголетия.
На дрозофилах было показано, что его гиперэкспрессия в клетках кишечника продлевает жизнь на 33–37%. У человека ген PGC-1 влечен в возникновение ряда возрастных патологий. Дефицит PGC-1 способствует нейродегенерации и диабету 2 типа, а введение PGC-1 восстанавливает почки поле повреждений.
Непосредственно для терапии старения ген PGC-1 пока не используют, однако его активно применяют для лечения различных возрастных патологий. Проведено несколько работ, как на клетках, так и на модельных мышах.
Китайские исследователи под руководством Wei-Jia Kong использовали ген PGC-1 для терапии глухоты на клеточной модели. Введение этого гена замедляло старение клеток крысы, ответственных за восприятие звуков. В другой работе китайский ученый Bing Chen с коллегами успешно использовал доставку гена PGC-1 в стволовые клетки для увеличения их стрессоустойчивости. А Pei-Qing Liu, вводил ген PGC-1 в клетки сердца, что защищало их от гипертрофии (патологического разрастания).
Несколько экспериментов были проведены уже на мышах. Ученые из Бостона под руководством Zolt Arany доставляли ген PGC-1 старым мышам с заболеванием периферических артерий. Терапия успешно восстанавливала кровоснабжение в мышцах. А исследователи Hollinger и Selsby использовали терапию геном PGC-1 для лечения наследственного заболевания мышц — миодистрофии Дюшена, которое, правда, не является возрастным. Однако терапия была успешной и в этом случае: доставка гена PGC-1 значительно улучшила работу мышц у мышей с патологией.
Генная терапия для поддержания стабильности генома и эпигенома
Характерной чертой и, по-видимому, одной из основных причин старения является накопление повреждений ДНК. Кроме того, многочисленные болезни преждевременного старения — прогерии — тоже возникают в результате чрезмерного накопления геномных повреждений.
Поэтому одним из самых перспективных путей продления жизни — является репарация повреждений и увеличение стабильности генома.
В течение жизни ДНК постоянно повреждается разными воздействиями. Из внешней среды на нее действует температура, УФ-излучение, химические мутагены и вирусы. Но и внутренние процессы самой клетки увеличивают геномную нестабильность: ДНК повреждается активными формами кислорода из митохондрий, а системы репликации (удвоения ДНК) и репарации часто работают неточно и сами вносят ошибки.
В результате с возрастом в ДНК накапливается целый спектр нарушений: разрывы, точечные мутации, перемещение кусков ДНК с одного места на другое, слипание хромосом, встраивание в геном вирусов и транспозонов. Если повреждений слишком много, клетка вынуждена пойти по одному из 3х путей: запустить процессы клеточного самоубийства (апоптоза), стать сенессентной или превратиться в раковую. Все эти процессы (в случае если им подвержено много клеток) чрезвычайно вредны для организма.
Наиболее изученный путь увеличения стабильности генома — это активация систем репарации ДНК. Именно этот подход используют в большинстве работ по генной терапии.
Активация репарации ДНК
Репарация ДНК — важнейшая для клеток задача, поскольку она позволяет сохранять самое ценное — информацию, заложенную в ДНК. Не случайно в эволюции у клетки сформировалось несколько взаимодополняющих систем обнаружения повреждений ДНК и их «залечивания». Это, например, пути распознавания 2- и 1-цепочечных разрывов ДНК; различные системы репарации ДНК — эксцизионная репарация, позволяющая удалять из ДНК поврежденные азотистые основания, негомологичное соединение концов и гомологичная рекомбинация, залечивающая 2-цепочечные разрывы ДНК, репарация активированная репликацией и пр. В этих системах задействованы сотни белков, функции которых переплетены сложной и причудливой сетью. Потенциально, каждый из этих генов является кандидатом для генной терапии старения, однако на сегодняшний день исследования в этой области только начинаются.

В 2013 году итальянские ученые под руководством Gemma Calamandre исследовали трансгенных мышей с активацией гена MTH1. Белок MTH1 участвует в репарации повреждений ДНК и РНК, вызываемых активными формами кислорода. Он исправляет дефектные нуклеотиды — окисленные по восьмому атому углерода гуанидины (из четырех букв, на которых написана ДНК эта обозначается «Г»).
Оказалось, что повышенная экспрессия MTH1 продлевает жизнь трансгенных мышей до 22%. Кроме того, у таких мышей геномные повреждения с возрастом не накапливались. Изменялось и их поведение: мыши становились менее тревожными и более любопытными.
В другом исследовании Johannes Grillari с коллегами проводил терапию геном другого белка репарации — SNEV — на клетках в пробирке. SNEV «залатывает» разрывы ДНК, а также участвует в уничтожении поврежденных белков и очищении клетки.
Доставка гена SNEV в клетки выстилки сосудов (эндотелия) человека значительно замедляла их старение: клетки делились в 2 раза больше, прежде чем состарились и прекратили деления. Кроме того, они становились более устойчивыми к стрессам.
Подавление активности ретротранспозонов
Повреждения ДНК могут вызывать и собственные геномные последовательности — ретротранспозоны. Это остатки ДНК ретровирусов, которые в древние времена встроились в геном, и сейчас занимают около 42% генома человека!
Обычно ретротранспозоны неактивны в клетках, однако с возрастом они активируются — и с них начинает считываться РНК. Это приводит к повреждениям ДНК и хромосомным перестройкам, а также — может вызывать аутоиммунный ответ, так как клетка решает, что заражена вирусами. Все эти процессы способствуют клеточному старению.

В 2011 году Виктория Луньяк из Института Бака США провела исследование по генной терапии, где подавляла активность ретротранспозонов в старых стволовых клетках человека. Для этого в старые клетки вводили лентивирусы, с которых считывались малые РНК (shRNA), подавляющие считывание информации с ретротранспозонов.
Генная терапия оказалась успешной и привела к омоложению старых клеток — они снова начали делиться.
Увеличение стабильности эпигенома
Для продления жизни чрезвычайно важным является поддержание стабильности не только генома, но и эпигенома. Дело в том, что с возрастом происходят изменения, которые не затрагивают последовательность ДНК, но, тем не менее, изменяют активность генов. Такие изменения носят название эпигенетических. Их особенностью является то, что они могут не только сохраняться в ряду клеточных делений, но и передаваться следующим поколениям.
В геноме человека около 18 000 генов, но далеко не все они работают в клетках. Клетки подавляющего большинства тканей имеют практически идентичный геном, не считая некоторого количества мутаций, возникающих по мере развития организма. Однако различия по структуре и функциям разных тканей определяются не этими незначительными отклонениями. Дело в том, что клетка каждой ткани имеет очень специфический наборов генов, которые работают и которые — «выключены».
Отчасти этот набор — профиль экспрессии генов — определяется работой многочисленных белков (например, активаторов и репрессоров работы генов). Но в значительной степени он связан с эпигенетическим состоянием клетки (в основном — плотностью «упаковки» ДНК). Поэтому поддержание стабильности эпигенома — процесс чрезвычайной важности!
С возрастом, однако, происходят эпигенетические изменения, нарушающие профили работы генов, что негативно сказывается на клеточных процессах и ускоряет клеточное старение. Например, с возрастом активируется целый набор генов и геномных последовательностей, которые в норме работать не должны (например, ретротранспозоны).
Активность генов регулируется многими факторами. Один из них — плотность «упаковки» ДНК, которая определяет ее доступность для ферментов, осуществляющих синтез РНК. ДНК в ядре всегда находится в «упакованном», намотанном на белки — гистоны — состоянии. Как нитки на катушку. Если ген «упакован» слишком плотно — он недоступен для ферментов, и синтеза РНК не происходит. Если же «упаковка» неплотная — ферменты легко садятся на него и начинают работать.
Активация генов при старении как раз связана с тем, что плотность «упаковки» ДНК падает.
В связи с этим несколько исследователей решили разработать генную терапию, глобально увеличивающую плотность «упаковки» ДНК в клетке.
Stephen L Helfand с коллегами активировали ген метилазы Suv39 — фермента, который модифицирует гистоны, увеличивая плотность упаковки ДНК. Эксперименты проводились на плодовых мушках — дрозофилах, которые в результате воздействия стали жить дольше.
А канадские ученые Igor Kovalchuk и Olga Kovalchuk использовали тот же самый подход, но на клетках человека. В своей работе они обнаружили, что активность гена Suv39h1 в старости падает. Они вводили ген Suv39h1 в клетки фибробластов (соединительной ткани) человека, что приводило к их омоложению и стимулировало деления.
Необходимо понимать, что такой подход — крайне грубое воздействие на эпигеном. Наверняка замедление старения требует гораздо более «ювелирного» воздействия и эпигенетических изменений узкого набора определенных генов. Однако пока — знания о роли эпигенетики в старении очень схематичны и приблизительны.
В настоящее время генная терапия для увеличения стабильности генома и эпигенома –чрезвычайно молодая область. Большинство работ проведены даже не на трансгенных животных, а на клетках в пробирке, а достигнутые успехи — довольно сдержанные. Однако необходимо понимать, что пока и фундаментальные исследования затронули лишь незначительный пласт того, что действительно происходит в старости с геномом и эпигеномом и выявили очень мало (довольно грубых) путей, как этому противодействовать.
Однако тема эта — чрезвычайно перспективна и наверняка таит в себе еще много сюрпризов и имеет большой потенциал для генной терапии!
Генная терапия для активации гормона klotho
Почти 20 лет назад, в 1997 году японские и американские ученые во главе с Yo-ichi Nabeshima обнаружили новый ген долголетия и дали ему название в честь греческой богини судьбы, плетущей нить жизни — Klotho. Его «выключение» у трансгенных мышей вызывало синдром ускоренного старения. А еще через 7 лет те же исследователи выяснили, что и активация klotho значительно продлевает мышам жизнь — самцам на 20–30%, а самкам — до 19%.
 А в 2014 году было показано, что определенные варианты в гене klotho (SNP Rs9536314) ассоциированы с долголетием и высокими умственными способностями у людей.
А в 2014 году было показано, что определенные варианты в гене klotho (SNP Rs9536314) ассоциированы с долголетием и высокими умственными способностями у людей.
Вырабатывается klotho в почках и сосудах мозга и разносится кровью по организму, как гормон. Он системно воздействует на большинство клеток в организме — связывается с рецепторами на их поверхности и подавляет сигналинг инсулина и IGF-1 (один из главных путей старения).
Уже через 3 года после открытия гена klotho — в 2000 году — была проведена первая работа по генной терапии, правда, не от старения, а от хронического заболевания сосудов — атеросклероза. Ryozo Nagai с коллегами системно ввел этот ген крысам и добился улучшения состояния сосудов и снижения давления.
С тех пор было проведено еще порядка 4–5 успешных работ по терапии геном klotho на модельных крысах и мышах. Правда, все они посвящены не старению, а различным возрастным патологиям сердечно-сосудистой системы и почек. Это повышенное давление — гипертония, заболевания почек, патологии коронарной артерии и диабет.
Генная терапия возраст-зависимых патологий
В старости ухудшается состояние почти всех тканей и систем организма — снижается тонус сосудов и сердца, происходит дегенерация тимуса — важнейшего органа иммунной системы, истощается костная, хрящевая и мышечная ткани, возникают многочисленные когнитивные нарушения — и это только начало списка.
Большинство этих патологий не считаются заболеваниями, однако очень существенно увеличивают их риск. Например, повышенное давление — гипертония — является мощным фактором риска инсульта, инфаркта и сердечной недостаточности. Кроме того, в старости эти патологии развиваются комплексно, что существенно снижает качество жизни человека и приводит к дряхлости.
Именно с такими нарушениями борется генная терапия возрастных патологий.
Однако в отличие от генной терапии старения, она всегда ограничивается какой-нибудь одной тканью или системой — лечением ожирения, дегенерации сетчатки или нарушений работы центра памяти — гипоталамуса. Генная терапия старения, наоборот, стремится омолодить все без исключения клетки и ткани организма.
И если генная терапия старения воздействует на консервативные пути старения, общие для большинства клеток организма, то генная терапия возрастных патологий — как правило, ограничивается воздействием на механизмы, специфические для определенной ткани. Довольно часто — это «второстепенные» или «третьестепенные» пути, регулируемые более глубокими и фундаментальными механизмами долголетия.
Совершенно очевидно, что лечить возрастные патологии гораздо проще, чем старение — для этого нет необходимости в глубинных знаниях о молекулярных механизмах старения. Поэтому неудивительно, что генная терапия возрастных патологий — гораздо более развитая область. Если для старения проведено не больше 2–3х работ по генной терапии на млекопитающих, то для возрастных нарушений — больше 40!
Цель такой терапии — вернуть старую ткань или систему в состояние, неотличимое от молодых животных. Естественно, так невозможно справиться со старением в целом. Если пациента спасут от инфаркта — через какое-то время у него разовьется, к примеру, диабет! Существуют даже исследования, которые показывают, что если бы мы смогли полностью вылечить все заболевания раком (а это одна из основных причин смерти) — это продлило бы среднюю продолжительность жизни людей всего на три года. Так что в целом такой подход гораздо менее эффективен, чем генная терапия старения, омолаживающая одновременно множество систем и в дополнение — продлевающая жизнь.
Тем не менее, по генной терапии возрастных патологий проведено довольно много высококачественных работ на модельных животных — мышах, крысах, кроликах и даже обезьянах. Это генная терапия в «классическом смысле»: модельным животным вводят терапевтический ген в составе вектора для доставки и анализируют, как это повлияет на возникновение возрастной патологии. При этом ценность исследования значительно возрастает если используются старые животные. Мы старались анализировать именно такие работы.
Разработанные подходы — являются мощным средством профилактики болезней и лечения старческой дряхлости. Однако применять их, по-видимому, имеет смысл только в том случае, если пациент имеет явную предрасположенность к тому или иному типу болезней — сердечно-сосудистым, нейродегенеративным и пр.
Сердечно-сосудистая система
По генной терапии возрастных патологий сердечно-сосудистой системы было проведено около 7 работ на старых мышах и крысах. Это одна из самых волнующих областей — поскольку на сегодняшний день сердечно-сосудистые заболевания — главная причина смертности в мире, на их приходится порядка 30% всех смертей — 17,3 миллиона человек ежегодно. Однако возникновению этих заболеваний предшествуют различные патологии, которые можно диагностировать и лечить — это нарушение образования новых кровеносных сосудов, снижение тонуса мышц сосудов и сердца, гипертония. Именно они были выбраны в качестве мишеней для генной терапии.
В большей части работ по генной терапии — использовали очень специфические гены, улучшающие работу только сердца и сосудов, ни один из них не являлся одновременно и геном долголетия. Например, для лечения повышенного давления — гипертонии — в организм доставляли ген BNP (натрийуретического пептида В-типа), который выделяется сердцем при повышенной нагрузке и расширяет сосуды, стабилизируя кровяное давление. А для старческой патологии сердца — потери способности к расслаблению — использовали ген кальциевых насосов, выкачивающих кальций из цитоплазмы мышечных клеток и расслабляющих мышцы.
Все эти подходы были успешны, но не приводили к радикальному омоложению; кроме того, ни в одной работе не исследовались побочные эффекты.
Самым интересным исследованием без сомнения является работа французского ученого Alain-Pierre Gadeau, где в качестве терапевтического агента использовался ген эмбрионального сигнального каскада — desert hedgehog (dh). Помимо важной роли в эмбриональном развитии, этот ген также «включается» и после ишемических повреждений (при недостатке кровоснабжения), обеспечивая образование новых кровеносных сосудов. Введение этого гена старым мышам после ишемии была очень успешной — кровоснабжение, а также плотность нервов в конечностях у старых больных мышей становилось такой же, как у молодых!
Остеопороз
Около 7 работ было проведено по генной терапии остеопороза — истощения костной ткани в старости, приводящего к хрупкости и переломам. Однако только две из них были проведены на старых животных. В остальных — остеопороз индуцировали искусственно.
Во всех исследованиях в качестве мишени были выбраны специфические для костной ткани механизмы. Например, в 2х работах использовали доставку генов BMP, способствующих образованию костной ткани. А в нескольких других исследованиях доставляли гены остеопротегерина (OPG) или оментина 1, препятствующих разрушению кости. Эффективность всех этих подходов была средней — состояние костной ткани улучшалось, но только частично; а побочные эффекты — не исследовались.
Пожалуй, единственным исключением была работа американских ученых под руководством Xiao-Bing Zhanga — по генно-клеточной терапии остеопороза. Ученые доставляли в стволовые клетки мыши в пробирке ген PDGFB — фактора роста, стимулирующего образование кости — после чего клетки вводили в организм. Это оказалось крайне эффективным: структура кости улучшилась, а крепость — возросла на 45%! Важно, что в этой работе исследовали побочные эффекты — и ничего не обнаружили. Однако все эксперименты проводились на взрослых, здоровых мышах (и состояние их костей становилось еще лучше), потому неясно, как будет работать терапия в случае старых и больных животных.
Хрящевая ткань
Более 5 работ по генной терапии посвящены возрастным патологиям хряща — дегенерации межпозвонковых дисков и остеоартриту — нарушениям, связанным с деформацией и истощением хрящевой ткани, приводящим к хронической боли. Важно отметить, что все работы проводились на взрослых, а не старых животных, у которых патологии вызывали хирургически — повреждая хрящ.
Несколько работ были направлены на улучшение структуры хряща. Например, в организм доставляли ген Sox9, стимулирующий продукцию важнейшей структурной молекулы — коллагена 2 типа. В других работах — подавляли воспаление при остеоартрите. Например, доставляли миРНК, подавляющие активность про-воспалительного гена NF-κB. Все эти подходы замедляли развитие патологий, но не останавливали его.
Однако одна из работ заслуживает отдельного внимания! В этом исследовании, проведенном китайским ученым Wang, использовался ген долголетия — SIRT6. Введение этого гена в область поврежденного хряща замедляло и воспаление, и старение клеток, и возникновение остеоартрита. Хочется отметить, что в этой работе воздействовали на общий для большинства клеток механизм долголетия. Этот ген может быть использован не только для терапии локальной возрастной патологии, но и для омоложения всего организма.
Мышцы
Истощение мышечной ткани — одна из основных причин старческой немощи и дряхлости; а также того, что человек — начинает выглядеть, как старик. Сплошная немощь и убожество доходящие до стыда. Именно то, что называется жизнь скрутила в бараний рог. Поэтому её эффективное лечение актуально не только для медицины, но и для косметологии.
Сегодня в генной терапии старческих патологий мышц — разрабатывается только один подход, который, впрочем, очень эффективен. Это подавление активности гена миостатина, который препятствует росту мышц. Его «выключения» можно добиться, например, при помощи доставки гена ингибитора миостатина — пептида MyoPPT. По данным Ketan Patel, его введение старым мышам приводит к блестящим результатам: значительно увеличивается не только мышечная масса, но и «включаются» гены долголетия (например, FOXO).

Элизабет Перриш
Заслуживает отдельного упоминания и то, что Элизабет Перриш — женщина, которая первой в мире прошла генную терапию старения, помимо гена теломеразы ввела себе именно ген ингибитора миостатина — для улучшения работы мышц.
Иммунная система
Возрастные изменения затрагивают и иммунную систему — организм становится более чувствительным к вирусным и бактериальным инфекциям; смертность от них увеличивается, а профилактика заболеваний — вакцинация — перестает помогать. Однако, несмотря на важность проблемы, работ по генной терапии всего 3, и ни одну из них нельзя признать достаточно успешной. Это неудивительно, учитывая скудность знаний о молекулярных и генетических механизмах, лежащих в основе старения иммунной системы.
Две работы посвящены терапии возрастной дегенерации тимуса — центрального органа иммунной системы, в котором созревают Т-лимфоциты (ключевые участники приобретенного иммунитета). В одной из них в тимус доставляли ген транскрипционного фактора FoxN1, регулирующего развитие тимуса и образование там Т-клеток. А в другой — улучшали кровоснабжение тимуса, при помощи доставки гена VEGF — фактора роста эндотелия сосудов. Однако в обоих случаях ученым удалось добиться лишь незначительного замедления деградации тимуса.
А в третьей работе при помощи генной терапии пытались улучшить эффективность вакцинации в старости. Для этого в организм вводили ген IL-2 — важнейшего медиатора воспаления и иммунитета — что действительно немного усилило системный иммунный ответ на вакцинацию. Однако он все равно оставался значительно слабее, по сравнению с молодыми мышами.
На сегодняшний день наибольшими успехами в области омоложения иммунитета может похвастаться фармакология. Фарм гигант Новартис даже провел клинические испытания аналога рапамицина (ингибитора пути старения mTOR), по улучшению реакции на вакцинацию у пожилых людей! Дело в том, что подавление хронического воспаления является не только одним из путей омоложения иммунной системы, но и замедляет старение всего организма.
Центральная нервная система
Генная терапия старческих патологий центральной нервной системы (ЦНС) — активно исследуемая и бурно развивающаяся область — ей посвящено уже более 10 работ! И проводились они не только на старых крысах и мышах, но даже на приматах — макаках-резусах. Это неудивительно, учитывая, что нейродегенеративные заболевания (болезнь Альцгеймера и Паркинсона) входят в Топ-10 основных причин смертей в мире, а терапия старческих патологий ЦНС — является эффективной профилактикой этих болезней.
Больше всего работ направлены на омоложение гиппокампа — древней структуры мозга, ответственной за формирование памяти. Все подходы «целятся» в очень специфичные для нервных клеток — нейронов — механизмы. Ученые пытаются улучшить структуру нейронов — вводя ген структурного белка Homer1c. Или сделать более эффективной передачу сигнала между нервными клетками (используя ген PkcD, участвующий в работе синапса). Отметим, что гены в гиппокамп доставляют при помощи прямой инъекции в эту зону мозга. В большинстве работ терапия приводила к улучшению памяти и пространственного обучения у старых мышей или крыс, иногда — даже до уровня молодых животных. К сожалению, исследовались только очень кратковременные эффекты такой терапии, так что их реальная эффективность остается неизвестной.
Самой многообещающей была работа Matthew J. During, посвященная не терапии, а — профилактике когнитивных нарушений. В гиппокамп молодых крыс ввели ген транскрипционного фактора CREB (участвующего в формировании долговременной памяти), а когда эти крысы состарились — оказалось, что их память в гораздо лучшем состоянии!
Интересно, что параллельно с генной терапией, в Лос-Анжелесе ведутся разработки по созданию искусственного гиппокампа крысы! Такой гиппокамп смоделирован, как совокупность нервных сетей и предназначен для имплантации в мозг вместо поврежденного. Его уже успели протестировать на живых крысах, что эффективно восстановило у них нарушения памяти, и руководитель проекта Теодор Бергер (Theodore Berger) испытывает энтузиазм и обещает создание искусственного гиппокампа человека к 2025 году!
Одна работа по генной терапии — посвящена омоложению другой структуры мозга — черной субстанции, а точнее — ее отдела Pars compacta. Эта часть мозга, в первую очередь, отвечает за управление движениями, однако еще одна её функция — это синтез нейромедиатора (вещества, обеспечивающего передачу сигнала от одного нейрона — к другому) дофамина.
Дофамин является частью «системы вознаграждения» мозга; он вырабатывается во время положительного опыта — секса, приёма вкусной пищи или наркотиков — и вызывает удовольствие. Однако он не менее важен для переключения внимания с одного этапа когнитивной деятельности на другой, и его недостаточность приводит к повышенной инертности мышления.
Для омоложения Pars compacta черной субстанции активировали путь долголетия и стрессоустойчивости — увеличивали стабильность белков в клетке! Взрослым крысам вводили ген шаперона GRP78, который обеспечивает повторную укладку неправильно свернутых белков или белков после деградации. Затем — отслеживали состояние животных до глубокой старости, и обнаружили, что генная терапия защищала нейроны от гибели, даже — если на них действовали повреждающими веществами (альфа-синуклеином).
И, наконец, проведены 3 очень интересные работы, где генную терапию использовали для системного омоложения всего мозга! Для системной доставки — генетические конструкции вводили в спинно-мозговую жидкость, омывающую различные отделы мозга.
В одном исследовании — в мозге системно подавляли воспаление, ингибируя про-воспалительные вещества — цитокины IL-12 и IL-23 при помощи миРНК, что довольно успешно улучшило когнитивные способности мышей. Правда, эксперименты проводились на животных с ускоренным старением. В другой работе — мозг очень старых крыс системно омолаживали геном инсулиноподобного фактора роста-1 (IGF-1)! Как известно, IGF-1 запускает один из главных путей старения в организме, однако в ЦНС его роль совсем иная — он является нейропротектором. Системная доставка гена IGF-1 в мозг существенно улучшила двигательную активность крыс, однако — не до уровня молодых.
А в замечательном исследовании Mark H. Tuszynski проводили генную терапию мозга старых макак-резусов геном NGF — фактора роста нервов, также являющегося нейропротектором. Введение этого гена было очень эффективным — число и размер нервных клеток (холинергических нейронов) становились, как у молодых обезьян! Кроме того, эффект от терапии сохранялся очень долго — дольше года.
Надо отметить, что у гена NGF очень хорошая репутация — уже больше 15 лет он успешно исследуется в клинических испытаниях на человеке от болезни Альцгеймера.
Все эти подходы показывают, какими разнообразными путями можно достигнуть улучшения деятельности мозга в старости. По видимости, использование комбинированных подходов к генной терапии мозга может привести даже к его омоложению.
Половая система
Очень много работ посвящено генной терапии половых нарушений в старости. У мужчин — это эректильная дисфункция, от которой по данным «Massachusetts Male Aging Study» страдают 39% мужчин в возрасте 40 лет и 67% — в возрасте 70 лет. А у женщин — прекращение репродуктивного периода — менопауза, которая наступает в среднем в 50 лет и приводит к бесплодию. Все работы по генной терапии проводились на старых животных — крысах или мышах.
Разработано около 6 подходов к лечению эректильной дисфункции, однако все они очень однообразные — воздействуют на специфические механизмы гладких мышц пениса. В нескольких работах — активировали сигнальную молекулу NO, необходимую для мышечного расслабления (гены eNOS, ecSOD , миРНК против аргиназы), а в других — вводили гены необходимых для работы мышц ионных каналов (КАТФ, Maxi-K). Эффективнее всего была, по видимости, доставка гена КАТФ — АТФ-зависимых калиевых каналов, необходимых для номального тонуса мышц. В этом случае — омоложение достигало уровня молодых животных.
По видимости, в любом случае терапия эректильной дисфункции будет эффективнее, если будет сопровождаться нормализацией гормонального баланса.
Для генной терапии женской половой системы была предпринята всего одна работа, однако она очень интересна! В ней воздействовали на главный гормональный регулятор — гипоталамус, причем вводили туда ген IGF-1 — инсулиноподобного фактора роста. Это заслуживает особого внимания, поскольку, как мы уже говорили, на уровне целого организма IGF-1 запускает старение, однако является нейропротектором в ЦНС. IGF-1 также участвует в регуляции половых гормонов (в частности — контролирует выделение гонадотропин-рилизинг-гормона (GnRH) в ответ на эстрогены).
Ген IGF-1 вводили самкам крыс среднего возраста в гипоталамус, а через несколько месяцев — у них улучшалась цикличность эструсов, а их яичники сохранялись в гораздо лучшем состоянии. Возможно, улучшения были действительно связаны с увеличение продукции IGF-1 и его регуляции половых гормонов. Но, не исключено, что такая терапия приводила и к омоложению гипоталамуса и, как следствие, омоложению, организма и его систем!
В целом разработанные подходы довольно интересны, однако — недоизучены. В первую очередь это касается генной терапии мужской половой системы, где не исследовались долговременные эффекты терапии, а также возможные побочные эффекты.
Возрастное ожирение
Другой возраст-зависимой патологией является увеличение веса тела, а точнее объема жира. Ожирение, с одной стороны, сильно ухудшает состояние здоровья (например, увеличивает риск диабета), а с другой — делает человека некрасивым. Так что генная терапия этой патологии — открывает новые перспективы и для медицины и для косметологии.
Работ по генной терапии ожирения в старости проведено всего 3, и все они очень интересные. В 2х исследованиях для снижения веса действовали на регуляторные центры головного мозга.
В одной из работ в область черного вещества — вводили ген нейротрофического фактора GDNF, способствующий выживанию нейронов. В результате старые жирные мыши сильно похудели, что — отчасти это связано с тем, что мыши стали меньше есть, а отчасти — с тем, что, генная терапия привела к активации гипоталамических нейронов, выделяющих кортикотропин (CRH).
В другой работе в гипоталамус вводили ген Pomc — проопиомеланокортина — предшественника меланокортинов, которые важны для регуляции энергетического баланса и метаболизма глюкозы. Эксперименты проводились на старых жирных крысах, которые после терапии сильно похудели. Интересно, что вначале их аппетит сильно снизился, однако через месяц восстановился, что не помешало дальнейшему снижению веса. Похудение отчасти было связано с тем, что терапия усилила расход энергии в жировой ткани — она рассеивалась в форме тепла. Очень важно и то, что у крыс улучшился еще и ряд параметров здоровья: нормализовался баланс липидов и глюкозы, и возросла чувствительность к инсулину.
И, наконец, в одной из работ ожирение мышц лечили системной доставкой гена Wnt, контролирующего раннее эмбриональное развитие, а во взрослых тканях — необходимого для поддержания стволовых клеток и регулирующего их дифференциацию (превращение в специализированные клетки). Ген Wnt вводили взрослым крысам в мышцы и следили за их здоровьем в течение долгого времени. Интересно, что терапия неожиданно привела к очень хорошим результатам: у крыс не только снижался вес, хотя они ели очень жирную пищу, но и — уменьшался риск возрастных патологий. У них нормализовался обмен глюкозы, снизился уровень триглицеридов в крови, и, что особенно интересно, даже увеличилось минеральная плотность костей!
В целом, хочется отметить, что подходы к генной терапии ожирения очень перспективны — в них помимо снижения веса, наблюдалось маркеры системного омоложения: нормализации обмена глюкозы, жиров, и даже — улучшению состояния костной ткани! По-видимому, это связано с тем, что во всех них ожирение пытались лечить системными воздействиями — омолаживая нервную систему, нормализуя гормональный баланс или воздействуя на пути стволовых клеток.
Зрение
Методы генной терапии разрабатываются и для нарушений зрения в старости, в частности, возрастной макулодистрофии (age-related macular degeneration — AMD), одной из самых частых причин потери зрения после 65. Однако необходимо отметить, что AMD считается не только возрастной патологией, но и официально признана заболеванием. Она связана с чрезмерным разрастанием сосудов и гибелью зрительных клеток — фоторецепторов сетчатки.
Все методы лечения AMD при помощи генной терапии направлены на подавление образования кровеносных сосудов — ангиогенеза. Для этого, как правило, ингибируют работу главного стимулятора ангиогенеза — VEGF — фактора роста эндотелия сосудов.
Например, в клетки доставляют участок гена рецептора VEGF — sFlt1, подавляющий работу VEGF. Этот подход разработан лучше всех остальных: уже не только проведены исследования на мышах, но и запущены первые стадии клинических испытаний на людях больных AMD.
В исследовании, опубликованном в 2015 году — участвовали 8 пациентов обоего пола от 71 до 86 лет. Ген sFlt01.19 вводили в область глаза, а через 52 недели — острота зрения улучшилась у всех пациентов. Побочных эффектов в этом исследовании не наблюдалось, что открывает перспективы для дальнейших клинических испытаний и введения лекарства в клиническую практику.
Другой подход к генной терапии AMD — тоже направлен на подавление роста сосудов, однако с использованием других генов — ангиостатина и эндостатина. И тоже был эффективен при тестировании как на кроликах, так и на макаках.
Таким образом, генная терапия AMD очень эффективна — и уже на стадии трансляции в клинику. Однако в качестве мишени она использует довольно специфический путь ангиогенеза и воспаления — VEGF, который вряд ли может быть интересен для системной терапии старения. Интересно, что он используется для лечения и других возрастных патологий, например, нарушений сердечно-сосудистой системы. Однако в их случае — VEGF, наоборот, необходимо активировать!
В целом, генная терапия возрастных патологий — довольно развитая область, по сравнению с генной терапией старения, однако — несравненно менее популярная, чем генная терапия всевозможных заболеваний. Напомним, что если по генной терапии рака запущено около 1415 клинических испытаний, то по генной терапии возрастных патологий — проведено всего 40–45 работ и то — на мышах, крысах и обезьянах. (Проводятся, правда, клинические испытания на больных AMD, однако это потому — что AMD официально признана болезнью). Такое «пренебрежение» генной терапией возрастных патологий, по-видимому, связано с общим фокусом медицины не на профилактику заболеваний, а на лечение болезней уже существующих.
В отношении работ по генной терапии возрастных патологий можно отметить, что перспективные, высококачественные работы есть, но они составляют не больше четверти всех проведенных исследований. В большинстве работ генная терапия приводит к довольно умеренному улучшению состояния здоровья (и, как правило, не достигает уровня молодых животных), длительность терапевтического эффекта не исследуется, побочные эффекты — не изучаются.
Есть, однако, и очень перспективные, выделяющиеся качеством работы. В особенности много таких работ проведено по генной терапии нарушений мозга. Это, например, генная терапия мозга старых обезьян-резусов геном NGF — фактора роста нервов, которая восстановила число нервных клеток (холинергических нейронов) до уровня молодых животных! Много перспективных исследований проведено по генной терапии возрастного ожирения. Они не только приводили к снижению веса, но и — улучшали целый набор показателей здоровья.
В целом, генная терапия возрастных патологий кажется мне эффективным способом профилактики заболеваний и борьбы с дряхлостью. По-видимому, особенно перспективно совмещать ее с генной терапией старения, как, например, сделала Элизабет Перриш, введя себе ген теломеразы вместе с геном ингибитора миостатина для омоложения мышц.
В заключение можно отметить, что хотя генная терапия старения — пока еще очень молодая область науки, однако она активно развивается в самых разных направлениях и уже сейчас вселяет большие надежды.
Все исследования находятся пока на доклинической стадии испытания (на модельных животных или клетках в пробирке), однако по эффективности генная терапия старения уже догоняет такие мощные и продлевающие жизнь воздействия, как ограничение питания и геропротекторы (например, рапамицин или метформин).
Глядя на все многообразие мишеней и подходов генной терапии хочется сравнить их и попытаться выделить наиболее перспективные направления развития.
Во-первых, проводить генную терапию старения гораздо более эффективно, чем целиться в отдельные возрастные патологии. Действительно, во всех работах по генной терапии старения — наблюдается не только продление жизни, но и замедление развития целого ряда возрастных патологий. Так, в работе Марии Бласко по генной терапии теломеразой, жизнь старых мышей не только увеличилась на 20%, но и возросла чувствительность к инсулину, улучшилась нервно-мышечная координация, снизился риск остеопороза и содержание молекулярных маркеров старения.
А Доншенг Кай при помощи терапии гипоталамуса геном NF-kb добился не только продления жизни мышам на 10%, но и улучшения умственных показателей и работы мышц. Кроме того, структура мышц, кожи и костей таких мышей также находилась в более молодом состоянии, по сравнение с контрольными животными (без терапии).
А терапия отдельной возрастной патологии снижает только риск определенной группы заболеваний, но не может препятствовать тому, что смерть наступит от каких-нибудь других возрастных болезней.
Второй, заслуживающий упоминания, момент: среди подходов к генной терапии старения можно выделить те, что воздействуют на большинство клеток организма, и требуют системной доставки, и те, которые фокусируются на регулирующих старение структурах (например, гипоталамусе). Вторые гораздо более легко и удобно использовать, и в данный момент они кажутся легче реализуемыми.
Дело в том, что системного воздействия очень сложно добиться даже при нынешнем состоянии вирусных систем доставки. Требуется, чтобы введенный в кровь вектор, попал в значительную часть клеток по всему организму. И, хотя Марии Бласко это блестяще удалось, есть данные, что другим лабораториям повторить ее успех не просто.
А в случае терапии гипоталамуса — необходимо, чтобы ген попал только в небольшой участок ткани мозга. А этого можно легко добиться инъекцией вектора с геном в соответствующую область.
В-третьих, чтобы добиться более существенных результатов в генной терапии старения, необходимо комбинировать разные подходы. Есть множество подтверждений тому, что воздействие сразу на несколько путей долголетия дает больший эффект на продолжительность жизни, чем воздействие на них по-отдельности. Например, если «выключить» у мышей ген гормона роста, они живут дольше на 50%. А если таких мышей еще и ограничить в питании, то эффект увеличится до 80%. А необычайный долгожитель — голый землекоп — грызун, который живет дольше мыши в 10 раз, отличается от нее активацией целого набора путей долголетия: это и повышенная устойчивость к стрессам, защита от рака, стабильность белковых молекул, защита от нейродегенерации и пр.
Таким образом, для того чтобы разработать генную терапию, радикально продлевающую жизнь, необходимо действовать одновременно на многие пути долголетия. То есть комбинировать те подходы генной терапии, которые разрабатываются сейчас для увеличения стабильности генома, омоложения гипоталамуса, уничтожения сенессентных клеток, увеличения устойчивости к стрессам, улучшения работы митохондрий, поддержания ниш стволовых клеток и пр.
Если сейчас терапия одним геном не приводит к увеличению продолжительности жизни более чем на 20%, то мы надеемся, что в будущем, за счет комплексной терапии старения, можно будет добиться поистине фантастических результатов.
13.11.2017 Автор: Анастасия Шубина Источник: geektimes.ru
![]()














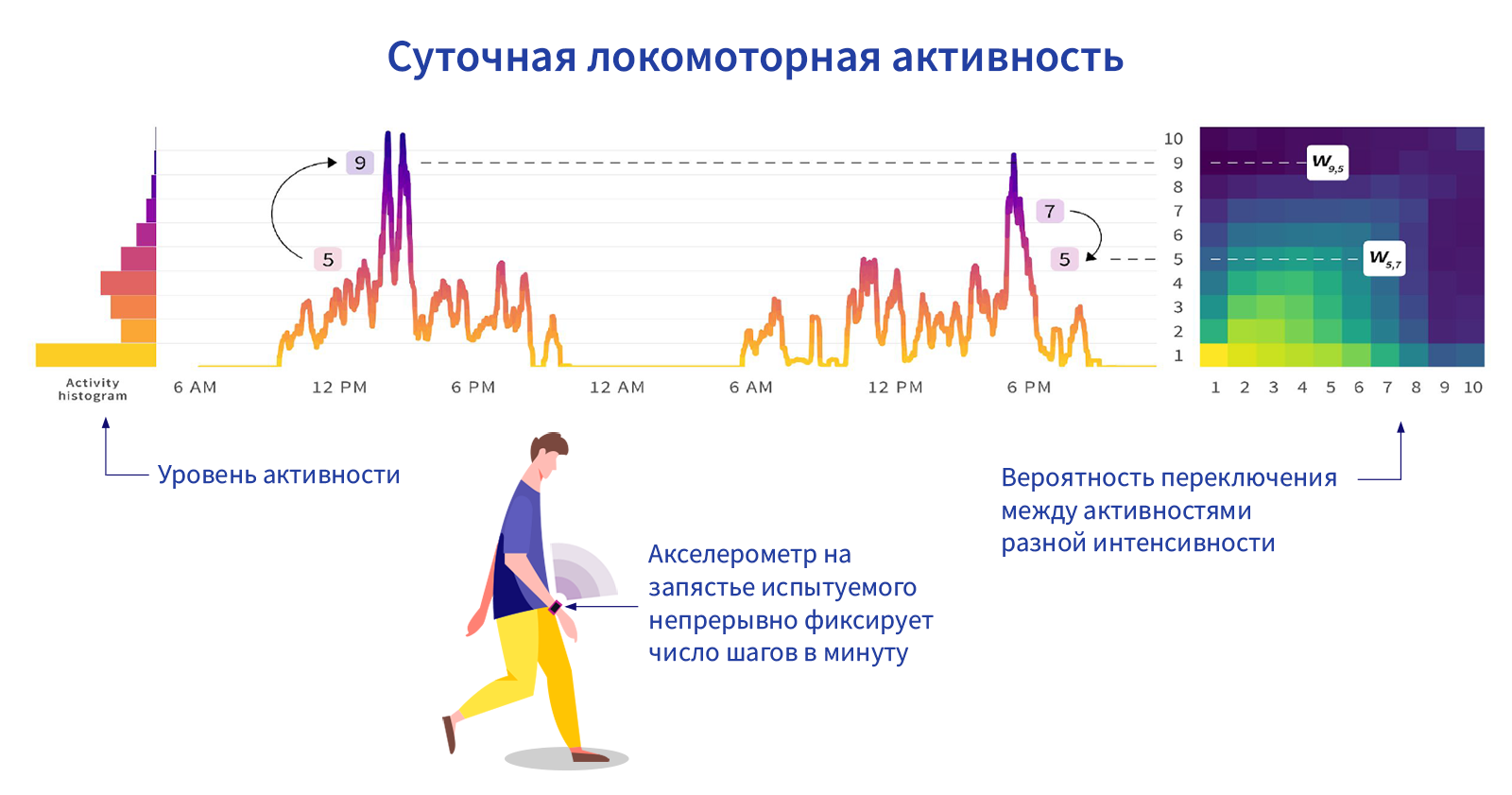
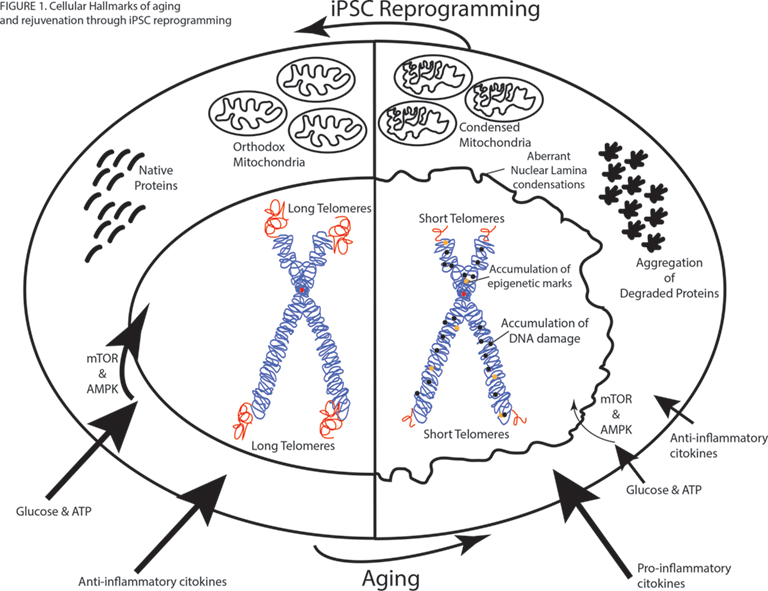








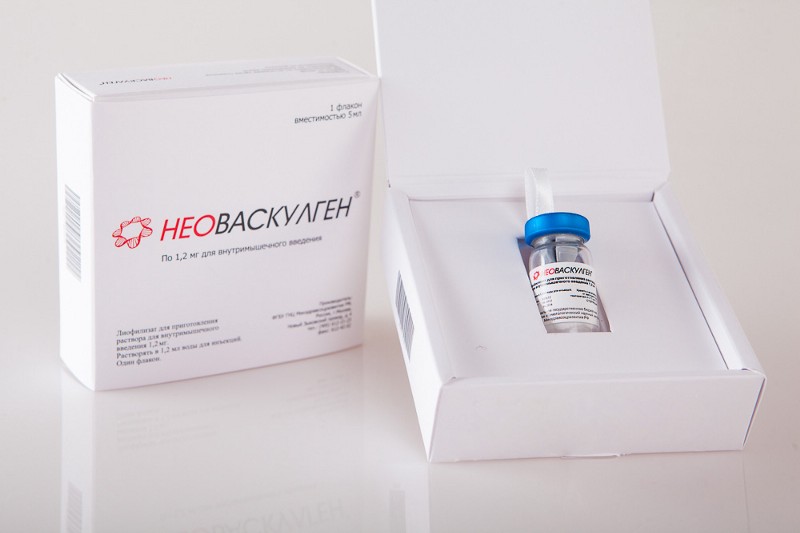
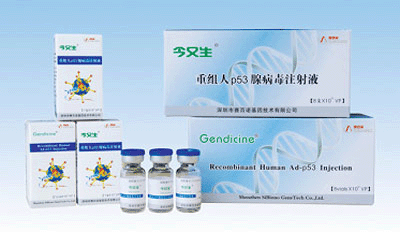
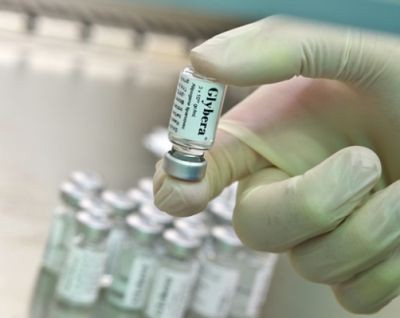





















 А в 2014 году было показано, что определенные варианты в гене klotho (SNP Rs9536314) ассоциированы с долголетием и высокими умственными способностями у людей.
А в 2014 году было показано, что определенные варианты в гене klotho (SNP Rs9536314) ассоциированы с долголетием и высокими умственными способностями у людей.