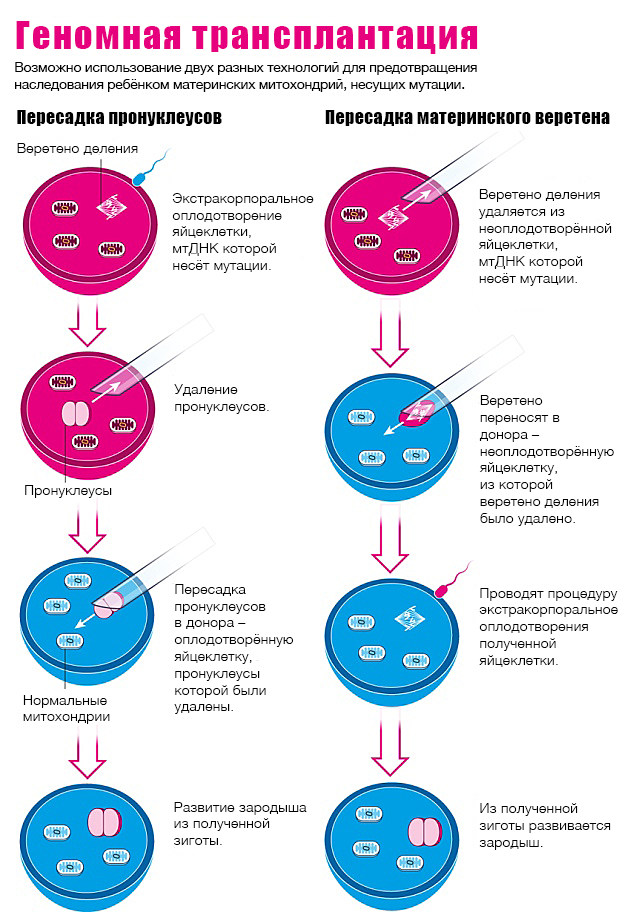
История вопроса (предпосылки):
Технологии создания и манипулирования ДНК обеспечивали прогресс в биологии с момента открытия двойной спирали ДНК. Но все еще остается трудно достижимым внесение сайт-специфичных изменений в геномы клеток и организмов. Ранние подходы основывались на принципе сайт-специфического узнавания последовательностей ДНК с помощью олигонуклеотидов, малых молекул или интронов со способностью к аутосплайсингу (self-splicing). Не так давно были разработаны сайт-направленные нуклеазы цинковый палец (ZFNs) и TAL эффекторные нуклеазы (TALENs), использующие принцип ДНК-белок узнавания. Как бы то ни было, сложности моделирования, синтеза и проверки работоспособности оставались препятствием для широкого внедрения этих нуклеаз для рутинного использования.
Преимущества:
В настоящее время биология находится в переходной стадии в связи с появлением удобного метода геномной инженерии животных и растений с использованием РНК-программируемого комплекса CRISPR-Cas9. Технология CRISPR-Cas9 основана на системах CRISPR-Cas типа II, которые обеспечивают бактерий приобретенным иммунитетом к вирусам и плазмидам. CRISPR-ассоциированный белок Cas9 является эндонуклеазой, которая использует направляющую последовательность в структуре РНК- дуплекса, tracrRNA: crRNA, чтобы сформировать комплекс с последовательностями ДНК-мишени, что позволяет Cas9 произвести сайт-специфичный двухцепочечной разрыв в ДНК. Дуплекс tracrRNA:crRNA был заменен химерной одиночной РНК-гид (направляющей) (sgRNA), сохраняющая две важнейшие характеристики дуплекса: последовательность в 5’ конце, которая определяет на ДНК сайт-мишень по принципу комплементарности, и шпильку (структуру дуплекса РНК) на 3’ конце, которая связывается с Cas9. Эта химерная РНК позволила создать простую двух компонентную систему, в которой изменения в направляющей последовательности sgRNA программировали Cas9 позволили направленно воздействовать на любую интересующую последовательность ДНК. Простота программирования CRISPR-Cas9, уникальный механизм разрезания ДНК, способность к множественному (мультиплексному) узнаванию мишеней, а также существование многих природных вариантов системы CRISPR-Cas типа II- все это вместе дало огромный толчок развитию этой дешевой, эффективной и в то же время простой в использовании технологии для точного и эффективного таргетинга, редактирования, модифицирования, регулирования и маркирования локусов в геноме широкого спектра клеток и организмов.
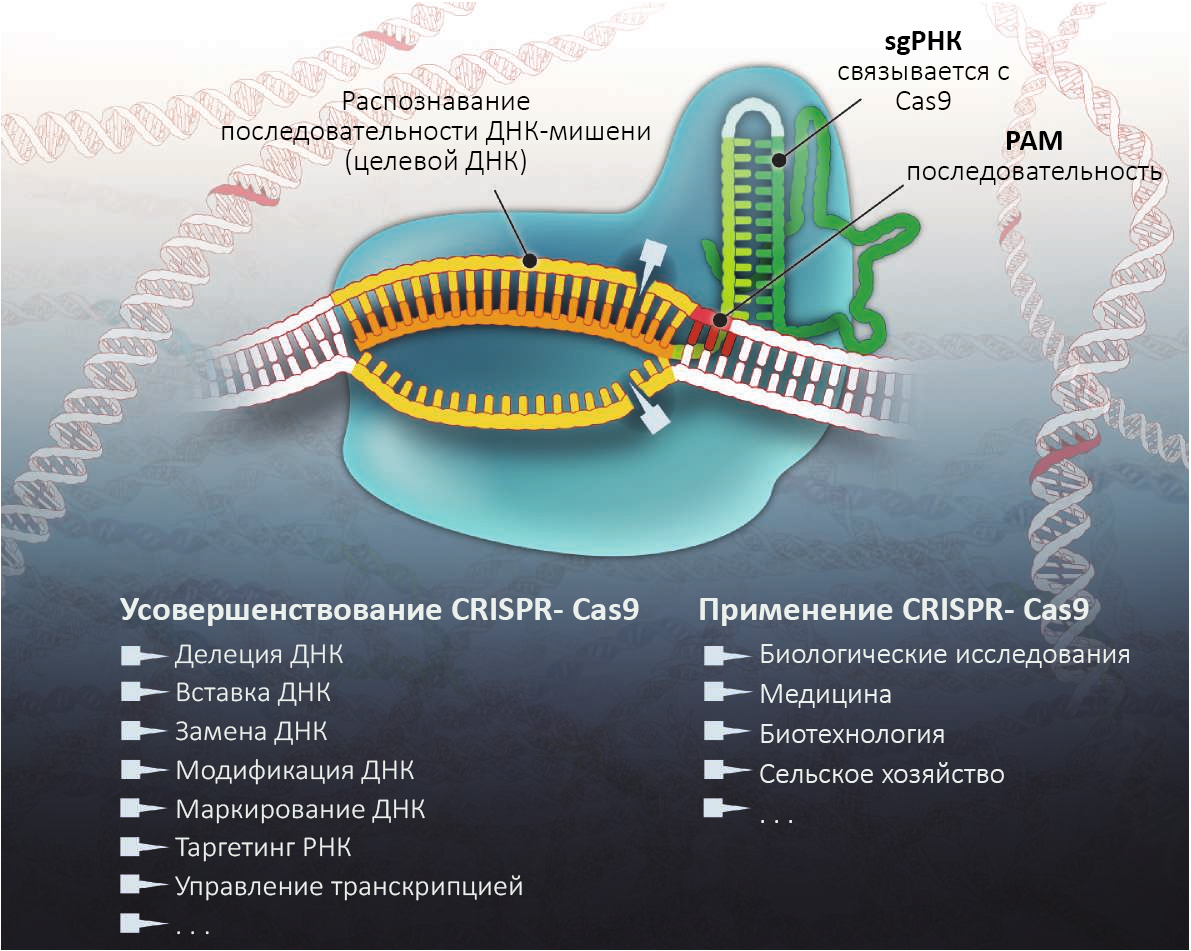
Фермент Cas9 (синий) осуществляет разрыв в двухцепочечной молекуле ДНК, используя два своих каталитических центра (лезвия), чтобы разрезать каждую цепочку ДНК в сайте-мишени (золотой) рядом с последовательностью PAM (красный) и используя соответствие 20-нуклеотидной последовательности (оранжевой) одиночной направляющей РНК (sgRNA). SgRNA включает в себя «шпильку» РНК, образованную из CRISPR РНК (светло-зеленой), и отдельной tracrRNA (темно-зеленой), которая связывается с белком Cas9 и стабилизирует его. Результатом Cas9-sgRNA-опосредованного разрезания ДНК является двух цепочечный разрыв с «тупыми» концами, который запускает работу ферментов репарации, изменяющих или восстанавливающих последовательности ДНК на сайте или вблизи сайта расщепления. Каталитически неактивным формы Cas9 также могут быть использованы для программируемого регулирования
транскрипции и визуализации локусов генома.
РЕДАКТИРОВАНИЕ ГЕНОМА
Новый рубеж генной инженерии с CRISPR-Cas9
Дженнифер А. Даудна 1,2,3 * и Эммануэль Шарпантье 4,5,6 *
Появление удобного инструмента геномной инженерии растений и животных, основанный на использовании бактериальной РНК-направляемой системы CRISPR-Cas9, изменило биологию. Мы рассматриваем историю биологии CRISPR (Коротких палиндромных повторов, регулярно расположенных группами) от их первоначального открытия и до выяснения механизма работы самого фермента CRISPR-Cas9, заложившего основу для выдающихся разработок в модифицировании, регулировании работы и маркировании локусов в геноме широкого спектра клеток и организмов из всех трех царств живой природы. Эти разработки стали точкой отсчета новой эры, в которой манипуляции с геномом больше не являются непреодолимым препятствием для экспериментов, и, таким образом, открывают путь к фундаментальным открытиям в биологии, с применением во всех отраслях биотехнологии, а также в лечения человека.
В последние 60 лет именно технологии изготовления и манипулирования ДНК обеспечивали прогресс в биологии. Эта эра началась с открытия двойной спирали ДНК и продолжилась развитием химических методов твердофазного синтеза ДНК, позволяющих обнаруживать и исследовать организацию генома. Ферменты (в том числе полимеразы, лигазы и рестриктазы (эндонуклеазы рестрикции)) и полимеразная цепная реакция (ПЦР) позволили изолировать отдельные гены и фрагменты генов, а также дали возможность вносить мутации в гены in vitro, в клетки и в модельные организмы. Одним из выдающихся достижений за последние два десятилетия является появление технологий секвенирования генома и стремительное накапливание данных о последовательности всего генома для большого числа различных типов организмов, включая человека. Теперь, РНК-направляемый фермент Cas9, который происходит от CRISPR-Cas системы адаптивного иммунитета бактерий, изменяет биологию, предоставляя геномной инженерии инструмент, основанный на принципе комплементарности. Простота его использования и эффективность привели к его быстрому распространению в лабораториях по всему миру. Ниже мы обсудим историю и биологию CRISPR систем, опишем молекулярные механизмы, лежащие в основе редактировании генома Cas9, и рассмотрим стремительное развитие использования этой технологии с момента первоначальной публикации о ней в 2012 году.
Геномная инженерия — «цель», длинной в десятилетия
С момента открытия двойной спирали ДНК, исследователи и клиницисты размышляли о возможности внесения конкретных изменений в геномы клеток и организмов. Многие из ранних подходов, именуемых «редактированием» генома, опирались на принцип сайт-специфического узнавания последовательностей ДНК (рис. 1). Исследование природных путей репарации ДНК в бактериях и дрожжах, а также механизмов рекомбинации ДНК (1-5), показало, что клетки имеют эндогенный механизм для устранения двухцепочечных разрывов ДНК (ДР (DSBs)), которые могли бы быть смертельными для них (6-9). Таким образом, способы внесения точечных разрывов в участки ДНК , где нужно провести изменения, оказались методом, имеющим большую ценность для геномной инженерии.
Ранние подходы к такому точечному разрезанию ДНК основывались на принципе узнавания пар оснований ДНК олигонуклеотидами или небольшими молекулами. Исследования, основанные на авторском описании формирования тройной спирали (трех нитчатой структуры) Ричем (Rich) и его коллегами в конце 1950-х годов (10, 11), показали, что олигонуклеотиды, соединенные с химическим лезвием или кросс-линкинг (сшивающих накрест) реагентами, такими как блеомицин и псорален, являются пригодными для сайт-специфичной хромосомной модификации в клетках дрожжей и млекопитающих (12-17). Как показали исследования, другие способы химического распознавания последовательностей ДНК, такие как пептидные нуклеиновые кислоты (PNA) и полиамиды, предоставляют возможность направленного связывания с локусами на хромосомах, которые могут быть модифицированы, если химический распознающий агент был соединен с разрезающим реагентом, таким как блеомицин (18- 20). Другая стратегия, основывавшаяся на спаривании оснований нуклеиновых кислот по принципу комплементарности, заключалась в использовании интронов со способностью к аутосплайсингу для изменения последовательности на ДНК (21, 22) или РНК (23) уровне. Хотя эти подходы не прижились, они продемонстрировали практическую ценность принципа спаривания оснований для сайт-специфической модификации генома.
Использование интров со способностью к аутосплайсингу для редактирования генома также предоставило возможность использования интрон-закодированных нуклеаз (самонаводящиеся эндонуклеазы), способных на сайт-специфическое разрезание ДНК и на взаимодействие с последовательностью интрона. Вставив сначала требуемые последовательности в интрон, исследователи могли включить выбранную генетическую информацию в геном на участках, узнаваемых самонаводящейся эндонуклеазой (24, 25). Примерно в то же время, первые доклады о «цинковом пальце»-опосредованном связывании с ДНК (26, 27) привели к созданию модульных (состоящих из заменяемых частей) белков со способностью к распознаванию ДНК, которые, в сочетании с доменом последовательность-независимой рестриктазы FokI, могут функционировать как сайт-специфические нуклеазы (28). Первоначально разработанные для распознавания последовательности в хромосоме, такие нуклеазы типа «цинковый палец» (ZFNs) оказались эффективными в стимулировании изменений в последовательности генома клеток дрозофил и млекопитающих (29, 30). И хотя ZFNs являются эффективными реагентами для редактирования генома в некоторых экспериментах, они не получили широкого распространения из-за трудностей в создании и валидации таких белков для конкретного интересующего локуса ДНК. Таким образом, область биоинженерии начала заполняться первыми сообщениями о наличии эффекторов, подобных активаторам транскрипции (TAL), которые встречаются в природе у бактерий, заражающих растения. В дальнейшем это позволило достаточно быстро создать FokI-связанные версии, которые могли бы быть использованы аналогично ZFNs для сайт-направленного редактирования генома (31-33). Такие TAL эффекторные нуклеазы (эффекторные нуклеазы, подобные активаторам транскрипции) (TALENs) были проще в изготовлении и валидации, (документированной процедуры, дающая высокую степень уверенности в том, что конкретный процесс, метод или система будет последовательно приводить к результатам, отвечающим заранее установленным критериям приемлемости (в производстве медицинских препаратов является одним из требований практики правильного (качественного) производства — прим. пер.), чем ZFNs, и, как следствие, создавали впечатление о возможности легкого, быстрого и дешевого редактирования генома. Но трудности проектирования структуры белка, синтеза и валидации остаются препятствием для широкого внедрения этих сконструированных нуклеаз для повседневного использования.
История и биология систем CRISPR-Cas
В параллельной, но совершенно отдельный области исследований, в нескольких лабораториях микробиологии и биоинформатики в середине 2000-х годов начали изучать CRISPRs (Короткие палиндромные повторы, регулярно расположенные группами), описанные в 1987 году японскими исследователями, как серии коротких прямых повторов, расположенных между короткими последовательностями в геноме кишечной палочки (34) (рис. 1). Позднее CRISPRs были обнаружены у многих бактерий и архей (35), и примерно в то же время были сделаны прогнозы об их возможной роли в репарации ДНК или регуляции работы генов (36, 37). Ключевой момент наступил в 2005 году, когда в результате наблюдений выяснилось, что многие разделительные последовательности (спейсеры) в пределах CRISPRs происходят из плазмид или имеют вирусное происхождение(38-40). Вместе с открытием, что CRISPR локусы транскрибируются (41) и наблюдением того, что cas (CRISPR- ассоциированные) гены кодируют белки с предполагаемыми нуклеазными и геликазными доменами (38, 40, 42, 43), было выдвинуто предположение о том, что CRISPR-Cas является системой приобретённой защиты, которая может использовать антисмысловые РНК, как «память» о прошлых вторжениях (44). В 2007 году было предоставлено первое экспериментальное доказательство CRISPR-Cas-опосредованного адаптивного иммунитета в эксперименте с инфицированием литическими фагами молочнокислой бактерии Streptococcus thermophilus (45). Это открытие привело к идее о том, что природные CRISPR-Cas системы, существующие в культуре бактерий, используемых в молочной промышленности, могут быть использованы для иммунизации против фагов — первого успешного применения CRISPR-Cas для биотехнологических целей (46). В 2008 году было показано, что зрелые CRISPR РНК (crRNAs) служат в качестве гида (направляющей последовательности) в комплексе с белками Cas для противостояния распространению вируса в E.coli (47). В том же году, ДНК-направленная активность системы CRISPR-Cas была обнаружена в патогенном штамме Staphylococcus epidermidis (48).
Функциональные CRISPR-Cas локусы состоят из CRISPR кассеты, состоящей из одинаковых повторов со вставленным между ними спейсерами, которые направленно взаимодействуют с чужеродной ДНК и кодируют компоненты crRNA и из оперона генов cas, кодирующих компоненты Cas белка. В природе, вирусы могут быть соотнесены с их хозяином бактерией или археей с помощью анализа CRISPR спейсеров (49, 50). Эти исследования показали, что вирусы постоянно видоизменяются, чтобы уклониться от CRISPR-опосредованного ослабления.
Формирование приобретенного иммунитета происходит в три стадии [для недавних обзоров см. (51-53)]: (i) вставка короткой последовательности чужеродной ДНК в CRISPR кассету; (ii) транскрипция пре-crРНК (полиспейсерный предшественник CRISPR-РНК), которая проходит созревание, чтобы образовать отдельно взятые crRNAs, каждая из которых состоит из части-повтора и части-спейсера, направленного на чужеродную ДНК; (iii) crRNA-направленное разрезание чужеродной нуклеиновой кислоты с помощью Cas белков в сайтах, комплементарных последовательности спейсера crRNA (протоспейсеры). В рамках этой общей темы, три типа CRISPR-Cas системы (I, II и III) используют прямые молекулярные механизмы, чтобы достичь узнавания нуклеиновой кислоты и её разрезания (54,55). Мотив, прилежащий к протоспейсеру (The protospacer adjacent motif (PAM))- это короткий мотив, соседствующий с последовательностью чужеродной ДНК, на которую направленно воздействует crRNA, играет важную роль в стадиях адаптации (узнавании и присоединении) и интерференции в системах I и II типа (39, 56-58). Системы I и III-го типов используют большой комплекс Cas протеинов для crRNA-направленного таргетинга (47, 59-63). В то время как система II-го типа нуждается лишь в одном белке для РНК-направленного узнавания и разрезания ДНК (64,65), и именно это свойство оказалось чрезвычайно полезным для манипуляций в геномной инженерии (смотри ниже).
Рис. 1. Хронология научных исследований в области биологии CRISPR-CAS и геномной инженерии. Здесь показаны лишь основные события в обеих областях. Эти две области объединились в 2012 году в связи с открытием того, что белок Cas9 является РНК-программируемой эндонуклеазой ДНК. В конечном итоге привело к тому, что, начиная с 2013 года, огромное количество работ было опубликовано, в которых Cas9 был использован для модификации генов в клетках человека, а также в других типах клеток и организмов. Изображение: журнал Science.
Функциональность CRISPR-Cas9
Первоначально биоинформатические анализы определили Cas9 (ранее COG3513, Csx12, Cas5 или Csn1), как огромный многофункциональный белок (36) с двумя предполагаемыми нуклеазными доменами, HNH (38, 43, 44) и RuvC-подобным (44). Дальнейшие генетические исследования показали, что Cas9 S.thermophilus крайне необходим для защиты против вирусной инвазии (45,66), и также может быть ответственен за двухцепочечные разрывы в проникших в клетку плазмидах и фагах (67). Также Cas9 позволяет in vivo таргетинг умеренных фагов и плазмид в бактерии (66,68), и требует наличия HNH и RuvC доменов, чтобы препятствовать эффективной трансформации плазмиды (68).
В 2011 году (66) исследования показали, что транс-активирующая crRNA — маленькая РНК, которая транс-закодирована перед локусом CRISPR-Cas типа II в геноме Streptococcus pyogenes – оказалась необходимой для созревания crRNA РНКазой III и белком Cas9, и, как выяснилось, tracrRNA — опосредованное активирование созревания crRNA обеспечивает последовательность-специфичный иммунитет против геномов паразитов. В 2012 году (64), было показано, что белок CRISPR-Cas9 штамма S.pyogenes является двойной-РНК-направляемой эндонуклеазой ДНК, который использует дуплекс tracrRNA:crRNA (66), чтобы обеспечить направленное разрезание ДНК (64) (рис.2). Cas9 использует свой HNH домен для разрезания нити ДНК, комплементарной 20-нуклеотидной последовательности crRNA; RuvC-подобный домен Cas9 разрезает нить ДНК напротив комплементарной цепочки (противоположную цепочку, некомплементарную crRNA- прим. переводчика) (64,65) (рис.2). Мутация в любом из двух доменов в Cas9 создает вариант белка с функцией одноцепочечного разрезания ДНК (никаза). В свою очередь, мутация в обоих доменах (dCas9; Asp10 →Ala, His840→Ala) создает РНК-направляемый белок, связывающийся с ДНК (64,65). Узнавание ДНК-мишени требует и спаривания оснований с последовательностью crRNA, и присутствия короткой последовательности (PAM), прилежащей к последовательности-мишени в ДНК (64,65) (рис.2).
Двойная tracrRNA:crRNA была сконструирована как химерная одиночная направляющая РНК (sgRNA), сохраняющая в себе две важнейшие характеристики: 20-нуклеотидную последовательность на 5’ конце sgRNA, которая определяет сайт-мишень на ДНК по принципу комплементарности, и двухцепочечную структуру (шпильку) на 3’ конце направляющей последовательности, связывающаяся с Cas9 (64) (рис.2). Эта разработка привела к созданию простой двухкомпонентной системы, в которой изменения в направляющей последовательности (20 нуклеотидов в исходной РНК) sgRNA могут быть использованы для направленного воздействия на любую интересующую ДНК последовательность до тех пор, пока она соседствует с PAM (64). В отличие от ZFNs и TALENs, которые требуют существенных изменений в белке для каждого сайта-мишени ДНК, CRISPR-Cas9 система требует только изменения в последовательности направляющей РНК. Поэтому CRISPR-Cas9 технология, использующая систему S.pyogenes, была очень быстро и повсеместно принята научным обществом для таргетинга, редактирования и модифицирования геномов большого спектра клеток и организмов. Филогенетические исследования (69-71), также как и эксперименты in vivo и in vitro (64,71,72), показали, что природные ортологи Cas9, из-за определенной специфичности Cas9 к дуплексам РНК (69-71), используют различные tracrRNA:crRNA транскрипты, как направляющую последовательность (рис.3). Описанная коллекция Cas9 ортологов содержит в себе огромный источник CRISPR-Cas9 систем для множественного таргетинга генов, и несколько ортологичных CRISPR-Cas9 систем уже были применены для успешного редактирования генома в человеческих клетках [Neisseria meningitidis (73, 74), S. thermophilus (73, 75), и Treponema denticola (73)].
Хотя акроним CRISPR и привлек внимание СМИ и теперь широко используется в научной и массовой литературе, почти все приемы редактирования генома основываются на применении белка Cas9 вместе с подходящими sgRNA. Как описывалось выше, CRISPR относится к повторяющейся природе повторов в CRISPR- кассете, которые кодируют crRNAs, и сам термин «CRISPR» не относится непосредственно к геномной инженерии. Тем не менее, мы предпочитаем использовать обозначение «CRISPR-Cas9» именно таким образом, несмотря на то, что использование этого термина является менее строгим, по сравнению с другими терминами, используемыми в этой области (76).
Механизм CRISPR-Cas9- опосредованного таргетинга генома
Структурный анализ белка Cas9 S.pyogenes выявил дополнительные сведения о механизме работы CRISPR-Cas9 (рис.3). Молекулярные структуры Cas9, установленные с помощью электронной микроскопии и рентгеновской кристаллографии, показали, что белок подвергается сильной конформационной перегруппировке непосредственно после связывания с направляющей РНК, а также дальнейшим изменениям при ассоциации с целевой двунитевой ДНК (дцДНК). Это изменение создает канал, находящийся между двумя структурными долями белка, который связывается с РНК-ДНК гибридом, и соосно упакованной двойной направляющей РНК структуре, соответствующей взаимодействию crRNA повтор- tracrRNA антиповтор (77,78). Богатая аргинином альфа спираль (77-79), соединяющая две структурные доли Cas9 играет ключевую роль в связывании с направляющая-РНК – ДНК-мишень гибридом, как было показано при помощи мутагенеза (77,78) и также, вероятно, является «шарниром» между ними. Конформационное изменение в Cas9 может быть частью механизма раскручивания двухцепочечной ДНК-мишени и направлять интерференцию РНК, но эту теорию еще предстоит проверить. Исследования также показали, что РАМ является ключевым элементом для первоначального связывания с ДНК; при отсутствии РАМ последовательности-мишени не распознаются Cas9, даже если они полностью комплементарны последовательности направляющей РНК (80). Кристаллическая структура Cas9 в комплексе с направляющей РНК и частично с двухцепочечной ДНК-мишенью показывает, что РАМ находится в пределах ДНК (неспаренной с РНК-гидом — прим. переводчика) (81). Аргининовые мотивы в С-концевом домене Cas9 взаимодействуют с PAM на некомплементарной цепочке внутри большой бороздки. Фосфодиэфирная группа в положении +1 в цепочке ДНК-мишени взаимодействует с малой бороздкой дуплексной PAM, что, вероятно, может привести к локальному расхождению цепей, так называемой R-петли, непосредственно перед PAM (81). Эксперименты с одиночной молекулой также показывают, что на скорость образования R-петли влияет, прежде всего, PAM, в то время как стабильность R-петли в основном зависит от элементов протоспейсера дистальных к PAM (82).
Вместе с одно молекулярными и объемными биохимическими экспериментами с использованием мутантных ДНК-мишеней, предполагаемый механизм основывается на том, что плавление ДНК-мишени начинается на уровне распознавания PAM, в результате чего происходит направленное формирование R-петли, расширяющейся по направлению к дистальному концу протоспейсера,что сопутствует интерференции цепи РНК и образованию РНК-ДНК гибрида (80-82).
Для того, чтобы оценить поведение Cas9 при связывании с мишенью в клетках, исследователи использовали иммунопреципитацию хроматина и высокопроизводительное секвенирование (ChIP-seq), с целью определения количества и типов сайтов связывания Cas9 в хромосоме. Результаты показали, что в клетках эмбриональной почки человека (HEK293) (83), и в мышиных эмбриональных стволовых клетках (mESCs) (84), количество сайтов связывания каталитически неактивной версии Cas9 превосходило количество сайтов, которые соответствовали последовательности sgRNA, используемой в каждом случае. Такие off-target (мимо, промах) взаимодействия с ДНК, происходившие, как правило, на участках, несущих PAM и частично комплементарную направляющей РНК последовательность, согласуются с установленными режимами узнавания ДНК Cas9 (80). Активные Cas9 редко разрезают ДНК в off-target сайтах связывания, что свидетельствует о несвязанности друг с другом событий связывания с ДНК и ее разрезания, в которых необходима почти идеальная комплементарность между направляющей РНК и сайтом-мишенью для эффективного разрезания ДНК. Эти наблюдения согласуются с результатами, полученными для Cas9-РНК-направляемых комплексов в экспериментах с одной молекулой (80). Более того, события связывания Cas9 происходят чаще в районах деконденсированного хроматина по сравнению с областями компактного, транскрипционно- неактивного хроматина.
Тем не менее, поскольку метод включает в себя кросс-линкинг (связывание, сшивание) клеток на ~ 10 мин перед гашением реакции, то становится трудно различить кратковременные и продолжительные связывающие взаимодействия. Вполне возможно, что многие из кажущихся off-target взаимодействий ДНК на самом деле отражают кратковременные контакты, которые обычно не вызывают интерференцию направляющей РНК.
 Рис. 2. Биология системы CRISPR-Cas типа II-A. Данный рисунок иллюстрирует систему типа II-A штамма S.pyogenes. (А) оперон гена cas вместе с tracrRNA и CRISPR кассетой. (B) Естественный путь противовирусной защиты включает в себя несколько стадий: 1) ассоциацию белка Cas9 с антипараллельным РНК-дуплексом (tracrRNA:crRNA) 2) совместный процессинг нескольких РНК дуплексов РНКазой III 3) от получившихся обрезков отрезаются еще кусочки, в результате чего и получается полностью созревшая crРНК. 4) формирование R-петли 5) разрезание ДНК-мишени (C ) подробное рассмотрение механизма природного разрезания ДНК с помощью дуплекса tracrRNA:crRNA. Изображение: журнал Science.
Рис. 2. Биология системы CRISPR-Cas типа II-A. Данный рисунок иллюстрирует систему типа II-A штамма S.pyogenes. (А) оперон гена cas вместе с tracrRNA и CRISPR кассетой. (B) Естественный путь противовирусной защиты включает в себя несколько стадий: 1) ассоциацию белка Cas9 с антипараллельным РНК-дуплексом (tracrRNA:crRNA) 2) совместный процессинг нескольких РНК дуплексов РНКазой III 3) от получившихся обрезков отрезаются еще кусочки, в результате чего и получается полностью созревшая crРНК. 4) формирование R-петли 5) разрезание ДНК-мишени (C ) подробное рассмотрение механизма природного разрезания ДНК с помощью дуплекса tracrRNA:crRNA. Изображение: журнал Science.
Конструируя клетки и организмы – модели
Проведенные в январе 2013 года, после публикации в 2012 году Jinek и коллегами (64), три исследования показали, что CRISPR-Cas9 является эффективным инструментом в редактировании генома человеческих клеток (75,85,86). «Очеловеченные» версии белка Cas9 штамма S.pyogenes (75,85,86) и белка Cas9 штамма S.thermophilus (75) были совместно экспрессированы со специально разработанными sgRNAs или вместе с молекулой tracrRNA, коэкспрессированной со специально разработанными crRNAs (75).
Эти процессы прошли успешно не только в клетках человеческой эмбриональной почки, клетках хронического миелолейкоза, или в индуцированных плюрипотентных стволовых клетках (75,85,86), но и в клетках мыши (75). Наблюдались ожидаемые изменения в целевой ДНК, которые указывали на то, что сайт-специфичные двухцепочечные разрывы с помощью РНК-направляемого Cas9 стимулировали редактирование гена при помощи негомологичного соединения концов (при репарации ДНК) (nonhomologous end joining repair (NHEJ)) или замену гена при помощи направляемой гомологией репарации (homology-directed repair (HDR)) (рис.4). Также был успешно достигнут таргетинг с помощью большого количества sgRNAs – именуемый мультиплексинг (75,86). В настоящее время РНК-программируемое Cas9 S.pyogenes— опосредованное редактирование применяется в различных человеческих клетках и эмбриональных стволовых клетках [(87-90); для ознакомления, см. (91-93)]. Некоторые исследования показывают, что эффективность CRISPR-Cas9-опосредованного редактирования, может достигнуть 80% и более, что выше , чем и у ZFNs или TALENs, даже не смотря на то, что прямое сравнение эффективности этих методов осложняется различием в сайтах-мишенях и уровне экспрессии белка (89,94).
Эти исследования были только началом того, что в итоге стало невероятно быстро развивающейся по всему миру областью, в которой лаборатории использовали CRISPR-Cas9, чтобы редактировать геномы широкого спектра типов клеток и организмов (обобщено в рис.5). На момент написания этой статьи, уже издано более 1000 работ , которые включали в себя акроним CRISPR в заголовке или в выдержке, причем большинство из них публиковались только с начала 2013. Большинство вариантов применения этой технологии уже обсуждались в недавних обзорных статьях (91-93). Здесь мы выделяем всего несколько примеров, которые показывают всю мощь этой технологии (рис.6).
Во-первых, это очень точное воспроизведение опухоль-ассоциированных хромосомных транслокаций, которые происходят во время канцерогенеза с помощью незаконного негомологичного соединения двух хромосом. Способность CRISPR-Cas9 производить двухцепочечные разрывы в определенных местах сделала возможным создании линий человеческих клеток и первичных клеток, носящих в себе такие же хромосомные транслокации, как и в клетках рака легких (95), острой миелоидной лейкемии и саркомы Юинга (96,97). Недавно опубликован метод создания моделей рака печени или злокачественной миеломы у мышей при помощи CRISPR-Cas9 (98,99). Таким образом, CRISPR-Cas9 предоставляет нам надежную технологию для изучения геномных перестроек, а так же патогенеза рака или других болезней.
Во-вторых, это систематический анализ функций генов в клетках млекопитающих. Библиотека лентивирусных sgRNA для всего генома была разработана, чтобы создать общий подход генетического скрининга «потери функции», удобный как для позитивного, так и для негативного отбора (100,101). Этот подход был также использован для определения генов, необходимых для жизнеспособности клеток рака и плюрипотентных стволовых клеток (102). И хотя уже пытались проводить аналогичные исследования, используя РНК-интерференцию (RNAi), чтобы уменьшить экспрессию генов, но такой метод не позволяет нокаутировать гены и характеризуется существенными off-target эффектами. Использование CRISPR-Cas9 для полногеномного исследования предоставит возможность полномасштабного скрининга мишеней для лекарственных препаратов и других фенотипов и, таким образом, повысится практическая польза и увеличится само число видов генетических скриннингов человека и других немодельных клеток и организмов.
![Cas9 направляемый (слева) Cas9 направляемый Дуплексом crRNA:tracrRNA одиночной направляющей РНК Linker loop- соединяющая петля (справа) Эволюция и структура Cas9. Структура Cas9 штамма S.pyogenes в лиганд-независимой форме и в форме связанных РНК и ДНК [из (77, 81)].](http://medach.pro/wp-content/uploads/2015/06/4U4y01fKtrk.jpg)
Рис. 3. Cas9 направляемый
(слева)
Cas9 направляемый
Дуплексом crRNA:tracrRNA одиночной направляющей РНК
Linker loop- соединяющая петля
(справа)
Эволюция и структура Cas9. Структура Cas9 штамма S.pyogenes в лиганд-независимой форме и в форме связанных РНК и ДНК [из (77, 81)]. Изображение: журнал Science.
Другими подходящими примерами применения CRISPR-Cas9, имеющих отношение к человеческому здоровью, является корректировка генетических мутаций, ответственных за наследственные заболевания. Успешно была исправлена доминантная мутация у мышей в гене Crygc, вызывающая катаракту (103). CFTR локус (Трансмембранный регулятор муковисцидоза) был исправлен при помощи гомологичной рекомбинации в культивированных первично взрослых кишечных стволовых клетках, полученных от пациентов с муковисцидозом. В результате чего произошло, увеличение колонии органоподобных клеточных культур- органоидов (органоиды – функциональные многоклеточные образования с исправленным геномом, аутологичные по отношению к донору клеток, которые могут быть введены обратно в организм больного – прим.пер.), несущих нужное генетическое изменение (104). Эти исследования подчеркивают потенциал этой технологии, которая может использоваться для генной терапии человека при лечении генетических заболеваний.
Последним примером системы CRISPR-Cas9, как технологии геномной инженерии, является применение на растениях и грибах. С момента демонстрации её в качестве инструмента для редактирования генома на Arabidopsis thaliana и Nicotiana benthamiana (105, 106), было показано редактирование генома культурных растений, в том числе, риса, пшеницы и сорго, а также сладкого апельсина и печеночника (107-111). Эта технология обещает изменить темп и направление сельскохозяйственных исследований. Например, в недавнем исследовании риса обнаружили, что гены-мишени были отредактированы в почти 50% клеток зародыша, получивших конструкции Cas9-направляющая-РНК и редактирование произошло до деления первой клетки (112). Кроме того, эти генетические изменения были переданы следующему поколению растений без новой мутации или реверсной мутации, а секвенирование всего генома не выявило существенного off-target редактирования. Такие данные позволяют предположить, что модификация геномов растений для обеспечения защиты от болезней и устойчивости к вредителям, может быть гораздо проще, чем это было в случае с другими технологиями. Регулирующее значение технологии CRISPR-Cas9 для использования в растениях пока еще не совсем ясно, и, безусловно, зависит от типа мутации (ий), которую (ые) нужно будет ввести.
В целом, отсутствие эффективных, недорогих, быстро создаваемых и простых в использовании, точных генетических инструментов, так же было ограничивающим фактором при анализе функций генов у модельных организмов в биологии развития и регенеративной биологии. Геномная инженерия, с помощью технологии CRISPR-Cas9 , дает возможность делать эффективные направленные геномные модификации зародышевой линии в таких модельных организмах, как мухи дрозофилы (113,114), рыба-зебра (94,115), круглые черви (116), саламандры (117) и лягушки (118,119). Эта технология также может облегчить создание более подходящих для фармакологических исследований и понимания человеческих болезней моделей таких организмов, как мыши (120-122) и крысы (123,124), а также свиньи (125) и обезьяны (126). В общем и целом, CRISPR-Cas9 уже оказывает серьезное влияние на функциональные геномные эксперименты, которые могут быть проведены в этих модельных организмах, и с помощью которых мы продвинемся в области экспериментальной биологии способами, нереальными еще пару лет назад.
 Рис. 4.
Рис. 4.
CRISPR-Cas9 как инструмент геномной инженерии
А) Различные варианты внесения тупых двухцепочечных разрывов ДНК в локусах генома, которые в дальнейшем будут объектом эндогенной репарации ДНК, катализируещей либо негомологичное сшивание концов (NHEJ), либо гомологическую репарацию (HDR).
В) Cas9 может работать, как никаза (nCas9), при условии, что один из ее активных доменов инактивирован. Когда nCas9 используется с двумя sgRNAs, которые распознают различные сайты в ДНК-мишени, то происходит смещенный двухцепочечный разрыв
С) Cas9 может функционировать, как РНК-направляемый связывающийся с ДНК белок, но только если был модифицирован таким образом, что оба его активных домена окажутся инактивированными. Такая каталитически неактивная форма или «мертвая» (dCas9- от англ. dead- мертвый — прим. Пер.) может быть использована, как медиатор увеличения или уменьшения транскрипционной активности, особенно если dCas9 сплавлен с эффекторным доменом (активатором или репрессором). Кроме того, dCas9 может быть сплавлен с флуорисцентными доменами, такими как, например, зеленый флуорисцентный белок (green fluorescent protein- GFP), для визуализации локусов в хромосомах в живых клетках. Если же dCas9 сплавить с другими доменами, такими как хроматин или ДНК модифицирующие домены, то можно получить инструмент для направленных эпигенетических изменений в геномной ДНК. Изображение: журнал Science.
Развитие этой технологии в будущем
Ключевым достоинством Cas9 является его способность связываться с сайтами, которые определены последовательностью направляющей РНК и РАМ, что дает возможность применения за пределами длительной модификации (модификация, вызываемая факторами среды и способная сохраняться на протяжении ряда поколений, через определенный промежуток времени организм возвращается к исходному признаку; Д. м. связана с воспроизводящимися в ряду клеточных поколений изменениями цитоплазмы, что сближает её с материнским эффектом, и возникает, как правило, при вегетативном или партеногенетическом размножении — прим. пер.). В частности, каталитически инактивированная версия Cas9 (dCas9) была многократно использована для направленной регуляции генов в масштабе всего генома. Упомянутая выше CRISPR интерференция (CRISPRi), показала, что может блокировать элонгацию в процессе транскрипции, связывание РНК полимеразы или связывание транскрипционных факторов, в зависимости от сайта (ов), узнаваемых комплексом dCas9-направляющая РНК. Впервые примененная интерференция на E.coli, секвенирование всего генома не обнаружило каких либо off-target эффектов (127). CRISPRi использовалась для одновременной репрессии нескольких генов, и эффекты этой интерференции оказались обратимого характера (127-130).
Как было отмечено у бактерий, сайт (ы) регулирования были распознаны только коэкспрессированной (ыми) направляющей (ими) РНК для dCas9. Анализ последовательности РНК показал, что CRISPRi- направленная репрессия транскрипции является высокоспецифичной. В более широком смысле, эти результаты показали, что dCas9 может быть использован в качестве модульной и гибкой ДНК-связывающейся платформы для накопления белков способных направленно воздействовать на последовательность ДНК-мишени. Это закладывает основу для будущих экспериментов, включающих скрининг всего генома, схожий с таковым который использовался с РНК-интерференцией. Отсутствие систем CRISPR-Cas у эукариот является важным преимуществом CRISPRi над РНК-интерференцей в различных областях применения, в которых конкуренция с эндогенными путями является проблематичной. Например, использование РНК-интерференции для сайелинсинга генов, которые сами являются частью пути РНК-интерференции (белки Dicer, Argonaute), может привести к тому, что результаты будет трудно интерпретировать из-за большого количества прямых и косвенных эффектов. Кроме того, любые РНК, которые используется для сайеленсинга определенных генов, могут конкурировать в клетке с эндогенной РНК-опосредованной регуляцией генов. CRISPR- Cas9 предоставляет большую универсальность в осваиваемых альтернативах благодаря своей способности постоянно менять генетический код и усиливать или уменьшать экспрессию гена на транскрипционном или посттранскрипционном уровнях. В то же время, РНК-интерференция ограничивается лишь «нокаутированием» генов. Хотя технология РНК-интерференции и улучшается с годами, неполное «нокаутирование» генов и непредсказуемое off-target взаимодействие до сих пор являются уязвимым местом этой технологии. Именно поэтому, сравнительные анализы двух данных технологий должны обратить свое внимание на превосходство технологии CRISPRi над RNAi именно в этих аспектах. Стало возможным использовать CRISPRi для эффективной регуляции генов в клетках млекопитающих с помощью созданной химерной версии dCas9, связанных с регуляторными доменами. В частности, связывание dCas9 с эффекторными доменами (в том числе с VP64 и KRAB) сделало возможным стабильную и эффективную активацию или репрессию транскрипции в клетках человека и дрожжей, соответственно (129).
Программируемая связывающая способность dCas9 может быть использована для визуализации специфических локусов в живых клетках. С помощью усовершенствованного зеленым флуорисцентным белком dCas9 и структурно оптимизированной sgRNA были получены изображения повторяющихся и неповторяющихся элементов в теломерах и кодирующих генах в живых клетках (131). Эта CRISPR визуализация потенциально может улучшить существующие технологии для изучения конформационной динамики хромосом в живых клетках, особенно если будет разработана технология много цветовой визуализации при помощи большого числа различных Cas9 белков.
Новые технологии, направленные на разрушение провирусов, могут быть использованы для элиминирования вирусного генома у инфицированных индивидов и, как следствие, несущих инфекцию. Привлекательность этого подхода состоит в том, что в нем используется основная функция CRISPR-Cas9, а именно — адаптивный иммунитет у бактерий. Направленный метод CRISPR-Cas9 показала, что может эффективно разрезать и видоизменять (мутировать) длинные концевые повторы HIV-1, а также удалять вирусные гены из хромосом инфицированных клеток (132,133).
Рисунок 5
Примеры типов клеток и организмов, которые были модифицированы с помощью Cas9
| Биология |
Биотехнология |
Биомедицина |
| Клеточные линии |
Модельные организмы |
Сельско-хозяйственные культуры |
Грибы |
- Органоиды
- hESCs
- iPSCs (ИПСК)
|
- HEK293
- U2OS
- K562
|
- Мыши
- Крысы
- Дрозофилы
- Круглые черви
- Arabidopsis
- Саламандры
- Лягушки
- Обезьяны
|
- Рис
- Пшеница
- Сорго
- Табак
|
- Kluyveromyces
- Chlamydomonas
|
CRISPR-Cas9 является перспективной технологией в области геномной инженерии и синтетической биологии. Был разработан множественный (мультиплексный) CRISPR -подход, чтобы облегчить направляемую эволюцию биомолекул, именуемый CRISPRm (134). CRISPRm заключается в оптимизации системы CRISPR-Cas9 для усиления самосборки генов, а также для вставки из ДНК -библиотеки в геном грибов. Этот процесс дает возможность увеличить активность биомолекул. Кроме того, стало возможным заставить Cas9 связываться с одноцепочечной РНК при помощи коротких ДНК олигонуклеотидов, которые можно менять, содержащих РАМ последовательность (РАМмеры). Этот метод используется для активации фермента и предлагает новые методы для таргетинга транскриптов без предварительного афинногого мечения (135).
Исследования показали, с какой эффективностью происходит таргетинг и разрезание РНК-программируемым белком Cas9 штамма S.pyogenes, а также уровень его специфичности с помощью наблюдения за уровнем off-site таргетинга (136-140). Off-site таргетинг определяется нечувствительностью Cas9 к несоответствиям в последовательности направляющей РНК и зависит от количества, позиции и разброса этих несовпадений во всей последовательности направляющей РНК (136-140) за пределами затравочной последовательности, определенной, как первые 8-12 нуклеотидов направляющей последовательности, проксимальной к РАМ (64) (рис.2). Количество экспрессируемого в клетке фермента Cas9- важный фактор в нечувствительности к несовпадениям (138). Как было показано, высокие концентрации фермента увеличивают количество off-site таргетинга, в то время как уменьшение концентрации ведет к увеличению специфичности, но опять же, понижает активность разрезания мишени (137). Несколько групп разработали алгоритм, который может выдать последовательность оптимальной sgRNA с минимальными off-target эффектами (например, http://tools.genome-engineering.org, http://zifit.partners.org, и www.e-crisp.org) (141–145). Развитие альтернативных технологий для полногеномного редактирования привед к тому, что также будут рассмотрены другие особенности этой реакции, такие как термодинамические свойства sgRNA, которые позволят в дальнейшем повысить специфичность каждой конструкции.
Ряд исследований технологии CRISPR-Cas9 относятся к особенностям ДНК таргетинга (рис.4): подход, заключающийся в двойном никовании (внесении одно цепочечного разрыва в ДНК — прим. пер.), состоит в использовании никазных вариантов Cas9 с двумя смещенными друг относительно друга sgRNAs, правильно расположенными на ДНК-мишени (146-148); sgRNA-направляемый белок dCas9, сплавленный с нуклеазой FokI, в котором два сплавленных dCas9-FokI мономера могут одновременно связываться с сайтами-мишенями на заранее определённом расстоянии друг от друга (149,150); короткие sgRNAs, усеченные на два или три нуклеотида на дистальном конце относительно РАМ, могут быть использованы с технологией «двойного никования» для дальнейшего уменьшения off-target активности (151). Первые два метода основываются на димеризации Cas9, схожей с таковой у сконструированных димеров ZFNs и TALENs, но с упором на то, что два соседствующих off-target связывания с последующим разрезанием произойдут с меньшей вероятностью, чем одно off-target разрезание (146-150). Недавно открытый метод основывается на утверждении, согласно которому, нуклеотиды на 5’-конце sgRNAs не являются обязательными для ее полной активности; однако, эти нуклеотиды могут скорректировать несоответствия в других позициях вдоль комплекса направляющая РНК-ДНК-мишень, и, таким образом, укороченные sgRNAs могут быть более специфичны (151). В будущем, исследования сфокусируются на дальнейшем развитии точности этой технологии, а также на увеличении частоты гомологической репарации относительно негомологичного соединения концов, чтобы способствовать сайт-специфической вставки новой генетической информации.

Рис. 6.
Будущие применения в биотехнологии и биомедицине. Изображение: журнал Science.
|
Будущее CRISPR-Cas9-опосредованной геномной инженерии
|
| Генная терапия человека |
Сельское хозяйство: растения, животные |
Синтетическая биология; изменение путей выработки определенных веществ |
Программируемый—РНК таргетинг |
Нокаутирование вирусных и патогенных
генов |
Экологический контроль за переносчиками заболеваний (стерилизация комаров) |
Скриннинги для
идентификацией мишеней для лекарств |
Выводы и перспективы
Наше понимание нормальной физиологии, направленного развития геномов и болезней у высокоорганизованных организмов было затруднено недостатком подходящих инструментов для точной и эффективной генной инженерии. Простая двух компонентная система CRISPR-Cas9, использующая принцип комплементарности в узнавании последовательностей ДНК-мишени при помощи направляющей РНК, является универсальной технологией, которая стимулирует развитие инновационных применений в биологии. Понимание CRISPR-Cas9 системы на биохимическом и структурном уровне позволяет создать варианты белка Cas9 с меньшими размерами и увеличенной специфичностью. Например, кристаллическая структура меньшего белка Cas9 грибов Actinomyces является примером того, как природа создала усовершенствованный фермент, заложивший основы для будущих искусственно собранных вариантов Cas9 (77). Глубокий анализ большего числа естественно эволюционирующих бактериальных ферментов Cas9 может выявить ортологи с различной специфичностью к связыванию с ДНК, что в дальнейшем может расширить выбор РАМs, и, кончено же, откроет нам укороченные варианты, более подходящие для доставки в человеческие клетки.
Кроме того, конкретные методы доставки Cas9 и его направляющей РНК в клетки и ткани должны принести пользу генной терапии человека. Например, недавние эксперименты подтвердили, что комплекс Cas9-РНК может быть введен напрямую в клетки при помощи нуклеофекции (метод невирусной трансфекции клеточных линий, заключается в образовании пор в клеточной мембране с помощью электрических импульсов и последующего внедрения в клетку генетического материала, она же – электропорация — прим. пер.) и при помощи пронизывающих клетку пептидов для обеспечения быстрого и выверенного по времени редактирования (89,152), а также происходит проверка трансгенных организмов, экспрессирующих Cas9 с регулируемого промотора. Многообещающим предвестником всплеска будущих исследований в этой области является недавняя демонстрация того, как комплексы Cas9-направляющая РНК, введенные во взрослую мышь, показали высокий уровень редактирования в клетках печени, с целью облегчить течение генетического заболевания (153). Понимание того, с какой частотой происходят гомологические репарации после Cas9-опосредованного разрезания ДНК, даст ускорение развитию этой области, благодаря возможности эффективной вставки новых или исправленных последовательностей в клетки и организмы. В частности, стремительное развитие этой области повысило градус полемики вокруг коммерческого применения системы CRISPR-Cas9.
Эпоха непосредственного редактирования генома поднимает ряд этических вопросов, на которые необходимо ответить ученым и обществу в целом. Каким образом мы можем использовать этот мощный инструмент так, чтобы обеспечить максимальную выгоду при минимальных рисках? Крайне важным является то, что даже люди, не являющиеся учеными-биологами, понимают основы этой технологии, что упрощает её публичное обсуждение. Регулирующие органы также должны рассмотреть, как лучше развивать ответственное использование технологии CRISPR-Cas9 без вреда для исследований и разработок.
Открытие возможностей технологии CRISPR-Cas9 еще раз подчеркивает то, что огромное количество открытий, давших толчок развитию молекулярной биологии и медицины, проистекают из фундаментальных исследований механизмов репликации ДНК, репарации ДНК и защиты против вирусов. Технология CRISPR-Cas9 прошла через схожий путь: после того, как мы поняли механизм, лежащий в основе работы системы CRISPR-Cas9, это знание может быть использовано в молекулярной биологии и генетике там, где мы даже не могли предвидеть.
Оригинал статьи
Перевод: Станислав Груздев
Источник: medach.pro







![Cas9 направляемый (слева) Cas9 направляемый Дуплексом crRNA:tracrRNA одиночной направляющей РНК Linker loop- соединяющая петля (справа) Эволюция и структура Cas9. Структура Cas9 штамма S.pyogenes в лиганд-независимой форме и в форме связанных РНК и ДНК [из (77, 81)].](http://medach.pro/wp-content/uploads/2015/06/4U4y01fKtrk.jpg)