Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить

Кощей Бессмертный Пренебрежимостареющий.
Рождение, рост, старение, смерть — эту череду событий мы воспринимаем как абсолютно естественную и неизбежную как минимум для всех животных. Но параллельны ли их пути к конечной точке, и все ли ее достигают? Эти вопросы всегда интересовали философов и естествоиспытателей, однако решать их на научной платформе стало возможным совсем недавно: во-первых, биологическая методология подтянулась, во-вторых, длительные наблюдения за животными в защищенных условиях (лабораториях, зоопарках) и затерянных природных уголках начали давать результаты, ну и наконец, общественный запрос на продление активной жизни зазвучал громче. Рассмотрим, как изменились наши представления о старении, как пытаются объяснить старение и его пренебрежимость некоторые теории и почему человеку так необходимо «разбирать» до молекул нестареющих животных.
Организмы запрограммированы на
выживание, а отнюдь не на смерть...
Томас Кирквуд
Старение обычно определяют как закономерный процесс постепенного нарушения и потери важных функций организма, особенно — способности к размножению и регенерации. В результате снижается способность адаптироваться к условиям окружающей среды, противостоять хищникам и болезням. Однако исследования последних лет заставили усомниться в универсальности этого закона: похоже, он не действует в отношении ряда живых организмов (подробнее этот феномен, названный пренебрежимое, или незначительное, старение, и его счастливых «обладателей» рассмотрим в отдельной статье), да и со старением человека не всё так однозначно. Собственно, полного единомыслия по поводу причин, «целей» и механизмов старения не было раньше, нет и сейчас: существует множество теорий старения и подходов к его изучению на разных уровнях — эволюционном, популяционном, организменном, клеточном, молекулярном [1]. Одни из них рассматривают старение как запрограммированный, предопределенный процесс, «умышленно» (с точки зрения эволюционной целесообразности) работающий на расчистку пространства для новых поколений — то есть эволюционного пластилина, — другие — как квазипрограмму (имитацию программы, работающую «без злого умысла»), третьи — как стечение неблагоприятных обстоятельств, сбой в работе защитных систем, накопление всевозможных повреждений.
Организмы стареющий и старый — качественно разные? Феномен «поздней жизни»
До начала 90-х годов XX века и эволюционные биологи, и геронтологи считали, что старение (как и смертность) на популяционном уровне прогрессирует по экспоненте до смерти последней особи поколения — и это для животных универсально. То есть соответствует общепризнанному «закону смертности» Б. Гомпертца, почти два века утверждавшему, что вероятность многоплодного организма (а это большинство животных) умереть растет с годами по экспоненте. Отдельные сообщения о замедлении темпов смертности европейцев в преклонном возрасте объясняли успехами здравоохранения или снижением смертности от непостоянных причин типа войн и эпидемий [2].
Но в 1992-м сразу в двух исследованиях зафиксировали плато в позднем возрасте на кривой смертности мушек Ceratitis и Drosophila, которых нельзя было заподозрить в заботе о пожилых собратьях. Позже замедление темпов смертности вплоть до плато обнаружили у других стареющих организмов: дрожжей, нематод, ос — и в ряде работ подтвердили у человека*. Темпы старения в этот период, видимо, тоже пренебрежимо малы. Таким образом, в конце XX века проявилась условность закона Гомпертца: судя по всему, безоговорочно справедлив он лишь для животных среднего возраста. В период новорождённости на кривой смертности наблюдается пик (из-за незрелости иммунных механизмов, каннибализма и материнской халатности), а в позднем возрасте — плато (вероятность не дожить до следующего года высока, но уже не растет и даже немного снижается). Конечно, Гомпертц и предположить не мог никакие плато, ведь для их фиксации нужна большая выборка 100-летних людей — условие, невыполнимое для начала XIX века из-за высокой смертности от случайных причин — инфекций, конфликтов и т.п.
* — Справедливости ради стόит отметить, что серьёзное исследование, опубликованное в 2014 году, не обнаружило отклонений от модели Гомпертца (а именно — позднего плато на кривой смертности) у приличной выборки жителей США 80–106 лет. Вынести окончательный вердикт относительно траектории человеческой смертности крайне сложно, но в конце концов совершенствование систем учёта данных по долгожителям в разных уголках мира даст такую возможность.
Что же изменилось в понимании старения с 1992 года? Простую концепцию (постепенное накопление физиологических дефектов) потеснила более сложная и оттого не всеми принимаемая. Судя по всему, феномен позднего торможения старения — не популяционный артефакт, а закономерность, проявляющаяся на индивидуальном уровне (рис. 1). Не существует научных подтверждений тому, что любой физиологический износ, связанный со старением, неуклонно прогрессирует до самой смерти. Корифей эволюционной биологии старения Майкл Роуз и его многочисленные единомышленники считают, что старение не неизбежно накопительный и неукротимый процесс простого физиологического износа, а многогранный феномен, в котором физиологические изменения — как частное его проявление — направляются и сдерживаются диктатом адаптации (следовательно, естественным отбором). В рамках эволюционного подхода старение — это расстройство адаптации в первой половине зрелости. После завершения постепенного снижения силы естественного отбора (который по понятным причинам активен в репродуктивный период) старение прекращается, адаптивные возможности стабилизируются, хоть и на более низком уровне. Отбор безразличен к генетическим эффектам, проявляющимся в преклонном возрасте, поскольку они не влияли на благополучие популяции на протяжении ее эволюционной истории [2].

Рисунок 1. Долгожители, не желающие мириться с феноменом старения. а — Владимир Михайлович Зельдин, актёр, не покидающий театральную сцену и после векового юбилея. До сих пор в нём легко можно узнать карающего судью Уоргрейва из «Десяти негритят» (1987), а поднапрягшись — даже пастуха Мусаиба из «Свинарки и пастуха» (1941). б — Фауджа Сингх, марафонец, начавший бегать после 80. В 101 год он пронес по улицам Лондона олимпийский огонь, а в 103 успешно финишировал на Лондонском марафоне. Не знает равных (среди тех, кому за...) он и на 100-метровке. Нет, одного всё же знает: атлета Хидекичи Миядзаки (в), которому во время установления мирового рекорда было уже за 103, продолжает он это увлекательное занятие — ставить рекорды — и на 106-м году жизни. г — Йоханна Кваас, 89-летняя гимнастка из Германии. д — Лейла Денмарк, участница разработки вакцины от коклюша в 1920-1930 гг. Рассталась с педиатрической практикой в 103 года — подвело зрение.
Что касается генетических основ адаптации, то они, скорее всего, разнородны. Некоторые из них могут работать на поддержание жизни и продуктивности в позднем возрасте «случайно» — из-за независящих от возраста преимуществ. Роль здесь могут играть аллели, «выгодные» в репродуктивном возрасте и потому закрепляющиеся отбором, но по принципу множественного действия позитивно влияющие и на выживаемость в пострепродуктивном периоде (протагонистическая плейотропия, по ди Грею) [3]. А вот вносить вклад в старение может плейотропия антагонистическая (термин М. Роуза) — эффекты работы генов, обеспечивающих преимущества в период размножения, однако вредных после — для особи, но не вида. Подтвержденных примеров такой своеобразной расплаты за былой успех пока немного: у бактерий это сигма-фактор σ70, у эукариот — теломераза. Традиционно к ним относили и белок — супрессор опухолей p53, но в последнее время накопились данные о пользе p53-сигналинга в любом возрасте (см. главу «Долголетие короткоживущих»). С другой стороны, целая теория квазипрограммируемого старения — TOR-центрическая (от названия киназы target of rapamycin, FRAP1) — базируется на позитивной роли TOR-сигналинга в период развития организма и обратной его роли в будущем: когда компонентам тела расти уже не нужно, внутриклеточная гиперсигнализация в ответ на поступление пищи (инсулиновую и аминокислотную рецепцию) приводит к старению и повреждениям органов. Эффект антагонистической плейотропии здесь особенно отчетливо просматривается для мужчин [4]. Однако предложены и другие популяционно-генетические механизмы, объясняющие старение.
В свете новой концепции (или, точнее, нового понимания), рассматривающей старение как сложный комплекс адаптаций, физиология организма преклонного возраста должна прилично отличаться от физиологии организма стареющего. Это, безусловно, вносит трудности в дизайн исследований старения, однако пренебрегать особостью «поздней жизни», ответственной за плато на кривой смертности, непродуктивно. Ведь понимание механизмов, формирующих это плато у человека в районе 100 лет, а у некоторых животных в молодом возрасте (рис. 2), открывает перспективы для смещения точки торможения старения в период жизни, когда человек находится в оптимальной кондиции*. Есть мнение, что с характерной для десятилетнего человека вероятностью смерти мы могли бы доживать и до 1000 лет [5].
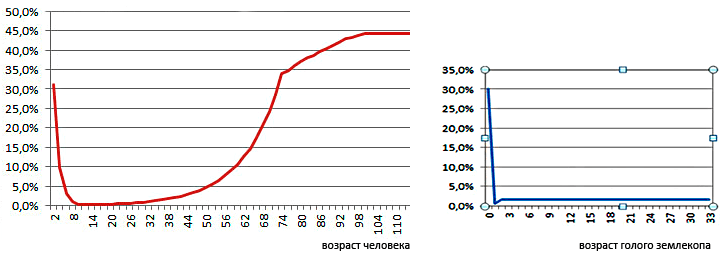
Рисунок 2. Иллюстративные кривые смертности человека (слева) и голого землекопа (справа). У человека вероятность умереть в течение года (отложена по оси ординат) растет после 30-40 лет экспоненциально, плато же, отражающее стабилизацию уровня смертности, наблюдается в крайне преклонном возрасте (ближе к 100 годам) — в отличие от грызуна Heterocephalus glaber (голого землекопа), живущего в 9 раз дольше мышей и крыс и стареющего незначительно. Кривая его смертности далека от экспоненты, что неудивительно — он вообще не знаком со старческими недугами «обычных» млекопитающих. Реальный график смертности американцев за 1999 год (с разделением на мужской и женский варианты) можно посмотреть на страничке www.azinet.com. Равная вероятность смертности в течение года у разных возрастных когорт голого землекопа обсуждается в статье [19]. Иллюстративные графики взяты с сайта nestarenie.ru (из лекционных материалов П. Федичева).
* - Официальная рекордсменка среди долгожителей — Жанна Луиза Кальма́н — умерла в возрасте 122 лет, и ее физическую форму в последние годы можно было назвать очень неплохой (рис. 3, слева), а интеллектуальную — просто прекрасной. До 100 лет она каталась на велосипеде, фехтовала и играла в теннис, балуясь парой сигарет в день и килограммчиком добротного шоколада в неделю. В некоторых интервью свое долголетие она связывала с тем, что всю жизнь тунеядствовала и занималась приятными вещами — игрой на фортепьяно и живописью. (Да и правда, ведь — ежедневная стирка нервов начальством на нелюбимой работе вряд ли продляет жизнь...)
Однако природа изредка «подкидывает» и более сложные для объяснения феномены, самостоятельно, без стараний ученых, смещая режим пренебрежимости старения на ранний возраст. К сожалению, стратегию и природа пока не доработала... Особенно показателен случай Брук Меган Гринберг, известной как «девушка, которая не стареет». Всю свою недолгую (20-летнюю) жизнь она страдала от тяжелых проявлений асинхронного замедления развития систем организма: единственное, что хоть как-то соответствовало ее хронологическому возрасту — это показатели системы «теломеры-теломераза». В 16 лет состояние ее зубов (молочных!) и костей соответствовало возрасту 8-10 лет, развитие структур мозга, эндокринные функции и антропометрические показатели — младенческому возрасту (рис. 3, справа), а элементы систем дыхания и пищеварения вообще не смогли развиться слаженно. Брук так и не научилась разговаривать и глотать пищу. Как бы то ни было, ее семья утверждает, что получила немало радости от общения с девочкой, а биологам представилась уникальная возможность установить механизмы старения обычных людей, разобравшись в причинах нестарения Брук [6]. Тщательные исследования ее генома никаких известных «профильных» мутаций не выявили, а недуг пока так и остался «синдромом X». Не меньше, чем возможность прояснения вечного вопроса о существовании программы старения (как неотъемлемой части программы развития), заинтриговал ученых и эпизод внезапного появления и спонтанного исчезновения у девочки опухоли головного мозга.
Очевидно, какие-то исследования можно продолжить и после смерти Брук в 2013-м из-за неполноценной работы бронхов. Тем более что в Калифорнийском университете работают еще с семью девочками (одной из них, правда, уже 25) с «синдромом X» разной «чистоты». Уже установлено, в частности, что эпигенетический возраст их крови вполне соответствует возрасту хронологическому (уровень метилирования ДНК пока считается самым надежным возрастным маркером). Возможно, это характерно не для всех их тканей, но как минимум одна всё же стареет [7].

Рисунок 3. Природа накладывает вето на возрастные изменения крайне непоследовательно. Слева — Жанна Кальмáн (1875-1997) празднует свой 117-й день рождения, держа в руке одну из последних в своей жизни сигарет (последних — не потому, что умерла, а потому, что бросила курить). Кого она только за 122 года не пережила — и всех близких родственников, и 22 главы государства французского... На 120-м юбилее Жанны один из журналистов спросил: «Мадам Кальман, увижу ли я вас на праздновании следующего вашего дня рождения?» На что получил ответ: «Почему бы и нет? Вы выглядите очень молодо». Справа — Брук Гринберг (1993-2013) на руках у младшей сестры. На верхней фотографии Брук 9 лет, сестре — 6; на нижней — Брук уже 16, а сестре — 13. В 17-летнем возрасте Брук весила 7 кг при росте 76 см, умственное развитие соответствовало возрасту 9–12 месяцев.
Старение клетки: за всё надо платить
Если рассматривать старение на клеточном уровне, особое развитие получили теории накопления повреждений. Изначально каждая из них претендовала на универсальность, сейчас же они неплохо ужились в рамках одной стройной концепции — сетевой. В комплекс повреждений, накапливающихся с годами, включают: свободнорадикальное окисление биомолекул, мутации хромосомной и митохондриальной ДНК, эпигенетические нарушения, неполадки в работе шаперонов и протеасом и вообще продукты «шума» (неточности) всех биологических процессов — от экспрессии генов до ферментативных реакций [8]. Таким образом, повреждения — это побочные продукты нормальной жизнедеятельности клетки, однако их спектр и количество у индивидуума не предопределены. Хотя все описанные повреждения приложимы к любой клетке, интенсивность их накопления может варьировать в зависимости от типа ткани и меняться во времени, причем накопление одних дефектов может запускать каскад других (рис. 4).
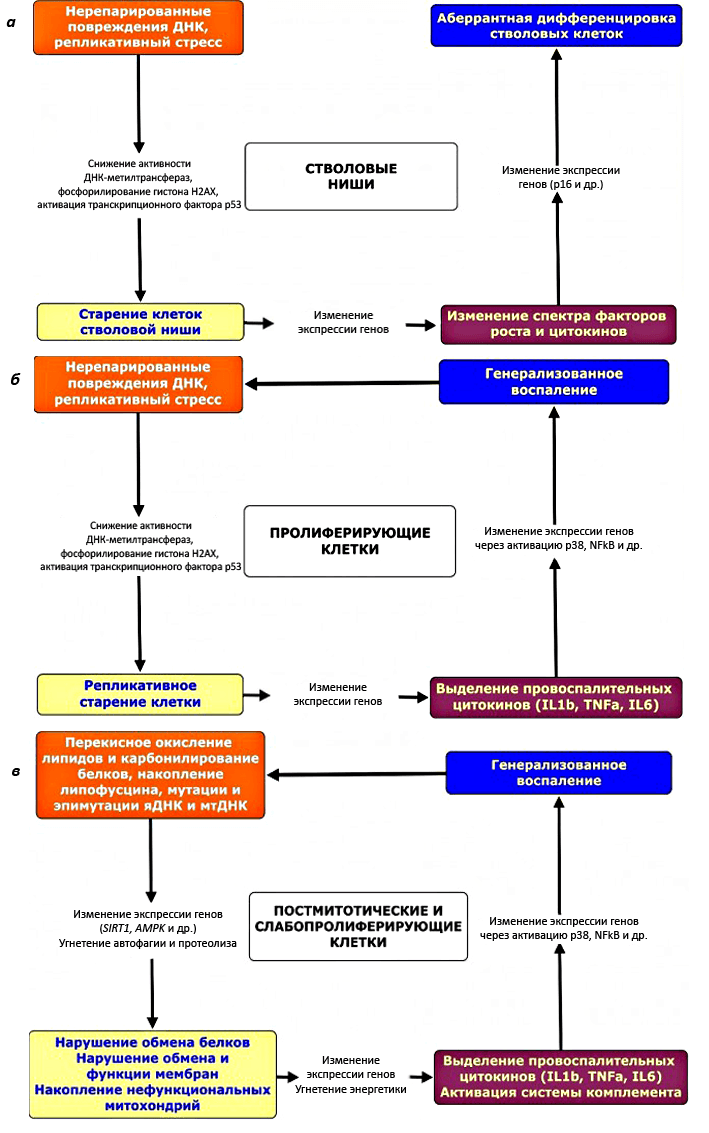
Рисунок 4. Схемы старения разных типов клеток, предложенные А. Москалёвым: а — стволовых ниш, б — активно делящихся, в — постмитотических или редко делящихся. Рисунки с сайта aging-genes.livejournal.com.
Если повреждение опасно, то для его нейтрализации эволюция выработала системы защиты и восстановления (тоже, кстати, «шумные»), они есть даже у самых эволюционно древних организмов — прокариот. А вот тенденцию к накоплению имеют как раз менее значимые повреждения, предотвращать и «чинить» которые у конкретного биологического вида природа может счесть избыточно дорогой затеей — по крайней мере, согласно теории одноразовой сомы. Последняя в своем модернизированном виде неплохо дополняет концепцию накопления повреждений, хотя принимается далеко не безоговорочно, в частности, сторонниками TOR-центрической теории старения [9] — несмотря на то, что и там речь идет о расплате, но за успех в молодости. Поскольку ресурсы организма ограничены, их нужно разумно распределять между функциями поддержания и ремонта тела, роста, размножения и т.д. Разумно — с точки зрения выживания популяции в конкретной экологической нише: если большинство диких мышей гибнет в первый год жизни от переохлаждения (и природу такой расклад устраивает), то зачем им инвестировать в развитие дорогих, но бесполезных для 90% популяции механизмов защиты от рака, а не в размножение? Защищенность организма от климатических встрясок, голода и хищников, наоборот, работает на поддержание тела и увеличение продолжительности жизни — в расчете на повторное стабильное воспроизводство в перспективе. И действительно, долгожителей много среди животных летающих, раковинных (панцирных), подземных и с относительно крупным мозгом. Таким образом, эколого-экономическая целесообразность может определять выбор между стратегиями выживания видов и стратегиями борьбы с накоплением повреждений, а следовательно, и старением (рис. 5).
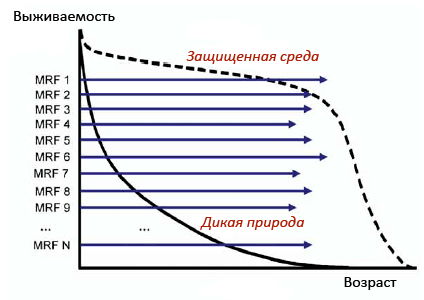
Рисунок 5. В теории одноразовой сомы долголетие определяют механизмы поддержания и репарации. По мнению Томаса Кирквуда, оптимальные инвестиции в функции поддержания и репарации тела (MRF, maintenance and repair functions) — единственное, что нужно для жизни организма — настолько долгой, насколько есть разумная вероятность его выживания: в дикой природе высока смертность от внешних причин, потому слишком крупные инвестиции не окупаются. Длина линий отдельных MRF на схеме символизирует период «гарантированного долголетия» — времени до момента, когда ограничение этой функции приведет к накоплению критической массы повреждений. Соответственно, мутации генов отдельных механизмов вносят вклад в сокращение продолжительности жизни. Количество (N) таких защитно-восстановительных механизмов потенциально велико (опять же, закреплялось эволюцией, исходя из целесообразности затрат на их «содержание»). Хотя все они подвергаются одинаковому отбору, для каждого из них возможны индивидуальные и популяционные вариации в длительности обеспечиваемого «гарантийного» периода. У видов, обитающих в изменчивых условиях, формируются особые механизмы контроля высшего уровня (сигнальные пути типа IGF-1 и TOR), «чувствующие» изменения среды и координирующие работу многочисленных MRF. Рисунок из [10].
Нечто подобное наблюдается и в масштабе индивидуальной жизни. Доступность пищи — важнейшая переменная в природе. Кратковременные периоды голодания должны вызывать перераспределение ресурсов с размножения на поддержание тела. И не даром одним из центральных механизмов регуляции продолжительности жизни стал инсулиновый сигналинг. Пластичность регуляции продолжительности жизни особей в пределах одного вида иллюстрирует пример разных судеб летних и зимних пчел. Еще интереснее вариации в биографии одной особи: в условиях скученности (дефицита ресурсов) нематоды C. elegans образуют дауэр-личинки — стрессоустойчивые формы, способные жить в 10 раз дольше (до лучших времен), чем обычный червь. Переключателем режимов развития служит «детектор среды» — ген daf-2 рецептора инсулиноподобного фактора роста 1 (IGF-1), действующий через посредника из FOXO-белков — Daf16, регулятора сотен генов, связанных с функциями поддержания организма: ответом на стресс, обменом белков, устойчивостью к микробам и т.д. [10]. К слову, у взрослых червей активность гена daf-2, наоборот, способствует старению.
Профессор Гарвардского университета В. Гладышев считает, что эволюционно первой стратегией борьбы с умеренными повреждениями было простое разбавление клеточным делением: как и прочее клеточное содержимое, повреждения распределяются между двумя дочерними клетками, что снижает нагрузку на каждую из них. Эту стратегию выработали прокариоты, используют стволовые клетки, к ней же вернулись и клетки раковые. Возникновение в процессе эволюции многоклеточных постмитотических клеток потребовало перераспределения вложений в развитие систем профилактики и устранения повреждений, которых, однако, неистребимое множество. Цена прецизионной борьбы со всеми неподъемна, постоянное разбавление делением у дифференцированных клеток невозможно — системы строгого контроля деления и супрессии опухолей сохраняют архитектуру тканей и защищают от рака (самый известный «контролер» — p53). Апоптоз — идеальное решение для сильно поврежденных клеток, причем особенно — для наделенных величайшей ответственностью стволовых клеток активно обновляемых тканей. А вот менее травмированные, но «неблагонадежные» клетки дешевле «арестовать» — отказать в возможности деления: временно, до репарации повреждений, или навсегда, обрекая на постепенное превращение в глубоко сенесцентные клетки [8]. Последние — настоящие мастера «САСПенса» (SASP, senescence-associated secretory phenotype): они секретируют вещества, разрушающие внеклеточный матрикс (протеазы), привлекающие иммуноциты (цитокины) и заставляющие соседние клетки делиться или тоже стареть (факторы роста), и всё это — в альтруистичной попытке самоустраниться с помощью иммунной системы и освободить место для клеток здоровых. Но иммунная система тоже не избавлена от возрастной дисфункции, итог — провоспалительная микросреда, нарушение тканевой архитектуры и риск онкогенеза. (Неоднозначность роли клеточного старения в процессе развития, поддержания и старения организма, а также вопросы очистки организма от старых клеток подробно и наглядно обсуждаются в обзоре [11].)
Таким образом, на клеточном уровне в каждой ткани постоянно решаются вопросы целесообразности масштабной защиты клеток, а для уже поврежденных — выживания (тогда — риск рака), старения и гибели [10, 12]. Накопление клеточных повреждений (клеточное старение) влечет за собой иммунные изменения (например, в профиле цитокинов и факторов роста) с развитием хронического воспаления, что стимулирует накопление повреждений — порочный круг замыкается (рис. 4) [13].
Клетки злокачественных опухолей избавляются от дорогих опций блокирования цикла, которые к тому же прямо или косвенно «сломаны» — иначе не допустили бы трансформации, — и возвращаются к примитивному разбавлению делением. Мутации ДНК в раковых клетках приводят к искажению метаболизма и более интенсивному накоплению повреждений, и чтобы выжить, клетки должны делиться всё быстрее. Не удивительно, что рак тесно связан со старением. Хотя старение иногда рассматривают как своеобразную плату за выключение механизмов, ведущих к малигнизации [12], по сути рак — болезнь старения: накапливающиеся с возрастом повреждения удаляются защитными механизмами (апоптозом, иммунной системой и др.), пока нарушение (старение) их самих не позволит каким-то клеткам перестроить метаболизм и выйти из-под контроля [8].
Но если перегрузку повреждениями считать причиной (или одной из причин) старения, то продолжительность жизни можно регулировать метаболическим перепрограммированием — вмешательствами, меняющими темп накопления повреждений, а главное — их профиль. Именно пейзаж повреждений (и его динамика) может объяснять парадоксальные природные примеры долгожительства на фоне выраженного окислительного стресса — например, у птиц. Никакой конкретный тип повреждений не отражает полную картину, а вмешательства, продляющие жизнь модельных животных, нередко повышают продукцию активных форм кислорода (АФК), зато, меняя профиль повреждений, активируют механизмы защиты и от окислительного стресса, и от других неполадок. Часто подобный феномен трактуют как гормезис — стимуляцию устойчивости небольшими дозами стрессоров [8].
Долголетие короткоживущих
К продляющим жизнь модельных организмов манипуляциям относят разнонаправленные изменения активности генов, а также снижение калорийности и компонентную модификацию рациона. Системы оценки калорийности можно обмануть, например, подавляя сигнальные пути, контролирующие клеточный рост (TOR и инсулина/IGF-1), тогда смерть животных откладывается и без голодания, хотя старение в режим пренебрежимого не переключается.
Что касается позитивных регуляторов, то в свежей статье коллектива А. Москалёва [14] можно найти внушительный список предполагаемых «генов долголетия» дрозофилы, имеющих человеческие ортологи, и критические замечания о постановке экспериментов, в которых роль этих генов определяли. Дрозофилам, в частности, идет на пользу гиперэкспрессия многих генов путей регуляции метаболизма (IGF-1R, PI3K, PKB, AMPK, TOR) и стресс-ответа (FOXO, HDAC, p53). Здесь следует иметь в виду, что гиперэкспрессия каких-то генов пути может вести не к повышению сигнализации по нему, а к подавлению, и именно блокирование передачи информации по некоторым путям (тому же TOR, например) способно продлять жизнь. Активность предполагаемых «генов долголетия» направлена на предотвращение или репарацию повреждений, причиняемых физиологическими и экологическими факторами, а в итоге — на повышение устойчивости клеток к стрессу. Причем работа систем стресс-ответа (Sir2, FOXO, JNK) может отключать сокращающие жизнь метаболические гены и влиять на другие механизмы, определяющие долголетие: репаративные, эпигенетические, «клининговые» (обезвреживание токсинов и свободных радикалов, протеолиз, аутофагию).
Группа биологов из Колумбийского университета (Нью-Йорк) подчеркивает важность для продления жизни нормальной работы транскрипционных факторов FOXO и p53, хотя согласно традиционным представлениям провоцируемые ими остановка клеточного цикла и апоптоз ведут к клеточному старению и формированию старческого фенотипа (патологиям, связанным с прекращением деления стволовых клеток и дегенерацией тканей) [15]. Но факты — упрямая вещь. Снижение активности p53 у стареющих мышей коррелирует с повышением частоты развития опухолей и снижением продолжительности жизни в целом. И наоборот, повышенное количество этого белка (и другого контролера клеточного цикла, ARF Ink4a, его мы обсудим в статье о голых и не очень землекопах) защищает от рака — что уже само по себе продляет жизнь мышам — и окислительных повреждений, откладывает старение. Важную роль в таком действии p53 на продолжительность жизни может играть способность этого белка к ситуативному подавлению TOR-сигналинга (рис. 6). Киназа TOR (или mTOR, «мишень рапамицина у млекопитающих») интегрирует вышележащие сигнальные ветви (инсулина, факторов роста, аминокислот), «чувствует» уровень питательных веществ, кислорода и энергии в клетке, направляет обмен по анаболическому пути. Гиперактивность TOR связывают с развитием диабета II типа, ожирения, рака, депрессии; ингибирует TOR-сигналинг иммунодепрессант рапамицин. Фактор p53 может бороться не только с работой TOR, но и с ее последствиями, повышая экспрессию генов антиоксидантов, необходимых для улавливания АФК — побочных продуктов интенсивного метаболизма. В качестве одной из главных мишеней для препаратов, предотвращающих старение — геропротекторов, — авторы статьи [15] рассматривают антагониста FOXO и p53 и одновременно «подельника» TOR — убиквитинлигазу Mdm2.
Деликатно подавлять другое звено схемы, изображенной на рисунке 6, — киназу PI3K — предлагает сотворивший знаменитых червяков-долгожителей американский геронтолог Роберт Шмуклер Рис. У группы нематод C. elegans, на порядок (!) переживших сородичей, Рис «выключил» ген age-1 (он же — daf-23), кодирующий как раз PI3K [16]. Действие такого нокаута Рис и ученые, ранее удвоившие срок жизни нематод отключением гена daf-2 (гомолога человеческих генов рецепторов инсулина и IGF), связывают с подавлением сигнализации по пути инсулин/IGF-1/FOXO, который сливается с PI3K/AKT/mTOR в точке «PI3K». Рецепция инсулина/IGF-1 по сути является одной из «периферий» системы, регулирующей метаболизм и реакцию на стресс (баланс «катаболизм/анаболизм», рост, деление, апоптоз и др.) в зависимости от пищевых и иных условий. Кстати, гиперактивность PI3K провоцирует развитие онкозаболеваний, потому ингибиторы этого фермента уже создаются. Подробное описание открытия пути инсулин/IGF-1/FOXO и продляющих жизнь C. elegans мутаций можно найти в статье непосредственного участника событий, Синтии Кеньон [17].
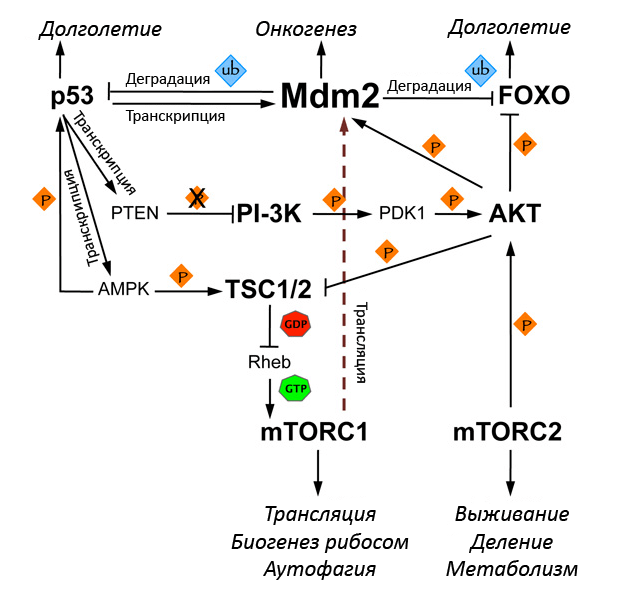
Рисунок 6. Схема сигнальных путей, связывающая Mdm2 с регуляцией метаболизма и продолжительности жизни. Стрелками показана положительная регуляция, «тупикáми» — отрицательная. Оранжевые ромбы отражают киназную активность, голубые — убиквитинлигазную. Киназа mTOR работает в составе комплексов mTORC1 и mTORC2. Эти комплексы способны увеличивать активность убиквитинлигазы Mdm2 посредством повышения трансляции ее мРНК или активации AKT (протеинкиназы B). AKT инактивирует «хорошее» звено цепи — комплекс TSC1/2 (белки гамартин и туберин), подавляющий mTOR-сигналинг, — зато активирует Mdm2, ускоряющую деградацию p53 и FOX-белков класса O. Гибели последних способствует и фосфорилирование, осуществляемое AKT. Mdm2 уничтожением p53 способствует работе mTORC1, поскольку p53 в ответ на повреждения ДНК и онкогенную нагрузку активирует гены PTEN (кодируемая им фосфатаза «отключает» киназу PI-3K, «подстрекающую» AKT на преступления против долголетия) и AMPK (его продукт «включает» TSC1/2). Если речь идет о защите от рака и продлении жизни, то компоненты схемы, подавляющие TOR-сигналинг, можно считать «дружественными», и наоборот. И действительно — в списке генов, гиперэкспрессия которых продляет жизнь дрозофил, можно найти и dFOXO, и dPTEN, и dTsc1 с dTsc2, и AMPK [14]. Рисунок из [15], адаптирован.
Очевидно, что мишенями продлевающей жизнь терапии могут быть разные звенья упомянутых сигнальных путей, но ясно и то, что существенной помехой для спасительных генетических и лекарственных манипуляций будут многочисленные, формирующие сложную молекулярную сеть пересечения этих путей друг с другом и иными каскадами. Например, фермент гликолиза GAPDH помимо энергетического обмена участвует в репарации ДНК и регуляции апоптоза. Ген малатдегидрогеназы (men) задействован в регуляции энергетического, липидного, углеводного обменов, уровня АФК, активации систем защиты от окислительного стресса. Эффекты этого гена, кстати, неплохо подпадают под описание гормезиса: гиперэкспрессия men у личинки дрозофилы приводит к окислительному стрессу, но смещает метаболический баланс в сторону катаболизма и активирует ряд защитных механизмов, побеждающих стресс в позднем возрасте и откладывающих смерть [14].
Не менее важная проблема — перенос результатов с лабораторных животных, обычно мелких и с непродолжительной жизнью, на человека. Хотя механизмы старения сформировались еще у дрожжей, а многие регуляторные пути, контролирующие продолжительность жизни модельных животных, консервативны, мы знаем, что в процессе эволюции этих видов не отбирались детерминанты долголетия. У человека защитные механизмы гораздо эффективнее. Более того, эксперименты с каждой моделью предполагают серьезные методические ограничения: нокауты возможны у одних организмов, гиперэкспрессия — у других, и т.д. Тем не менее эти животные подарили нам базовые знания о жизни и смерти клеток и направили биогеронтологические поиски в нужное русло. Интересны, например, работы по сравнению динамики экспрессии генов, связанных с продолжительностью жизни, у человека и лабораторных животных. И здесь важно нащупать связь экспрессии не только со старением, но и с его переходом в фазу пренебрежимости: мы ведь помним, что в преклонном возрасте у многих мелких «мучеников науки» кривая смертности тоже выходит на плато.
В поисках универсального маркера старения и идеального подопытного
Изменения в экспрессии генов связывают со старением обоснованно: у многих животных, включая человека, наблюдают возрастзависимые изменения транскрипционных профилей, однако сложно сказать, что есть причина, что следствие, а что побочный эффект (и с каким «знаком»). Да еще и ткани стареют по-разному... Научные коллективы редко, но всё же прибегают к масштабным сравнениям транскриптомов людей разного возраста и классических модельных организмов.
Интересные данные представили в 2006 году Дж. Зан и соавторы [18]. Сравнив возрастную динамику экспрессии генов в человеческих мышцах, почках и мозге, они выявили шесть генетических путей, меняющих активность с годами: экспрессия четырех из них повышалась (генов компонентов внеклеточного матрикса, факторов активации комплемента, компонентов цитозольных рибосом и генов, связанных с клеточным ростом), а двух — снижалась (генов компонентов митохондриальной электронтранспортной цепи (ЭТЦ) и транспортеров хлорид-ионов). Сравнение этой «возрастной подписи» человека с данными по мышам и дрозофилам показало, что лишь один путь меняет активность в течение жизни у всех трех организмов, причем в одинаковых направлении и темпе, — путь, кодирующий белки ЭТЦ.
Однако этот факт вовсе не означает, что снижение наработки белков ЭТЦ — универсальная причина старения. Дело в том, что у еще одного популярного модельного животного — червя C. elegans — блокирование синтеза компонентов ЭТЦ прилично продляет жизнь. Потому авторы работы полагают, что снижение активности этого генетического пути, наоборот, может способствовать человеческому долголетию или быть проявлением антагонистической плейотропии. А главное — может рассматриваться как один из общих для животных маркеров старения. Еще один очень важный вывод (базирующийся не только на результатах этой работы): возрастзависимая картина экспрессии почти всех генов человека видоспецифична, то есть радикально отличается от таковой у червей, мух и мышей. Это одна из причин, почему короткоживущие организмы не могут считаться идеальными моделями для изучения механизмов «нормального» старения. Однако само по себе осознание этого факта мало что дало бы. Если бы не...
Если бы в начале XXI века не обратили внимания на бесшерстных крысоподобных обитателей подземелья с беспрецедентной для грызунов продолжительностью жизни, не страдающих от рака, атеросклероза и много чего еще. А главное, заветное плато на кривой их смертности начиналось уже в юности (рис. 2). Чем не достойный объект для анализа механизмов долгожительства и пренебрежимого старения? И помимо этого мелкого млекопитающего, зовущегося голым землекопом, долгожителей с отложенным старением (или вовсе без него) в разных классах и царствах уже обнаружили немало. Но о них речь пойдет в отдельной статье.
Резюме
Итак, старение человека сейчас чаще рассматривают как сложный и нелинейный процесс: за прогрессирующим снижением адаптивных возможностей организма следует их стабилизация в возрасте 90-100 лет. Гипотез и теорий, объясняющих причины старения и его механизмы, сотни, и пока научное сообщество не выбрало из них самые правдоподобные. Интегрируя представления некоторых авторитетных биогеронтологов о молекулярных механизмах старения, можно предположить следующую череду событий: накопление разнородных повреждений клеточных структур и определенные паттерны работы сигнальных систем ведут к блокировке деления клеток или их гибели (что защищает организм от рака, пока не повредятся сами защитные механизмы), нарушению способности тканей к регенерации и запуску воспалительных процессов, что в итоге еще больше ускоряет накопление повреждений и старение. Схемы систем, регулирующих клеточные метаболизм и ответ на стресс, репарацию ДНК и утилизацию поврежденных структур, запутанны и пересекаются во множестве точек. Задача, стоящая перед биогеронтологами, — установить в работе с животными-долгожителями наиболее перспективные точки воздействия на механизмы, определяющие продолжительность жизни. Ну а на классических моделях всё потом проверить, заодно подтвердив или опровергнув часть гипотез старения.
Литература
- Эволюция идей в геронтологии. Блог А. Москалёва;
- Rose M.R., Burke M.K., Shahrestani P., Mueller L.D. (2008). Evolution of ageing since Darwin. J. Genet. 87, 363–371;
- Rose M.R., Flatt Th., Graves J.L., Greer L.F., Martinez D.E., Matos M. et al. (2012). What is Aging? Front. Genet. 3, 134;
- Blagosklonny M.V. (2010). Revisiting the antagonistic pleiotropy theory of aging: TOR-driven program and quasi-program. Cell Cycle. 9, 3151–3156;
- Федичев П. FAQ: Пренебрежимое старение. 7 фактов о животных, которые не знают старости. Портал «Постнаука»;
- Walker R.F., Pakula L.C., Sutcliffe M.J., Kruk P.A., Graakjaer J., Shay J.W. (2009). A case study of «disorganized development» and its possible relevance to genetic determinants of aging. Mech. Ageing Dev. 130, 350–356;
- Walker R.F., Liu J.S., Peters B.A., Ritz B.R., Wu T., Ophoff R.A., Horvath S. (2015). Epigenetic age analysis of children who seem to evade aging. Aging (Albany NY). 7, 334–339;
- Gladyshev V.N. (2012). On the cause of aging and control of lifespan. BioEssays. 34, 925–929;
- Blagosklonny M.V. (2010). Why the disposable soma theory cannot explain why women live longer and why we age. Aging. 2, 884–887;
- Kirkwood Th.B.L. (2005). Understanding the odd science of aging. Cell. 120, 437–447;
- van Deursen J.M. (2014). The role of senescent cells in ageing. Nature. 509, 439–446;
- биомолекула: «Старение — плата за подавление раковых опухолей?»;
- Схемы старения клеток. Блог А. Москалёва;
- Proshkina E.N., Shaposhnikov M.V., Sadritdinova A.F., Kudryavtseva A.V., Moskalev A.A. (2015). Basic mechanisms of longevity: A case study of Drosophila pro-longevity genes. Ageing Res. Rev. 24, 218–231;
- Poyurovsky M.V. and Prives C. (2010). P53 and aging: A fresh look at an old paradigm. Aging. 2 (7), 380–382;
- Cohen J. (2015). Death—defying experiments. Science. 350, 1186–1187;
- Kenyon C. (2010). The first long-lived mutants: discovery of the insulin/IGF-1 pathway for ageing. Phil. Trans. R. Soc. B. 366 (1561), 9–16;
- Zahn J.M., Sonu R., Vogel H., Crane E., Mazan-Mamczarz K., Rabkin R. et al. (2006). Transcriptional profiling of aging in human muscle reveals a common aging signature. PLoS Genet. 2 (7), e115. doi: 10.1371/journal.pgen.0020115;
- Buffenstein R. (2008). Negligible senescence in the longest living rodent, the naked mole-rat: insights from a successfully aging species. J. Comp. Physiol. B. 178, 439–445.
Источник: http://biomolecula.ru/content/1871














































































