«Кимрайа»: встречайте первую в мире T-клеточную CAR-терапию
Провозглашено начало новой эры в лечении онкологических заболеваний.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало «Новартис» (Novartis) разрешение на «Кимрайа» (Kymriah, тисагенлеклейсел) — первую в мире официально одобренную T-клеточную CAR-терапию (CAR-T). Регулятор вынес положительный вердикт раньше срока, установленного на конец сентября.
Внутривенный «Кимрайа», ранее проходивший под внутренним обозначением CTL019, допущен для применения против В-клеточного острого лимфобластного лейкоза (ALL) из клеток-предшественников у детей и взрослых (до 25-летнего возраста), заболевание которых рефрактерно к лечению или рецидивировало по крайней мере два раза.
Появление «Кимрайа», как целиком персонализированной под пациента терапии, провозглашает начало новой эры в отрасли биотехнологий и ведении онкологических заболеваний.
Нынешние варианты борьбы с острым лимфобластным лейкозом ограничены, притом что медиана общей выживаемости очень скромна, находясь в пределах трех–девяти месяцев. Острый лимфобластный лейкоз диагностируется в четверти случаев рака у пациентов в возрасте до 15 лет. Шансы на выживание в течение пяти лет у тех, кто столкнулся с множественными рецидивами или не смог добраться до ремиссии, находятся в пределах 10–30%.
Механизм действия «Кимрайа»
Механизм действия тисагенлеклейсела, разработанного совместно с Пенсильванским университетом, следующий. Аутологичные T-клетки пациента, полученные из мононуклеарных клеток периферической крови посредством стандартной процедуры лейкафереза, генетически перепрограммируются трансфекцией лентивирусным вектором, вызывающим экспрессию химерных антигенных рецепторов (CAR), которые распознают и уничтожают CD19-положительные раковые B-клетки. Трансфектированные T-клетки культивируются, очищаются и преобразуются в суспензию, которая криоконсервируется для безопасной доставки к пациенту.
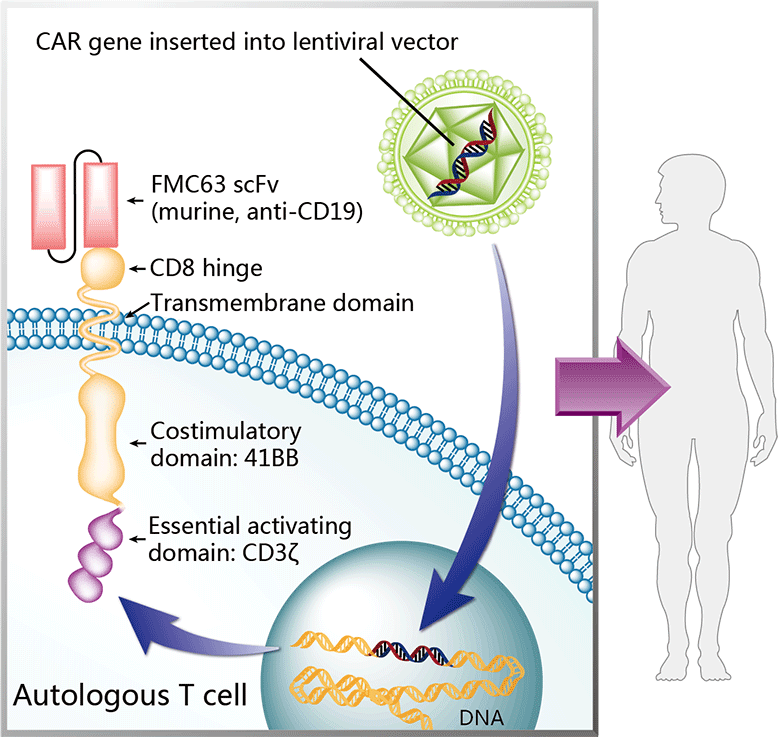
Конструкция CAR составлена из трех компонентов (scFv-41BB-CD3ζ): одноцепочечного переменного фрагмента антитела против CD19, связывающегося с CD19; костимулирующего домена 4-1BB (CD137), усиливающего опосредованные T-лимфоцитами ответы; интрацеллюлярного T-клеточного рецепторного CD3-зета домена сигнальной цепи, индуцирующего активацию T-лимфоцитов и противоопухолевую активность.
Клиническая эффективность «Кимрайа»
Тисагенлеклейсел характеризуется высокой таргетированностью. Это подтверждается результатами опорных клинических испытаний ELIANA фазы II, в рамках которого 68 пациентов получили единственную дозу тисагенлеклейсела — оценка эффективности была проведена для 63 человек.
По истечении трех месяцев на полную ремиссию (количество бластных клеток в костном мозге не превышает 5%) либо полную ремиссию с частичным восстановлением форменных элементов крови вышли 83% участников (n=52/63; p<0,0001): соответственно 63% (n=40/63) и 19% (n=12/63) пациентов. При этом минимально остаточного (резидуального) заболевания, как онкогематологического маркера потенциального рецидива, не было зафиксировано ни у кого из ответивших на лечение. Показатель медианы длительности ремиссии достигнут пока не был.
Безопасность «Кимрайа»
Что касается безопасности применения тисагенлеклейсела, 49% пациентов зафиксировали синдром выброса цитокинов (CRS) уровня 3 или 4 — известную негативную побочную реакцию CAR-терапии, связанную с активированием видоизмененных иммунологических клеток. Смертельных исходов из-за осложнений лечения не наблюдалось.
С цитокиновым штормом предложено справляться назначением «Актемра» (Actemra, тоцилизумаб), блокатора интерлейкина 6 авторства «Рош» (Roche): регулятор уже внес соответствующее назначение в спектр показаний этого препарата.
Стоимость лечения «Кимрайа»
Учитывая равно как особенности лекарственного ценообразования на Западе, так и новаторскую составляющую CAR-терапии вкупе с ее невероятной эффективностью, стоимость тисагенлеклейсела окажется попросту запредельной. Так и получилось: «Novartis» захотела 475 тыс. долларов за одно вливание «Кимрайра».
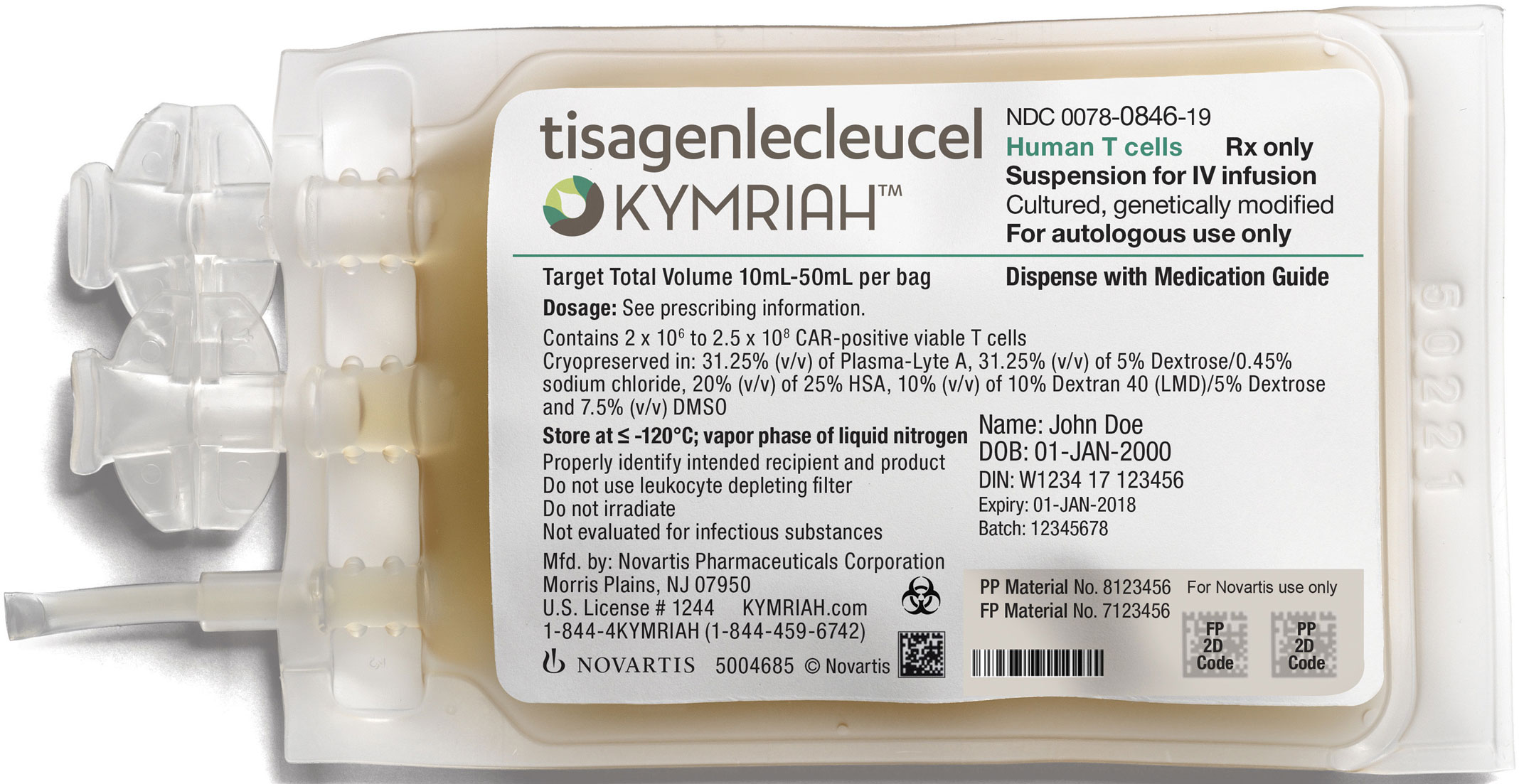
К слову, швейцарский фармацевтический локомотив заявил о сотрудничестве с Центрами по обслуживанию Medicare и Medicaid (CMS) — федеральных программ здравоохранения США: оплата лечения «Кимрайа» будет производиться только в том случае, если пациент ответил на препарат к концу первого месяца после инъекции.
Стоимостный вопрос столь уникального медикамента тесно связан с рисками его принятия в сообществе. Так, например, «Байоджен» просит за «Спинраза» (Spinraza, нусинерсен), появившееся в конце 2016 года первое лекарство против спинальной мышечной атрофии, 750 тыс. долларов в первый год, а затем по 375 тыс. долларов ежегодно. Несмотря на огромный ценник, продажи антисмыслового нусинерсена растут как на дрожжах.
Тем не менее в апреле «ЮниКьюэ» (uniQure) отказалась от «Глибера» (Glybera, алипоген типарвовек) против дефицита липопротеинлипазы (семейная хиломикронемия, гиперлипопротеинемия типа Ia). А в июле «ГлаксоСмитКляйн» (GlaxoSmithKline) объявила о своем желании избавиться от орфанного бизнеса, включающего «Стримвелис» (Strimvelis) против врожденного дефицита аденозиндезаминазы. Следует понимать, что компании требуют за курс указанных генотерапевтических лекарств соответственно 1,2 млн и 665 тыс. долларов.
Производство «Кимрайа»
Как оценивает «Новартис», которая серьезно подготовилась к выходу новинки на рынок, время, необходимое для запуска производственного цикла и выхода готового тисагенлеклейсела, индивидуализированного под каждого пациента, займет 22 дня.
Будущее «Кимрайа»
«Новартис» собирается в этом году подать заявку на расширение назначений тисагенлеклейсела, подключив взрослых пациентов с рецидивирующей и/или рефрактерной диффузной B-крупноклеточной лимфомой (DLBCL), относящейся к агрессивным неходжкинским лимфомам.
Промежуточные результаты клинических испытаний JULIET фазы II продемонстрировали, что на третьем месяце после однократного введения тисагенлеклейсела общий ответ зафиксирован среди 45% пациентов (n=23/51): полный ответ у 37% участников (n=19) и частичный у 8% (n=4). Полный ответ оставался стабильным на протяжении трех месяцев после прекращения сбора данных.
Конкуренты и CAR-терапия
Основное противостояние на CAR-арене сейчас ведется между «Новартис» и «Кайт фарма» (Kite Pharma), которую на днях купила «Гилеад сайенсиз» (Gilead Sciences), выложившая приблизительно 11,9 млрд долларов наличными.
До конца ноября FDA должно принять решение относительно поданной в марте заявки на CAR-терапевтический аксикабтаген cилолейcел (axicabtagene ciloleucel), или KTE-C19, нацеленный на рецидивирующие и/или рефрактерные агрессивные неходжкинские лимфомы, такие как DLBCL, трансформированная фолликулярная лимфома (TFL) и первичная медиастинальная B-крупноклеточная лимфома (PMBCL).
Определенных успехов добились «Джуно терапьютикс» (Juno Therapeutics) и «Блюбёрд байо» (Bluebird Bio), работающие отдельно, но каждая совместно с «Селджен» (Celgene): первая хвастается достижениям CAR-терапии среди пациентов с DLBCL, фолликулярной лимфомой на стадии 3B или мантийноклеточной лимфомой (MCL), вторая довольна результатами лечения множественной миеломы.
Новым сильным игроком стала китайская «Наньцзин ледженд байотек» (Nanjing Legend Biotech), заявившая о потрясающих результатах CAR-терапии: пять пациентов с рецидивирующей и/или рефрактерной множественной миеломой, за которыми велось наблюдение сроком свыше года, продолжают оставаться в статусе строгого полного ответа. И это удивительно, ведь клетки экспериментального LCAR-B38M персистируют в организме всего лишь несколько месяцев. Общепризнано, что длительная ремиссия требует постоянного присутствия CAR-клеток. Так что больные, скорее всего, полностью излечились.
30.08.2017 Источник: mosmedpreparaty.ru