Обращение возраста: измерение эпигенетического возраста двух разных видов с помощью одних часов
ВВЕДЕНИЕ
Несколько десятилетий назад исследования гетерохронного парабиоза, в которых системы кровообращения старых и молодых мышей были связаны с тем, чтобы стимулировать смешивание их крови, показали, что молодая кровь может омолодить стареющих мышей и наоборот - старая кровь старит молодых мышей 1. Недавнее возрожденный, такой подход подтвердил это наблюдение и продемонстрировал положительное влияние на мышцы, сердце, мозг и многие другие органы 2-7. Повторные инъекции молодой плазмы более старым мышам, эффективная альтернатива парабиозу, подтвердили распространенное мнение о том, что благоприятный эффект обусловлен факторами, передающимися через кровь; в противовес вероятности того, что старые мыши могли бы извлекать пользу из лучше функционирующих органов молодых 8. Многие исследования и коммерческие инвестиции были сделаны для выявления и выделения из крови фактора (ов) омоложения, которые теоретически могут быть полезными для смягчения или лечения возрастных состояний, таких как болезнь Альцгеймера и прочие. Терапия фракцией плазмы, используемая в исследовании, описанном ниже, основана на принципе гетерохронного плазменного обмена (HPE), при котором плазма старых крыс заменяется плазмой молодых 9. Этот подход основан на гетерохронном парабиозе, но без необходимость физического соединения кровеносных систем двух животных вместе. Ожидается, что помимо значительного снижения стресса для животных, HPE будет оказывать более глубокое воздействие, поскольку 100% крови старого животного может быть заменено. Это в отличие от гетерохронного парабиоза, где молодая крыса, имеющая приблизительно половину веса старой крысы, вносит менее 50% в объединенную циркуляцию плазмы в парабиотических партнерах. Общая потеря восстановления тканей с возрастом может отражать негативное влияние накапливающихся с возрастом ингибирующих белков в стареющих тканях и кровообращении 10. Следовательно, если предполагаемые факторы старения присутствуют в плазме крови старых животных 10, они останутся в парабиотическом партнере.
При рассмотрении концепции старения и омоложения важно понимать, что улучшение здоровья или функционирования органов с помощью лекарств или хирургического вмешательства не обязательно указывает на изменение молекулярного возраста. Следовательно, концептуально сложно проверить, действительно ли терапия фракцией плазмы или любое другое предполагаемое лечение действительно меняет биологический возраст, потому что нет единого мнения о том, как измерять биологическое старение 11. Мы решили эту проблему, используя как клинические биомаркеры, так и молекулярные биомаркеры старения. Хотя клинические биомаркеры имеют очевидные преимущества (свидетельствующие о дисфункции органов или заболеваниях), они не являются ни достаточно механистическими, ни проксимальными по отношению к фундаментальным механизмам старения, чтобы служить их индикаторами. Давно признано, что эпигенетические изменения являются одним из нескольких основных признаков старения 12-16. С техническим прогрессом платформ метилирования, которые могут обеспечить количественные и точные профили специфических метилирований CpG; пришло понимание как можно объединить уровни метилирования нескольких локусов ДНК для разработки точной оценки возраста 17-21. Такие оценки возраста метилирования ДНК (DNAm) проявляют неожиданные свойства: они применимы ко всем источникам ДНК (отсортированные клетки, ткани и органы) и неожиданно ко всему возрастному спектру (от пренатальных образцов ткани до тканей долгожителей) 20,22. Значительный объем литературы показывает, что эти эпигенетические часы отражают аспекты биологического возраста 22. Это подтверждается тем фактом, что расхождение между возрастом ДНК и хронологическим возрастом (термин «ускорение эпигенетического возраста») является прогностическим фактором смертности от всех причин даже с учетом различных известных факторов риска 23-25. Патологии и состояния, которые связаны с ускорением эпигенетического возраста, включают, но не ограничиваются ими, когнитивное и физическое функционирование 26, долгожительство 25,27, синдром Дауна 28, ВИЧ-инфекцию 29, ожирение 30 и раннюю менопаузу 31.
Мы продемонстрировали, что многотканевые часы человека могут быть непосредственно применены к профилям метилирования ДНК шимпанзе 20, но их эффективность на профилях других животных снижается из-за эволюционного расхождения геномных последовательностей. В последнее время эпигенетические часы для мышей были разработаны и успешно используются для оценки и подтверждения золотых стандартов интервенций долголетия, таких как ограничение калорий и абляция рецептора гормона роста 32-37. Эти наблюдения убедительно свидетельствуют о том, что возрастное изменение метилирования ДНК является эволюционно законсервированным признаком, и, таким образом, точные оценки возраста, разработанные для людей, могут применяться для разных видов. Здесь мы опишем разработку и характеристики шести различных эпигенетических часов для крыс. Двое из этих эпигенетических часов относятся как к людям, так и к крысам. Мы использовали эти шесть эпигенетических часов для оценки лечения на основе фракции плазмы в 4 тканях крысы от двухлетних крыс. Подтверждающие результаты этих эпигенетических часов вместе с физиологическими, гистологическими и когнитивными оценками демонстрируют, что введение плазменной фракции обратило старение у крыс.
РЕЗУЛЬТАТЫ
Данные метилирования ДНК
Все данные метилирования ДНК были сгенерированы на специальной матрице метилирования, которая применяется ко всем млекопитающим. В общей сложности мы получили профили метилирования ДНК n = 517 образцов из 13 различных тканей крысы (Rattus norvegicus) (дополнительная таблица 1, 2 и 3) с возрастами от 0,0384 года (т.е. 2 недели) до 2,3 года (т.е. 120 недель). Образцы ткани крысы были получены из 3 разных стран: (i) Индии (Nugenics Research в сотрудничестве с NMIMS School of Pharmacy's), (ii) Соединенных Штатов (H. Chen и L. Solberg Woods) и (iii) Аргентины (R Гойя) Неконтролируемая иерархическая кластеризация показывает, что профили метилирования кластеризованы по типу ткани, как и следовало ожидать (дополнительный рисунок 1).
Наши основанные на метилировании ДНК возрастные оценки (эпигенетические часы) были разработаны («обучены» на языке машинного обучения) с использованием n = 517 тканей крысы. Двое эпигенетических часов, относящихся к обоим видам, были разработаны путем добавления n = 850 образцов ткани человека в обучающую выборку от крыс. Ткани крысы и человека были профилированы на одной и той же платформе метилированного массива (HorvathMammalMethylChip40), которая фокусируется на 36 000 высоко консервативных CpGs (методы).
Эпигенетические часы
Мы разработали шесть видов различных часов для крыс, различных в нескольких отношениях (тип ткани, биологический вид и вид измерения возраста). Некоторые часы применяются ко всем тканям (пантканевые часы), в то время как другие специально созданы для конкретных тканей / органов (мозг, кровь, печень). Пантканевые часы для крыс настраивали на всех доступных тканях. Мозговые часы были настроены с использованием образцов ДНК, выделенных из цельного мозга, гиппокампа, гипоталамуса, неокортекса, черной субстанции, мозжечка и гипофиза. Часы печени и крови были настроены, соответственно, с использованием образцов печени и крови из обучающей выборки. Четыре вида часов (пантканевые, для мозга, крови и печени) применимы только к крысам, часы вида “человек-крыса” применимы к обоим видам. Эти двое межвидовых (человека и крысы) пантканевых часов различаются по типу измерения. Одни оценивают абсолютный возраст (в единицах лет), а другие оценивают относительный возраст, который представляет собой отношение хронологического возраста к максимальной продолжительности жизни; со значениями от 0 до 1. Это соотношение позволяет проводить выравнивание и биологически значимое сравнение между видами с очень разной продолжительностью жизни (крыса и человек), что невыполнимо путем простого измерения абсолютного возраста.
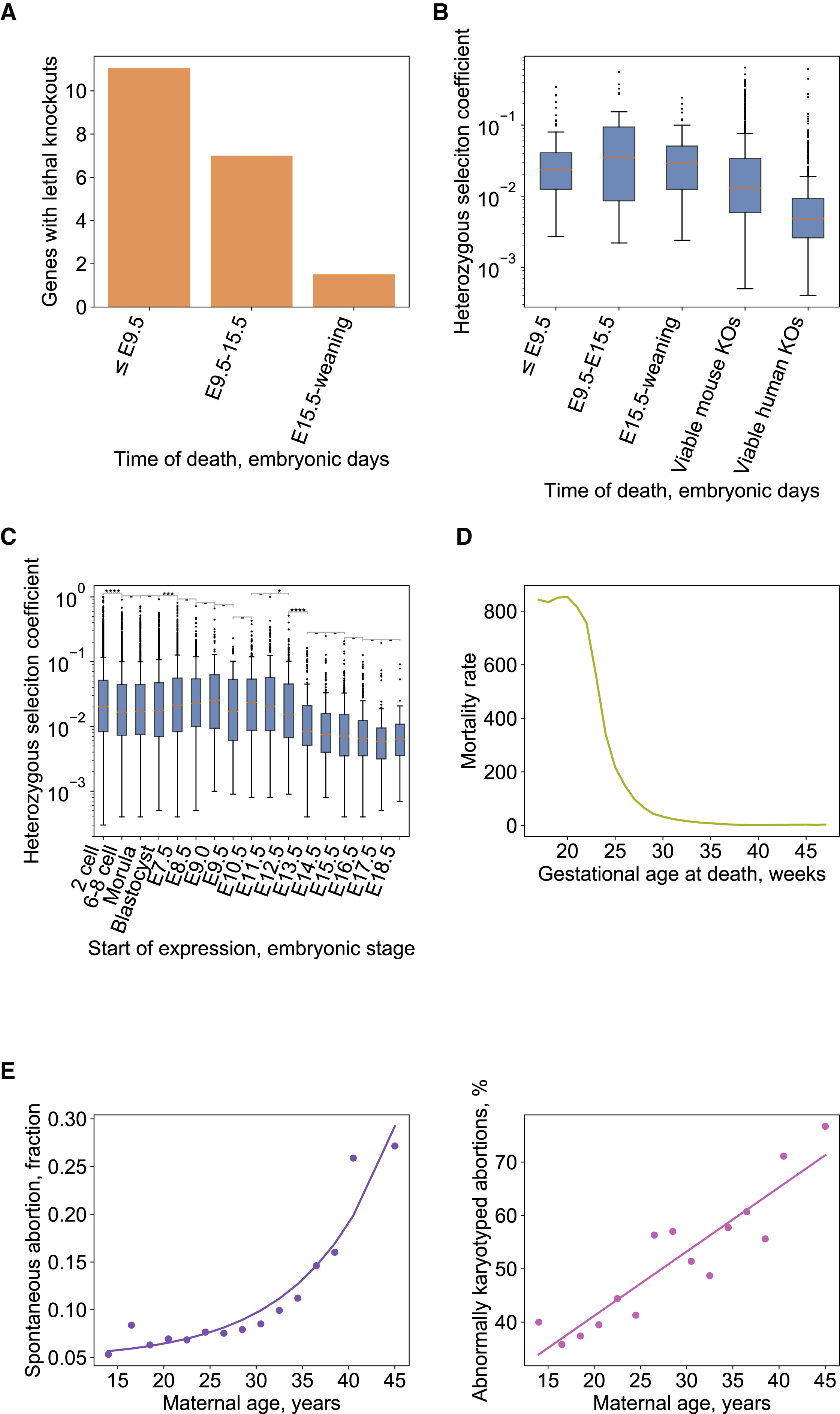
Чтобы получить объективные оценки шести эпигенетических часов, мы использовали а) перекрестную проверку обучающих данных и б) оценку на независимом наборе тестовых данных. В перекрестной проверке приводятся объективные оценки возрастной корреляции R (определяемой как корреляция Пирсона между оценкой возраста (возраст DNAm) и хронологическим возрастом), а также медианная абсолютная ошибка (рис. 1). Оценки перекрестной проверки возрастных корреляций для всех шести часов выше 0,9. У четырех часов для крыс были средние абсолютные погрешности, в пределах от 0,12 года (1,4 месяца) для часов крови крысы до 0,189 года (2,3 месяца) для пантканевых часов крысы, рис. 1A-D). Двухвидовые часы возраста человека и крысы генерировали корреляцию возраста R = 0,99, когда оба вида анализировались вместе (рис. 1E), но ниже, когда анализ ограничивается только тканями крысы (R = 0,83, рис. 1F). Напротив, часы человека-крысы для относительного возраста демонстрируют высокую корреляцию независимо от того, проводится ли анализ с образцами обоих видов (R = 0,96, рис. 1G) или только с образцами крысы (R = 0,92, рис. 1H). Это показывает, что относительный возраст позволяет избежать искажений, неминуемо возникающих, когда абсолютный возраст видов с очень разной продолжительностью жизни измеряется с использованием одной формулы. Частично это связано с неравномерным распределением данных обучающей выборки на противоположных концах возрастного диапазона.
 Рисунок 1: перекрестная проверка шести эпигенетических часов для крысы. A-D) Четыре вида эпигенетических часа, которые настраивались только на тканях крысы. E-H) Результаты для 2 часов, которые были обучены на тканях человека и крысы. Оценка возраста метилирования ДНК (ось у, в единицах лет) по сравнению с хронологическим возрастом для A) пан-ткани крысы, B) мозга крысы, C) крови крысы и D) часов печени крысы. Точки окрашены A) типом ткани или B) областью мозга. E и F) часы "Человек-крыса" , оценки абсолютного возраста. G, H) Оценка относительного возраста по часам человек-крыса, которая представляет собой отношение хронологического возраста к максимальной продолжительности жизни соответствующих видов. Десятикратные оценки перекрестной проверки возраста (ось Y, в годах) только в образцах E, G (человеческие (зеленые) и крысы (оранжевые), а также F (H) (окрашены по типу ткани). Каждая панель сообщает размер выборки, коэффициент корреляции, медиана абсолютной ошибки (MAE).
Рисунок 1: перекрестная проверка шести эпигенетических часов для крысы. A-D) Четыре вида эпигенетических часа, которые настраивались только на тканях крысы. E-H) Результаты для 2 часов, которые были обучены на тканях человека и крысы. Оценка возраста метилирования ДНК (ось у, в единицах лет) по сравнению с хронологическим возрастом для A) пан-ткани крысы, B) мозга крысы, C) крови крысы и D) часов печени крысы. Точки окрашены A) типом ткани или B) областью мозга. E и F) часы "Человек-крыса" , оценки абсолютного возраста. G, H) Оценка относительного возраста по часам человек-крыса, которая представляет собой отношение хронологического возраста к максимальной продолжительности жизни соответствующих видов. Десятикратные оценки перекрестной проверки возраста (ось Y, в годах) только в образцах E, G (человеческие (зеленые) и крысы (оранжевые), а также F (H) (окрашены по типу ткани). Каждая панель сообщает размер выборки, коэффициент корреляции, медиана абсолютной ошибки (MAE).
Как видно из названия, пантканевые часы для крыс очень точны в оценке возраста всех тестируемых образцов ткани, и их эффективность на отдельных тканях может быть более четко видна на дополнительном рисунке 2. Мы также оценили точность шести эпигенетических часов на независимом тестовом наборе данных, полученных при исследовании фракций плазмы. В необработанных образцах ткани крысы эпигенетические часы показали высокие возрастные корреляции во всех тканях (R> = 0,95 в крови, печени и гипоталамусе и R> = 0,86 в ткани сердца, дополнительный рисунок 3).
Омолаживающий эффект от терапии фракцией плазмы
Способность генерировать эпигенетические часы возраста для определенных органов крысы можно легко оцененить с точки зрения их практической полезности в исследованиях старения. Тем не менее, оценка показаний пантканевых часов гораздо глубже, поскольку она распространяется на концептуальный аспект в отношении старения. Возможность оценивать возраст различных органов крысы с помощью показаний одних часов, будь то пантканевые часы для крыс или пантканевые часы человека-крысы, это очень сильный индикатор того, что эпигенетический возраст регулируется во всех тканях организма, и эта регуляция опосредована системно. Это, в свою очередь, подразумевает, что возможно централизованно изменять скорость старения в разных тканях организма; принцип, который лежит в основе терапии фракцией плазмы.
Мы применили шесть часов к независимому тестовому набору данных (n = 76), включающему четыре ткани крысы (кровь, печень, сердце, гипоталамус). Основная цель этого - проверить гипотезу о том, что лечение плазменной фракцией обращает вспять эпигенетический возраст двухлетних крыс.
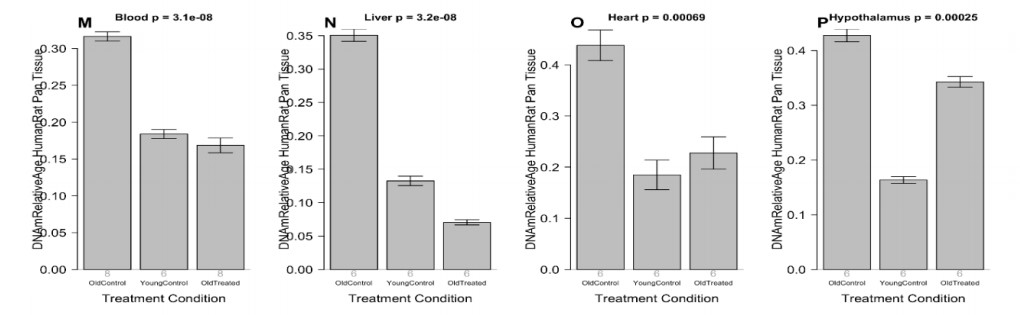
Терапию плазменной фракцией проводили крысам в соответствии с экспериментальным планом, изображенным на дополнительном рис 4. Вкратце, 18 крыс Sprague Dawley были разделены на три группы. Группа из 6 молодых крыс (30 недель), вторая группа из 6 старых крыс (109 недель) и третья группа из 6 старых крыс, получавших плазменную фракцию (также 109 недель). Терапия плазменной фракцией состоит из двух серий внутривенных инъекций плазменной фракции. Крысам делали инъекции четыре раза в разные дни в течение 8 дней. Вторая идентичная серия инъекций была проведена через 95 дней. В целом эксперимент длился 155 дней. В течение всего эксперимента брали гематологические и биохимические анализы кровь через регулярные промежутки времени, чтобы контролировать воздействие лечения на кровь и плотные жизненно важные органы. Когнитивные функции крыс были оценены четыре раза в течение этого периода, и в конце эксперимента животных умерщвляли и получали профили метилирования ДНК нескольких органов. Профили метилирования ДНК оценивали с использованием вышеупомянутых шести эпигенетических часов. Результаты, полученные из этих профилей, представлены на рисунке 2, который показывает, что эпигенетический возраст старых и молодых крыс легко различим по всем шести часам. Важно отметить, что плазменная обработка старых крыс очень сильно и значительно снижает эпигенетический возраст крови, печени и сердца до уровней, сопоставимых с молодыми крысами.
Согласно шести эпигенетическим часам, плазменная фракция омолаживала печень на 73,4% (от 63% до 81% в зависимости от времени, дополнительная таблица 8), кровь на 52% (от 47 до 56%), сердце на 52 % (от 40 до 74%) и гипоталамус на 11% (от 1 до 20%). Эффект омоложения становится еще более выраженным, если мы используем последние версии наших эпигенетических часов: печень 75%, кровь 66%, сердце 57%, гипоталамус 19%. Согласно окончательной версии эпигенетических часов, среднее омоложение по четырем тканям составило 54,2%. Другими словами, лечение более чем вдвое уменьшило эпигенетический возраст (Рисунок 2I-P).
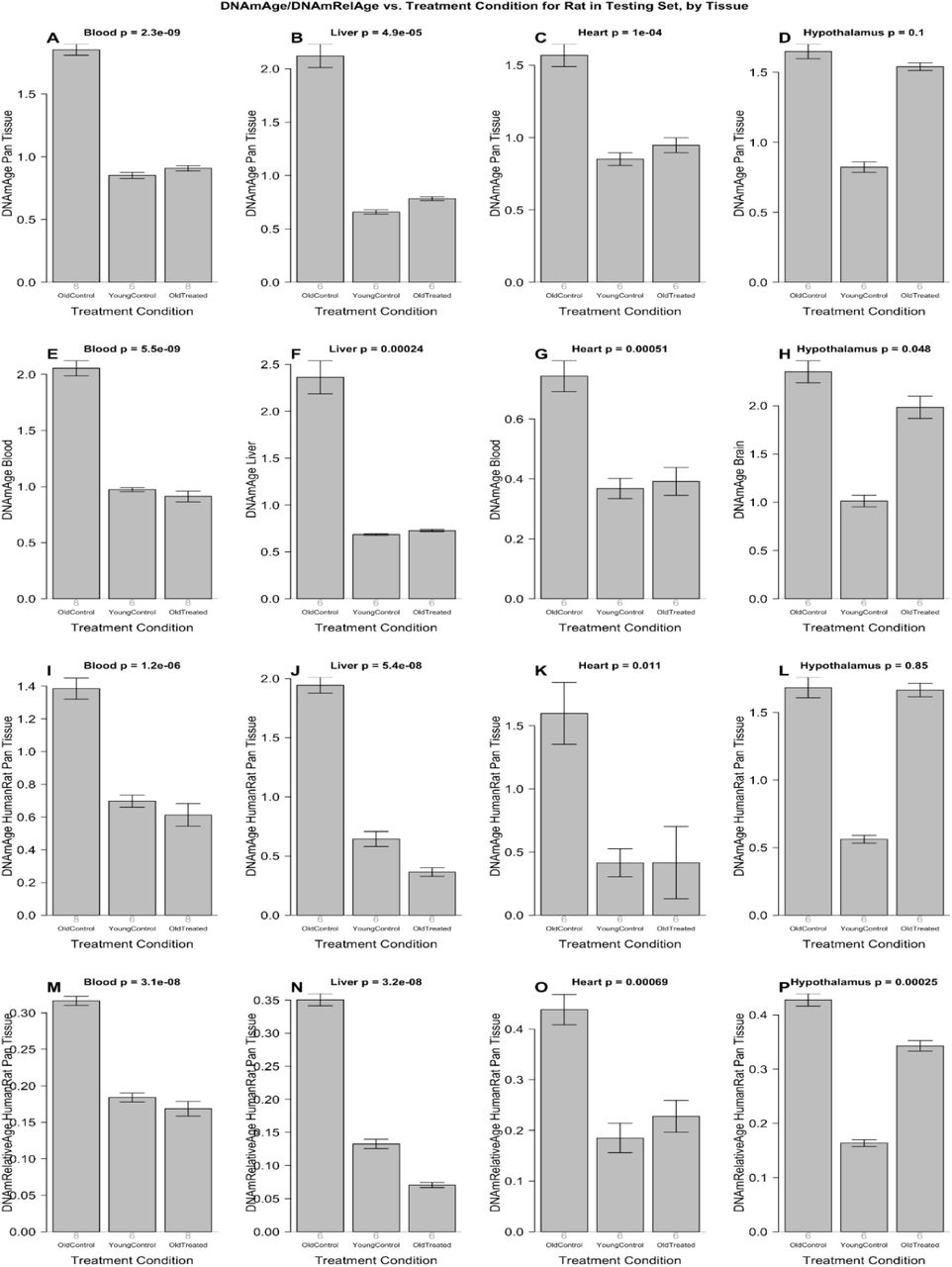 Рисунок 2: Анализ эпигенетических часов результатов обработки фракцией плазмы. Шесть эпигенетических часов применены к независимым данным испытаний для четырех типов тканей крысы (столбцы): кровь, печень, сердце и гипоталамус. A-D) Крысиные пантканевые часы. E) Крысиные кровяные часы F) Часы печени крысы. Г) крысиные кровяные часы. H) Часы мозга крысы, применяемые к гипоталамусу. I-L) Измерение абсолютного возраста по часам человека-крысы. M-P) Измерение по часам человека-крысы относительного возраста, определяемого как возраст / максимальная продолжительность жизни вида. На каждой гистограмме указано среднее значение и одна стандартная ошибка. Значения P являются результатом анализа отклонений. Значения р-критерия Стьюдента являются результатом сравнения двух групп старых контролей (левая полоса) со старыми обработанными образцами (правая полоса), то есть молодые контроли были опущены.
Рисунок 2: Анализ эпигенетических часов результатов обработки фракцией плазмы. Шесть эпигенетических часов применены к независимым данным испытаний для четырех типов тканей крысы (столбцы): кровь, печень, сердце и гипоталамус. A-D) Крысиные пантканевые часы. E) Крысиные кровяные часы F) Часы печени крысы. Г) крысиные кровяные часы. H) Часы мозга крысы, применяемые к гипоталамусу. I-L) Измерение абсолютного возраста по часам человека-крысы. M-P) Измерение по часам человека-крысы относительного возраста, определяемого как возраст / максимальная продолжительность жизни вида. На каждой гистограмме указано среднее значение и одна стандартная ошибка. Значения P являются результатом анализа отклонений. Значения р-критерия Стьюдента являются результатом сравнения двух групп старых контролей (левая полоса) со старыми обработанными образцами (правая полоса), то есть молодые контроли были опущены.
Эпигенетические часы являются привлекательными агрегированными биомаркерами, поскольку они суммируют информацию о многих CpGs в одном числе (оценка возраста). Тем не менее, может быть любопытно взглянуть на реакцию на терапию отдельных CpG. Мета-анализ возрастного метилирования отдельных CpG в 13 необработанных тканях крысы отрицательно коррелировал с таковым в 4 тканях животных, обработанных фракцией плазмы (r = -0,62, приложение, рис 5А). Эта обратная корреляция также может наблюдаться, когда ткани анализируются индивидуально. Что касается крови, вызванные лечением изменения метилирования отрицательно коррелировали, r = -0,64, с возрастными изменениями (приложение, рис 5D). Для мозга, печени и сердца обратные корреляции были r = -0,38 (приложение, рис 5C), r = -0,61 (приложение, рис 5E) и r = -0,47 (приложение, рис 5F) соответственно. Таким образом, метилирование в отдельных CpGs, которое обычно изменяется с возрастом, было эффективно обращено путем обработки фракцией плазмы.
Физические и наружные эффекты
Уменьшение эпигенетического возраста у крыс, получавших плазменную фракцию, является особенно значительным, поскольку, по-видимому, это указывает на то, что старение является скоординированным процессом, а не стохастическим, происходящим независимо между различными органами. Перед дальнейшим рассмотрением этого понятия необходимо определить, действительно ли уменьшение эпигенетического возраста является биологически значимым. Другими словами, сопровождается ли омоложение эпигенетического возраста изменениями в других хорошо охарактеризованных возрастных конечных точках. Не менее важной является необходимость определения того, вызывало ли лечение фракцией плазмы какие-либо побочные эффекты.
Вес крыс в течение всего эксперимента контролировали через регулярные интервалы, и графики из приложения рис. 6А показывают, что обработка плазменной фракцией никоим образом не влияла на потребление пищи и аппетит, поскольку масса обработанных и необработанных крыс была сходной, и не было никаких явных признаков физической или поведенческой аномалии. Эти особенности повторяли те, которые мы наблюдали в среднесрочном (30-дневном) пилотном эксперименте, где, кроме того, мы также измерили и обнаружили, что сила хвата старых крыс значительно улучшилась при этой обработке (приложение, рис. 6В). Через 15 дней после обработки сила обработанных фракцией плазмы старых крыс была неотличима от таковой у молодых. Эти и другие обнадеживающие результаты среднесрочных экспериментальных исследований побудили нас к более длительному (155-дневному) исследованию с новым препаратом фракции плазмы. Результаты этого исследования составляют основной корпус этого отчета. Эти два независимых исследования дали сходные результаты, которые варьировались только по величине, что согласуется с их различной продолжительностью. Гистологические исследования различных органов не выявили каких-либо явных отклонений после 155 дней лечения (приложение, рис. 7 и таблица 4). Вместо этого окрашивание маслом Red O показало, что накопление жира в старых тканях было значительно снижено у крыс, получавших плазменную фракцию (приложение, рис. 8).
Показатели клеток крови и гематология
Для мониторинга потенциального воздействия фракции плазмы на кровь крыс мы измерили уровни гемоглобина, средний корпускулярный объем (MCV), средний корпускулярный гемоглобин (MCH), среднюю концентрацию корпускулярного гемоглобина (MCHC), уровни гематокрита (HCT) и подсчитали число эритроцитов, тромбоцитов, лейкоцитов и лимфоцитов через 0, 60 и 155 дней от начала лечения. Эти показатели крови являются информативными признаками нарушения функции костного мозга и жизненно важных органов и, что важно, они варьируются в зависимости от возраста животного. На рис. 9 из приложения видно, что все эти показатели крови были очень разными у молодых и старых крыс в начале эксперимента, и со временем обработка плазменной фракцией подтолкнула все эти параметры, за исключением тромбоцитов, от значений, демонстрируемых старыми необработанными крысами, в сторону молодых. Это легко увидеть по движению оранжевых точек, представляющих обработанных старых крыс на каждом графике, в сторону синих точек, представляющих молодых крыс. Лечение плазменной фракцией не привело к изменениям показателей крови, которые указывали бы на дисфункцию органов. Вместо этого она омолаживала кровь крыс, что согласуется со значительным снижением эпигенетического возраста их крови, измеряемого как мультитканевыми часами крыс, так и кровяными часами.
Биомаркеры для жизненно важных органов
Чтобы выяснить влияние обработки фракцией плазмы на жизненно важные органы, мы измерили уровни следующих биомаркеров через 30, 60, 90, 120 и 155 дней от начала эксперимента: билирубин, сывороточная глутамино-пировиноградная трансаминаза (SGPT) и сыворотка. глутамино-оксалоуксусная трансаминаза (SGOT) для мониторинга функции печени; триглицериды (TG), HLD и холестерин для мониторинга риска атеросклероза и болезней сердца, а также функции печени; глюкоза для мониторинга поджелудочной железы и диабета; и креатинин и азот мочевины крови для функции почек. Уровни всех этих биомаркеров у обработанных старых крыс были изменены в сторону значений молодых крыс, без исключения (рис. 3). Это легко увидеть по движению оранжевых точек, представляющих обработанных старых крыс на каждом графике, в сторону синих точек, которые представляют молодых крыс. В совокупности эти результаты показывают, что функция всех жизненно важных органов, протестированных с помощью их соответствующих биомаркеров, была омоложена обработкой плазменной фракцией. Это полностью согласуется с изменением эпигенетического возраста их сердец и печени.
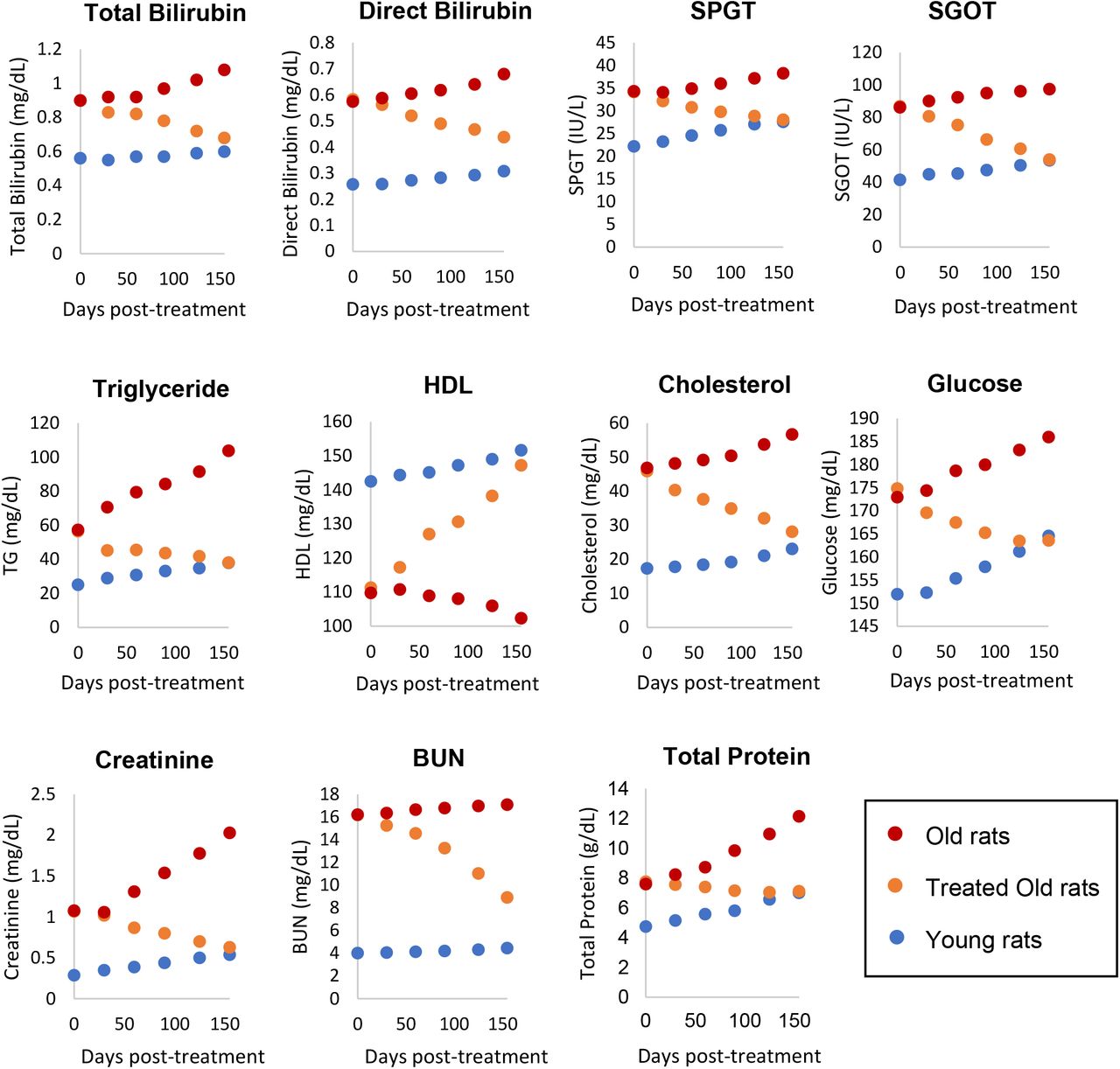 Рисунок 3: Оценка воздействия фракции плазмы на функции жизненно важных органов. Через 0, 30, 60, 90, 120 и 155 дней после начала эксперимента здоровье и функции жизненно важных органов (печени, сердца, почек и поджелудочной железы) 6 крыс в группе контролировали посредством измерений соответствующих биомаркеров. SPGT = сывороточная глутамино-пировиноградная трансаминаза, SGOT = сывороточная глутамино-оксалоуксусная трансаминаза, HDL = липопротеин высокой плотности и BUN = азот мочевины крови. Красные точки представляют точки данных старых крыс, оранжевые точки представляют обработанных старых крыс, а синие представляют молодых крыс. Для ясности нанесенные на график точки представляют средние значения от 6 крыс каждая. Подробные измерения каждого параметра со стандартными отклонениями приведены в дополнительной таблице 7.
Рисунок 3: Оценка воздействия фракции плазмы на функции жизненно важных органов. Через 0, 30, 60, 90, 120 и 155 дней после начала эксперимента здоровье и функции жизненно важных органов (печени, сердца, почек и поджелудочной железы) 6 крыс в группе контролировали посредством измерений соответствующих биомаркеров. SPGT = сывороточная глутамино-пировиноградная трансаминаза, SGOT = сывороточная глутамино-оксалоуксусная трансаминаза, HDL = липопротеин высокой плотности и BUN = азот мочевины крови. Красные точки представляют точки данных старых крыс, оранжевые точки представляют обработанных старых крыс, а синие представляют молодых крыс. Для ясности нанесенные на график точки представляют средние значения от 6 крыс каждая. Подробные измерения каждого параметра со стандартными отклонениями приведены в дополнительной таблице 7.
Когнитивная функция.
Снижение когнитивной функции является характерной особенностью увеличения возраста. Обучение и память, которые являются составными характеристиками когнитивных функций, снижаются не только у человека, но и у крыс, начиная с 12-месячного возраста (соответствующий возрасту человека 38 лет). Лабиринт Барнса использовался для измерения латентного периода, необходимого крысам для нахождения правильного выхода из лабиринта. Видеоматериалы, иллюстрирующие латентную картину трех крыс (молодых, старых и старых, не получавших лечения), можно найти в Приложении. В течение месяца после обработки фракции плазмы у крыс наблюдалось значительное снижение латентности к выходу (рис. 4), то есть они учились и запоминали лучше. После второго месяца крысы, подвергшиеся лечению, начали слегка снижать период задержки по сравнению со старыми крысами, не получавшими лечения, и они снова учились намного быстрее последних. К третьему месяцу стало ясно, что обработанные крысы запоминали лабиринт намного лучше, чем необработанные, даже с первого дня испытания, поскольку их период задержки был значительно уменьшен, и к концу периода тестирования их задержка была аналогична задержке у молодых крыс. Эта особенность была сохранена и повторена на четвертом месяце. В совокупности эти результаты показывают, что фракция плазмы улучшила обучение и память крыс. Интересно, что эпигенетический возраст обработанных образцов мозга крыс (гипоталамус) был ниже, чем у нелеченных старых, но менее заметно, по сравнению с уменьшением эпигенетического возраста крови, сердца и печени. Это наталкивает на многочисленные интересные мысли относительно понимания взаимосвязи между когнитивной функцией, биологическим возрастом и физическим здоровьем, которые будут более подробно рассмотрены в ходе обсуждения.
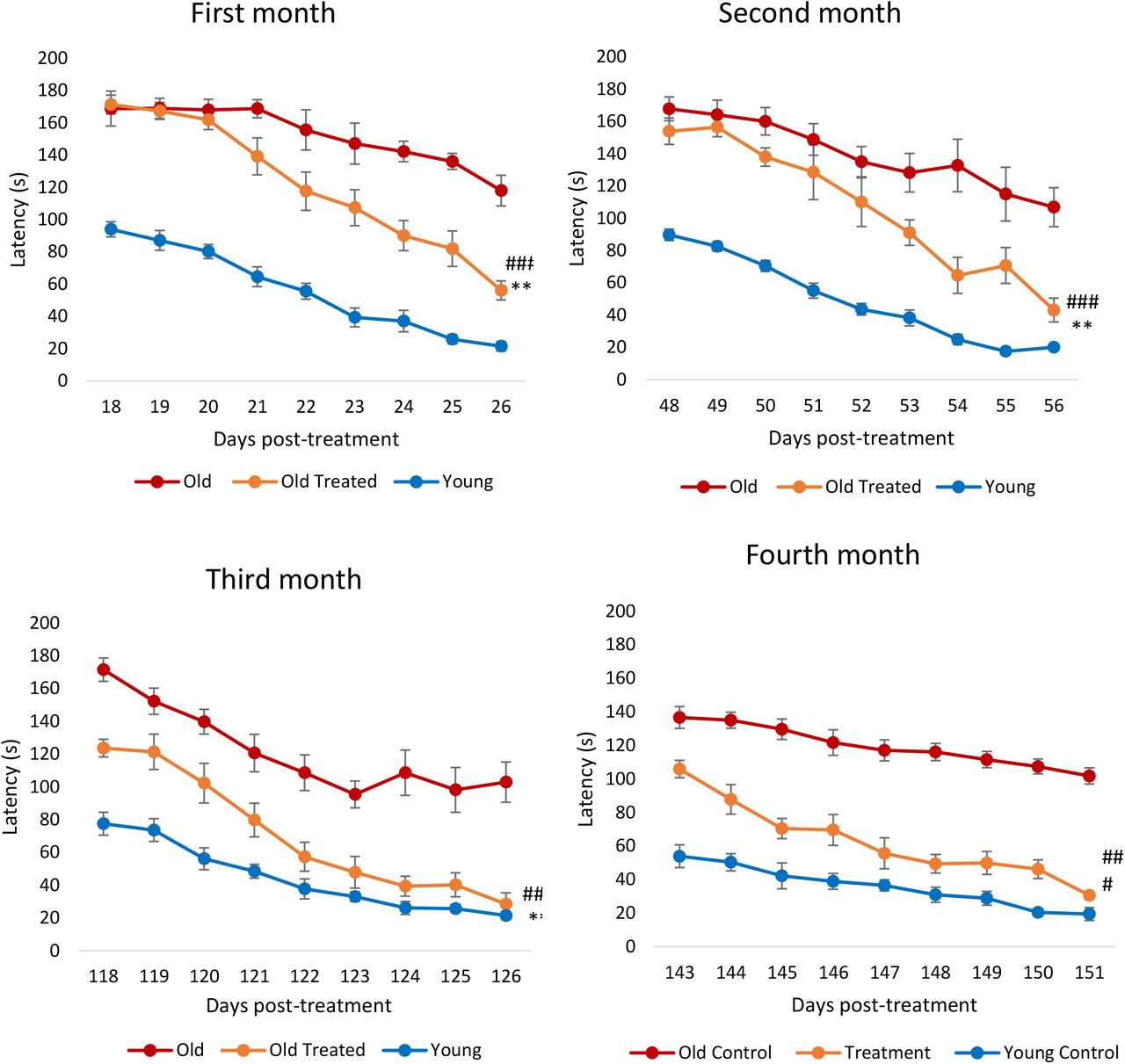 Рисунок 4: Оценка лечения фракцией плазмы по когнитивной функции (обучение и память). Крыс подвергали испытанию в лабиринте Барнса в течение первого-четвертого месяца с начала эксперимента. Каждая оценка состоит из девяти последовательных дней испытаний, в течение которых время (в секундах), требуемое крысам для нахождения аварийного отверстия (задержки), было записано и нанесено на график. Столбики ошибок отображают 2 стандартных ошибки.
Рисунок 4: Оценка лечения фракцией плазмы по когнитивной функции (обучение и память). Крыс подвергали испытанию в лабиринте Барнса в течение первого-четвертого месяца с начала эксперимента. Каждая оценка состоит из девяти последовательных дней испытаний, в течение которых время (в секундах), требуемое крысам для нахождения аварийного отверстия (задержки), было записано и нанесено на график. Столбики ошибок отображают 2 стандартных ошибки.
Клеточный стресс
Нет сомнений в том, что снижение эпигенетического возраста печени, сердца, мозга и крови за счет плазменной фракции сопровождалось поразительным улучшением функции этих органов. В дополнение к снижению функции органа с возрастом происходит усиление двух особенностей клеточного стресса, а именно окислительного стресса и хронического воспаления; их чрезмерность связана с множественными патологиями. Мы выполнили панель испытаний биомаркеров для этих двух признаков у тестируемых крыс.
Окислительный стресс
Окислительный стресс возникает в результате избытка активных форм кислорода (АФК) в клетках. Эта ситуация может возникнуть из-за перепроизводства АФК или снижения способности удалять или нейтрализовывать АФК. Хотя АФК на низких уровнях не вредны и даже необходимы, на более высоких уровнях они взаимодействуют с такими биомолекулами, как липиды, и нарушают их функцию. Измерение уровня малонового диальдегида (МДА), который является конечным продуктом перекисного окисления полиненасыщенных жирных кислот, позволяет выявить уровни клеточных АФК. Количество MDA было явно выше в мозге, сердце, легком и печени у старых крыс (рис. 5), и обработка плазменной фракцией снизила этот уровень до уровня молодых крыс. Следовательно, независимо от источника повышенных АФК у старых крыс, плазменная фракция, по-видимому, способна эффективно снижать ее.
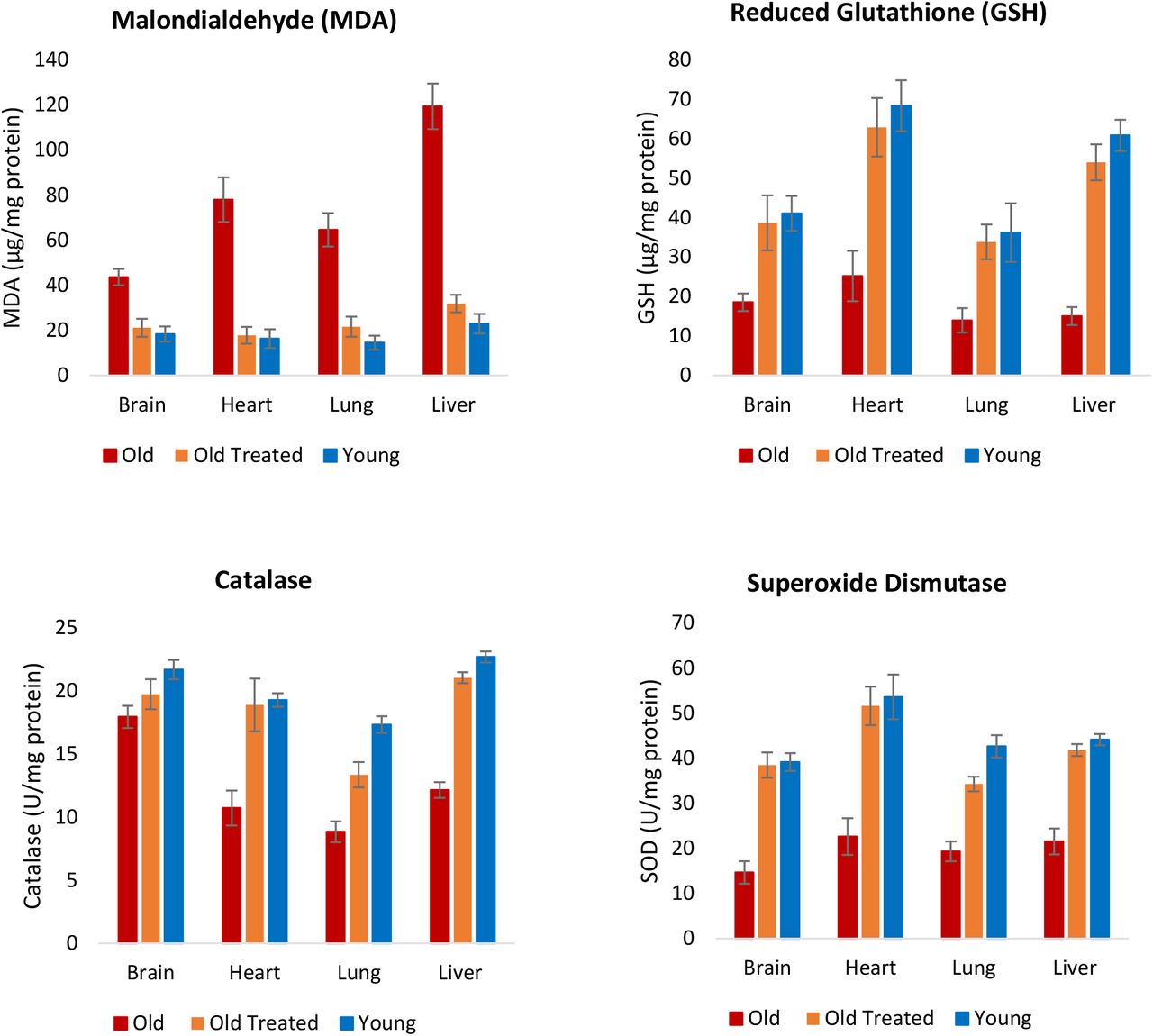 Рисунок 5: Оценка обработки фракцией плазмы при окислительном стрессе. В конце экспериментального периода в 155 дней определяли уровень перекисного окисления липидов, который является показателем внутриклеточного уровня активных форм кислорода (АФК), путем измерения количества малонового диальдегида (МДА), который является конечным продуктом полиненасыщенной жирной кислоты. перекисное окисление. Уровни трех антиоксидантов; Также были измерены пониженные уровни глутатиона, каталазы и супероксиддисмутазы, чтобы определить влияние обработки фракции плазмы на окислительный стресс. Столбики ошибок отображают 2 стандартных ошибки.
Рисунок 5: Оценка обработки фракцией плазмы при окислительном стрессе. В конце экспериментального периода в 155 дней определяли уровень перекисного окисления липидов, который является показателем внутриклеточного уровня активных форм кислорода (АФК), путем измерения количества малонового диальдегида (МДА), который является конечным продуктом полиненасыщенной жирной кислоты. перекисное окисление. Уровни трех антиоксидантов; Также были измерены пониженные уровни глутатиона, каталазы и супероксиддисмутазы, чтобы определить влияние обработки фракции плазмы на окислительный стресс. Столбики ошибок отображают 2 стандартных ошибки.
Помимо увеличения производства АФК, снижение эффективности в устранении АФК также способствует возрастанию его уровня. АФК нейтрализуются клеточными антиоксидантами, включая, но не ограничиваясь этим, восстановленный глутатион, каталазу и супероксиддисмутазу, которые работают совершенно по-разному. Уровни этих трех антиоксидантов были снижены в тканях старых необработанных крыс, но обработка плазменной фракцией увеличила их до уровней, сопоставимых с молодыми (Рисунок 5). Остается выяснить, было ли снижение уровней АФК, измеренное с помощью МДА, связано лишь с увеличением количества антиоксидантов, или же лечение плазменной фракцией также вызвало сопутствующее снижение выработки АФК от множественных и различных внутриклеточных источников. Тем не менее, конечная точка снижения уровня АФК у старых крыс до уровня молодых является еще одним свидетельством омолаживающего эффекта лечения.
Хроническое воспаление
Воспаление является важным ответом, который помогает защитить организм, но избыточное воспаление, особенно в отношении продолжительности этого ответа, может иметь очень пагубные последствия. Это происходит, когда воспаление не проходит и сохраняется неопределенное время; состояние, называемое хроническим воспалением, которое по причинам, недостаточно понятным, увеличивается с возрастом и связано с множеством состояний и патологий. Уровни двух самых надежных и распространенных биомаркеров хронического воспаления, интерлейкина 6 (IL-6) и фактора некроза опухоли α (TNF-α), у старых крыс были значительно выше (рис. 6), и они очень быстро снижались в течение нескольких дней при обработке фракцией плазмы до уровней, сопоставимых с таковыми у молодых крыс. Это было особенно заметно по IL-6. Со временем уровни этих воспалительных факторов начали постепенно повышаться, но они снова очень эффективно снижались после второго введения плазменной фракции на 95-й день. Снижение этих маркеров воспаления согласуется с профилем ядерного фактора erythroid 2-like 2 protein (Nrf2) , который играет основную роль в разрешении воспаления, частично за счет ингибирования экспрессии IL-6 и TNF-α. Nrf2 также индуцирует экспрессию антиоксидантов, которые нейтрализуют АФК, что также является важным признаком воспаления 39. Таким образом, фракция плазмы снижает окислительный стресс и хроническое воспаление, которые являются возраст-зависимыми пантканевыми стрессами, до уровней, обнаруженных у молодых крыс.
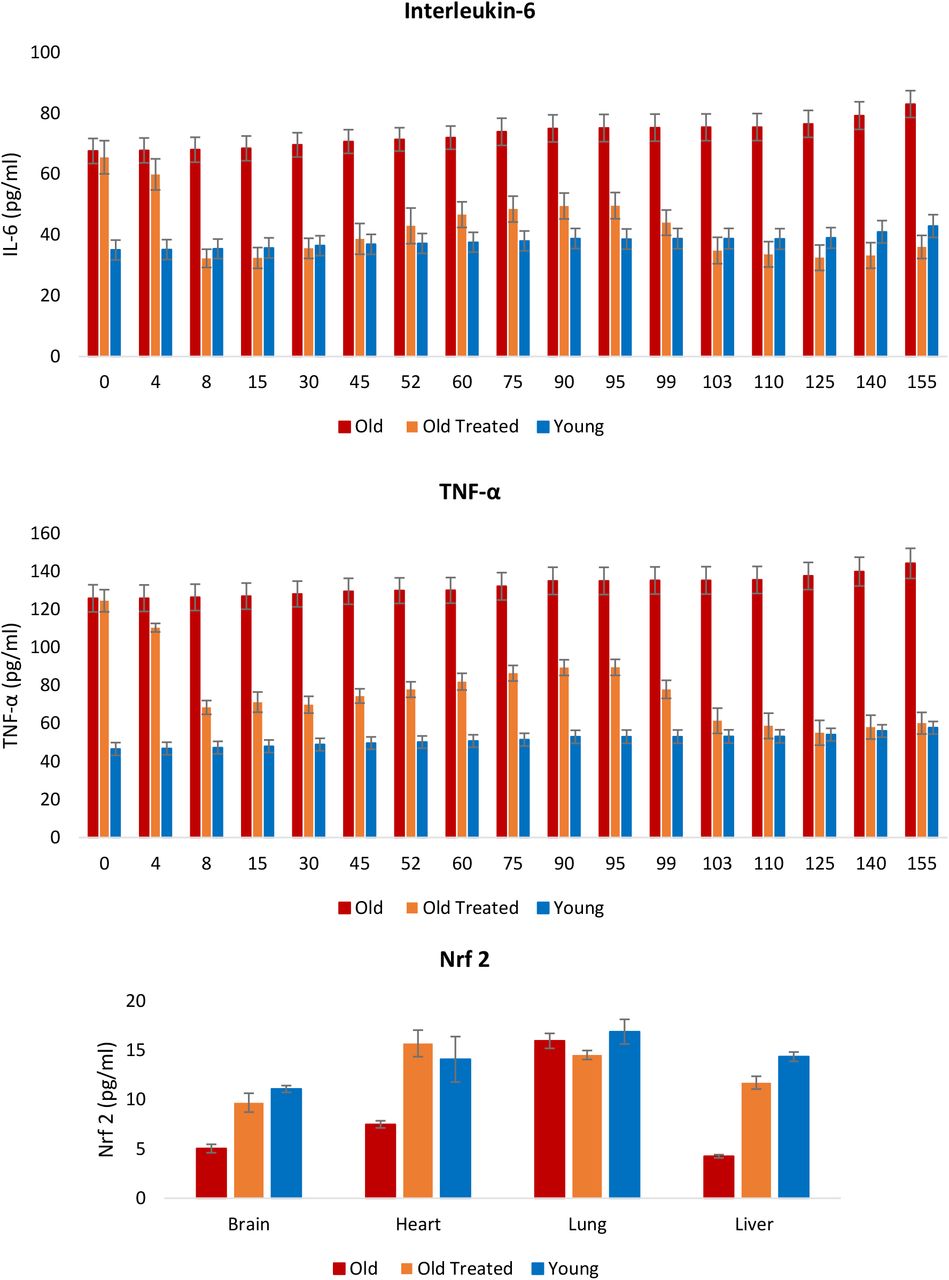 Рисунок 6: Оценка влияния лечения плазменной фракцией на хроническое и системное воспаление. Уровни интерлейкина-6 (IL-6) и фактора некроза опухоли α (TNF-α) в крови измеряли с регулярными интервалами в течение 155-дневного периода эксперимента. В конце эксперимента уровни Nrf2, ключевого модулятора воспаления и окислительного стресса, были измерены в мозге, сердце, легких и печени крыс. Столбики ошибок отображают 2 стандартных ошибки.
Рисунок 6: Оценка влияния лечения плазменной фракцией на хроническое и системное воспаление. Уровни интерлейкина-6 (IL-6) и фактора некроза опухоли α (TNF-α) в крови измеряли с регулярными интервалами в течение 155-дневного периода эксперимента. В конце эксперимента уровни Nrf2, ключевого модулятора воспаления и окислительного стресса, были измерены в мозге, сердце, легких и печени крыс. Столбики ошибок отображают 2 стандартных ошибки.
Клеточное старение
Одним из наиболее характерных факторов старения является сенесцентная клетка. Клетки стареют из-за множества возможных причин, включая исчерпывающую репликацию (репликативное старение), избыточную экспрессию онкогена или передачу сигналов о хроническом повреждении ДНК из-за нерепарируемой ДНК. Многие стареющие клетки включают экспрессию кислой бета-галактозидазы, которая известна как бета-галактозидаза, ассоциированная со старением (SA-β-галактозидаза). Поскольку наличие этой активности фермента сигнализирует о старческом состоянии клеток, SA-β-галактозидаза используется в качестве биомаркера стареющих клеток. Стареющие клетки окрашиваются в синий цвет, когда они снабжены субстратом SA-β-галактозидазы с кислотным pH, как это наблюдается при высоком уровне в мозге и печени старых крыс (рис. 7). Обработка плазменной фракцией в очень значительной степени снижала уровень стареющих клеток. В сердце и легких старых крыс очень мало стареющих клеток, и это не изменилось после лечения.
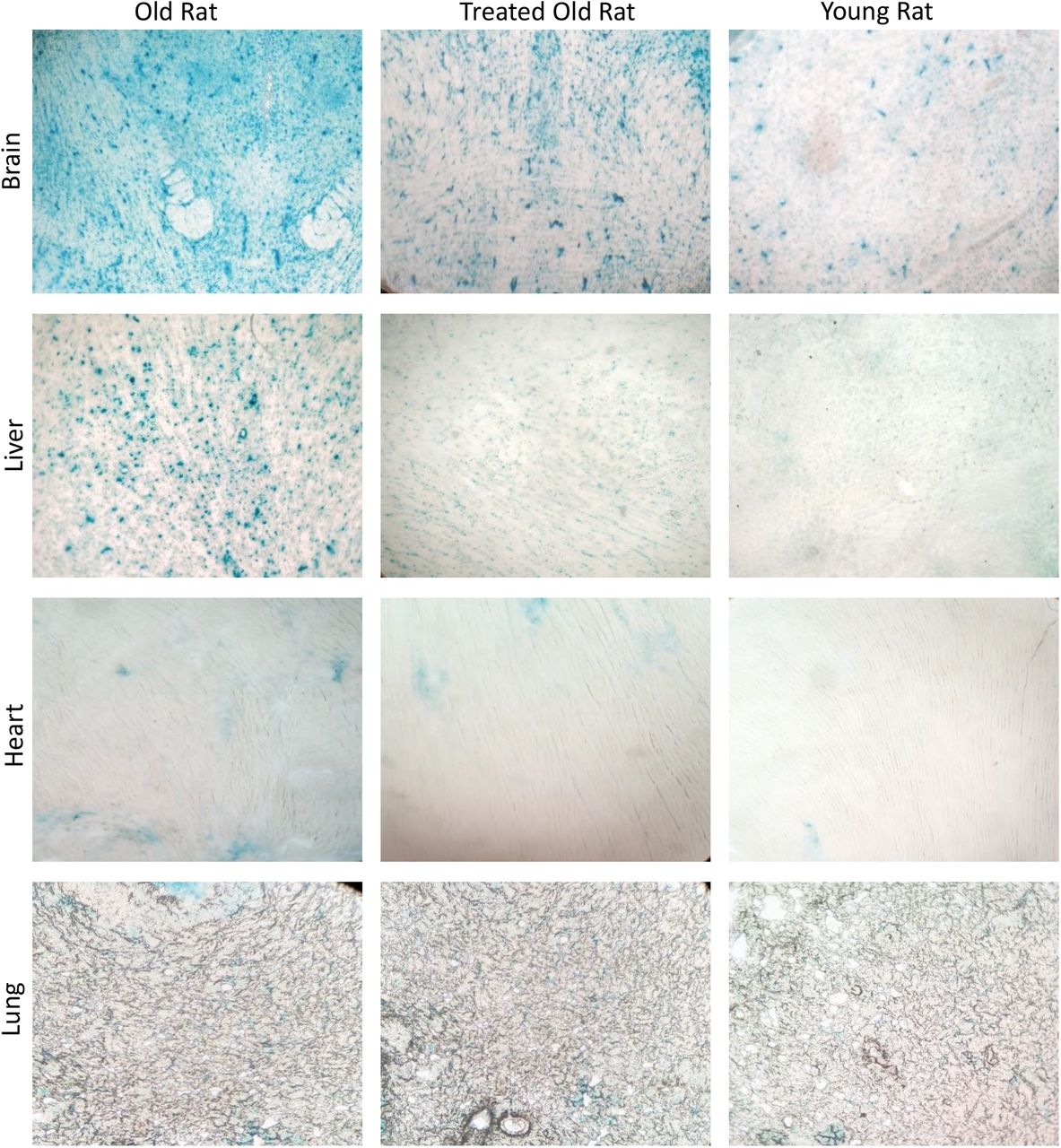 Рисунок 7: Оценка влияния обработки фракцией плазмы на клеточное старение. В конце экспериментального периода, составляющего 155 дней, стареющие клетки головного мозга, сердца, легких и печени старых крыс, старых крыс, получавших плазменную фракцию, и молодых крыс были окрашены на связанную со старением бета-галактозидазу, чья активность на субстрате обеспечивала окрашивание стареющих клеток в синий цвет.
Рисунок 7: Оценка влияния обработки фракцией плазмы на клеточное старение. В конце экспериментального периода, составляющего 155 дней, стареющие клетки головного мозга, сердца, легких и печени старых крыс, старых крыс, получавших плазменную фракцию, и молодых крыс были окрашены на связанную со старением бета-галактозидазу, чья активность на субстрате обеспечивала окрашивание стареющих клеток в синий цвет.
Обсуждение
Это исследование состоит из двух связанных частей; первая из которых касается разработки шести крысиных эпигенетических часов, которые впоследствии были использованы во второй части для исследования влияния лечения фракцией плазмы на возраст.
Разработка крысиных эпигенетических часов
Эпигенетические часы для людей нашли много биомедицинских применений, включая измерение возраста в клинических испытаниях на людях 22,40. Эти часы обеспечивают стандартное измерение состояния метилирования ДНК, как зависимость от хронологического возраста. Как ни впечатляет его точность, именно отклонение от этого стандарта было особенно важным, поскольку оно раскрыло связь между ускоренным эпигенетическим возрастом и связанным с этим повышенным риском множества состояний и патологий, что указывает на то, что эпигенетические часы связаны с биологическим возрастом. Это вдохновило на разработку подобных часов для животных, причем часы для мышей были особенно привлекательны, поскольку позволяют моделировать эпигенетический возраст в мышиной системе, и в то же время позволяют подвергнуть тщательной проверке существующие модели старения мыши в отношении эпигенетического. старения. Действительно, с тех пор были разработаны многочисленные мышиные эпигенетические часы, которые успешно прошли валидацию на таких факторах, как рапамицин, ограничение калорийности и абляция факторов роста, которые все хорошо характеризуются по своему воздействию на старение мышей 32-37. Хотя преимущества мыши как биологической модели в немалой степени зависят от их размера, это также создает ограничение в исследованиях, которые требуют регулярного интервала сбора достаточного количества крови для анализа, как это имело место во второй части этого исследования. Разработка шести эпигенетических часов крысы, описанных здесь, была основана на новых данных метилирования ДНК, которые были получены из тринадцати типов тканей крысы. Двое мультивидовых часов типа "человек крыса" показывают возможность построения эпигенетических часов для двух видов на основе одной математической формулы. Критическим шагом на пути преодоления видового барьера было использование массива метилирования ДНК млекопитающих, который профилировал 36 тысяч проб, высоко консервативных для многочисленных видов млекопитающих. Профили метилирования ДНК крыс представляют собой наиболее полный набор данных из всех сопоставимых метилом с одним базовым разрешением у крыс в разных тканях и возрастах. Мы ожидаем, что доступность этих часов и их впечатляющая производительность во второй части этого исследования обеспечат значительное повышение привлекательности крысы как биологической модели в исследованиях старения.
Помимо своей полезности, эти часы показывают несколько существенных особенностей в отношении биологии старения. Во-первых, пантканевые часы крысы вновь подтверждают , что уже имплицировали пантканевые часы человека, а именно то, что старение может быть скоординированным биологическим процессом, который согласованно происходит во всем организме. Учитывая, что система кровообращения орошает и связывает все органы, более вероятно, что регуляция и гармонизация возраста осуществляются системно. Во-вторых, способность объединять эти двое пантканевых часов в единые пантканевые часы человека и крысы свидетельствует о высокой консервативности процесса старения у двух эволюционно удаленных видов. Это подразумевает, хотя и не гарантирует, что методы лечения, которые изменяют эпигенетический возраст крыс, измеренный с использованием часов человека-крысы, могут оказывать аналогичное воздействие на людей. Если это будет подтверждено, это будет серьезным изменением в исследованиях старения. Хотя механизм сохранения старения может быть одинаково выведен из существования множества отдельных часов для других млекопитающих (мышь, собака), единственная формула часов человека-крысы, которая в равной степени применима к обоим видам, эффективно демонстрирует этот факт. Очевидно, что механизм, лежащий в основе старения, является очень древним и важным биологическим процессом, который сохраняется во времени во всем царстве млекопитающих.
Объединение двух видов с очень разной продолжительностью жизни, таких как крыса и человек, ставит неизбежную проблему неравного распределения точек данных по возрастному диапазону. Кластеризация более короткоживущих и более долгоживущих видов в нижнем и более высоком возрастном диапазоне, соответственно, может исказить точность часов, когда они применяются по отдельности к любому из видов. Этот эффект смягчается созданием пантканевых часов относительного возраста человека и крысы, в которые включается предполагаемый возраст в контексте максимальной продолжительности жизни, зарегистрированной для соответствующих видов. В дополнение к минимизации перекоса, эта математическая операция также генерирует гораздо более биологически значимое значение, поскольку она указывает относительный биологический возраст и приспособленность организма по отношению к его собственным видам. Этот принцип станет важной особенностью для включения в будущие составные эпигенетические часы разных видов.
Терапия плазменной фракцией
Несмотря на то, что эксперименты по парабиозу, показывающие, что органы старых мышей извлекают биологическую выгоду от совместного использования кровообращения с молодыми, проводились десятилетия назад, впоследствии мало что было сделано, чтобы извлечь выгоду из этого замечательного наблюдения, вплоть до недавнего времени, когда эти эксперименты были успешно повторены и значительно расширены. 8,10. Было показано, что перенос плазмы у молодых также работает 8. Это было важно по двум причинам, первая из которых заключалась в том, что она подтвердила мнение о том, что именно факторы крови улучшают состояние старых животных, а не то, что они получают пользу от более здоровых и лучше функционирующих жизненно важных органов. молодых животных. Во-вторых, он предоставил гораздо менее требовательный и более гуманный способ исследования этого явления.
Предполагалось, что улучшение функции органов у старых животных быстро и интуитивно указывает на омоложение. Это, однако, не единственная достоверная интерпретация, поскольку в равной степени возможно, что органы старых животных были улучшены в функции, но без влияния на их эпигенетическое состояние или эпигенетический возраст. Это подымает постоянный вопрос о том, что же именно стареет. Если старение определяется исключительно в функциональном отношении как снижение функции органов и тканей, то улучшение этих функций может быть логически истолковано как омоложение. Очевидно, что эта перспектива натолкнется на многочисленные концептуальные препятствия в реальных и теоретических сценариях, которые здесь не будут рассматриваться. Эта проблема осталась бы неразрешимой, если бы возраст мог измеряться только временем, а не молекулярным методом.
Улучшение функции всех тестируемых органов коррелировало со значительным снижением их эпигенетического возраста, за исключением мозга, где снижение является значительным только для некоторых наших часов для крыс (например, на часах мозга и часах относительного возраста человека и крысы). Тот факт, что крысы показывают лучшие результаты в тесте лабиринта, имеет два не исключающих друг друга объяснения: это может быть следствием молекулярного омоложения мозга или того, что оно отражает более здоровую функцию мозга благодаря общим физическим улучшениям.
Это, конечно, поднимает связанный и не менее интересный вопрос: почему лечение плазменной фракцией не уменьшает эпигенетический возраст мозга на такую же величину, как и другие органы? Мы можем приступить к решению этого вопроса только после того, как впервые поймем, что влечет за собой эпигенетическое старение. В настоящее время наши знания в этой области остаются ограниченными, но, тем не менее, ясно, что: (а) эпигенетическое старение отличается от процесса клеточного старения и истощения теломер 41, (б) несколько типов стволовых клеток ткани эпигенетически моложе, чем не стволовые клетки той же ткани 42,43, (c) значительное количество возрастных сайтов метилирования, включая некоторые CpG часов, проксимальны к генам, белки которых участвуют в процессе развития 44, (d) эпигенетические часы связаны со сроками развития 22,45 и (е) имеют отношение к эпигеномной системе обслуживания 20,46. В совокупности эти признаки указывают на то, что эпигенетическое старение тесно связано с процессом развития и гомеостатическим поддержанием организма в зрелом возрасте. В то время, как большинство органов тела обновляются в течение жизни хозяина, хотя и с разной скоростью, мозг, по-видимому, делает это, в лучшем случае, гораздо медленнее 27,47. В то время, как большинство тканей содержат стволовые клетки, которые необходимы для пополнения и оборота, стволовые клетки в мозге взрослого были обнаружены только в определенной и очень ограниченной области субвентрикулярной зоны, обонятельной луковице (у крыс), гиппокампе и пролиферативной области гипоталамуса 48. Например, если омолаживающий эффект лечения плазменной фракцией опосредуется через процесс развития и вовлекает стволовые клетки ткани, то его влияние на эпигенетический возраст мозга, по-видимому, будет скромным, что действительно и происходит. Однако следует отметить, что улучшение функции мозга зависит не столько от нейрогенеза, сколько от образования синапсов и таких факторов, как NMDA-рецепторы, плотность которых снижается с возрастом 49,50.
Помимо омоложения жизненно важных органов обработанных крыс, фракция плазмы также влияла на два фундаментальных физиологических процесса, которые лежат в основе множества патологий, а именно окислительный стресс и воспаление. В течение недели лечения маркеры хронического воспаления (IL-6 и TNF-α) были значительно снижены и оставались низкими на протяжении всего эксперимента. Аналогично, маркеры окислительного стресса в мозге, сердце, легких и печени, которые были намного выше у контрольных старых крыс, были в конце экспериментального периода, неразличимыми между обработанными фракцией плазмы старыми крысами и молодыми. Одновременно с этим резким снижением окислительного стресса были повышены уровни антиоксидантов (GSH, Catalase и SOD) в этих тканях, что указывает на то, что модулирование уровней АФК до уровня у молодых крыс является по крайней мере одним способом, с помощью которого фракция плазмы подавляет окислительный стресс. Остается выяснить, снижается ли скорость генерации АФК. Уровни Nrf2, транскрипционного фактора, который влияет на окислительный стресс, а также воспаление, при терапии фракцией плазмы старых крыс были подняты до уровня молодых, что указывает на еще один уровень, с помощью которого это лечение модулирует эти два критических процесса. В совокупности эти результаты показывают, что обработка фракцией плазмы влияет не только на явную работу органов, но и на основные физиологические процессы, которые имеют решающее значение для оптимального функционирования органов и здоровья.
Применяемая здесь система обработки плазменной фракцией была протестирована несколько раз с воспроизводимым успехом. В дополнение к улучшениям в клинических показателях старения, наша работа впервые показывает, что лечение плазменной фракцией также значительно снижает эпигенетический возраст нескольких тканей. Это, очевидно, очень эффективно омолаживает несколько тканей у старых крыс; требуется только две серии инъекций. Омоложение органов, не являющихся кровью, в результате этого внутривенного лечения в сочетании с обращением эпигенетических часов в этих органах подтверждает мнение о том, что старение можно системно контролировать, по крайней мере частично, посредством системы кровообращения через плазму в качестве посредника. Важно оценить потенциальное изменение в здравоохранении, которое может внести лечение плазменной фракцией и эпигенетические часы. Вместо лечения одного заболевания за раз и, в конечном итоге, сопутствующих заболеваний, лечение плазменной фракцией путем омоложения организма может быть в состоянии системно снизить риск возникновения нескольких заболеваний, в первую очередь.
Материалы и методы
материалы
В общей сложности мы проанализировали n = 593 образца ткани крысы из 13 различных источников ДНК (дополнительная таблица 1). Возраст варьировался от 0,0384 лет (то есть 2 недели) до 2,3 лет (то есть 120 недель). Данные о крысах состояли из обучающей выборки (n = 517) и тестового набора (n = 76). Для создания часов на крысах мы добавили n = 850 образцов тканей человека к обучающей выборке. Сначала мы настроили / разработали эпигенетические часы, используя обучающие данные (n = 517 тканей). Затем мы оценили данные независимых экспериментов (n = 76 для оценки эффекта обработки фракцией плазмы (дополнительная таблица 3). Мы использовали n = 517 тканей для настройуи 4 часов: пантканевые часы, основанные на всех доступных тканях, часы мозга, основанные на областях всего мозга - гиппокампе, гипоталамусе, неокортексе, черной субстанции, мозжечке и гипофизе, часы печени на основе всех образцов печени и часы крови.
методы
Ткани крысы были получены в 4 разных лабораториях в трех странах: (i) Индия: исследования в области наногеники в сотрудничестве с Университетом фармацевтики SVKM, Университет NMIMS (К. Сингх), (ii) США: Университет медицинских наук штата Теннесси (Х. Чен). ) и Висконсинский медицинский колледж (LC Solberg Woods), и (iii) Аргентина: Университет Ла-Плата (Р. Гойя).
Крысы из Теннесси и Висконсина
Образцы крови (n = 48). Самцов и самок разнородных племенных крыс разводили в Медицинском колледже штата Висконсин (Solberg Woods Lab) или в Центре медицинских наук Университета Теннесси (Hao Chen Lab). Популяции гетерогенного запаса (ГС) были первоначально созданы путем скрещивания восьми инбредных штаммов с последующим поддержанием колонии таким образом, чтобы свести к минимуму инбридинг, что позволило получить генетическое картирование множества сложных признаков с высокой разрешающей способностью 51. Крысы были умерщвлены в разном возрасте передозировка изофлурана (> 5%). Стволовая кровь была собрана немедленно и хранилась при -80 ° C до обработки. Образцы крови обрабатывали стрептокиназой (60-80 МЕ / 200 мкл крови, инкубация в течение ночи при 37 ° C) и ДНК экстрагировали с использованием мини-набора QiaAmp Blood (Qiagen Cat No./ID: 51304) в соответствии с инструкциями производителя. Все процедуры были одобрены Институциональным комитетом по уходу и использованию животных Центра медицинских наук Университета Теннесси или Медицинским колледжем штата Висконсин и следовали Руководству NIH по уходу и использованию лабораторных животных. Геномную ДНК выделяли из образцов ткани, главным образом, с использованием химии Puregene (Qiagen).
ДНК из печени извлекали вручную и из крови с использованием автоматической системы Autopure LS (Qiagen). Из тканей и образцов свернувшейся крови ДНК извлекали вручную, используя QiaAmp DNA Blood Midi Kit и DNeasy Tissue Kit в соответствии с протоколом производителя (Qiagen, Valencia, CA). ДНК из ВА10 экстрагировали на автоматизированной платформе для экстракции нуклеиновых кислот Anaprep (Biochain) с использованием метода экстракции на основе магнитных шариков и набора для экстракции ДНК из ткани (AnaPrep).
Крысы из Университета Ла-Плата (лаборатория Р. Гойи).
Различные типы тканей / клеток (жировая, кровь, мозжечок, гиппокамп, гипоталамус, печень, неокортекс, яичники, гипофиз, кожа, черная субстанция): молодые (3,7 месяца, n = 11), поздние взрослые (LA, 8,0 месяца, n = 9), использовали самок среднего возраста (MA, 15,7 мес., n = 6) и старых (25,5 мес., n = 14) самок крыс Sprague-Dawley (SD), выращенных в нашем институте. Животных содержали в комнате с контролируемой температурой (22 ± 2ºC) в цикле свет / темнота 12:12 ч. Еда и вода были доступны ad libitum. Все эксперименты на животных проводились в соответствии с Руководством по защите животных NIH (INIBIOLP's Assurance Assurance No A5647-01) и одобрено нашим Институциональным IACUC (Протокол № P05-02-2017).
Сбор образцов тканей: перед умерщвлением путем обезглавливания крыс взвешивали, у животных отбирали кровь из хвостовых вен под анестезией изофлураном и собирали в пробирки, содержащие 10 мкл EDTA 0,342 моль / л для 500 мкл крови. Мозг был удален, осторожно разорвав зрительный и тройничный нервы и стебель гипофиза (чтобы не разрывать гипофиз), взвешен и помещен на холодную тарелку. Все области мозга были вскрыты одним экспериментатором (см. Ниже). Череп был передан второму экспериментатору, отвечающему за рассечение и взвешивание аденогипофиза. Остальная часть тела была передана другим 2 или 3 экспериментаторам, которые рассекали и собирали цельные яичники, образец ткани печени, жировой ткани и ткани кожи из дистальной части хвостов.
Рассечение области мозга: префронтальная кора, гиппокамп, гипоталамус, черная субстанция и мозжечок быстро рассекались на холодной платформе, чтобы избежать деградации тканей. После вскрытия каждый образец ткани сразу помещали в 1,5 мл пробирку и на мгновение погружали в жидкий азот. Протокол вскрытия мозга был следующим. Сначала для удаления обонятельной луковицы был сделан фронтальный венечный срез, затем мозжечок отделяли от мозга и продолговатого мозга с помощью щипцов. Чтобы изолировать медиальный базальный гипоталамус (MBH), мозг помещали брюшной стороной вверх, и в центре среднего возвышения был сделан второй коронарный срез (-3,6 мм относительно брегмы). Часть MBH была взята из переднего блока головного мозга, а другая часть из заднего блока в обоих случаях с помощью щипцов. Гиппокамп был рассечен от коры в обоих полушариях с помощью щипцов. Эту процедуру также выполняли на передних и задних блоках, альтернативно размещая хвостовую сторону мозга вверх и ростральную сторону вверх. Чтобы вскрыть черную субстанцию, в каждом полушарии из задней части мозга удаляли срез ткани толщиной 1 мм (-4,6 мм, относящийся к брегме) с помощью щипцов. Наконец, передний блок был помещен спинной стороной вверх, чтобы отделить префронтальную кору. С помощью острого скальпеля был сделан разрез в 2 мм от продольной трещины, и еще один разрез был сделан в 5 мм от нее. Кроме того, были сделаны два перпендикулярных разреза на расстоянии 3 мм и 6 мм от самой ростральной точки с получением блока префронтальной коры размером 9 мм2. Эта процедура была выполнена в обоих полушариях и двух префронтальных областях, собранных в трубке с кодовой меткой.
Передняя часть гипофиза: с помощью щипцов твердое вещество, покрывающее железу, было удалено, оставив орган свободным на sella turcica. Нервная доля была аккуратно отделена от передней доли гипофиза (AP), которая затем была осторожно поднята с помощью тонких изогнутых щипцов с наконечниками, направленными вверх. Он был быстро взвешен, затем помещен в пробирку и немедленно помещен в жидкий азот.
Яичники: Половой аппарат был рассечен путем разрезания брыжейки, чтобы изолировать рога матки, трубчатый яйцевод, яичники и соединение между анусом / прямой кишкой и вульвой / влагалищем, оставляя единицу половых органов и мочевого пузыря изолированной. Яичники были тщательно отделены от яйцеводов; жир вокруг яичников также был удален. Обе гонады были помещены в одну пробирку Эппендорфа и немедленно помещены в жидкий азот.
Печень: удаление ткани печени производилось путем разрезания части средней доли (0,5 см х 0,5 см). Ткань помещали в пробирку и немедленно сохраняли, погрузив в жидкий азот.
Жировая ткань: образцы жировой ткани были получены из жировой ткани тонкой кишки.
Кожа хвоста: Для кожной ткани 5 см дистальной части хвоста разрезали ножницами. Кожа была отделена, а волосы удалены скальпелем. Ткань помещали в пробирку и хранили, как описано для других тканей.
ДНК извлекали из крови на автоматизированной платформе для экстракции нуклеиновых кислот под названием QiaSymphony (Qiagen) с помощью набора для экстракции на основе магнитных шариков, QIAsymphony DNA Midi Kit (Qiagen). ДНК извлекали из ткани на автоматизированной платформе для экстракции нуклеиновых кислот под названием Anaprep (Biochain) с помощью набора для экстракции на основе магнитных шариков, Tissue DNA Extraction Kit (Biochain). ДНК из областей мозга экстрагировали с использованием автоматизированной платформы для экстракции нуклеиновых кислот под названием QIAcube HT (Qiagen) с набором для экстракции column-based QIAamp 96 DNA QIAcube HT Kit (Qiagen).
Крысы из исследовательской группы Nugenics
Использовали крыс Sprague Dawley обоего пола, из которых собирали кровь, весь мозг, сердце и печень. Были подготовлены две партии или образцы: первая партия была предназначена для настройки эпигенетических часов: n = 42 образца крови, n = 18 всего мозга, n = 18 сердца, n = 18 образцов печени. Вторая партия тестового набора включала n = 76 образцов ткани (n = 22 крови, n = 18 печени, n = 18 сердца, n = 18 гипоталамуса). Данные испытаний использовались для оценки эффекта лечения в 3 состояниях: молодые (30-недельного возраста) и обработанные старые образцы (109 недель) и необработанные старые образцы (снова 109 недель). Мы оценили 4 источника ДНК: кровь (n = 18), печень (n = 18), сердце (n = 18) и гипоталамус (n = 18). Номер утверждения комитета по этике - CPCSEA / IAEC / P-6/2018.
Самцов крыс Sprague Dawley 8 недель (200-250 г) и 20 месяцев (400-450 г) закупали в Национальном институте биологических наук, Пуна, Индия. Животных содержали в помещении приюта для животных Фармацевтической школы при университете NMIMS SVKM, Мумбаи, во время исследования в стандартных условиях (циклы свет: темнота, 55-70% относительной влажности) при температуре 22 ± 2 ° C с свободный доступ к воде и стандартной подаче гранул (Nutrimix Std-1020, Nutrivet Life Sciences, Индия). Животных акклиматизировали в лабораторных условиях в течение семи дней до начала исследования. Протокол эксперимента был утвержден Комитетом по этике животных. Номер официального утверждения: CPCSEA / IAEC / P-75/2018. Крыс умерщвляли в разном возрасте путем передозировки изофлурана (> 5%). Стволовая кровь была собрана немедленно и хранилась при -80 ° C до обработки. 100 мкл образца крови обрабатывали 20 мкл протеиназы К, а затем объем доводили до 220 мкл с помощью фосфатно-солевого буфера (PBS) в 1,5 мл или 2 мл микроцентрифужной пробирке. 200 мкл буфера AL тщательно перемешивали с этой смесью путем встряхивания и инкубировали при 56 ° C в течение 10 минут. Затем к образцу добавляли 200 мкл этанола (96–100%) и тщательно перемешивали путем встряхивания, и ДНК экстрагировали с использованием набора для крови и тканей Qiagen DNeasy, Qiagen Cat No./ID: 69504, следуя инструкциям производителя. Протокол исследования был утвержден Комитетом по этике институциональных животных (номер для утверждения CPCSEA / IAEC / P-6/2018), который был сформирован в соответствии с нормами Комитета по контролю и надзору за экспериментами на животных (CPCSEA), Правительство Индии и соблюдало стандартные руководящие принципы по обращению с экспериментальными животными.
В соответствии с инструкциями производителя, 20 мкл протеиназы К пипетировали в микроцентрифужную пробирку объемом 1,5 или 2 мл, к этой 50–100 мкл добавляли антикоагулированную кровь и объем доводили до 220 мкл с помощью PBS. Добавляли 200 мкл буфера AL и тщательно перемешивали встряхиванием и инкубировали при 56 ° C в течение 10 минут. Наконец 200 мкл этанола (96–100%) добавляли к образцу и тщательно перемешивали путем встряхивания. Смесь добавляли в спин-колонку DNeasy Mini, помещенную в пробирку для сбора 2 мл, и центрифугировали при 6000 × g в течение 1 минуты. Далее спин-колонку DNeasy Mini помещали в новую пробирку для сбора 2 мл (предыдущий поток и пробирку для сбора отбрасывали), добавляли 500 мкл буфера AW1 и центрифугировали в течение 1 минуты при 6000 × g. Снова проточная и сборная трубка была выброшена. Спин-колонку DNeasy Mini помещали в новую пробирку для сбора 2 мл, добавляли 500 мкл буфера AW2 и центрифугировали в течение 3 минут при 20000 × g для сушки мембраны DNeasy. Проточная и сборная трубки были выброшены. Спин-колонку DNeasy Mini помещали в чистую 1,5 мл или 2 мл микроцентрифужную пробирку и 200 мкл буфера AE пипетировали прямо на мембрану DNeasy. Образец инкубировали при комнатной температуре в течение 1 мин, а затем центрифугировали в течение 1 мин при 6000 х g для элюирования.
Образцы тканей человека
Чтобы построить часы человека-крысы, мы проанализировали ранее сгенерированные данные метилирования из n = 850 образцов человеческой ткани (жировой ткани, крови, костного мозга, дермы, эпидермиса, сердца, кератиноцитов, фибробластов, почек, печени, легких, лимфатического узла, мышц, гипофиз, кожа, селезенка) от людей, возраст которых варьировался от 0 до 93. Образцы тканей были получены из трех источников. Образцы тканей и органов из Национального консорциума NeuroAIDS по тканям 52. Образцы крови из исследования антиретровирусной когорты подростков в Кейптауне 53. Кожа и другие первичные клетки предоставлены Kenneth Raj 41. Утверждение этики (IRB № 15-001454, IRB № 16-000471, IRB № 18-000315, IRB № 16-002028).
Экспериментальная процедура плазменной фракции
Хотя технологии переливания для человека хорошо разработаны и безопасны, переливание для мелких животных все еще находится на начальной стадии развития, требуя современных методов и остается сложной задачей. Мы использовали уникальную плазменную фракцию «Эликсир», разработанную Nugenics Research. Необходимую дозу обработки фракции плазмы готовили и вводили внутривенно, используя стерильный физиологический раствор в качестве носителя. Рассчитанные дозы вводили внутривенно животным старой обработанной группы; 4 инъекции каждый чередующийся день в течение 8 дней, и вторая доза, начиная с 95-го дня, состоящая из 4 инъекций каждый чередующийся день в течение 8 дней, как показано на дополнительной иллюстрации 4. Животным вводили аналогичное количество стерильного физиологического раствора (плацебо). Старой контрольной группы. Вес тела, корм и потребление воды животными контролировали в каждый момент времени. Когнитивные способности животных оценивали с помощью аппарата Barnes Maze (продолжительностью недели обучения) через 1, 2, 3 и 4 месяца с начала 1-й серии инъекций. Образцы крови отбирали через заданные промежутки времени с помощью ретроорбитального сплетения во время лечения для гематологической оценки. Сыворотку отделяли от образцов крови каждого животного и оценивали по биохимическим показателям. Плазму отделяли от образцов крови каждого животного и использовали для оценки маркеров воспаления, то есть TNF-α и IL-6. Животных умерщвляли из каждой группы на 155-й день лечения, и жизненно важные органы (мозг, сердце, легкие и печень) этих животных собирали для тестирования биомаркеров окислительного стресса, уровня Nrf2, гистопатологических и иммуногистохимических исследований.
Оценка конечных точек
Вес тела: Вес тела крыс регистрировали до начала протокола лечения, а затем на 30, 60, 90, 120 и 155-й день.
Сила хвата: измеритель силы хвата использовался для измерения силы хвата передних конечностей, которая характеризует мышечную силу животных. Вкратце, когда крыса ухватилась за планку измерителя мышечной силы, пиковая сила тяги была зарегистрирована на цифровом датчике силы. Напряжение было зарегистрировано в то время, когда крыса выпустила планку из передних лап. В день проводились шесть последовательных измерений с интервалом в одну минуту.
Способность к обучению в лабиринте Barnes: платформа лабиринта Barnes (диаметром 91 см, на высоте 90 см от пола) состояла из 20 отверстий (каждое диаметром 5 см). Все отверстия были заблокированы, за исключением одного целевого отверстия, которое вело к помещенному в углубление выходу в спасательный ящик. Пространственные сигналы, яркий свет и белый шум использовались, чтобы мотивировать крысу находить выход во время каждого сеанса. На этапе адаптации каждая крыса исследовала платформу в течение 60 с. Любая крыса, которая не нашла спасательный ящик, направлялась к нему и оставалась там в течение 90 с. На этапе сбора каждое испытание проводилось по одному и тому же протоколу с целью обучения каждой крысы найти цель и войти в спасательный ящик в течение 180 с. Крыса оставалась в ящике еще 60 с. Четыре испытания в день с интервалом примерно 15 минут проводились в течение 6 дней подряд. (Flores et al., 2018) Аппарат лабиринта Барнса использовался для определения способности к обучению животных после лечения. Испытания выполнялись в каждом месяце эксперимента.
Гематологические тесты: кровь брали из ретроорбитального сплетения с использованием гепаринизированных капиллярных трубок до лечения, а также на 60 и 155 день эксперимента. Одна порция крови хранилась в простых флаконах, из которых собирали сыворотку и хранили для биохимического анализа. Другая часть была непосредственно подвергнута оценке различных гематологических параметров с использованием стандартных инструментов. Уровни гемоглобина (Hb), количество эритроцитов (RBC), объем упакованных клеток (PCV), средний корпускулярный объем (MCV), средняя корпускулярный гемоглобин (MCH), средняя концентрация корпускулярного гемоглобина (MCHC) и тромбоциты были проанализированы в образцы крови во всех экспериментальных группах.
Биохимический анализ. Образцы крови отбирали из ретроорбитального сплетения с использованием гепаринизированных капиллярных трубок до обработки и на 30, 60, 90, 125 и 155-й день эксперимента. Одна порция крови хранилась в простых флаконах, из которых собирали сыворотку и хранили для биохимического анализа. Кроме того, уровни сывороточной глутамат-пируваттрансаминазы (S.G.P.T-IU / L) определяли кинетическим методом, рекомендованным Международной федерацией клинической химии (IFCC). Все тесты проводились с использованием коммерчески доступных диагностических наборов (Erba Mannheim, Германия, на полуавтоматическом биохимическом анализаторе Erba Mannheim). Тесты на функцию почек, такие как определение уровня креатинина в сыворотке (мг / дл) и мочевой кислоты (мг / дл), проводились в соответствии с модифицированной реакцией Джаффе с коммерчески доступными диагностическими наборами (Erba Mannheim, Германия на биохимическом полуавтоматическом анализаторе Erba Mannheim). Уровень глюкозы в крови (рандом) (мг / дл) (Gaikwad et al., 2015), общий белок (г / дл), общий билирубин (мг / дл), прямой билирубин (мг / дл), триглицерид (мг / дл) Определяли HDL (мг / дл), холестерин (мг / дл), альбумин (г / дл) (Erba Mannheim).
Оценка окислительного стресса. В конце эксперимента выделяли мозг, сердце, легкие и печень и 10% гомогенат ткани готовили в охлажденном льдом 50 мМ PBS (pH 7,4) с использованием гомогенизатора с последующей обработкой ультразвуком в течение 5 минут. Гомогенат центрифугировали при 2000 g в течение 20 минут при 4 ° C, аликвоты супернатанта собирали и хранили при -20 ° C до дальнейшей оценки.
Оценка степени перекисного окисления липидов (ПОЛ) (малоновый диальдегид (МДА): образцы гомогената тканей мозга, сердца, легких и печени обрабатывали 1% -ным раствором фосфорной кислоты и водным раствором 0,6% -ной тиобарбитуровой кислоты. Реакционную смесь нагревали при 80 ° С. в течение 45 минут охлаждали на ледяной бане и экстрагировали 4,0 мл N-бутанола. Слой н-бутанола отделяли и поглощение образовавшегося розового комплекса оценивали при 532 нм как показатель степени перекисного окисления липидов.
Оценка восстановленного глутатиона (GSH). Содержание GSH в гомогенате ткани мозга, сердца, легких и печени определяли путем обработки гомогената сульфгидрильным реагентом 5,5’-дитиобис (2-нитробензойной кислотой) (DTNB). Вкратце, 20 мкл гомогената ткани обрабатывали 180 мкл 1 мМ раствора DTNB при комнатной температуре. Оптическую плотность получающегося желтого цвета измеряли при 412 нм с использованием спектрофотометра для микропланшетов (Powerwave XS, Biotek, США).
Определение активности каталазы. Гомогенат тканей мозга, сердца, легких и печени (20 мкл) добавляли к 1 мл 10 мМ раствора H2O2 в кварцевой кювете. Снижение оптической плотности этой смеси измеряли с использованием спектрофотометра в УФ-режиме при 240 нм. Скорость уменьшения оптической плотности через три минуты после добавления гомогената сердца принималась в качестве показателя активности каталазы, присутствующей в гомогенате.
Оценка активности супероксиддисмутазы (SOD). Гомогенат ткани мозга, сердца, легких и печени (20 мкл) добавляли к смеси из 20 мкл 500 мМ Na2CO3, 2 мл 0,3% Triton X-100, 20 мкл 1,0 мМ ЭДТА, 5 мл 10 мМ гидроксиламина и 178 мл дистиллированной воды. К этой смеси добавляли 20 мкл 240 мкМ NBT. Оптическую плотность этой смеси измеряли при 560 нм в кинетическом режиме в течение 3 минут с интервалами в одну минуту. Скорость увеличения оптической плотности определялась как показатель активности СОД.
Концентрация Nrf2 в жизненно важных органах: Nrf2 оценивали в гомогенатах мозга, сердца, легких и печени с использованием набора ELISA для Nrf2 (Kinesis Dx, США). Орган был удален; и гомогенат готовили и хранили при -20 ° С до проведения анализа. Уровень Nrf2 определяли с использованием набора в соответствии с протоколом производителя, а значения рассчитывали по оптической плотности образцов.
Провоспалительные цитокины (IL-6 и TNF-α): Цитокины оценивали в плазме, которую отделяли от крови животных и хранили при -200 ° С до проведения анализа. Уровни провоспалительных цитокинов, включая TNF-α и IL-6, определяли с использованием набора для сэндвич-ELISA (Kinesis Dx, США) в соответствии с протоколом производителя, а значения рассчитывали по оптической плотности.
Гистопатология жизненно важных органов: ткани головного мозга, сердца, селезенки, почек, легких, печени и яичка, фиксированные в 10% -ном буферизованном растворе формалина, помещали в парафин, а серийные срезы (толщиной 3 мкм) вырезали с помощью микротома (Leica RM 2125, Германия). ). Репрезентативные срезы окрашивали гематоксилином и эозином и исследовали под световым микроскопом (Leica, Германия). Гистопатологические данные были объективными, и срезы были обследованы у патологоанатома, непосвященного в детали терапии.
Окрашивание SA-β-gal. Этот анализ проводили с использованием коммерчески доступного набора для определения окрашивания старением β-галактозидазы (Cell Signaling, # 9860). Вкратце, криосрезы фиксировали раствором фиксатора в течение 10–15 минут при комнатной температуре с последующим окрашиванием свежим окрашивающим β-gal раствором в течение ночи при 37 ° C. Пока β-галактозидаза все еще находится на планшете, проверьте сечение под микроскопом (увеличение в 100 раз) на наличие синего цвета.
Окрашивание маслом Red O: Криосрезы (толщиной 6 мкм) фиксировали в 10% растворе формалина в нейтральном забуференном буфере. Предметные стекла инкубировали со свежеприготовленным рабочим раствором Oil Red O в течение 15 минут. Накопление липидов оцифровывали с помощью микроскопа.
Профилирование метилирования ДНК
Мы сгенерировали данные метилирования ДНК, используя специальный чип Illumina HorvathMammalMethylChip40. По своей структуре массив метилирования млекопитающих способствует эпигенетическим исследованиям среди видов млекопитающих (включая крыс и людей) благодаря очень высокому охвату (более тысячи X) высококонсервативных CpG у млекопитающих. С этой целью был использован анализ биоинформационной последовательности для выявления 36 тысяч высококонсервативных CpGs у 50 видов млекопитающих. Эти 36k CpG обладают фланкирующими последовательностями, которые высоко консервативны у млекопитающих. Кроме того, пользовательский массив содержит две тысячи проб, выбранных из исследований биомаркеров человека. Ожидается, что не все пробы 36k в массиве будут работать для всех видов, но каждая проба предназначена для охвата определенного подмножества видов, так что в целом все виды имеют большое количество проб. Конкретное подмножество видов для каждой пробы приведено в файле манифеста чипа, который был размещен в Omnibus Gene Expression. Метод нормализации SeSaMe был использован для определения бета-значений для каждой пробы 54.
Штрафные регрессионные модели
Мы разработали шесть различных эпигенетических часов для крыс путем регрессии хронологического возраста всех CpG, которые, как известно, соответствуют геному или Rattus norvegicus. Возраст не изменился. Мы использовали все ткани для пантканевых часов. Мы ограничили анализ кровью, печенью и мозговой тканью для часов крови, печени и мозговой ткани соответственно. Модели штрафной регрессии были созданы с помощью функции R «glmnet» 55. Мы исследовали модели, полученные с помощью регрессии «эластичная сеть» (альфа = 0,5). Оптимальные параметры штрафа во всех случаях определялись автоматически с использованием 10-кратной внутренней перекрестной проверки (cv.glmnet) на тренировочном наборе. По определению, альфа-значение для регрессии эластичной сети было установлено равным 0,5 (средняя точка между регрессией типа Риджа и Лассо) и не было оптимизировано для производительности модели. Мы выполнили схему перекрестной проверки для получения объективных (или, по крайней мере, менее предвзятых) оценок точности различных оценок возраста на основе ДНК. Один тип состоял в исключении из регрессии одной выборки (LOOCV), прогнозировании возраста для этой выборки и итерации по всем выборкам.
Оценка относительного возраста
Чтобы придать биологический смысл оценке возраста крыс и людей , имеющих очень разную продолжительность жизни, а также для преодоления неизбежного перекоса из-за неравного распределения точек данных от крыс и людей по возрастному диапазону, оценка относительного возраста производилась по формуле: Относительный возраст = возраст / максимальный срок жизни, где максимальная продолжительность жизни для крыс и людей была установлена на 3,8 лет и 122,5 года соответственно.
Финальная версия эпигенетических часов
Окончательные версии наших эпигенетических часов предназначены для будущих исследований образцов тканей крыс. Эти окончательные версии часов были разработаны путем объединения исходных данных обучающей выборки (n = 517 тканей крысы) с «необработанными» образцами из данных испытаний на крысах. Увеличение размера выборки обучающих данных приводит к более высокой точности в соответствии с анализом перекрестной проверки (Приложение, рисунок 10, Приложение рисунок 11). Используя окончательный вариант эпигенетических часов, мы обнаруживаем, что эффекты лечения становятся еще более значительными, особенно для гипоталамуса (Приложение рис. 12). Окончательные версии пантканевых часов, часов для печени, часов крови, мозговых часов и часов «человек-крыса» можно найти в дополнительном материале.
Эпигеномные широко ассоциативные исследования (EWAS) возраста
EWAS выполняли в каждой ткани отдельно, используя функцию R "standardScreeningNumericTrait" из пакета "WGCNA" R 56. Затем результаты объединяли по тканям с использованием метода мета-анализа Стуффера. Наши исследования хронологических возрастов в рамках эпигеномной ассоциации показывают, что эффекты старения в одной ткани часто плохо сохраняются в другой ткани (Приложение рис. 13).
Благодарности
Разработка часовых тканей крысы была поддержана Полем Г. Аллена Фронтиерс Груп (SH) и грантом от Open Philanthropy (SH). Гетерогенные исходные крысы, предоставленные (HC и LS), были поддержаны грантом NIH DA-037844 (NIDA, HC и LW). RG был поддержан грантом № MRCF 7-25-19 от Благотворительного фонда медицинских исследований и Общества экспериментальных геронтологических исследований, Новая Зеландия (RG). Сбор образцов тканей человека был поддержан финансированием NIH через институты NIMH и NINDS следующими грантами: «Банк мозга Манхэттена для ВИЧ» (MHBB): U24MH100931; Техасский исследовательский центр NeuroAIDS (TNRC): U24MH100930; Национальный банк неврологического СПИДа (NNAB): U24MH100929; California NeuroAIDS Tissue Network (CNTN): U24MH100928 Координационный центр данных (DCC): U24MH100925. Образцы крови человека были поддержаны R21MH107327. Содержание является исключительно ответственностью авторов и не обязательно отражает официальную точку зрения NNTC или NIH.
Заявление о конфликте интересов
Некоторые авторы являются основателями, владельцами, сотрудниками (Гарольд Катчер и Акшай Сангхави) или консультантами Nugenics Research (Стив Хорват и Агнивеш Шривастава), которые планируют коммерциализировать лечение «Эликсиром». Другие авторы (Кавита Сингх, Шраддха Хайрнар) получили финансовую поддержку от Nugenics Research. У других авторов нет конфликта интересов.
Вклад авторов
Обработка фракцией плазмы была разработана Гарольдом Катчером (HK) в консультации с Акшаем Сангхави (AS). KR, SH и HK составили рукопись. Все авторы помогли отредактировать статью. JZ и SH разработали эпигенетические часы. SH генерирует данные метилирования ДНК. JZ, KR, SK, CL, SH провели статистический анализ и создали цифры и таблицы. KS руководил проектом плазменной обработки и проводил эксперименты с SK и AgS. RG, HC, CH, LSW, MC-M, ML, PC, TW, AM предоставили образцы ткани крысы. AL и SH предоставили человеческие данные.
Аффилиация авторов
1 Отдел генетики человека, Медицинская школа им. Дэвида Геффена, Калифорнийский университет, Лос-Анджелес, Лос-Анджелес, Калифорния, США;
2 Отдел биостатистики, Филдинговая школа общественного здравоохранения, Университет Калифорнии, Лос-Анджелес, Лос-Анджелес, Калифорния, США;
3 Школа фармацевтического и технологического менеджмента Shobhaben Pratapbhai Patel, Университет NMKS SVKM, Мумбаи, Индия;
4 Отдел радиационных эффектов, Центр радиационной, химической и экологической опасности, Общественное здравоохранение Англии, Чилтон, Дидкот, Великобритания;
5 Nugenics Research Pvt Ltd, Индия;
6 Институт экспериментальной фармакологии Кордовы (IFEC), Школа химических наук, Национальный университет Кордовы, Кордова, Аргентина;
7 Научно-исследовательский институт биохимии Ла-Платы - Гистология B, Патология B, Медицинский факультет, Университет Ла-Плата, La Plata CC 455 (zip 1900), Аргентина;
8 Медицинский факультет Университета Уэйк Форест, 1 Медицинский центр Драйв, Уинстон Салем, Северная Каролина, 27157, США;
9 Департамент фармакологии, наркологии и токсикологии, Центр наук о здоровье Университета Теннесси, Мемфис, TN 3993, США;
10 Департамент неврологии, Медицинская школа им. Дэвида Геффена, Калифорнийский университет, Лос-Анджелес, Калифорния, 90095, США.
# Совместное первое авторство
Контакты:
Стив Хорват E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра. Адрес: здание Gonda, 695 Charles Young Drive South, Лос-Анджелес, Калифорния 90095
Гарольд Катчер Электронная почта: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Препринт bioRxiv DOI: https://doi.org/10.1101/2020.05.07.082917
Эта версия размещена 8 мая 2020 года.
Стив Хорват1,2 #, Кавита Сингх3 #, Кен Радж4 #, Шраддха Хайрнар3, Акшай Сангхави5, Агнивеш Шривастава5, Джозеф А. Золлер 2, Цезарь З. Ли2, Клаудия Б. Херену6, Мартина Канателли-Маллат7, Марианн Леман7, Марианн Леман7 Солберг Вудс8, Анхель Гарсия Мартинез9, Тенгфей Ванг9, Присцила Кьявеллини7, Эндрю Дж. Левин10, Хао Чен9, Родольфо Дж. Гойя7, Гарольд Л. Катчер5
Ключевые слова: омоложение, плазменная фракция, эпигенетические часы, метилирование ДНК, крыса
Перевод: Ник Сестрин