Клеточное старение. Определение пути вперед
Клеточное старение - это состояние клетки, вовлеченное в различные физиологические процессы и широкий спектр возрастных заболеваний. В последнее время быстро растет интерес к терапевтическому нацеливанию на клеточное старение ради более здорового старения и облегчения связанных с возрастом заболеваний, также известному как сенотерапия. Таким образом, точное обнаружение стареющих клеток, особенно in vivo, имеет важное значение. Здесь мы представляем консенсус Международной ассоциации клеточного старения (ICSA), определяющий и обсуждающий ключевые клеточные и молекулярные особенности старения и предлагающий рекомендации по их использованию в качестве биомаркеров. Мы также представляем ресурсный инструмент для облегчения идентификации генов, связанных со старением, SeneQuest (доступен по адресу http://Senequest.net). Наконец, мы предлагаем алгоритм для точной оценки и количественного определения старения, как в культивируемых клетках, так и in vivo. ![]()
Сенесцентные клетки: тонкая грань между жизнью и смертью
Клеточные состояния связывают как физиологические, так и стрессовые сигналы с гомеостазом тканей и здоровьем организма. В обоих случаях результаты варьируются и определяются характеристиками сигнала (тип, величина и длительность), пространственно-временными параметрами (где и когда) и способностью клетки реагировать (Gorgoulis et al., 2018). В случае потенциально разрушительного стресса повреждение обращается и структурная и функциональная целостность клеток восстанавливается. С другой стороны, повреждение может быть необратимым, и тогда клетки активируют механизмы смерти, главным образом для ограничения дегенерации ткани. Между этими крайностями клетки могут приобретать другие состояния, часто связанные с выживанием, но также с постоянными структурными и функциональными изменениями. Примером является непролиферативное, но жизнеспособное состояние, отличное от G0 покоя и терминальной дифференцировки, называемое клеточной сенесценцией (Rodier and Campisi, 2011). Формально описанная в 1961 году Hayflick и его коллегами, сенесценция происходит от латинского слова senex, означающего «старый» (Hayflick and Moorhead, 1961), первоначально наблюдалась в нормальных диплоидных клетках, которые перестали размножаться после конечного числа делений (предел Хейфлика), позже была приписана укорочению теломер (см. раздел «Арест клеточного цикла»). С тех пор клеточная сенесценция была идентифицирована как реакция на многочисленные стрессоры, включая воздействие генотоксических агентов, лишение питательных веществ, гипоксию, дисфункцию митохондрий и активацию онкогена (Таблица 1). За последнее десятилетие усовершенствованные экспериментальные инструменты и разработанные репортерно- абляционные модели мышей значительно расширили наши знания о причинах и фенотипических последствиях сенесцентности клеток. Тем не менее, конкретные маркеры и консенсус по определению того, какие же клетки являются сенесцентными, отсутствуют. Кроме того, хотя связь со старением организма очевидна, старение и сенесцентность не являются синонимами (Rodier and Campisi, 2011). Действительно, клетки могут подвергаться старению, независимо от возраста организма, из-за множества сигналов, включая сигналы, не зависящие от укорочения теломер. Следовательно, сенесцентные клетки обнаруживаются на любой стадии жизни от эмбриогенеза, где они способствуют развитию тканей, до зрелого возраста, где они предотвращают размножение поврежденных клеток и способствуют восстановлению тканей и подавлению опухоли. Таким образом, клеточная сенесценция может быть примером эволюционной антагонистической плейотропии или клеточной программы с полезными и вредными эффектами. Здесь мы проясняем природу клеточной сенесценции путем: (1) представления ключевых особенностей сенесцентных клеток, (2) предоставления исчерпывающего определения сенесценции, (3) предложения средств для идентификации сенесцетных клеток и (4) определения роли сенесценции клетки в физиологических и патологических процессах, что в целом прокладывает путь для разработки новых терапевтических стратегий.
Таблица 1. Перечень факторов, вызывающих старение
Определение и характеристики клеточной сенесценции
Клеточная сенесценция - это состояние клетки, вызванное стрессовыми воздействиями и определенными физиологическими процессами, для которого характерны длительная и в целом необратимая остановка клеточного цикла, с секреторными функциями, макромолекулярным повреждением и измененным метаболизмом (рис. 1). Эти функции могут быть взаимозависимыми (рисунок 1), но для ясности описаны здесь отдельно.
Рисунок 1. Признаки фенотипа старения

Остановка клеточного цикла
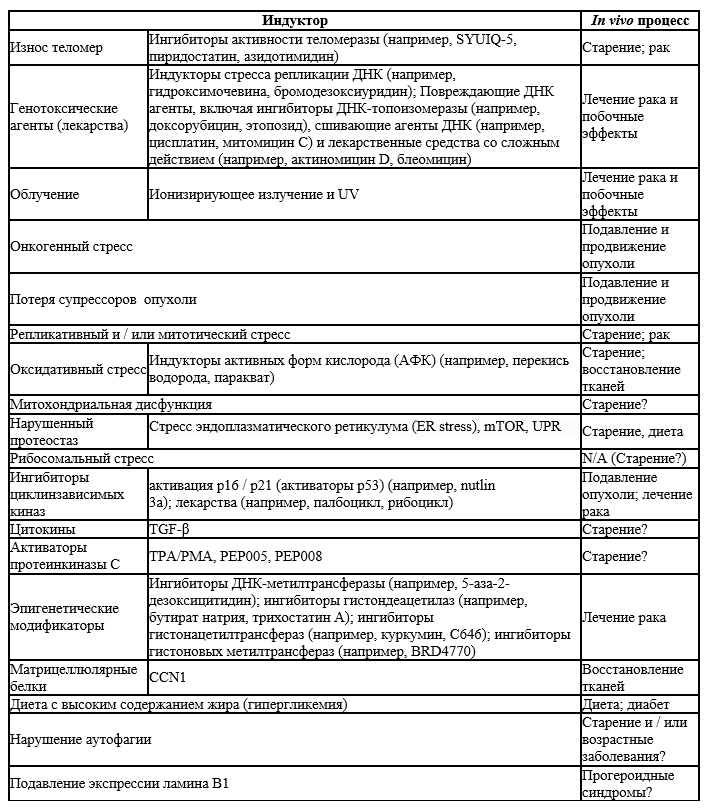
Одной из общих черт сенесцентных клеток является практически необратимая остановка клеточного цикла, которая может быть тревожным ответом, вызванным вредными воздействиями или аберрантной пролиферацией. Этот арест клеточного цикла отличается от покоя и терминальной дифференцировки (He and Sharpless, 2017). Покой - это состояние временного ареста цикла с восстановлением соответствующими стимулами; Терминальная дифференцировка - это приобретение специфических клеточных функций, сопровождаемое длительной остановкой клеточного цикла, опосредованное путями, отличными от путей клеточного старения (Рис 2). В свою очередь, сенесцентные клетки приобретают новый фенотип. Хотя остановка клеточного цикла при сенесценции, как правило, необратима, повторный вход в клеточный цикл может происходить при определенных обстоятельствах, особенно в опухолевых клетках (Galanos et al., 2016, Миланович и др., 2018, Патель и др., 2016, Салех и др., 2019) (Рис 2).
Рисунок 2. Остановка клеточного цикла в стареющих, покоящихся и терминально дифференцированных клетках
В клетках млекопитающих семейства белков ретинобластомы (RB) и белки p53 важны для установления ареста клеточного цикла при сенесценции (Rodier and Campisi, 2011).
RB1 и члены его семейства p107 (RBL1) и p130 (RBL2) фосфорилируются с помощью специфических циклин-зависимых киназ (CDK; CDK4, CDK6, CDK2). Такое фосфорилирование снижает способность членов семейства RB подавлять активность фактора транскрипции семейства E2F, необходимую для осуществления клеточного цикла (Sharpless and Sherr, 2015). Однако в стареющих клетках накапливаются ингибитор CDK2 p21WAF1 / Cip1 (CDKN1A) и ингибитор CDK4 / 6 p16INK4A (CDKN2A). Это накопление приводит к постоянной активации белков семейства RB, ингибированию трансактивации E2F и последующей остановке клеточного цикла, которые со временем уже не могут быть обращены вспять путем последующей инактивации белков семейства RB или p53 (Beauséjour et al., 2003). Это обеспечивается гетерохроматизацией генов-мишеней E2F (Salama et al., 2014), действием цитокинов, секретируемых стареющими клетками (Rodier and Campisi, 2011) и / или устойчивым производством активных форм кислорода (ROS) (Takahashi et al., 2006). Примечательно, что в сенесцентных мышиных клетках ARF - белок альтернативной рамки считывания генного локуса p16INK4a, который активирует p53 - также играет важную роль в регуляции остановки клеточного цикла (Sharpless and Sherr, 2015).
Дополнительные особенности сенесцентной остановки клеточного цикла включают дефекты биогенеза рибосом и дерепрессию ретротранспозонов (De Cecco et al., 2019, Лессард и др., 2018). Тем не менее, в настоящее время не было выявлено какого-либо конкретного маркера именно сенесцентной остановки клеточного цикла (Hernandez-Segura et al., 2017). Например, активация RB и p53 также происходит при других формах остановки клеточного цикла (Rodier and Campisi, 2011). Даже p16INK4A, который считается более специфичным для сенесценции, экспрессируется в некоторых не сенесцентных клетках (Sharpless and Sherr, 2015) и не экспрессируется всеми сенесцентными клетками (Hernandez-Segura et al., 2017). Таким образом, обнаружение ареста клеточного цикла, связанного со старением, требует количественной оценки множества факторов и признаков.
Секреция
Сенесцентные клетки секретируют множество факторов, включая провоспалительные цитокины и хемокины, модуляторы роста, ангиогенные факторы и матриксные металлопротеиназы (MMPs), которые в совокупности называются ассоциированным с старением секреторным фенотипом (SASP) или секретомом сенесцентного мессенджинга (SMS) (Рисунок 1; Таблица 2) (Коппе и др., 2010, Kuilman and Peeper, 2009). SASP является отличительной чертой сенесцентных клеток и опосредует многие из их патофизиологических эффектов. Например, SASP усиливает и распространяет сенесценцию в аутокринном и паракринном режиме (Acosta et al., 2013, Коппе и др., 2010, Kuilman and Peeper, 2009) и активирует иммунные ответы, которые удаляют сенесцентные клетки (Крижановский и др., 2008a, Муньос-Эспин и Серрано, 2014). Факторы SASP опосредуют развивающееся старение (Muñoz-Espín et al., 2013, Storer et al., 2013), заживление ран (Demaria et al., 2014) и пластичность ткани (Mosteiro et al., 2016), а также способствуют стойкому хроническому воспалению (известному также как инфламмэйджинг) (Franceschi and Campisi, 2014). Таким образом, SASP может объяснить некоторые пагубные проэйджинговые эффекты сенесцентных клеток. Кроме того, SASP может привлекать незрелые иммуносупрессивные миелоидные клетки к опухолям простаты и печени (Di Mitri et al., 2014, Eggert et al., 2016) и стимулировать онкогенез, управляя ангиогенезом и метастазированием (Coppé et al., 2010).
Таблица 2. Компоненты секреторного фенотипа (SASP), связанные со старением

В то время как остановка клеточного цикла при сенесценции регулируется путями подавления опухолей p53 и p16INK4A / Rb, SASP контролируется ремоделированием энхансера и активацией факторов транскрипции, таких как NF-κB, C / EBPβ, GATA4 (Ito et al., 2017, Кан и др., 2015, Kuilman and Peeper, 2009, Salama et al., 2014), мишень рапамицина млекопитающих (mTOR) и p38MAPK (Freund et al., 2011, Ито и др., 2017, Kuilman and Peeper, 2009). Сигналы, запускающие активацию SASP, многообразны и различаются в зависимости от индуктора сенесценции, но включают повреждение ДНК, фрагменты цитоплазматического хроматина (CCF), которые запускают реакцию интерферона типа 1, и ассоциированные с повреждением молекулярные структуры (DAMP), которые активируют инфламмасомы (Acosta et al. ., 2013, Davalos et al., 2013Ли и Чен, 2018).
Состав и мощность сигналов SASP существенно различаются в зависимости от продолжительности сенесцентного состояния, происхождения просенесцентного стимула и типа клеток (Childs et al., 2015). Кроме того, секвенирование РНК отдельных клеток (scRNA-seq) выявляет значительную вариабельность между экспрессирующими SASP клетками (Wiley et al., 2017). Например, переход от раннего трансформирующего фактора роста β (TGF-β) -зависимого секретома к провоспалительному секретому обусловлен флуктуацией активности Notch1 (Ito et al., 2017). Более того, ответ на интерферон типа 1 возникает, как более позднее событие и частично обусловлен дерепрессией ретротранспозируемых элементов LINE-1 (De Cecco et al., 2019). Сенесцентные клетки также связываются со своей микросредой через юкстакринную передачу сигналов NOTCH / JAG1 (Ito et al., 2017), производство ROS (Kuilman et al., 2010), цитоплазматические мосты (Видео S1) (Biran et al., 2015) и внеклеточные везикулы, такие как экзосомы (Takasugi et al., 2017). В целом, определение сенесцентного секретома в каждом биологическом контексте поможет идентифицировать молекулярные сигнатуры сенесценции.
Макромолекулярные повреждения
Повреждение ДНК.
Первой молекулярной особенностью, связанной с сенесцентностью, было укорочение теломер, являющееся результатом проблемы репликации на концах ДНК, во время серийных пассажей (Shay and Wright, 2019). Теломеры представляют собой повторяющиеся структуры ДНК, обнаруженные в концевых петлях на хромосомных концах и стабилизированные шелтериновым белковым комплексом. Такое устройство делает теломеры незаметными для путей ответа на повреждения ДНК (DDR) и двухцепочечной репарации ДНК (DSB) (de Lange, 2018, Шей и Райт, 2019). Теломераза, фермент, который поддерживает длину теломер, не экспрессируется большинством нормальных соматических (не стволовых) клеток, но экспрессируется большинством раковых клеток, которые преодолели сенесценцию. Кроме того, восстановление активности теломеразы в нормальных клетках приводит к удлинению теломер, продлевая их репликативную продолжительность жизни в культуре (Bodnar et al., 1998,Шей и Райт, 2019).
Укорочение теломер во время пролиферации завершается дестабилизацией петли теломер и расщеплением теломер, дисфункция теломер (TIF) активирует DDR, что в конечном итоге вызывает остановку клеточного цикла. Этот ответ также может быть вызван ингибированием или изменением генов, участвующих в поддержании теломер (d'Adda di Fagagna, 2008). Другая форма повреждения ДНК, называемая telomere-associated foci (TAF), может происходить из-за окислительного повреждения в теломерных G-reach повторах, независимо от длины теломер или потери шелтерина (de Lange, 2018, Шей и Райт, 2019).
Хотя половина постоянных очагов повреждения ДНК в сенесцентных клетках локализуется в теломерах, другие стрессовые субцитотоксические воздействия также могут вызывать сенесценцию, если причинят непоправимое повреждение ДНК (рис. 1). Многочисленные генотоксические агенты, включая радиацию (ионизирующую и ультрафиолетовую), фармакологические агенты (например, некоторые химиотерапевтические средства) и окислительный стресс вызывают сенесценцию. Кроме того, активированные онкогены могут включить сенесценцию (известную как OIS) как подавляющий опухоль ответ, ограничивая неконтролируемую пролиферацию потенциально онкогенных клеток. OIS часто опосредуется опухолевыми супрессорами p16INK4A и ARF, которые кодируются локусом CDKN2A, вызывая остановку клеточного цикла (Kuilman et al., 2010, Серрано и др., 1997). Тем не менее, DDR также играет важную роль в запуске OIS (Gorgoulis and Halazonetis, 2010, Gorgoulis et al., 2018, Halazonetis и др., 2008). В этом случае сигнал повреждения исходит из репликационных вилок, разрушенных в результате гиперпролиферации, вызванной онкогеном . Недавно было показано, что пути DDR и ARF могут действовать согласованно во время OIS, причем первый требует более низкой онкогенной нагрузки, чем последний (Gorgoulis et al., 2018).
Сенесцентные клетки несут стойкое повреждение ядерной ДНК, называемое DNA-SCAR (DNA segments with chromatin alterations reinforcing senescence , сегменты ДНК с изменениями хроматина, усиливающими старение). DNA-SCAR отличаются от очагов временного повреждения; в отличие от преходящих очагов, они специфически ассоциируются с промиелоцитарными лейкемическими (PML) ядерными тельцами, лишены белков репарации ДНК RPA и RAD51, а также одноцепочечной ДНК (ssDNA) и содержат активированные формы медиаторов DDR CHK2 и p53 (Rodier et al. ., 2011). DNA-SCAR представляют собой динамические структуры с потенциалом регулирования множества аспектов сенесцентных клеток, включая остановку роста и SASP (Rodier et al., 2011). Однако, поскольку не все вызывающие сенесцентность стимулы генерируют устойчивый сигнал повреждения ДНК, DNA-SCAR не является глобальной особенностью сенесцентных клеток. CCF - другой тип повреждения ДНК в сенесцентных клетках (Иванов и др., 2013). CCF активирует провоспалительный ответ, опосредованный путем cGAS-cGAMP-STING (Ivanov et al., 2013, Ли и Чен, 2018), который может служить ассоциированным с сенесцентностью маркером.
Повреждение белка.
Протеотоксичность является признаком старения и клеточной сенесценции (Каушик и Куэрво, 2015). Таким образом, поврежденные белки помогают идентифицировать сенесцентные клетки (рисунок 1). Важным источником повреждения белка является ROS, который окисляет остатки метионина и цистеина и изменяет укладку и функционирование белка (Höhn et al., 2017). Многие протеинтирозинфосфатазы (PTP) содержат остатки цистеина в своих активных центрах, которые могут быть инактивированы окислением. Эта инактивация может вызывать сенесценцию путем гиперактивации сигналинга ERK, аналогично действию активированных онкогенов (Deschênes-Simard et al., 2013). Высокие уровни фосфо-ERK были обнаружены в предопухолевых поражениях, богатых сенесцентными клетками, такими как меланоцитарные невусы и доброкачественная гиперплазия предстательной железы (benign prostatic hyperplasia (BPH)) (Deschênes-Simard et al., 2013), и являются характерными для сенесценции, вызванной терапией (Haugstetter et al., 2010). Характер окисления PTP может быть выявлен с помощью моноклонального антитела, которое распознает окисленный цистеин (Karisch et al., 2011).
ROS в присутствии металлов может карбонилировать остатки пролина, треонина, лизина и аргинина. Карбонилирование белка обнажает гидрофобные поверхности, что приводит к разворачиванию и агрегации, а карбонильные остатки белка могут быть обнаружены с помощью антител (Nyström, 2005). Кроме того, карбонильные остатки могут реагировать с аминогруппами с образованием оснований Шиффа, способствуя агрегации белка. Последующее перекрестное сшивание с сахарами и липидами образует нерастворимые агрегаты, которые называют липофусцин, в переводе с греческого «липо» означает жир, а «фукус» означает «темный». Липофусцин может быть визуализирован в лизосомах с помощью световой микроскопии или гистохимического метода с использованием биотинилированного аналога Sudan Black B (SBB) GL13 (Evangelou et al., 2017). Последний становится еще одним индикатором сенесцентных клеток в культуре и in vivo (Evangelou et al., 2017, Gorgoulis et al., 2018, Myrianthopoulos et al., 2019). Следует отметить, что накопление повреждений продолжается, даже когда деление клеток прекращается, и может продолжаться в течение месяцев или даже лет.
Большинство окислительных повреждений белков необратимо, и деградация с помощью протеасомо- убиквитиновой системы (UPS) или аутофагии часто устраняет эти белки. Поскольку UPS (Дешен-Симард и др., 2013) и аутофагия активны в сенесцентных клетках, они могут оказаться полезными для характеристики сенесцентного состояния (Ogrodnik et al., 2019a). Точно так же тельца PML действуют как датчики ROS и окислительного повреждения (Niwa-Kawakita et al., 2017) и также могут быть неэксклюзивными биомаркерами клеточной сенесценции (Vernier et al., 2011).
Повреждение липидов. Липиды необходимы для целостности клеточной мембраны, производства энергии и передачи сигнала. Некоторые возрастные заболевания характеризуются изменением липидного обмена, что приводит к изменению липидного профиля (Ademowo et al., 2017). Хотя сенесцентные клетки отмечены изменениями в метаболизме липидов, неясно, как это способствует фенотипу старения (рис. 1).
Дисфункция митохондрий во время старения может привести к ROS-управляемому повреждению липидов, отложению липидов (Correia-Melo et al., 2016, Огродник и др., 2017) и накоплению липофусцина (Gorgoulis et al., 2018). Помимо окисления, сообщалось о модификациях альдегидов, происходящих из липидов (например, 4-гидрокси-2-ноненал [4-HNE]) в сенесцентных клетках (Ademowo et al., 2017, Jurk et al., 2012).
Накопление липидов в сенесцентных клетках можно визуализировать, используя различные коммерческие красители и анализы (Ogrodnik et al., 2017) или иммуноокрашивание на липид-ассоциированные белки, такие как перилипин 2 (Ogrodnik et al., 2017). Важно, что генетический или фармакологический клиренс сенесцентных клеток у тучных и пожилых мышей уменьшал отложения липидов в печени (Ogrodnik et al., 2017) и мозгу (Огродник и др., 2019b).
Хотя связь с накоплением липидов известна, наши знания о специфическом составе липидных метаболитов в сенесцентных клетках скудны. Уровни жирных кислот, их предшественников и фосфолипидные катаболитов - таких как эйкозапентаеноат (EPA), малонат, 7-альфа-гидрокси-3-оксо-4-холестеноат (7-HOCA) и 1-стеароилглицерофосфоинозитол - увеличиваются в сенесцентных фибробластах, тогда как уровни линолеатов, дигомолинолеатов и 10-гептадеценоатов, снижаются (James et al., 2015). Кроме того, повышается уровень свободного холестерина, сопровождающийся снижением количества фосфолипидов и сложных эфиров холестерина, полученных из ацетата, в то время как содержание синтазы жирных кислот и стеароил-КоА-десатуразы-1 снижается (Maeda et al., 2009). Существует несколько методов обнаружения изменений липидов в тканях и клетках, но их использование в качестве биомаркера сенесцентного состояния остается ограниченным из-за высокой изменчивости профиля липидов, связанного с сенесцентностью. Например, метаболиты липидов значительно различаются между старением, вызванным онкогенами, и репликативным старением (Quijano et al., 2012).
Дерегулированный метаболический профиль
Митохондрии. Сенесцентные клетки демонстрируют изменения в митохондриальной функции, динамике и морфологии. Митохондрии в сенесцентных клетках менее функциональны, имеют пониженный мембранный потенциал, повышенную протонную протечку, сниженные скорости слияния и деления, повышенную массу и содержание метаболитов цикла трикарбоновых кислот (TCA) (Kaplon et al., 2013, Passos et al., 2010). В то время как митохондрии более многочисленны, похоже, что их способность продуцировать АТФ снижается (Birch and Passos, 2017, Корольчук и др., 2017). Напротив, сенесцентные клетки часто вырабатывают больше ROS, способных вызвать повреждение белков и липидов, как обсуждалось в предыдущих разделах (см. «Повреждение белка» и «Повреждение липидов»), но также укорочение теломер и активацию DDR (Passos et al., 2007). Целевые аспекты митохондриальной биологии, такие как электронная транспортная цепь (ETC), сборка комплекса I, скорость деления митохондрий и биогенез, митохондриальные сиртуины и / или нарушение цикла TCA, могут вызывать сенесцентное состояние (Correia-Melo et al., 2016, Jiang et al., 2013, Kaplon et al., 2013, Мива и др., 2014, Моисеева и др., 2009, Park et al., 2010, Wiley и др., 2016). Измененные соотношения AMP: ATP и ADP: ATP во время старения способствуют остановке клеточного цикла, активируя AMPK (AMP-активируемую протеинкиназу), главный датчик недостатка энергии (Birch and Passos, 2017).
Дисфункция митохондрий во время старения также участвует в регуляции SASP. Митофагия (митохондриальный клиренс) в сенесцентных клетках, по-видимому, подавляет SASP (Correia-Melo et al., 2016). Генетическое или фармакологическое ингибирование ETC может вызвать сенесценцию, даже если в клетках отсутствует экспрессия ключевых провоспалительных факторов SASP, таких как IL-6 и IL-8 (Wiley et al., 2016). Отношения NAD + / NADH снижаются в сенесцентных клетках (Wiley et al., 2016), что может влиять на активность поли-ADP рибозной полимеразы (PARP) и сиртуинов, и те и другие участвуют в активации регулятора SASP NF-kB (Birch and Passos, 2017).
Хотя существенные данные подтверждают роль митохондрий в старении клеток в культуре, о старении в естественных условиях известно меньше. Модели мышиной митохондриальной дисфункции и усиленного окислительного стресса показывают ускоренное старение (Wiley et al., 2016), но детальная характеристика митохондриальной функции в сенесцентных клетках in vivo отсутствует. Поскольку митохондриальная дисфункция характеризует и другие клеточные процессы (Eisner et al., 2018), она не является постоянным биомаркером сенесцентности. Наконец, не ясно, способствуют ли сенесцентные клетки снижению митохондриальной функции во время старения и при возрастных заболеваниях (Шривастава, 2017).
Лизосомы. Секреция требует одновременной активации анаболических и катаболических процессов (см. Секреция) (Salama et al., 2014). Увеличение катаболизма обеспечивает энергию и сырье, и этому способствует лизосома, конечный компартмент переработки при фагоцитозе, эндоцитозе и аутофагии (Settembre and Ballabio, 2014). Биогенез лизосом осуществляется транскрипционно и зависит от клеточных энергетических или перерабатывающих потребностей (Settembre and Ballabio, 2014). Интересно, что когда уровни аминокислот в просвете лизосомы высоки, mTOR1 активируется и наоборот (Settembre and Ballabio, 2014). Кроме того, лизосомы взаимодействуют с митохондриями для сохранения митохондриального гомеостаза (см. «Митохондрии») (Park et al., 2018).
Лизосомы в сенесцентных клетках увеличиваются по количеству и размеру, что наблюдается при микроскопии в виде гранулярности цитоплазмы (Robbins et al., 1970) Видео S1; для не сенесцентных клеток см. Видео S2). Увеличение числа лизосом может отражать попытку сбалансировать постепенное накопление дисфункциональных лизосом путем получения большего количества новых лизосом. Таким образом, соблюдается баланс между анаболизмом и катаболизмом, жизненно важный для секреции. Этот баланс поддерживается во время OIS через TOR-autophagy spatial-coupling compartment (TASCC), который координирует производство факторов SASP (Salama et al., 2014).
Повышенное содержание лизосом не обязательно отражает увеличение их активности, так как стадия деградации аутофагии также ухудшается (Park et al., 2018). Таким образом, ось лизосома-митохондрия деградирует, что приводит к снижению оборота митохондрий, что увеличивает выработку ROS. Впоследствии ROS нацеливается на клеточные структуры, включая лизосомы, образуя порочную петлю обратной связи, вызывающую еще большее повреждение (Park et al., 2018). Увеличение массы лизосом связано с активностью бета-галактозидаз (SA-β-gal), связанной со старением (Hernandez-Segura et al., 2018)), биомаркера сенесцентности. Однако, хотя присутствие SA-β-gal является заметным в сенесцентных клетках (Dimri et al., 1995, Эрнандес-Сегура и др., 2018), это не является ни обязательным, ни детерминантным для сенесцентного фенотипа (Hernandez-Segura et al., 2018). С терапевтической точки зрения увеличенный лизосомальный компартмент обладает повышенной способностью улавливать лекарства, которые могут быть протонированы, такие как селективные ингибиторы CDK4 / 6, палбоциклиб, рибоциклиб и абемакиклиб. Эта способность снижает их эффективную концентрацию в цитозоле и ядре, но уравновешивается медленным высвобождением лекарств из лизосом, тем самым увеличивая время воздействия лекарств (Llanos et al., 2019). Другим признаком сенесценции, связанным с лизосомной дисфункцией, является внутрилизосомное накопление агресом липофусцина (см. «Повреждение белка» и «Повреждение липида») (согласно обзору Gorgoulis et al., 2018). Интересно, что липофусцин, как сообщалось, стимулировал экспрессию антиапоптотического фактора Bcl-2, придавая устойчивость к апоптозу, еще одной характеристике сенесцентных клеток (McHugh and Gil, 2018). Лизосомы в сенесцентных клетках также участвуют в процессинге хроматина (CCF) (см. «Повреждение ДНК» и «Секреция») (Ivanov et al., 2013).
Эпигенетические изменения и изменения в генной экспрессии
Перечисленные выше признаки связаны с изменениями в экспрессии генов, определяемыми регуляцией транскрипции кодирующих и некодирующих РНК, которые можно использовать для обнаружения сенесцентности. Здесь мы обсуждаем такие серьезные изменения и описываем новую базу данных, которая может помочь в идентификации генов, связанных с сенесцентностью, называемую SeneQuest (http://Senequest.net) (см. Дополнительная информация и таблица S1).
Хроматиновый ландшафт
Эпигенетические модификации в сенесцентных клетках происходят, но в основном это зависит от контекста (Cheng et al., 2017). Например, репликативное старение коррелирует с глобальной потерей метилирования ДНК в сайтах CpG (Cheng et al., 2017). В дополнение к глобальной потере метилирования ДНК клеточная сенесценция влечет за собой очаговое увеличение метилирования ДНК на некоторых островках CpG (Cruickshanks et al., 2013). Интересно, что этот профиль метилирования ДНК в некоторой степени напоминает паттерны, связанные с раком и старением (Cruickshanks et al., 2013Се и др., 2018). Клетки, подвергающиеся OIS, не обнаруживают таких изменений в метилировании ДНК (Xie et al., 2018), усиливая разнообразный характер эпигенетических изменений при старении.
Сенесцентные клетки демонстрируют глобальное увеличение доступности хроматина, но общий профиль генома варьируется в зависимости от возбуждающих факторов (De Cecco et al., 2013). и Варианты гистонов и их индивидуальные модификации (Cheng et al., 2017, Эрнандес-Сегура и др.,2018, Рай и др., 2014) показывают изменения во время старения. Например, H4K16ac часто обогащается активными промоторами в сенесцентных, но не пролиферирующих клетках (Rai et al., 2014). Их накопление тесно коррелирует с вариантом гистона H3.3, который депонируется в хроматин независимо от репликации ДНК с помощью шаперонов HIRA / UBN1 / CABIN1 и ASF1a (Rai et al., 2014). Примечательно, что протеолитическое расщепление N-конца H3.3 коррелирует с репрессией генов в разных подгруппах генов во время старения (Ivanov et al., 2013). Глобальная потеря линкерного гистона H1 является еще одной особенностью сенесцентности (Funayama et al., 2006). Определенные модификации гистонов имеют решающее значение для старения, такие как повышенный уровень H4K20me3 и H3K9me3, которые способствуют остановке пролиферации (Cheng et al., 2017Ди Микко и др., 2011, Salama et al., 2014), тогда как повышенный уровень H3K27ac у энхансеров генов способствует SASP (Hernandez-Segura et al., 2018).
Сенесцентность также связано с морфологическими изменениями хроматина. Ассоциированные с сенесцентностью очаги гетерохроматина (SAHF), визуализируемые как DAPI-плотные очаги, обогащены гетерохроматиновым белком (HP) 1. SAHF состоят из факторов хроматина, включая RB, вариант гистонов macroH2A, белков группы A с высокой подвижностью, HIRA / UBN1 / CABIN1 и шапероны ASF1a - и для них характерно увеличение плотности ядерных пор (Boumendil et al., 2019, Salama et al., 2014). Первоначально предполагалось, что SAHF способствуют регуляции генов (Salama et al., 2014). Однако с тех пор было показано, что SAHF содержат, в значительной степени поздно реплицируемые, гетерохроматические области с низким содержанием генов, даже в пролиферирующих клетках, и вероятно их роль в экспрессии генов, связанных с сенесцентностью, невелика (Salama et al., 2014). Сенесцентность также коррелирует с глобальной потерей линкерного гистона H1 (Funayama et al., 2006). Примечательно, что SAHF, по-видимому, зависят от типа клеток и воздействий, так как они наблюдаются не во всех сенесцентных клетках (Di Micco et al., 2011, Кеннеди и др., 2010, Шарплесс и Шерр, 2015), что делает их полезными для идентификации сенесцентности, в то время как функциональное значение еще предстоит выяснить.
Другой признак хроматина, называемый сенесцентно-ассоциируемым растяжением сателлитов (senescence-associated distension of satellites (SADS)) , соответствует декомпрессии
(пери) центрического конститутивного гетерохроматина (Cruickshanks et al., 2013, De Cecco et al., 2013, Swanson et al., 2013). SADS предшествуют образованию SAHF и могут с большой вероятностью быть связаны со сенесцентностью (Swanson et al., 2013). Ретротранспозируемые элементы представляют собой другой тип конститутивного гетерохроматина, связанного с сенесцентностью. Нормально репрессированные ретротранспозоны LINE-1 (L1) активируются, стимулируя путь cGAS-STING, который вызывает интерфероновый ответ типа 1 (см. Раздел) (De Cecco et al., 2013). Следовательно, помимо запуска геномной нестабильности, эти элементы подпитывают SASP (Criscione et al., 2016).
Пониженная регуляция ламина В1, основного компонента ядерной пластинки, является еще одной ключевым признаком сенесцентности (Dou et al., 2015Freund et al., 2012, Шах и др., 2013, Шими и др., 2011). Потеря ламина B1 коррелирует с эпигенетическими профилями (Salama et al., 2014), а также сенесцентно-ассоциированными структурами хроматина (SAHFs и SADSs) (Salama et al., 2014Swanson et al., 2013). Его восстановление происходит преимущественно в областях, богатых H3K9me3, процесс, который, по-видимому, высвобождает H3K9me3 из ядерной пластинки, способствуя пространственной перестройке гетерохроматина H3K9me3 с образованием SAHFs (Salama et al., 2014). Анализ Hi-C (картирование контактов хроматина по всему геному) в OIS выявил снижение локальной связности в регионах, обогащенных H3K9me3 и ламином B1 (Chandra et al., 2015). Репликативное старение, с другой стороны, показало потерю дальних и усиление ближних взаимодействий внутри хромосом (Criscione et al., 2016), подразумевая, что природа связанных с сенесцентностью взаимодействий хроматина высокого порядка зависит от возбуждающих факторов и контекста (Zirkel et al., 2018). Кроме того, предполагается, что потеря ламина B1 и снижение ядерной целостности подпитывают SASP, способствуя образованию CCF (Dou et al., 2015, Иванов и др., 2013), стимулируя тем самым путь cGAS-STING и интерфероновый ответ (см. раздел) (Li and Chen, 2018). Опосредованное аутофагией формирование CCF (Dou et al., 2015) вместе со сниженным синтезом гистонов (O’Sullivan et al., 2010) также может привести к глобальной потере ядерных гистонов во время старения, влияя на ландшафт хроматина (Chan and Narita, 2019, Иванов и др., 2013).
Транскрипционные подписи
Несколько генов, связанных с остановкой клеточного цикла и SASP, часто исследуют в сочетании с другими биомаркерами для подтверждения сенесцентного фенотипа или типа сенесцентности (рис. 1). Например, должны определяться повышенная экспрессия ингибиторов циклинзависимой киназы, CDKN1A (p21WAF1 / Cip1), CDKN2A (p16INK4A) и CDK2B (p15INK4B) и подмножества генов SASP, наряду со сниженной экспрессией циклинов CCNA2 и CCNE2 и LMNB1. Кроме того, следует установить транскриптом предполагаемых сенесцентных клеток, который затем можно будет сравнить с увеличением числа существующих транскриптомов старения (Hernandez-Segura et al., 2018).
Исследования полного транскриптома сыграли важную роль в определении основных путей сигналинга, участвующих в установлении фенотипов старения, и в некоторых случаях, в прогнозировании мишеней для лекарств (Zhu et al., 2015). Набор из 13 генов был дифференцированно отрегулирован в нескольких типах клеток, подвергающихся различным формам старения, включая вызванное онкоген-индуцированное, репликативное и индуцированное повреждением ДНК (Hernandez-Segura et al., 2017). Совсем недавно в аналогичном исследовании, в котором рассматривались только фибробласты и эндотелиальные клетки, также предпринимались попытки определить связанные со старением сигнатуры транскриптома (Casella et al., 2019). Из-за текущей нехватки наборов данных транскриптома и доступности большего количества исследований одиночных клеток, которые позволяют оценить изменчивость внутри популяции (Wiley et al., 2017Zirkel et al., 2018), эти генные сигнатуры, вероятно, изменятся в ближайшие годы. Но в конечном итоге сигнатура экспрессии генов старения окажется полезной для идентификации сенесцентности при многих условиях в культуре и in vivo.
микроРНК и некодирующие РНК
Некодирующие РНК, в частности микроРНК (miRNA), могут влиять на программу старения, поодиночке или совместно. Функциональные исследования выявили несколько микроРНК, которые прямо или косвенно модулируют изобилие ключевых эффекторов старения, включая p53, p21WAF1 / Cip1 и SIRT1 (Suh, 2018). miR-504 нацелен на 3'UTR p53, снижая численность и активность p53 (Hu et al., 2010). Кроме того, Gld2-опосредованная стабилизация miR-122 делает возможным его связывание с 3'-UTR CBEP, что приводит к снижению полиаденилирования и трансляции мРНК p53 (Burns et al., 2011). И наоборот, miR-605 нацелен на MDM2, вызывая р53-опосредованное старение (Xiao et al., 2011) и множественные miRNA подавляют p21WAF1 / Cip1, включая 28 miRNA, блокирующие OIS (Borgdorff et al., 2010). Аналогично, miR-24 подавляет p16INK4a в клетках (Lal et al., 2008) и модели заболеваний, включая остеоартроз (Philipot et al., 2014). Сложные петли обратной связи miRNA могут модулировать программы старения. Например, путь p53 / miRNA / CCNA2 управляет старением независимо от оси p53 / p21WAF1 / Cip1 (Xu et al., 2019). Аналогично, p53-зависимая активация miR-34a / b / c подавляет клеточную пролиферацию и факторы выживания (Hermeking, 2010). Некодирующие РНК также регулируют SASP (Panda et al., 2017). MiR-146a / b, например, увеличивается через несколько недель после индукции старения и ослабляет провоспалительное плечо SASP (Bhaumik et al., 2009). miRNA также подавляют репрессоры старения, включая членов группы Polycomb (PcG) CBX7, EED, EZH2 и SUZ12 (miR-26b, 181a, 210 и 424), что приводит к дерепрессии p16INK4a и инициации старения (Overhoff et al., 2014). Наконец, роль miRNA в старении выходит за рамки их классических функций. Например, Argonaute 2 (AGO2) связывает let-7f в ядре, образуя комплекс с RB1 (pRB), что приводит к репрессии хроматина на промоторах CDC2 и CDCA8 (Benhamed et al., 2012). Глушение этих генов-мишеней E2F необходимо для инициации старения.
Длинные некодирующие РНК (lncRNAs) (> 200 нт) могут связывать РНК, ДНК или белки для регуляции старения. Например, ANRIL, антисмысловой транскрипт размером 30-40kb, кодируемый локусом CDKN2A, связывает CBX7 для подавления экспрессии INK4b / ARF / INK4a (Kim et al., 2017). Аналогично, lncRNA PANDA рекрутирует комплексы PcG, подавляя гены, способствующие старению (Kim et al., 2017), тогда как молчание GUARDIN, p53-чувствительной lncRNA, вызывает старение или апоптоз (Hu et al., 2018). Напротив, после OIS, индуцированного RAF, VNA lncRNA сохраняет старение, уменьшая подавляющее отложение H2A.Z на промоторах INK (Kim et al., 2017). Кроме того, lncRNA UCA1 нарушает ассоциацию РНК-связывающего белка hnRNP A1 с p16INK4A, но не с p14ARF, транскриптами (Kim et al., 2017). Кроме того, некодирующее профилирование РНК с упором на микроРНК обеспечивает сигнатуру старения (Suh, 2018). Интересно отметить, что содержание miRNA в небольших внеклеточных везикулах, высвобождаемых стареющими клетками, меняется с течением времени (Terlecki-Zaniewicz et al., 2018).
Иммунорегуляторные и антиапоптотические белки
Поиск белковых маркеров сенесцентности начался с OIS. В дополнение к идентификации известных регуляторов клеточного цикла, эти исследования идентифицировали DCR2 как общий маркер старения (Collado et al., 2005), характеризующий, как позже было показано, и другие типы старения. DCR2 является рецептором -приманкой, защищающим сенесцентные клетки от опосредованного иммунитетом апоптоза, таким образом блокируя иммунный надзор за сенесцентными клетками (Sagiv et al., 2013). Аналогично, производство лигандов MICA и ULBP2, активирующих рецептор естественных клеток-киллеров (NKG2D), увеличивается при старении, вызванном репликативными, OIS- и ДНК-повреждениями (Крижановский и др., 2008b, Сагив и др., 2016). Маркеры клеточной поверхности представляют особый интерес, поскольку они должны позволять количественное определение, выделение и транскрипционный анализ отдельных сенесцентных клеток, выделенных из тканей. Однако лиганды DCR2 и NKG2D неодинаковы у различных видов, что делает невозможным сравнение между мышью и человеком. Недавно на клеточной поверхности были идентифицированы два дополнительных активированных маркера, Notch1 в OIS и DPP4 в репликативном и OIS (Hoare et al., 2016). Оба белка участвуют в регуляции SASP. Кроме того, окисленная форма мембраносвязанного виментина была идентифицирована как маркер старения, который может быть использован для воздействия на эти клетки адаптивной иммунной системой (Frescas et al., 2017). Наконец, стареющие клетки устойчивы к апоптозу, который может быть опосредован повышенной экспрессией антиапоптотических членов семейства BCL-2 (Yosef et al., 2016).
Модели для изучения клеточного старения in vivo
Senescence Reporter Mice
Несколько трансгенных мышей были разработаны для оценки экспрессии p16Ink4a in vivo или ex vivo с использованием репортеров люциферазы или флуоресцентного белка. Измерение активности люциферазы в продольном направлении выявило увеличение экспрессии p16INK4A с возрастом мышей, а также возрастное увеличение вариабельности между животными, тогда как выделение флуоресцентных клеток p16 + позволило произвести фенотипирование (Liu et al., 2019, Охтани и др., 2010). Этот подход позволяет эндогенному промотору p16INK4A управлять сигналами, но вызывает гемизиготность p16. В другой мышиной модели (p16-3MR) используется люцифераза (rLUC), мономерный красный флуоресцентный белок (mRFP) и гибридный белок тимидинкиназы вируса простого герпеса (HSV-TK-), управляемый промотором p16INK4A, присутствующим в бактериальной искусственной хромосоме и интегрированный в геном мыши (Demaria et al., 2014). Этот подход позволяет обнаруживать и уничтожать стареющие клетки и не нарушать эндогенный локус CDKN2A. Наконец, мыши INK-ATTAC экспрессируют слитый белок FKBP-Caspase 8 и репортер усиленного зеленого флуоресцентного белка (eGFP) для уничтожения и обнаружения клеток p16+, управляемых фрагментом 1.6 кБ промотора p16INK4A (Baker et al., 2011., Folgueras et al., 2018). Несмотря на различия между этими мышами, они были ценны тем, что показали, что сенесцентные клетки способствуют широкому спектру возрастных патологий (Calcinotto et al., 2019). Также доступны мышиные модели, экспрессирующие люциферазу и eGFP из промотора p21WAF1 / Cip1, (Ohtani et al., 2007).
Мышиные модели ускоренной сенесцентности и ускоренного старения
Было разработано несколько моделей прогерических мышей для имитации синдромов прогерии человека, включая нарушения репарации ДНК и нарушения целостности генома (Folgueras et al., 2018). Мыши-прогероиды с ускоренным старением и сокращенной продолжительностью жизни также полезны для оценки роли клеточного старения в старении и тестирования сенотерапевтических средств. Например, демонстрация того, что удаление клеток, экспрессирующих p16INK4A, замедляет возрастное увядание у прогероидных мышей BubR1H / H, является первым доказательством того, что сенесцентные клетки являются причиной определенных фенотипов старения (Baker et al., 2011)., Folgueras et al., 2018). BUBR1 важен для контрольной точки сборки митотического веретена (Guo et al., 2012). Мыши BubR1H / H, которые экспрессируют 10% от нормального уровня BUBR1, имеют повышенную анеуплоидию, некоторые прогероидные признаки и повышенную экспрессию маркеров старения в нескольких органах (Folgueras et al., 2018). Избирательное удаление клеток p16INK4A + у мышей BubR1H / H- INK-ATTAC задерживает кифоз, катаракту и атрофию мышц, но не задерживает сердечные аритмии и повышение жесткости артериальной стенки, а также не продлевает продолжительность жизни (Baker et al., 2011, Folgueras et al., 2018).
Точно так же у прогероидных мышей Ercc1- / Δ, несущих дефект репарации ДНК, преждевременно развиваются множественные заболевания, связанные с возрастом, отчасти обусловленные ускоренным накоплением стареющих клеток в многочисленных тканях (Folgueras et al., 2018). Ercc1- / Δ мыши (Folgueras et al., 2018) экспрессируют 5% нормального уровня эндонуклеазы ERCC1-XPF, что важно для иссечения нуклеотидов, межцепочечной сшивки и восстановления двухцепочечного разрыва. Эти мыши развивают многочисленные возрастные гистопатологические поражения практически в каждой ткани (Folgueras et al., 2018) и накапливают окислительное повреждение ДНК быстрее, чем мыши дикого типа (Wang et al., 2012). Обработка мышей Ercc1- / Δ сенолитическими препаратами снижает маркеры старения и увеличивает продолжительность здоровья (Fuhrmann-Stroissnigg et al., 2017, Юсефзаде и др., 2018, Zhu et al., 2015). Скрещивание этих моделей с репортерными трансгенами p16INK4A позволяет продолжительно наблюдать нагрузку сенесцентных клеток у живых животных (Robinson et al.,2018, Юсефзаде и др., 2018).
Синдром Хатчинсона-Гилфорда (HGPS) - это сегментарная или тканеспецифическая прогерия, вызванная мутациями, которые ставят под угрозу процессинг ламина А (Cau et al., 2014). У мышей с измененной или удаленной LMNA развиваются HGPS-подобные фенотипы. Они также накапливают сенесцентные клетки, что определяется по окрашиванию SA-β-gal и уровням мРНК маркеров старения, в скелетных мышцах и сердце, что согласуется с сайтами возрастной патологии и заболеваний (Folgueras et al., 2018). Точно так же в мышиной модели HGPS, которая воспроизводит патогенную LMN-сплайсинговую мутацию (мыши LmnaG609G / G609G), наблюдалось старение в печени и почках (Osorio et al., 2011). Однако пока не было показано, что сенесцнтные клетки являются причиной патологии HGPS.
Мышиная модель трихотиодистрофии (ТТД) (Andressoo et al., 2006), вызванный специфической мутацией в гене Xpd, также указывает на роль сенесцентных клеток в преждевременном старении. Здесь роль сенесцентности в стимулировании старения при XpdTTD / TTD была четко задокументирована тем фактом, что обработка пептидом изоформы D-ретро инверсо (DRI-) FOXO4 была способна нарушить взаимодействие FOXO4 с p53. Лечение с помощью пептида FOXO4-DRI с снизило сонливость у мышей XpdTTD / TTD , улучшило плотность меха, активность на беговых колесах и физические реакции на внешние стимулы (Baar et al., 2017).
Потеря Cu-Zn-супероксиддисмутазы (Sod1) у мышей ускоряет старение (Zhang et al., 2017). У мышей Sod1 - / - наблюдается повышенное окислительное повреждение ДНК, сенесцентность (p16INK4A, p21WAF1 / Cip1), факторы SASP (Il1β, Il6), клетки SA-β-gal + и возрастная патология в почках (Zhang et al., 2017). До настоящего времени не было продемонстрировано, что сенесцентность ведет к патологии у мышей Sod1 - / -.
Удаление репрессивной субъединицы NFKB1 фактора транскрипции NF-κB вызывает преждевременное старение у мышей. Было показано, что эти мыши испытывают хроническое прогрессирующее воспаление слабой степени, которое способствует широкому спектру фенотипов старения и ранней смертности; однако, в отличие от некоторых широко используемых моделей мышей с прогерией, максимальная продолжительность жизни этих мышей составляет приблизительно 20 месяцев. Кроме того, эти мыши демонстрируют повышенную частоту сенесцентных клеток во многих тканях (Jurk et al., 2014).
Наконец, в результате селективного инбридинга мышей AKR / J были получены многочисленные штаммы мышей с ускоренным старением (SAMP), включая SAMP1-3 и SAMP6-11 (Takeda et al., 1997). Хотя эти мыши имеют повышенную сенесцентность и, следовательно, могут быть использованы для тестирования сенотерапии, остается неясным, какие мутантные гены управляют старением в этих линиях.
Идентификация клеточной сенесценции in vivo
Упрощенный алгоритм обнаружения сенесцентных клеток in situ
In vivo сенесцентные клетки находятся в тканях. Их влияние на функцию тканей может быть локальным или глобальным из-за SASP (Xu et al., 2018). Чтобы понять, как сенесцентность клеток влияет на функцию тканей, ремоделирование тканей и старение, нам нужны инструменты для выявления сенесцентных клеток в тканях.
На большинстве тканей может быть выполнен анализ отдельных клеток. Общие методы включают иммуноокрашивание, гибридизацию in situ и многоцветную проточную цитометрию
(с визуализацией). Еще большее количество маркеров можно оценить с помощью массовой цитометрии (цитометрия по времени пролета [CYTOF]) (Abdelaal et al., 2019). Хотя все это выглядит многообещающе, ограничения включают потерю информации о пространственных ассоциациях и переменную эффективность выделения различных типов клеток, в том числе при различении сенесцентных и не сенесцентных клеток. Следовательно, микроскопическое изображение остается предпочтительным методом обнаружения сенесцентности in situ.
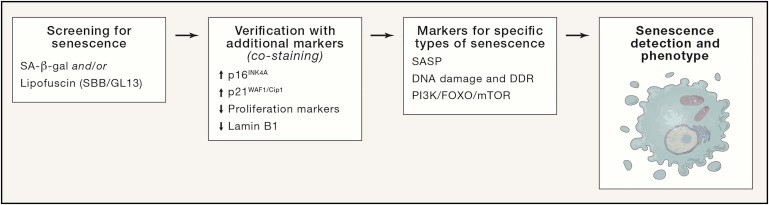
Как уже упоминалось, в настоящее время не существует ни одного маркера с абсолютной специфичностью для сенесцентных клеток. Специфичность маркера варьируется в зависимости от типа клетки, ткани, стадии развития организма, вида и других факторов. Тем не менее, некоторые маркеры имеют более универсальную валидность, в то время как другие связаны с конкретными типами сенесцентности. Поэтому мы рекомендуем мультимаркерный подход, сочетающий более широкие и более специфические маркеры для более надежного обнаружения сенесцентных клеток in situ (рис. 3).
Рисунок 3. Трехшаговый рабочий процесс с несколькими маркерами для обнаружения стареющих клеток
Проблемы по обнаружению сенесцентных клеток у людей
Роль сенесцентности в болезнях человека ясна из клеточных исследований, в то время как доказательства in vivo только сейчас появляются (Childs et al., 2015, Он и Шарплесс, 2017, Муньос-Эспин и Серрано, 2014). OIS, первоначально описанный в культуре, был первым типом сенесцентности, подтвержденным у людей (Serrano et al., 1997). OIS или старение, вызванное потерей опухолевого супрессора, было подтверждено in vivo на предраковых опухолях человека и мыши (Collado et al., 2005, Горгулис и Халазонетис, 2010, Kuilman and Peeper, 2009) и первичных или леченных новообразования (Haugstetter et al., 2010). Более поздние сообщения о разнообразных действиях секретома сенесцентности (см. «Секреция») привели к признанию его про-онкогенных свойств, установив то, что сейчас принято считать двойной ролью сенесцентности в канцерогенезе (Lee and Schmitt, 2019). В последнее время появились доказательства, связывающие сенесцентность с другими распространенными возрастными заболеваниями человека. Эти заболевания включают нейродегенеративные расстройства, глаукому, катаракту, атеросклероз и сердечно-сосудистые заболевания, диабет, остеоартрит, легочный фиброз почек и печени (Childs et al., 2015Он и Шарплесс, 2017, Муньос-Эспин и Серрано, 2014) (Таблица S2).
В большинстве исследований сенесцентность оценивается в культурах ex vivo или свежих образцах с помощью окрашивания SA-β-gal или косвенных маркеров в фиксированных формалином тканях (Haugstetter et al., 2010, Он и Шарплесс, 2017, Kuilman and Peeper, 2009, Муньос-Эспин и Серрано, 2014, Серрано и др., 1997). Поскольку SA-β-gal не подходит для фиксированных тканей, анализ на сенесцентность в образцах человека является сложной задачей. Гистохимический краситель SBB взаимодействует с липофусцином, еще одним отличительным признаком сенесцентных клеток (Georgakopoulou et al., 2013). Липофусцин сохраняется в фиксированном материале (Georgakopoulou et al., 2013) и является устойчивым, он даже был изолирован из окаменелых человеческих останков в возрасте 210 000 лет (Harvati et al., 2019), Myrianthopoulos et al., 2019). Недавно разработанный реагент (GL13) может применяться в иммуногистохимии (Evangelou et al., 2017) и позволил идентифицировать сенесцентные клетки Ходжкина и Рида-Штернберга (HRS) при лимфомах Ходжкина (cHL), где они давали плохой прогноз (Myrianthopoulos et al., 2019). Эти клетки имеют гигантские размеры, большое и иногда мультилобулярное ядро (признак абортивного клеточного цикла), имеют повышенную секреторную активность, встроены в воспалительную среду и демонстрируют гистологический паттерн, явно отражающий особенности сенесцентного фенотипа (Küppers). и др., 2012) (Рисунок 1). Другим методом идентификации и количественного определения сенесцентных клеток in vivo является окрашивание SA-β-gal в сочетании с анализом ImageStream X (Biran et al., 2017).
Несмотря на многообещающие результаты, которые дает каждый маркер, ни один маркер не является полностью специфичным для сенесцентности (Sharpless and Sherr, 2015) (Шарплесс и Шерр, 2015). Мы рекомендуем комбинировать цитоплазматические (например, SA-β-gal, липофусцин), ядерные (например, p16INK4A, p21WAF1 / Cip1, Ki67) и SASP, контекстные и / или специфичные для типа клеток маркеры (Childs et al., 2015) (Рисунок 3).
Выводы, открытые вопросы и перспективы
После первого описания клеточного старения, проведенного Хейфликом и его коллегами почти 60 лет назад, был достигнут значительный прогресс в понимании характеристик и функций сенесцентных клеток. Ограничением, особенно для изучения биологических образцов, остается отсутствие специфических маркеров. Чтобы преодолеть это препятствие, мы предлагаем мультимаркерный подход (рисунок 3). Эту стратегию также можно использовать для оценки эффективности сенолиза, нового терапевтического подхода, недавно введенного в клинические испытания для лечения различных возрастных патологий (Myrianthopoulos et al., 2019).
Концептуально старение можно рассматривать как нелинейную, многопараметрическую функцию [F (x, y) = z], в которой зависимая переменная (результат), z, зависит от независимых переменных x (стимул) и y (среда). Нелинейная обработка продиктована динамическими генетическими и эпигенетическими процессами, которые могут привести к циклам перепрограммирования, пока не будет достигнуто устойчивое состояние. На первый взгляд, результаты заключаются в выводе из клеточного цикла и секреции биоактивных молекул. Тем не менее, последние данные свидетельствуют о том, что остановка клеточного цикла не всегда является обязательной, поскольку постмитотические клетки, уже неспособные к пролиферации, могут приобретать черты сенесцентности, и при определенных условиях сенесцентные клетки могут повторно войти в клеточный цикл. SASP выглядит общей характеристикой, связанной с сенесцентностью, но она очень неоднородна. Таким образом, для понимания плейотропных фенотипов сенесцентных клеток необходим переход от традиционного редукционизма к более систематическим, многопараметрическим подходам. Разработка сложных высокопроизводительных методов и инструментов машинного обучения, которые могут обрабатывать данные по многим омикам, поможет достичь этой цели (Vougas et al., 2019). Хотя у «старого» и «нового» есть свои плюсы и минусы, мы можем объединить лучшее, чтобы получить «профильный» анализ фенотипов сенесцентности. Этот подход, вероятно, представит более конкретные сигнатуры, связанные со старением, для решения важных неотвеченных вопросов: что вызывает и регулирует SASP, как генетические и эпигенетические детерминанты взаимодействуют с запускающими стимулами и клеточной микроокружающей средой? Какие системы геномной репарации действуют в различных сценариях старения, что заставляет клетки избегать задержки роста и какие фенотипы приобретают «сбежавшие» сенесцентные клетки? Ответы на эти и другие вопросы помогут разработать конкретные панели маркеров для каждого подтипа сенесцентности (см. Шаг 3 на рисунке 3) и послужат ориентиром для развивающейся области сенотерапии (van Deursen, 2019)., таким образом, достигая наилучшего результата в духе точной медицины.
Благодарности
Мы хотели бы поблагодарить Николаоса Кастринакиса, Панагиотиса В.С. Василею, Гкикас Магиоркинис, Элени Фициу и Микела Боргесан за их ценную поддержку этой работы. Мы заранее приносим свои извинения за то, что по причине нехватки места мы опустили ссылки на соответствующие статьи и обзоры. М.Д. финансируется Голландским онкологическим фондом, Нидерланды (грант ID 10989). В.Г., К.Е. и К.В. были финансово поддержаны исследовательской и инновационной программой Horizon 2020 Европейского Союза в рамках грантового соглашения Марии Склодовской-Кюри №. 722729 (СИНТРЕЙН); Благотворительный фонд социальных и культурных наук (KIKPE), Греция; Фонд KIKPE, Афины, Греция; Пентагон Биотехнология, Великобритания; DeepMed IO, Великобритания; номер гранта 775 от Греческого фонда исследований и инноваций (HFRI); и гранты NKUA-SARG 70/3/9816, 70/3/12128 и 70/3/15603. MS: финансируется IRB и грантами Министерства экономики Испании, совместно финансируемыми Европейским фондом регионального развития (ERDF) (SAF2013-48256-R), Европейским исследовательским советом (ERC-2014-AdG / 669622), и Фондом LaCaixa.
Декларация интересов
М.Д. является соучредителем и акционером Cleara Biotech и имеет патенты, связанные с сенолитиками. А.А. является соучредителем и акционером Oncosence. J.C. является соучредителем и акционером Unity Biotechnology и имеет патенты, связанные с сенолитиками. D.Z. является соучредителем и акционером Unity Biotechnology и имеет патенты, связанные с сенолитиками. J.G. владеет акциями и выступает в качестве консультанта Unity Biotechnology; является научным основателем, владельцем акций и консультантом Geras Bio; и имеет патенты, связанные с сенолитиками. T.v.Z. является членом консультативного совета клиники Майо Роберта и Центра Арлин Когод по проблемам старения в Нучидо.
Источник: https://www.cell.com/cell/fulltext/S0092-8674(19)31121-3
Перевод: Ник Сестрин
31 октября 2019 DOI: https://doi.org/10.1016/j.cell.2019.10.005
Авторы: Vassilis Gorgoulis, Peter D. Adams, Andrea Alimonti, Dorothy C. Bennett, Oliver Bischof, Cleo Bishop, Judith Campisi, Manuel Collado, Konstantinos Evangelou, Gerardo Ferbeyre, Jesús Gil, Eiji Hara, Valery Krizhanovsky, Diana Jurk, Andrea B. Maier, Masashi Narita, Laura Niedernhofer, João F. Passos, Paul D. Robbins, Clemens A. Schmitt, John Sedivy, Konstantinos Vougas, Thomas von Zglinicki, Daohong Zhou, Manuel Serrano, Marco Demaria.








































































