Вступление. Открытия лаборатории Белозерского.
В конце 1960-х годов в МГУ, на одном из семинаров межфакультетской лаборатории биоорганической химии, сотрудник А.Н. Белозерского, Борис Ванюшин, занимавшийся изучением необычных нуклеотидов в составе ДНК, высказал идею о том, что некоторые из этих необычных нуклеотидов, а именно 5-метилцитозин, играют важную роль в механизмах регуляции экспрессии генов, клеточной дифференцировки и процессов старения организма.
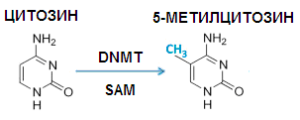 Образование этого 5-метилцитозина в ДНК было обусловлено ферментативным метилированием обычного цитозина, то есть посадкой на него метильных групп. ДНК в месте посадки на её цитозин метильных групп несколько изменяла свои свойства.
Образование этого 5-метилцитозина в ДНК было обусловлено ферментативным метилированием обычного цитозина, то есть посадкой на него метильных групп. ДНК в месте посадки на её цитозин метильных групп несколько изменяла свои свойства.
Количество 5-метилцитозина в ДНК менялось в разные периоды жизни организма от максимального, при рождении, до минимального, у дряхлого от старости. Так впервые в СССР была сформирована идея о том, что старение на уровне генома регулируется эпигенетически ([1] [2]) — то есть путём механизма вызывающего длительное и стабильное изменение экспрессии генов, которое не связано с изменениями в последовательности ДНК. В последующем Ванюшин опубликовал цикл работ под названием «Метилирование ДНК — эпигенетический контроль за генетическими функциями организма» и в 1977 году вместе с Г. Бердышевым книгу «Молекулярно-генетические механизмы старения».
К сожалению, из-за сложности и затратности, используемой в те годы технологии изучения процессов метилирования ДНК, дальнейшие исследования в этом направлении были резко сужены.
Сегодня имеется множество разных методов определения метилирования ДНК, некоторые из которых (прохождение цепи ДНК через микропору генноинженерного белка порина А) позволяют читать результаты, не разрушая при этом ДНК, что намного упростило и удешевило подобные исследования ([3] [4])
Ванюшин был поражен ярко выраженным глобальным уменьшением степени метилирования ДНК во всех органах нерестящейся горбуши, которая после нереста очень быстро погибает от внезапно наступившей старости. Аналогичное понижение уровня метилирования ДНК и запрограммированная гибель наблюдалась и у таких растений как бамбук и агава – процессы, которые запускались только после цветения этих растений. Срубив цветоносный побег можно надолго остановить этот процесс старения и предотвратить резкое понижение уровня метилирования ДНК ([5]). Быстрое снижение общего уровня метилирования ДНК наблюдалось при старении однолетнего растения Arabidopsis thaliana ([6]), но не в случае, когда оно из-за засоленной почвы превращалось в многолетник ([7]). Более того была найдена мутация drd1-6, которая воздействуя на механизм регулирующий старение листьев с помощью RdDM (RNA-directed DNA methylation) ([8]), т.е. через микроРНК воздействующую на метилирование ДНК, вызывала резкое замедление старения листьев Arabidopsis ([9]).
Чемпион по уровню метилирования ДНК Гигантская секвойя (24% генома, тогда как у мыши их всего 4%, а у винной мушки 0.03%), которая может достигать возраста в 2000-4000 лет, обладает способностью к вегетативному размножению путём клонирования. Так вот, эта способность резко снижается с возрастом растения и фазой его развития, как и у всех многолетних растений. Одновременно снижается уровень метилирования ДНК (до 14% генома). Однако стоит высадить обработанный фитогормонами черенок в землю, как через некоторое время происходит удивительное омоложение – после того как растение образует корни, способность к вегетативному размножению путём клонирования резко возрастает и одновременно восстанавливается повышенный уровень метилирования ДНК ([10]).
Эпигенетика
Что же за наука — эпигенетика? Вот как Борис Ванюшин объясняет этот термин: «Эпигенетика – наука о наследуемых свойствах организма, которые не связаны с изменением собственно нуклеотидной последовательности ДНК и могут быть не прямо, а опосредованно закодированы в геноме. К числу известных эпигенетических механизмов (сигналов) относятся: энзиматическое метилирование ДНК, гистоновый код (разные энзиматические модификации гистонов – ацетилирование, метилирование, фосфорилирование, убиквитинирование и др.) и замалчивание генов малыми РНК (miRNA, siRNA).» ([11]).
Модификации гистонов при старении
Коротко остановимся на энзиматических (ферментативных) модификациях гистонов. Гистоны это щелочные белки, участвующие в упаковке ДНК в ядре (ДНК намотана на множество состоящих из гистонов катушек-кассет, называемых нуклеосомами) и одновременно выполняющие функцию структуры регулирующей, под влиянием их эпигенетических модификации, такие процессы как транскрипция, репликация, репарация.
Ферменты модифицирующие гистоны обычно объединены в комплексы из многих белков, такие как, например, поликомб ингибиторные комплексы PRC1 и PRC2 или комплекс NuRD (Nucleosome Remodeling Deacetylase). Наиболее изученными являются метки гистона H3, такие как H3K27me3, H3K4me3, H3K27ac1 (где за названием гистона H3 идёт буква K обозначающая аминокислоту лизин, затем порядковый номер этой аминокислоты в последовательности аминокислот гистона H3, затем сокращенное название модифицирующей метки: me – метильная или ac ацетильная группа и цифра отображающая количество таких групп).
Эти гистоновые метки, очевидно, играют важную роль в процессах, от которых зависит продолжительность жизни, что подробно обсуждается в одном из последних обзоров ([12]). Так, например, ингибирование фермента уменьшающего степень метилирования метки не активного хроматина — H3K27me3 до H3K27me1 в ответ на дисфункцию митохондрий, препятствует активации механизма, реагирующего на развёрнутые белки UPRmt (unfolded protein response) – консервативного механизма препятствующего ускоренному старению у таких эволюционно далёких друг от друга видов как червячок C. Elegans и млекопитающее — мышка ([13])
Обнаружено, что некоторые важные для понимания, изменения метилирования ДНК, происходят главным образом в районах так называемого бивалентного хроматина. ([14]) Особенностью бивалентного хроматина является то, что на таком хроматине обычно расположен ключевой набор онтогенетически регулируемых генов, которые характеризуются тем, что несут сразу два (би, от лат. bis — «дважды») типа меток гистона H3: 1.) активные (H3K4me3 – трижды метилированный лизин в положении 4) и 2.) неактивные (H3K27me3 — трижды метилированный лизин в положении 27; (не путать с H3K27ac3 — трижды ацетилированным лизином в положении 27, который наоборот является меткой активного хроматина).
В клетках взрослого организма метка H3K27me3 частично заменяется на метку H3K9me3 (гистон H3 с трижды метилированным лизином в положении 9) ([15]).
При старении изменения метилирования ДНК затрагивают в первую очередь именно участки хроматина с репрессивными метками (H3K9me3 и H3K27me3), а также гены, кодирующие белки группы Поликомб – белки участвующие в работе комплексов PRC1 и PRC2 ([16]).
Показано, что признаками преждевременного старения клеток (называемого синдромом Вернера), являются глобальная потеря H3K9me3 наряду с гипометилированием ДНК, а также изменения активности ряда генов и архитектуры гетерохроматина ([17]).
По данным Sun и других исследователей, при старении стволовых клеток из которых образуются клетки крови, в их геноме исчезают 355 бивалентных участков хроматина, характерных для молодого организма, но при этом возникает 1245 бивалентных участков хроматина, характерных для старого организма ([18]). Они также обнаружили, что увеличение метки активного хроматина H3K4me3 тесно коррелирует с гипометилированием ДНК (следует отметить, что в работе других исследователей такая же корреляция при вызванном старением гипометилировании была обнаружена для H3K4me1, причем она не зависела от типа клетки ([19])), тогда как H3K27me3 расположена как на участках с гипо- , так и на участках с гиперметилированием ДНК. Кроме того с гипометилированием ДНК коррелировало снижение метки H3K36me3, характерной для процессов связанных с транскрипционной элонгацией и сплайсингом. Следует отметить, что истощение H3K36me3 приводит к значительному сокращению продолжительность жизни ([20]).
Метилирование ДНК
Теперь что представляет собой метилирование ДНК. Это результат процессов, в ходе которых на определённые нуклеотиды в составе ДНК садится или же наоборот удаляется метильная группа. Такая метильная группа может исполнять роль метки-закладки, информирующей белковые комплексы как им себя вести относительно этого участка ДНК. Например, если метильные метки расположены на промоторе (последовательности нуклеотидов ДНК на которую садится РНК-полимераза чтобы начать синтез РНК) гена, то это обычно приводит к ингибированию (репрессии) данного гена. Удаление с промотора метильных групп (деметилирование) приводит к активации (дерепрессии) такого гена.
ДНК построена из четырёх нуклеотидов, но у эукариот метилированию обычно подвергается только один из них – цитозин.
Посадку метильной группы осуществляет фермент ДНК-метилтрансфераза.
Следует при этом отметить, что регуляция посредством метилирования ДНК характерна не для всех организмов. Так, например у плодовой мушки дрозофилы число таких метилированных цитозинов ничтожно мало – всего 0.03%, а у червячка C. elegans и дрожжей и того меньше ([21]). У мышки их заметно больше – порядка 4%.
Казалось бы так ли уж важно понимать процессы метилирования ДНК для того чтобы разобраться в механизмах старения, ведь у плодовой мушки и у дрожжей эти процессы не играют существенной роли, однако они стареют также как и другие организмы. Почему важно изучать роль метилирования ДНК в механизмах старения?
Начнём с того, что метилирование ДНК как правило, исчезает при образовании зиготы – клетки, образующейся в результате оплодотворения и с которой начинается процесс развития нового организма. Затем, по мере развития организма, происходит постепенное накопление всё новых и новых метильных групп. Причем характер метилирования, регулирующего генную активность (экспрессию) при делении клеток передается вновь образованным клеткам. Считается, что метилирование ДНК позволяет стабилизировать экспрессию генов в клетках, закрепляя «клеточную память» в клетках, которые делятся и дифференцируются из эмбриональных стволовых клеток в клетки различных специализированных тканей организма. Поскольку изменение метилирования ДНК закреплено клеточной памятью и стабильно наследуется клетками-потомками данной клетки, но не является само по себе мутацией ДНК, его можно назвать эпигенетическим. ([22]) Все соматические клетки организма (за исключением иммунных клеток вроде T и B клеток, а также эритроцитов, которые при созревании вообще теряют ядро), несмотря на значительные различия в их физиологических функциях, имеют ДНК с одной и той же последовательностью нуклеотидов, но отличающуюся по характеру метилирования. Этот феномен — что в разных клетках одного и того же организма ДНК метилирована по-разному, Ванюшин с соавторами обнаружили ещё в 1970 м году, что уже тогда позволило им первыми заявить, что метилирование ДНК – механизм регуляции экспрессии генов и клеточной дифференцировки ([23]). Было обнаружено что после рождения в ходе старения у коровы, крысы и у мышей понижается содержание метилированного цитозина, причем понижение это происходит главным образом на участках ДНК, несущих многократно повторяющиеся последовательности ([24] [25]). При этом была подмечена закономерность — Mus musculus теряет участки метилирования со скоростью порядка 4,7 Х 104 (в месяц примерно 0.012% от уровня новорожденного), тогда как Peromyscus leucopus теряет 5-метилцитидин со скоростью 2.3 Х 104 (в месяц примерно 0.006% от уровня новорожденного) и при этом живет в два раза дольше чем Mus musculus. У человека общий уровень метилирования ДНК в соматических клетках также неуклонно снижается. В фибробластах человека при приближении репликативного старения, когда способность клетки к делениям заметно падает, происходит общее снижение уровня метилирования ДНК (главным образом в районах бедных на содержание генов, поздно реплицирующихся участков, а также LAD (lamina-associated domain) – доменах ДНК примыкающих к ядерной мембране (что сопровождает отслаивание гетерохроматина от ядерной ламины и замену ламина А на его укороченный аналог – прогерин ([26]) ), Все эти участки обычно несут метки гистонов неактивного хроматина — гетерохроматина). Вместе с тем происходит очаговое гиперметилирование там, где расположены CpGi островки, локализованные на генных промоторах, где метилирование ДНК приводит к ингибированию генов. По мнению авторов этого исследования и их последователей, постаревшие клетки очень похожи на раковый эпигеном ([27] [28]).
 Участок ДНК с CpG динуклеотидом Фото: серыми столбиками обозначены водородные связи с противоположной комплементарной цепью ДНК
Участок ДНК с CpG динуклеотидом Фото: серыми столбиками обозначены водородные связи с противоположной комплементарной цепью ДНК
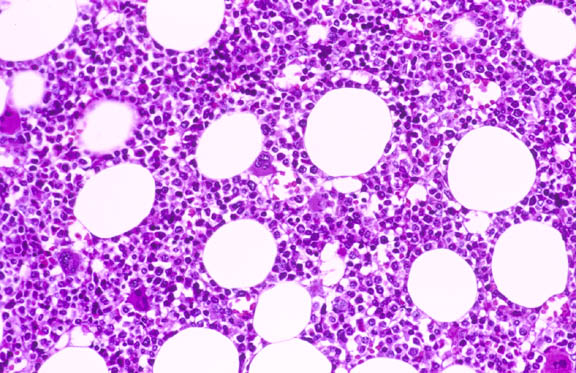
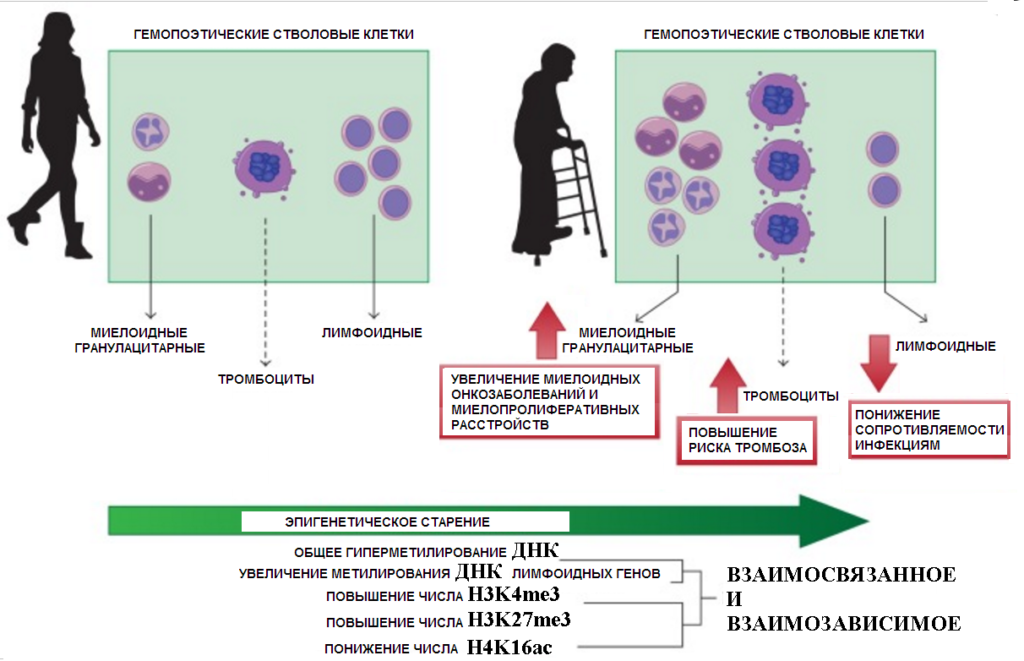
Однако в стволовых клетках предшественниках клеток крови, которые сохраняют способность к делению до глубокой старости организма метилирование ДНК не снижается, а перераспределяется: усиливается в участках генома связанных с лимфоидной и эритроидной специализацией. В результате при старении количество образуемых клеток этих типов снижается ([29]).
CpG участки и CpG островки
Обычно метилирование, связанное с изменениями активности генов, происходит на цитозине расположенном на так называемых CpG участках ДНК, где за нуклеотидом цитозина в направлении от 5I (пять штрих) к 3I (три штрих) (исходя из нумерации атомов углерода в молекуле сахара пентозы, см. рисунок) следует нуклеотид гуанина (это часто обозначают так: 5I → 3I).
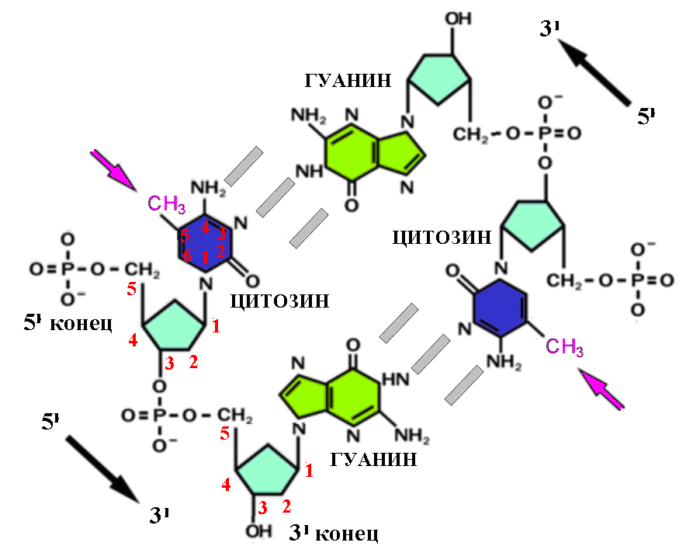 Участок ДНК с CpG динуклеотидом (серыми столбиками обозначены водородные связи с противоположной комплементарной цепью ДНК). Фиолетовая стрелка указывает на метильную группу 5-метилцитозина. Метилирование ДНК в CpG динуклеотидах обычно симметрично.
Участок ДНК с CpG динуклеотидом (серыми столбиками обозначены водородные связи с противоположной комплементарной цепью ДНК). Фиолетовая стрелка указывает на метильную группу 5-метилцитозина. Метилирование ДНК в CpG динуклеотидах обычно симметрично.
С развитием технологии секвенирования накопились данные о том что помимо метилирования на CpG участках существует также достаточно значимое не-CpG-метилирование, когда в окружении 5-метилцитозина вместо гуанина стоят другие нуклеотиды. Не-CpG метилирование имеет несколько свойств, которые отличают его от CpG метилирования. Так, в отличие от метилирования участков CpG, которое обычно симметрично, то есть метилирован цитозин на обеих цепях ДНК (гуанину комплементарно противостоит цитозин в противоположной цепи), при не-CpG-метилировании метильная группа чаще сидит только на одной из цепей ДНК — то есть не симметрично ([31]).
Скопления таких CpG динуклеотидов называют CpG островками и обозначают CpGi. Такие CpGi можно встретить более чем у половины всех генов составляющих геном организма. Длина таких островков обычно не превышает тысячи нуклеотидов. CpG динуклеотиды островков CpGi составляют только 1-2% всех CpG динуклеотидов и в большинстве случаев не метилированы. Если CpGi находится на территории промотора гена, то его метилирование приводит к ингибированию функции этого гена. Если же CpGi находится в другой части гена, например, в районе энхансера (англ. enhancer — усилитель) — небольшого участка ДНК, способного связываться с факторами транскрипции и таким образом увеличивать уровень транскрипции генов — то это метилирование может стимулировать транскрипцию.([32] [33])
Метилирование повторов, промоторов и энхансеров
Метилирование CpG на большей части генома направлено на стабилизацию генома путём контроля ДНК повторов. К числу таких повторов относятся: расположенные по бокам транспозонов, ретровирус-подобные (в отличие от ретровируса они не имеют гена env) элементы длиной 100-1800 пар нуклеотидов, называемые ещё длинными терминальными повторами LTR (long-terminal repeats); длинные (3,500-8000 п.н.) вкрапления ядерных элементов LINE (long interspersed nuclear elements); короткие (длиной 50-700 п.н.), имеющие на 3’-конце поли (А) последовательность, вкрапления ядерных элементов SINE (short interspersed nuclear elements), такие как Alu. Эти повторы, составляющие порядка трети от всего генома, по мнению ряда авторов, представляют собой мобильные паразитирующие ретротранспозируемые элементы ([34]), которые путём метилирования ДНК поддерживаются в неактивном состоянии, что позволяет избежать риска инсерционного мутагенеза ([35]).
По материалу ([36]) Схематическое изображение характера метилирования ДНК по всей хромосоме. Показаны повторяющиеся элементы и примеры генов с CGi-промотором. Стрелки указывают начальные участки транскрипции (стрелкой с синим цветом указано начало активной транскрипции, красным цветом показан участок с подавленной метилированием ДНК транскрипцией).
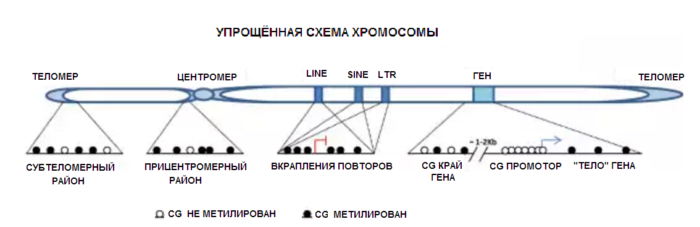 По материалу ([36]) Схематическое изображение характера метилирования ДНК по всей хромосоме. Показаны повторяющиеся элементы и примеры генов с CGi-промотором. Стрелки указывают начальные участки транскрипции (стрелкой с синим цветом указано начало активной транскрипции, красным цветом показан участок с подавленной метилированием ДНК транскрипцией).
По материалу ([36]) Схематическое изображение характера метилирования ДНК по всей хромосоме. Показаны повторяющиеся элементы и примеры генов с CGi-промотором. Стрелки указывают начальные участки транскрипции (стрелкой с синим цветом указано начало активной транскрипции, красным цветом показан участок с подавленной метилированием ДНК транскрипцией).
Не следует однако думать, что они не участвуют в функционировании клетки. Как отмечено в приведённом выше обзоре Elbarbary et al.,(30) повторы LINE и SINE могут регулировать транскрипцию генов путем изменения структуры хроматина и функционируя в качестве энхансеров и промоторов. Когда они транскрибируются в качестве части более крупного транскрипта, они могут регулировать синтез изоформ белков, воздействуя на альтернативный сплайсинг ([37]) или образование 3′-конца. Помимо этого они могут кодировать множество некодирующих РНК, а также влиять на метаболизм матричных РНК. На все эти их способности существенным образом влияет возрастное гипометилирование этой ДНК. Так, например, установлено, что гипометилирование повторяющихся элементов в лейкоцитах крови связано с риском последующих тяжёлых желудочных поражений и развития рака желудка, что может быть использовано для ранней диагностики этих заболеваний ([38] [39]). Прогрессирующая возраст-зависимая потеря уровня метилирования затрагивает также промоторы таких генов как ITGAL и IL17RC чья транскрипционная активация вследствии деметилирования способна вызвать аутоиммунные реакции ([40]). Кроме того деметилирование ДНК утяжеляет течение таких аутоиммунных заболеваний как криопирин-ассоциированные периодические синдромы (CAPS) вследствие активации гена NLRP3 продуктом которого является криопирин – основной компонент NLRP3 инфламмасом, и как следствие этого, активации воспалительных процессов ([41])
Причиной развития онкологических заболеваний, как правило, является ингибирование генов супрессоров подавляющих опухолевый рост. Одной из причин такого ингибирования супрессоров нередко является гиперметилирование их промоторов.
Маркеры канцерогенеза связанные со старением. Красные квадратики это наличие данного, связанного с возрастом, гена маркера рака (сбоку) при конкретных типах онкологии (сверху). По статье ([42])
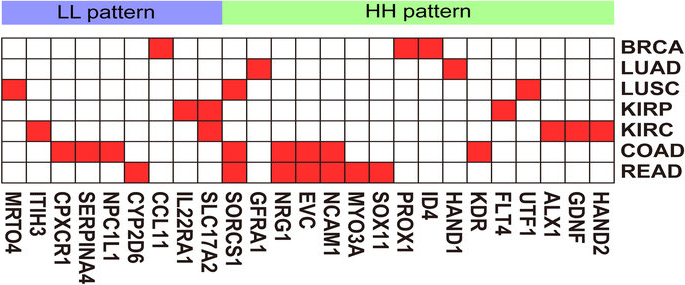 Маркеры канцерогенеза связанные со старением. Красные квадратики это наличие данного, связанного с возрастом, гена маркера рака (снизу) при конкретных типах онкологии (справа). По статье ([42]
Маркеры канцерогенеза связанные со старением. Красные квадратики это наличие данного, связанного с возрастом, гена маркера рака (снизу) при конкретных типах онкологии (справа). По статье ([42]
Так, например, при неопластической прогрессии различных видов рака, включая рак молочной железы, первоначальная инактивация гена-супрессора опухолей p16INK4A закрепляется эпигенетически метилированием CpGi островка на промоторе этого гена ([43]).
Интригующей особенностью транспозонов является их способность нести участки связывания транскрипционных факторов, таких как OCT4, CTCF, SOX2, NANOG, p53 и ESR1. При снижении уровня метилирования ДНК снижается и их способность связывать такие факторы.
У млекопитающих участки хроматина с частыми повторами в области, прилегающей к центромерам, обычно сильно метилирована, что, как предполагается, необходимо для предотвращения возможности аномальной гомологичной рекомбинации ([44])
Участки повторов примыкающие к теломерам имеют строение характерное для гетерохроматина т.е. богаты на гистоновые метки неактивного хроматина (H3K9me3 и H4K20me3) и достаточно высокое содержание метилированного цитозина ([45]).
Общее уменьшение метилирования ДНК, и в частности, на участках, примыкающих к теломерам, сопровождается резким удлинением теломеров ([46]), вероятно вследствие активации альтернативного пути удлинения хромосом. В некоторых случаях, однако, удается удлинить теломеры и без уменьшение метилирования ДНК или активации теломеразы (правда при этом снижатся содержание меток гетерохроматина за счет снижения активности гистон метилтрансфераз Suv39 и Suv420 ответственных соответственно за образование H3k9me3 и H4k20me3), только за счет размножения эмбриональных стволовых клеток на стадии бластоцисты in vitro ([47] [48]). В то же время ферментные белки семейства Tet (Ten-eleven translocation), которые окисляют 5-метилцитозин до 5-гидроксиметилцитозина, промежуточного продукта в процессах деметилирования ДНК, необходимы для поддержания теломер и стабильности хромосом ([49]). В свою очередь у млекопитающих укорочение теломер до критической длины, приводит к потере метилированных гистонов и снижению метилирования ДНК ([50]).
Ферментативная регуляция процессов метилирования ДНК
После репликации двухспиральная синтезированная ДНК имеет метильные группы только на одной цепи. Чтобы скопировать паттерн метилированных цитозинов UHRF1 связывается с метилированной ДНК и метит гистон Н3 убиквитином (Ubi). Затем эту метку и белок UHRF1 распознает метилтрансфераза DNMT1 и сажает метильную группу на цитозин противоположной цепи. ([53])
Паттерн (характерное распределение, узор) метилирования ДНК возникает на ДНК под влиянием метилтрансфераз DNMT3A и DNMT3B, которые переносят метильную группу с S-аденозил-метионина на цитозин ДНК с образованием 5-метилцитозина ([51]), а затем сохраняется и поддерживается при клеточных делениях метилтрансферазой DNMT1 совместно с UHRF1 — ДНК-связывающим белком, распознающим 5-метилцитозин. Нарушение взаимодействия DNMT1 с UHRF1 малой молекулой NSC232003 приводит к общему деметилированию цитозинов на ДНК после деления клетки ([52]).
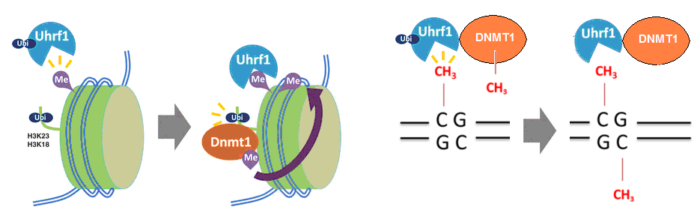 После репликации двухспиральная синтезированная ДНК имеет метильные группы только на одной цепи. Чтобы скопировать паттерн метилированных цитозинов UHRF1 связывается с метилированной ДНК и метит гистон Н3 убиквитином (Ubi). Затем эту метку и белок UHRF1 распознает метилтрансфераза DNMT1 и сажает метильную группу на цитозин противоположной цепи. ([53])
После репликации двухспиральная синтезированная ДНК имеет метильные группы только на одной цепи. Чтобы скопировать паттерн метилированных цитозинов UHRF1 связывается с метилированной ДНК и метит гистон Н3 убиквитином (Ubi). Затем эту метку и белок UHRF1 распознает метилтрансфераза DNMT1 и сажает метильную группу на цитозин противоположной цепи. ([53])
Важную роль в регуляции процессов метилирования ДНК по-видимому играет семейство микроРНК miR-29. При истощении miR-29a наблюдается общее понижение уровня метилирования ДНК. Следует отметить, что факторы способствующие старению и канцерогенезу, такие как c-Myc ([54] [55]), сигнальный путь хеджехог (hedgehog) и воспалительные процессы (NF-κB сигналы) ([56]) подавляют синтез miR-29 ([57]). В то же время блокировка miR-29a приводит к повышению эффективности перепрограммирования соматических клеток в индуцированные плюрипотентные стволовые клетки iPSC ([58]), повышая пластичность клетки – её способность к трансформации (в том числе и в раковые клетки). Предполагается, что miR-29a является регулятором, который ингибирует как ДНК метилтрансферазы, так и деметилазы ([59]). Так, например, принудительное повышение синтеза miR-29 подавляя активность ДНК метилтрансфераз DNMT3A и -B восстанавливало паттерн метилирования ДНК и таким образом индуцировало реэкспрессию заингибированных метилированием генов супрессоров опухоли таких как FHIT и WWOX, что приводило к ингибированию онкогенеза как in vitro, так и in vivo ([60]).
Важно отметить что уровень miR-29 в старых клетках намного выше чем в молодых ([61]) и что повышение активности miR-29 приводит понижению активности множества генов, способствующих росту тела, тем самым способствуя физиологическому замедлению и в конечном итоге прекращения роста тела ([62]).
Закономерности изменения метилирования по мере старения
Профиль метилирования ДНК как показали исследования различается в клетках разных тканей и является тканеспецифичным – т.е. каждая ткань имеет свой характерный для неё профиль метилирования ДНК ([63]). Более того этот профиль может изменяться одинаковым образом на протяжении жизни человека. ([64]) То есть в отличие от однонуклеотидных полимофизмов, мутаций которые наследуются в составе ДНК и поэтому одинаковые во всех клетках организма, профиль метилирования ДНК может меняться на протяжении жизни. Более того изменения метилирования носят не стохастический характер, не случайны, а по всей видимости могут быть связаны с биологическими механизмами участвующими в процессах развития и старения, а потому могут предопределять продолжительность жизни. Удивительнее всего то, что темп старения организма (по изменениям метилирования ДНК) устанавливается в самом раннем возрасте и в последующем носит неизменный стационарный характер даже в годы глубокой старости ([65]). Причём старческая слабость (характеризуемая термином Frailty) и индексом FI34 ([66]) оценивающим риск смертности, как оказалось, выраженно коррелирует со снижением уровня метилирования ДНК и вызванным им расслаблением эпигенетического контроля, следствием чего являлось снижение качества функционирования организма, и в меньшей степени с хронологическим возрастом ([67] [68]).
Как известно, хотя и ДНК в сперматозоидах и в ооцитах имеют высокую степень метилирования, после оплодотворения первоначально в зиготе отцовская ДНК почти полностью деметилирована, причем в отсутствие репликации ДНК, затем деметилируется и материнская ДНК, и лишь после достижения стадии бластоцисты начинается постепенное метилирование ([69]) закрепляющее изменения связанные с дифференцировкой в клетках потомках зиготы ([70]) При этом из одной оплодотворенной яйцеклетки человека в течение жизни образуется порядка 37000 миллиардов (37 триллиардов) различных клеток, из которых состоят 210 гистологически различимых тканей формирующих высокоспециализированные органы нашего организма ([71]).
Уже в ДНК эмбриональных стволовых клеток человека метилирование достигает максимума — метилировано почти 80% CpG, а оставшиеся неметилированными CpG остатки обычно расположены в островках CpGi, локализованных на генных промоторах ([72]).
С разработкой высокочувствительных методов исследования метилирования, рядом авторов были опубликованы данные по изменениям метилирования в процессе старения. Так, например, были исследованы изменения метилирования путём сопоставления этого показателя у новорожденных и у столетних ([73]). Было обнаружены три ключевых различия:
Первое, метилом (паттерн метилирования ДНК генома) столетних, по сравнению с новорожденными, продемонстрировал выраженное гипометилирование затрагивающее порядка 500,000 CpG динуклеотидов, в результате которого средний уровень метилирования CpG сократился с 81% у новорожденных до 73% у столетних. Такое понижение метилирования наблюдалось для всех участков хроматина, включая промоторы, основную часть генов, а также междугенные участки;
Во-вторых, метилом столетних продемонстрировал потерю гомогенности метилирования ДНК. У новорожденных уровень метилирования соседствующих CpG динуклеотидов обычно был одинаковым, тогда как у столетних он часто различался, что могло быть связано с вызванным старением гипометилированием определённых CpG динуклеотидов;
В-третьих, детальный анализ регуляторных участков показал, что зависящее от возраста гипометилирование было особенно заметно в бедных CpG группами промоторах и в генах, которые являются тканеспецифичными по экспрессии. Гипометилирование этих участков у столетних было сопряжено с несколько повышенным уровнем генной экспрессии. Одновременно с этим было обнаружено, что метилирование CpG островков на промоторах, которые оказывают сильное влияние на экспрессию генов, с возрастом повышается. ([74] [75] [76]) А как известно метилирование промотора может сильно снизить генетическую экспрессию на соответствующем гене, путём изменения локальной структуры хроматина и блокировки инициации транскрипции ([77]).
При изучении около 500 000 участков метилирования CpG было обнаружено более чем 2-кратное изменение уровня метилирования с момента рождения и до наступления старости примерно в 90 из 160 участков CpG, где такое изменение было достоверно связано со старением ([78])
При старении наблюдается повышение метилирования ДНК (а значит понижение активности экспрессии) гена отвечающего за экспрессию каталитической субъединицы теломеразы TERT – фермента поддерживающего длину теломер; рецептора мотилина MLNR, регулирующего желудочно-кишечные клетки; регулирующего тропонин Т мышц гена BRUNOL6/CELF6; а также гена LINC00304, кодирующего длинную междугенную не кодирующую белки РНК, задействованную в регуляции транскрипции ([79])
Характер паттерна метилирования ДНК у опухолевых клеток часто намного старше, хронологического возраста пациента ([80]) поэтому лекарства, противодействующие старению в какой-то мере защищают и от онкологических заболеваний.
Причиной многих старческих онкологических заболеваний является способность раковых клеток к миграции и инвазии, что отчасти связано с синтезом длинной некодирующей РНК H19, которая ингибирует РНК let-7. Лекарство от старости — антидиабетический препарат метформин резко снижал способность раковых клеток к миграции и инвазии, путём понижения синтеза H19, что было связано с метилированием ДНК на её промоторе ([81]). Следует правда учитывать, что H19 помогает мелатонину противодействовать связанному со старением сокращению способности клеток к пролиферации ([82]).
Возрастной модуль метилирования и эпигенетические часы
Hernandez et al.,(2011) выявили в клетках из различных отделов мозга человека CpG локусы, метилирование которых четко коррелировало с хронологическим возрастом. Большинство таких локусов было обнаружено в пределах CpGi островков. Причем CpG сайты, где уровень метилирования ДНК коррелировал с возрастом обычно были расположены физически близко к генам ДНК связывающих факторов и регуляторов транскрипции ([83]).
Несмотря на существенные различия картин распределения участков метилирования ДНК, в самых разных тканях и клетках, можно заметить сходство в возрастных изменениях метилирования ДНК (так называемый возрастной модуль метилирования), причем даже в таких разных, как ткани головного мозга и кровь. ([84]) По мнению Horvath et al. по этой причине в крупномасштабных эпидемиологических исследованиях, по результатам исследования ДНК крови можно предполагать, что аналогичные изменения метилирование ДНК происходят и в ткани головного мозга и ряде других тканей.
Эту особенность метилирования ДНК некоторые учёные использовали для того чтобы предсказать биологический возраст человека. Bocklandt et al.,(2011) выявили 88 участков CpG вблизи 80 генов, для которых процент метилирования в слюне достоверно коррелирует с возрастом. Уровень метилирования трех генов, линейно зависел от возраста на протяжении пяти десятилетий.
Это позволило построить модель, которая могла предсказывать возраст субъекта на основе уровня метилирования всего двух молекул цитозина в геноме ([85]).
Koch & Wagner провели идентификацию CpG участков метилирования ДНК, которые можно было бы использовать для определения возраста во многих различных тканях. Они выявили 19 CpG участков, которые непрерывно подвергаются гиперметилированию в процессе старения. Для построения графика определения возраста донора по ткани были использованы четыре из них связанные с генами NPTX2 (Neuronal pentraxin-2), TRIM58 (Tripartite motif family 58), GRIA2 (Glutamate receptor 2) и KCNQ1DN (KCNQ1 downstream neighbour), а также дополнительно гипометилирующийся CpG участок вблизи гена BIRC4BP ([86]).
Giuliani et al идентифировали регионы генома, где уровень метилирования ДНК зубов коррелирует с возрастом человека. Они предложили проводить оценку метилирования ДНК из зубов в генах ELOVL2, FHL2 и Penk ([87]).
В работе Hannum et al., ([88]) был использован разработанный ранее чип для определения метилирования ДНК на 485,577 CpG участках и при этом параллельно сразу на 12 образцах ([89]). Для построения оптимального графика был отобран 71 показатель метилирования. Точность модели при этом составила 96% , а ошибка + 3.9 года.
Horvath использовал для построения модели эпигенетических часов 353 CpG участков. Это позволило сделать модель универсальной и точной – её можно использовать независимо от ткани источника ДНК. С помощью этой модели можно сравнивать биологический возраст разных тканей человеческого тела ([90]). Так, например, использование «эпигенетических часов Хорвата» для изучения взаимосвязи между эпигенетическим возрастом и ожирением в различных человеческих тканях, позволило выявить неожиданно сильную корреляцию между высоким индексом массы тела и эпигенетическим возрастом ткани печени. Это открытие позволяет объяснить, почему у людей, страдающих ожирением рано появляются многие возрастные патологии, включая рак печени ([91]).
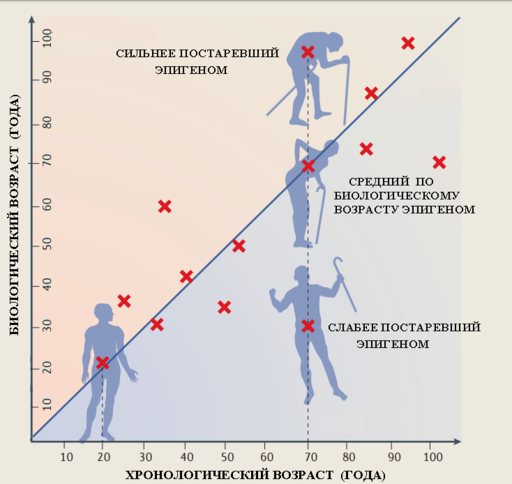
По статье (30 ). Люди одного и того же хронологического возраста могут иметь разные по биологическому возрасту геномы. Одни люди моложе своего паспортного возраста, другие наоборот старше.
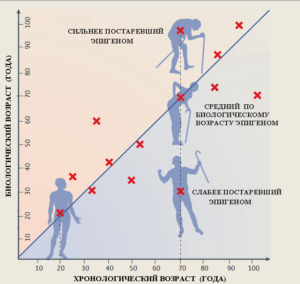 По статье (30). Люди одного и того же хронологического возраста могут иметь разные по биологическому возрасту геномы. Одни люди моложе своего паспортного возраста, другие наоборот старше.
По статье (30). Люди одного и того же хронологического возраста могут иметь разные по биологическому возрасту геномы. Одни люди моложе своего паспортного возраста, другие наоборот старше.
Этот же метод позволил приоткрыть тайну «нестареющих детей». Выяснилось, что хотя внешне эти люди, выглядевшие детьми, несмотря на не детский хронологический возраст, по данным антропологического обследования не старели, их возраст по данным эпигенетических часов оказался не моложе их хронологического «паспортного» возраста ([92]). Зато люди, которые доживают до почтенного возраста в 105 – 109 лет эпигенетически, как оказалось, примерно на 8 – 9 лет моложе своего паспортного возраста. Замедленным старением по сравнению со сверстниками нередко отличаются и их потомки ([93]).
Weidner et al. ([95]) построили модели для предсказания биологического возраста по образцам крови, основанную всего на трех CpG участках, расположенных в генах ITGA2B (integrin, alpha 2b), ASPA (aspartoacylase) и PDE4C (phosphodiesterase 4C, cAMP specific). Тем не менее, даже такая модель давала точность определения с разбросом менее 5 лет и точнее чем длина теломер. Причём предсказание не зависело от состава форменных элементов крови – процентного соотношения в крови моноцитов, лимфоцитов, нейтрофилов, базофилов или эозинофилов. Тем не менее, в другом исследовании был разработан алгоритм, позволяющий по метилированию ДНК клеток крови быстро и довольно точно оценивать состав популяции иммунных клеток, что позволяет обходиться без проточной цитометрии и микроскопии ([96]).
Cледует отметить, что хотя все вышеприведенные модели для предсказания биологического возраста пока основаны на не вполне понятных интуитивно выбранных закономерностях, они тем не менее, позволяют предсказывать риск смерти от старческих заболеваний ([97] [98] [99] [100]), и, в частности, вероятность заболеть раком ([101]).
Методы неизбирательного воздействия на процессы метилирования и деметилирования ДНК
Наряду с успехами в разработке методов оценки метилирования ДНК, шла разработка методов избирательного воздействия на процессы и механизмы, с помощью которых отдельные гены или последовательности ДНК подвергаются активному метилированию или деметилированию.
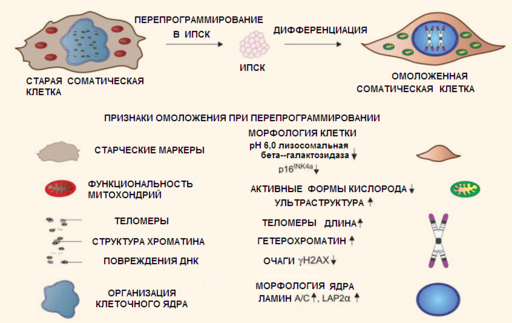
Разработана среда, которая вызывает глобальное гипометилирование ДНК в клетках in vitro. Эта среда, называемая 2i, содержит два низкомолекулярных ингибитора, один из которых ингибирует сигнальный путь ERK1 / 2 (PD0325901), а другой Gsk3β (CHIR99021), что воздействуя на транскрипционный регулятор PRDM14, приводит к понижению активности de novo метилтрансфераз Dnmt3a и Dnmt3b, а также их регулятора Dnmt3L([102]). Эта среда широко используется для перепрограммирования и поддержания плюрипотентного состояния клеток. С её помощью удается при перепрограммировании соматических клеток в ИПСК в какой-то мере очистить ДНК от метильных групп, чтобы начать de novo метилирование «с чистого листа» ([103]). Следует отметить, что при переграммировании соматических клеток в ИПСК в клетках всё же остается довольно большое число CpG участков сохраняющих паттерн донора от которого они произошли ([104]), причем он сохраняется и при дифференцировке ИПСК в соматические клетки и «сосуществует» наряду с тканеспецифичным паттерном метилирования ДНК, который приобретает клетка при дифференцировке. Вместе с тем возрастные изменения метилирования ДНК исчезают при переграммировании соматических клеток в ИПСК и не восстанавливаются при дифференцировке ИПСК в соматические клетки. Поэтому соматические клетки, полученные из ИПСК омоложены ([105]).
По ([112]). Для того чтобы подавить метилирование ДНК, 5-азацитидин должен предварительно встроиться в ДНК. Только тогда он способен подавить активность метилтрансферазы ДНК (DNMT). Поэтому на метилирование ДНК в неделящихся клетках он влияние не оказывает.
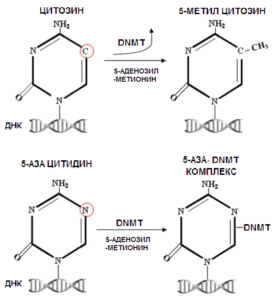 По ([112]). Для того чтобы подавить метилирование ДНК, 5-азацитидин должен предварительно встроиться в ДНК. Только тогда он способен подавить активность метилтрансферазы ДНК (DNMT). Поэтому на метилирование ДНК в неделящихся клетках он влияние не оказывает.
По ([112]). Для того чтобы подавить метилирование ДНК, 5-азацитидин должен предварительно встроиться в ДНК. Только тогда он способен подавить активность метилтрансферазы ДНК (DNMT). Поэтому на метилирование ДНК в неделящихся клетках он влияние не оказывает.
Кроме того влиять на метилирование ДНК можно с помощью не-метилируемых аналогов цитозина, таких как 5-азацитидин и зебуларин (zebularine), широко используемых для ингибирования активности метилтрансферазы ДНК и уменьшения геномного метилирования ДНК ([106]), что приводит к активации синтеза двухцепочечных РНК (dsRNA) содержащих эндогенные ретровирусы (ERVs), которые в свою очередь индукцируют активацию интерферон — реагирующих генов ([107]). Ни о каком избирательном ингибировании или активации геномного метилирования ДНК с помощью таких средств речи пока не идет. Тем не менее, использование 5-азацитидина позволило ещё в 1979 году в новаторской работе Тейлора и Джонса показать, что лечение иммортализованных линий клеток эмбриональных фибробластов мыши деметилирующим ДНК агентом 5-азацитидином позволяет вызвать перепрограммирование с образованием миогенных, хондрогенных и адипогенных клонов ([108]). Причем такой подход неизбирательного деметилирования ДНК успешно используется для прямого перепрограммирования клеток и сейчас ([109] [110] [111]).
Недостатком деметилирующих ДНК агентов типа 5-азацитидина в недостаточно высокой активности и токсичности, а также то что он для воздействия на метилирование должен встраиваться в ДНК. Поэтому предпринимались попытки создать лекарственные препараты, действующие на метилирование не встраиваясь в ДНК. К числу найденных препаратов такого типа относятся прокаинамид и его производные вроде IM25 ([113]); RG108 (N-фталил-L-триптофан), который обладал слабой токсичностью ([114]), вызывал деметилирование и реактивацию генов-супрессоров опухолей, но при этом не влиял на метилирование субцентромерных последовательностей ([115]); а также производные L-глутаминовой кислоты ([116]). Обнаружено также, что некоторые лекарственные препараты (метадон ([117])) могут способствовать повышению уровня метилирования ДНК.
В мезенхимальных клетках стромы человеческого костного мозга RG108, вызывая деметилирование промоторов, стимулировал экспрессию таких факторов противодействующих старению как: TERT, bFGF, VEGF,и ANG . Вместе с тем он подавлял «гены старения»: ATM, p21 и p53. Это предотвращение старения косвенно подтверждало снижение уровня маркера старения: окраски на ассоциированную со старением бета-галактозидазу (SA-β-gal), свидетельствовавшее об уменьшении численности постаревших клеток([118]).
Конечно, несмотря на обнадёживающие результаты, лечение старения и перепрограммирование такими неизбирательными препаратами напоминает ремонт будильника с помощью молотка и клещей. Нужны препараты более целенаправленного действия подобные тем, что используют растения для омоложения при вегетативном размножении черенками. И подобные препараты стали появляться.
Методы избирательного воздействия на процессы метилирования и деметилирования ДНК
Модель DNMT1 секвестра. Верхняя панель: DNMT1 может получить доступ к транскрипционно неактивным полуметилированным геномным участкам и прометилировать цитозин. Нижняя панель: DNMT1 не может получить доступ к транскрипционно активным полуметилированным геномным участкам, поскольку с ним связывается DiR (красным цветом) и ингибирует метилирование.
Была предложена гипотеза, о том, что определённые некодирующие РНК участвуют в поддержании паттерна метилирования связываясь с DNMT1 и ингибируя его на «вверенных» им участках. Разработана методика выделения таких РНК, названных DiR (DNMT1-interacting-RNA) и продемонстрирована их регуляторная роль в защите от неправильного метилирования ([119]).
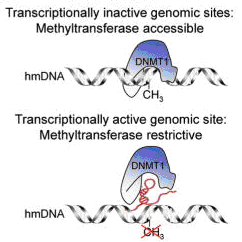 Модель DNMT1 секвестра. Верхняя панель: DNMT1 может получить доступ к транскрипционно неактивным полуметилированным геномным участкам и прометилировать цитозин. Нижняя панель: DNMT1 не может получить доступ к транскрипционно активным полуметилированным геномным участкам, поскольку с ним связывается DiR (красным цветом) и ингибирует метилирование.
Модель DNMT1 секвестра. Верхняя панель: DNMT1 может получить доступ к транскрипционно неактивным полуметилированным геномным участкам и прометилировать цитозин. Нижняя панель: DNMT1 не может получить доступ к транскрипционно активным полуметилированным геномным участкам, поскольку с ним связывается DiR (красным цветом) и ингибирует метилирование.
Накопились данные о том, что в подобном механизме сайт-избирательной регуляции метилирования ДНК могут быть задействованы различные некодирующие РНК и в первую очередь длинные некодирующие РНК ([120]). Кроме того, возможно, что в избирательном de novo метилировании генных промоторов также участвуют микро РНК ([121]). Известно, что наблюдается корреляция между изменением метилирования ДНК и изменениями экспрессии генов в различных клетках, образовавшихся в ходе дифференцировки ([122]). К сожалению, со времён модели генной регуляции Бриттена-Дэвидсона предложенной ими ещё в 1969 году ([123]) по-прежнему не решена главная проблема — почему в одинаковых эмбриональных клетках в ходе дифференцировки активируются различные группы генов. Если в зиготе все участки ДНК деметилированы, то каким образом происходит избирательное de novo метилирование? Как и какие РНК управляют этим процессом? Раскрытие этих механизмов позволит подойти к решению задач по целенаправленному перепрограммированию клеток постаревшего человека в клетки 12 летнего подростка – т.е. к кардинальному решению проблемы омоложения организма с помощью механизмов аналогичных RdDM используемого секвойей, живущей тысячелетиями.
Некоторый задел в разработке подобных технологий уже есть ([124]). Так, были предприняты попытки как избирательного деметилирования промоторов некоторых генов с целью их активации, так и избирательного метилирования с целью подавления их активности.
Янг с соавт. разработали эффективный метод избирательного целевого деметилирования конкретных CpG в клетках человека с использованием объединенного путём молекулярной инженерии избирательно связывающего ДНК домена TALE (transcription activator-like effector) и каталитического домена TET1 (Ten-eleven translocation methylcytosine dioxygenase 1) гидроксилазы катализирующего превращение 5-метилцитозина в 5-гидроксиметилцитозин ([125]). . Используя эту объединенную молекулу TALE-TET1, они показали, что деметилирование определенных CpG на участке промотора может привести к существенному увеличению экспрессии соответствующих генов человека ([126]).
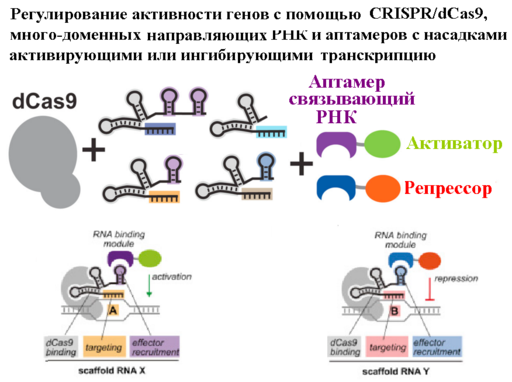
Другой способ избирательно активировать гены это повлиять на характер модификации гистона H3, а именно заменить метку репрессированного хроматина H3K27me3 на метку активного хроматина H3K27ac3. Сделать это искусственно, позволил фермент с программируемой «доставкой по адресу» с помощью РНК, состоящий из лишенного (в результате двойной мутации D10A и H840A) нуклеазной активности CRISPR-Cas9 домена, называемого dCas9, соединенного с каталитическим центром ацетилтрансферазы p300. Такой фермент позволяет с большой точностью избирательно находить в нужном месте гистон H3 и заменять его метильную метку на активную ацетилированную форму, что позволяет регулировать активность конкретных генов ([127]). Более того, технология CRISPR-Cas9 позволяет с помощью подобранной библиотеки направляющих РНК (sgRNA) проводить такую правку одновременно на десятках, выбранных для модификации генах.
Схематическое изображение системы деметилирования метилцитозинов (красные кружки) ДНК (черные нити) по наводке sgРНК (красная нить) с помощью фермента на основе dCas9 (голубой кружок и овал) соединенной через покровный РНК-связывающий белок бактериофага MS2 (зелёные нити) с каталитическим доменом TET1 (красные квадратики). По (126)
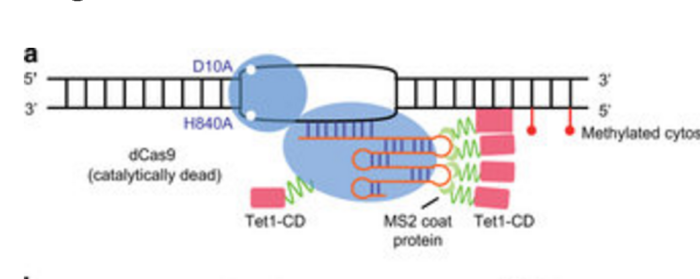 Схематическое изображение системы деметилирования метилцитозинов (красные кружки) ДНК (черные нити) по наводке sgРНК (красная нить) с помощью фермента на основе dCas9 (голубой кружок и овал) соединенной через покровный РНК-связывающий белок бактериофага MS2 (зелёные нити) с каталитическим доменом TET1 (красные квадратики). По (126)
Схематическое изображение системы деметилирования метилцитозинов (красные кружки) ДНК (черные нити) по наводке sgРНК (красная нить) с помощью фермента на основе dCas9 (голубой кружок и овал) соединенной через покровный РНК-связывающий белок бактериофага MS2 (зелёные нити) с каталитическим доменом TET1 (красные квадратики). По (126)
Аналогичную возможность избирательно находить и изменять десятки мишеней позволяет и другой искусственный фермент на основе dCas9, но уже присоединенной через покровный РНК связывающий белок бактериофага MS2, к каталитическому домену TET1 ([128]). В отличие от упомянутого выше TALE-TET1, этот фермент позволяет одновременно деметилировать CpG на участках промоторов многих генов одновременно. В цитируемой работе в качестве таких генов были выбраны гены RANKL, MAGEB2 и MMP2. Возможно, что с его помощью удастся лечить раковые заболевания, воздействуя на некоторые механизмы их образования, такие как, например гиперметилирование CpG на островке гена ZNF154, найденное, по меньшей мере, в 15 эпителиальных типах твердых опухолей из 13 различных органов ([129]). Можно также подобрать ряд генов, которые желательно активировать на определённых этапах старения организма.
Не менее важно научиться также избирательно метилировать промоторы генов, которые желательно заингибировать. Для этого тоже созданы искусственные ферменты. Сначала на основе таких ДНК-связывающих белков, как ZFP (zinc finger proteins) и TALE (transcriptional activator-like effector), связанных с ДНК метилтрансферазой DNMT3A ([130] [131]), а затем, на базе dCas9 ([132]), поскольку трудно, дорого и нецелесообразно создавать фермент для каждого CpG участка.
Фермент на основе dCas9-DNMT3A был успешно протестирован для ингибирования гена-супрессора CDKN2A (циклин зависимой киназы 2A), который является одним из наиболее часто гиперметилированных генов при онкологии (например [133]) и играет важнейшую роль в процессах старения, поскольку кодирует ингибитор клеточного цикла р16 ([134]). Полученный на основе dCas9-DNMT3A фермент, также как и TALE-DNMT, p16 ([135]), вызывал сильную репрессию транскрипции р16 и как следствие усиление пролиферации фибробластов человека (131).
Такие ферменты можно будет использовать, например, для профилактики диабета 2 типа. Поскольку известно, что повышенное метилирование ДНК на CpG участках генов KLF14, FHL2 и GNPNAT1 связано с более низким риском развития в будущем сахарного диабета 2 типа ([136]), можно людям с низким метилированием этих генов вводить профилактический препарат, повышающий метилирование этих генов. И таких примеров масса.
В общем, перспективы открылись вполне соответствующие 21 веку.
Литературу смотрите в первоисточнике: rlegroup.net
Автор: Дмитрий Джагаров, специально для RLEgroup