Содержание:
Часть 1. Резюме, Введение
Часть 2. Беспозвоночные как модельные системы для скрининга способствующих долголетию малых молекул
Часть 3. Ингибитор белка-мишени рапамицина млекопитающих (mTOR)
Часть 4. Метформин и другие бигуанидины
Часть 5. Ресвератрол и другие активирующие сиртуины соединения
Часть 6. Другие потенциальные антивозрастные препараты
Часть 7. Сенолитические препараты
Часть 8. Проблемы скрининга антивозрастных препаратов. Заключение
Часть 1
Резюме
Для старения характерно прогрессивное накопление дегенеративных изменений, кульминацией которого является нарушение функций и увеличение вероятности смерти. Старение является основным фактором риска для многих патологий человека, в том числе рака, сахарного диабета 2 типа, а также сердечно-сосудистых и нейродегенеративных заболеваний, и, соответственно, является причиной огромной социальной и экономической нагрузки. Важнейшей целью исследований в области старения является разработка вмешательств, способных отсрочить развитие множества возрастных болезней и увеличить продолжительность здоровой жизни. Наблюдения, согласно которым долголетия и улучшения состояния здоровья модельных организмов можно добиться с помощью низкокалорийной диеты или несложных генетических манипуляций, стимулировали поиск химических соединений, способных увеличить продолжительность жизни. Большая часть сигнальных путей, модулирующих скорость старения млекопитающих, имеют гомологи у дрожжей, мух-дрозофил и круглых червей, что указывает на целесообразность проведения первичного скрининга для идентификации таких фармакологических вмешательств на беспозвоночных моделях. За последние годы было обнаружено несколько соединений, способных увеличивать продолжительность жизни беспозвоночных и даже грызунов. В данной статье представлены основные данные касательно стратегий поиска и прогресса в идентификации соединений, способных увеличивать продолжительность жизни организмов, начиная от беспозвоночных и заканчивая мышами, а также обсуждаются значительные трудности, препятствующие переносу полученных результатов в клиническую практику.
Введение
Старение характеризуется молекулярными, клеточными и организменными изменениями, кульминацией которых проявляется утратой организмом способности к поддержанию физиологической целостности. Старение человека ассоциировано со значительным возрастанием предрасположенности к широкому диапазону заболеваний, в том числе к раку, сахарному диабету 2 типа, нейродегенерации и заболеваниям сердечно-сосудистой системы, что ведет к повышению общей заболеваемости и смертности. Долгосрочной целью изучения старения является разработка вмешательств, способных откладывать развитие возрастных болезней и обеспечивать долголетие. Для достижения этой цели исследования в области биогеронтологии посвящены выяснению базовых механизмов старения. Существующие на сегодняшний день данные свидетельствуют о том, что многие из этих механизмов в ходе эволюции сохранились у эукариот, начиная от дрожжей и заканчивая млекопитающими.
Проведенные в течение последних десятилетий исследования на различных организмах позволили идентифицировать клеточные сигнальные пути, модулирующие скорость процесса старения. Многие из этих путей выполняют функцию регистрации статуса питания организма (рисунок 1) и инициируют сигнальные каскады, модулирующие специфичные внутри- и межклеточные пути, соответствующим образом изменяющие физиологию клеток-мишеней. Эти чувствительные к питательным веществам пути, в том числе сигнальные механизмы, опосредуемые инсулином и инсулиноподобным фактором роста (IGF), белком-мишенью рапамицина (mTOR), аденозинмонофосфат-активируемой протеинкиназой (AMPK) и сиртуинами, координируют протекание процессов, связанных с ростом и метаболизмом клеток, а также интегрируют их с уровнями питательных веществ, энергии, факторов роста и стресса. Снижение уровней питательных веществ и факторов роста изменяет сигналы, передаваемые этими путями. Генетические или, в некоторых случаях, фармакологические манипуляции над этими путями могут обеспечивать увеличение продолжительности жизни, тогда как возрастное нарушение их регуляции может способствовать физиологическому старению организма.
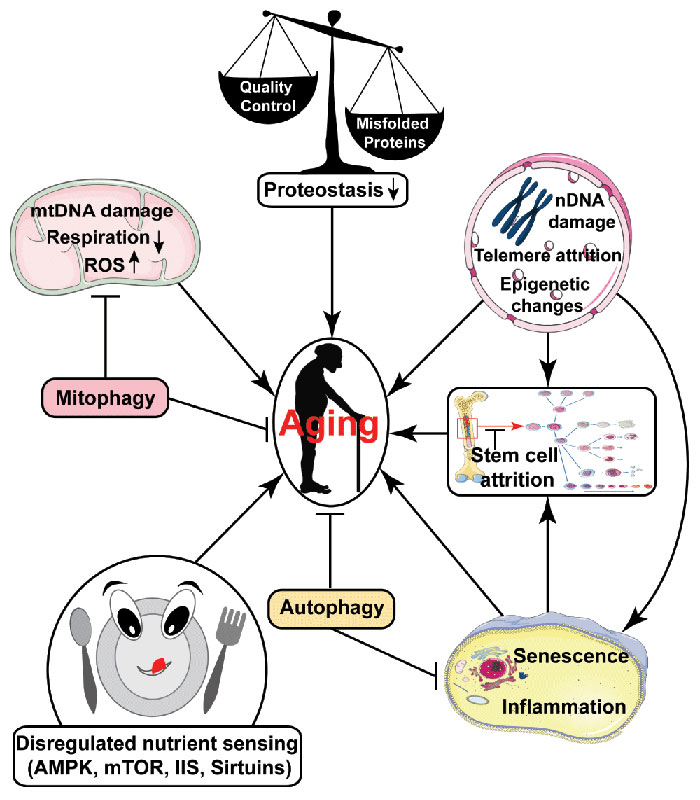 Рисунок 1. Резюме различных факторов, которые могут способствовать старению. Нарушение регуляции регистрирующих питательные вещества механизмов, нарушение протеостаза, износ стволовых клеток, накопление повреждений ДНК, снижение активности аутофагии, накопление клеток, вступивших в фазу физиологического старения, а также усиление стерильного воспаления относятся к важным механизмам, движущим процесс старения.
Рисунок 1. Резюме различных факторов, которые могут способствовать старению. Нарушение регуляции регистрирующих питательные вещества механизмов, нарушение протеостаза, износ стволовых клеток, накопление повреждений ДНК, снижение активности аутофагии, накопление клеток, вступивших в фазу физиологического старения, а также усиление стерильного воспаления относятся к важным механизмам, движущим процесс старения.
Низкокалорийная диета – диетический режим, подразумевающий снижение общего количества употребляемых калорий без развития истощения или уменьшение употребления определенных диетических компонентов, таких как аминокислоты, является наиболее хорошо описанным вмешательством, замедляющим старение и откладывающим развитие заболеваний у широкого диапазона видов. К молекулярным эффекторам, вовлеченным в проявление выдающихся эффектов низкокалорийной диеты, относятся перечисленные выше регистрирующие питательные вещества сигнальные пути. Предварительные данные свидетельствуют о том, что некоторые из этих путей могут оказывать влияние и на старение человека, а также поражающие его заболевания. Например, была выявлена взаимосвязь между генетическими вариантами гена FOXO3A, кодирующего фактор транскрипции на нижних этапах пути, опосредуемого инсулином и инсулиноподобным фактором роста, и долголетием человека. Люди с карликовостью Ларона имеют значительно сниженные уровни инсулиноподобного фактора роста в сыворотке и выраженную устойчивость к развитию сахарного диабета 2 типа и рака. Фармакологические вмешательства, частично воспроизводящие эффекты низкокалорийной диеты за счет модулирования активности этих чувствительных к питательным веществам механизмов потенциально способны увеличивать продолжительность здоровой жизни и долголетие в целом. Например, была описана способность рапамицин, являющегося специфичным ингибитором mTOR, оказывать некоторые из положительных эффектов низкокалорийной диеты при условиях стандартного кормления и употребления питательных веществ. Аналогичным образом было показано, что несколько других молекул, таких как метформин и ресвератрол, модулируют чувствительные к питательным веществам сигнальные механизмы и способствуют увеличению продолжительности здоровой жизни многочисленных модельных организмов. Ниже эти эффекты будут описаны более детально.
Помимо нарушения регуляции чувствительных к питательным веществам сигнальных путей, к прочим механизмам, вовлеченным в губительные проявления старения, относятся (рисунок 1):
- дисфункция митохондрий, ведущая к нарушению дыхательного метаболизма, усилению генерации активных форм кислорода (АФК), а также другим последствиям,
- повышенное накопление повреждений ДНК, индуцированное экзогенными воздействиями и эндогенными сбоями, в том числе ошибками репликации ДНК и активными формами кислорода,
- сниженный протеостаз, ассоциированный с повышением частоты неправильного сворачивания и агрегации белковых молекул,
- физиологическое старение клеток, способствующее нарушению функционирования тканей,
- усиление стерильного воспаления,
- истощение запасов стволовых клеток и
- эпигенетические перестройки.
Фармакологические агенты, воздействующие на некоторые из этих изменений, являются кандидатами в антивозрастные препараты. В данном обзоре предоставлена общая информация о фармакологических вмешательствах, обладающих доказанной или потенциальной способностью откладывать старение и способствовать поддержанию здоровья в преклонном возрасте. Сначала мы резюмируем основные моменты вклада, внесенного исследованиями на беспозвоночных модельных системах в предпринятые попытки проведения скрининга, направленного на идентификацию малых молекул, способных выступать в роли антивозрастных препаратов. После этого мы детально рассматриваем молекулы, потенциальная способность которых увеличивать продолжительность жизни и откладывать развитие заболеваний в настоящее время изучается. И в самом конце обсуждаем сложности, сопровождающие поиск новых антивозрастных препаратов и перенос этой работы в клиническую практику.
Часть 2
Беспозвоночные как модельные системы для скрининга способствующих долголетию малых молекул
В силу различных факторов, в особенности легкости генетических манипуляций и схожести физиологии с физиологией человека, мыши стали наиболее востребованным млекопитающим модельным организмом в биологии старения. Однако в силу высоких затрат на содержание и относительно большой продолжительности жизни мышей проведение крупномасштабного объективного скрининга с использованием данного организма невыполнимо. На основании понимания того, что многие ассоциированные со старением сигнальные пути сохранились в ходе эволюции даже у сильно отличающихся видов, для такого скрининга начали использовать короткоживущие беспозвоночные модели. Нематоды Caenorhabditis elegans, отличающиеся короткой продолжительностью жизни, составляющей около 3 недель, легкостью выращивания и проведения генетических манипуляций, а также хорошо описанными биологическими параметрами, представляют собой весьма привлекательную модель для химического скрининга, проводимого с целью идентификации соединений, модулирующих продолжительность жизни и возрастные фенотипы. На сегодняшний день наиболее обширный скрининг увеличивающих продолжительность жизни малых молекул провели Petrascheck et al., проанализировавшие влияние 88 000 соединений на долголетие нематод. Они идентифицировали 115 молекул, значительно увеличивающих продолжительность жизни этих организмов. Интересен тот факт, что структура одного из этих соединений напоминает структуру антидепрессанта, оказывающего влияние на сигнальный механизм, опосредуемый нейротрансмиттером серотонином. Впоследствии они установили, сто антагонист серотонинового рецептора миансерин, также применяемый в качестве антидепрессанта, при применении в определенной концентрации увеличивает продолжительность жизни нематод, предположительно через механизмы, ассоциированные с низкокалорийной диетой. При изучении 19 соединений, заведомо оказывающих влияние на физиологию человека, Evason et al. установили, что противосудорожные препараты этосуксимид, триметадион и 3,3-диетил-2-пирролидинон в определенных дозировках откладывали проявления возрастных изменений и увеличивали продолжительность жизни C.elegans.
В поисках миметиков низкокалорийной диеты помощью биоинформационного подхода Calvert et al. проанализировали препараты, индуцирующие изменения генной экспрессии, аналогичные изменениям экспрессии, ассоциированным с низкокалорийной диетой, и идентифицировали 11 малых молекул, обладающих искомым свойством. Интересен тот факт, что из пяти протестированных препаратов четыре – рапамицин (в дозе 10 мкм), аллантоин (250 мкм), трихостатин А (100 мкм) и LY-294002 (100 мкм) – обеспечивали увеличение продолжительности жизни и увеличение продолжительности здоровой жизни у нематод C.elegans дикого типа. Однако они не оказывали никакого влияния на долголетие мутантов eat-2, являющихся генетической моделью низкокалорийной диеты. Это свидетельствует о том, что увеличивающее продолжительность жизни действие этих препаратов действительно опосредовано механизмами, имеющими отношение к низкокалорийной диете.
Alavez et al. обнародовали данные, согласно которым связывающие амилоид соединения поддерживают белковый гомеостаз и увеличивают продолжительность жизни C.elegans. Воздействие связывающего амилоид красителя тиофлавина Т (ThT) в дозе 50 или 100 мкм на взрослых нематод дикого типа увеличивало среднюю продолжительность жизни на 60% и максимальную продолжительность жизни на 43-78%. Терапия ThT снижала агрегацию бета-амилоида и сохраняло целостность мышечной ткани у C.elegans с моделированной болезнью Альцгеймера, что приводило к уменьшению доли парализованных червей. Опосредованная ThT супрессия агрегации белков и увеличение продолжительности жизни зависели от молекулярных шаперонов, аутофагии, протеосомной функции, регулятора протеостаза белка теплового шока-1 (HSF-1) и фактору транскрипции SKN-124. Структурно схожие с ThT соединения также увеличивают продолжительность жизни нематод на 40%, однако в значительно более низких концентрациях, чем ThT. Более того, воздействие других связывающих белковые агрегаты соединений, таких как куркумин (100 мкм) и рифампицин (10-100 мкм) увеличивало продолжительность жизни нематод на 45%. Эти результаты подчеркивают важность протеостаза в продолжительности жизни и продолжительности здоровой жизни нематод и обеспечивают дальнейший стимул в разработке вмешательств, поддерживающих протеостаз для подавления процесса старения и развития возрастных болезней.
Плодовые мушки дрозофилы Drosophila melanogaster представляют собой еще одну простую модель, подходящую для скрининга потенциальных антивозрастных соединений. Исследователи имеют в распоряжении большое разнообразие генетических линий дрозофил с разной продолжительностью жизни, пригодных для валидации эффективности соединения в отношении разных генетических профилей. Так же как и нематоды C.elegans, дрозофилы имеют короткую продолжительность жизни, и существует большое количество генетических инструментов, позволяющих проводить исследования механизмов действия перспективных соединений. Первое исследование, продемонстрировавшее возможность увеличения продолжительности жизни с помощью химического соединения, было проведено Kang et al., которые показали, что добавление в корм мушек 4-фенилбутирата – препарата, оказывающего множество эффектов, в том числе ингибирующего гистоновую деацетилазу, – в дозе 5-10 мМ значительно увеличивало как медиану, так и максимальную продолжительность жизни, не оказывая отрицательного влияния на подвижность, устойчивость к стрессу и репродуктивную функцию. В более позднем исследовании был описан скрининг ингибиторов протеинкиназы на предмет увеличения продолжительности жизни дрозофил. 17 из 80 протестированных ингибиторов значительно увеличивали продолжительность жизни, не оказывая влияния на количество потребляемой пищи, что свидетельствует о непричастности низкокалорийной диеты. В этом отношении результаты исследования, недавно проведенного Slack et al., свидетельствуют о том, что ослабление активности опосредуемого RAS-Erk-ETS сигнального механизма приводит к снижению активности сигнального пути, опосредуемого инсулином/инсулиноподобным фактором роста, и обеспечивает увеличение продолжительности жизни дрозофил. Траметиниб (1,56-15,6 мкМ), являющийся высокоспецифичным ингибитором MEK, ослабляющим сигналы ниже RAS, может увеличивать продолжительность жизни самок дрозофил на 12% (p=1.92 × 10-10), а в более высоких дозах (156 мкМ) улучшает выживаемость на более поздних этапах жизни. Траметиниб эффективно увеличивает продолжительность жизни даже при добавлении в корм особей среднего возраста. Эти и похожие данные для других препаратов – увеличение продолжительности жизни мышей с помощью терапии рапамицином, начатой в среднем возрасте, см. ниже – указывают на то, что антивозрастные препараты могут быть эффективными для человека даже при применении в зрелом возрасте, что позволяет избежать их потенциального побочного действия на процесс развития.
Часть 3
Ингибитор белка-мишени рапамицина млекопитающих (mTOR)
mTOR – сохранившаяся в ходе эволюции сериновая/треониновая киназа, регистрирующая доступность питательных веществ, факторов роста и внешнего стресса и реагирующая на них. Этот фермент играет ключевую роль в стимуляции процесса роста. У многоклеточных эукариотов mTOR существует в составе двух отличающихся мультибелковых комплексов: mTORC1 и mTORC2, различающихся ассоциацией с регуляторным белком mTOR (RAPTOR) и рапамицин-нечувствительным компаньоном mTOR (RICTOR) соответственно. Рапамицин формирует комплекс с белком FKBP12, связывающимся с mTORC1 и ингибирующим его активность. Важен тот момент, что хроническая терапия рапамицином также подавляет активность mTORC. Активность mTORC1 регулируется питательными веществами (глюкозой и аминокислотами), цитокинами, гормонами (инсулин или инсулиноподобный фактор роста-1), энергией (уровни АТФ) и окислительным стрессом через сигнальные механизмы, опосредуемые фосфоинозитол-3-киназой (PI3K), протеинкиназой В (AKT) и АМФ-зависимой киназой (AMPK). Ключевые медиаторы нижних звеньев сигнального пути, опосредуемого mTORC1, представляют собой механизмы, регулирующие рост клеток, пролиферацию, реакцию на стресс и аутофагию. Поэтому mTORC1 принадлежит ключевая роль в интегрировании роста и поддержания функционирования клеток с доступностью питательных веществ, гормональными сигналами и другими стимулами окружающей среды.
В ряде исследований была установлена взаимосвязь между опосредуемым mTORC сигнальным путем и долголетием целого спектра организмов, начиная от дрожжей и заканчивая млекопитающими. Ингибирование сигналов mTORC с помощью генетических и фармакологических методов увеличивает продолжительность жизни дрожжей, нематод, плодовых мух и мышей. Аналогичным образом делеция гена мышей, кодирующего эффектор нижних этапов опосредуемого mTORC сигнального механизма S6-киназу, повышает окислительный метаболизм, защищает от развития возрастного и индуцированного диетой ожирения, а также увеличивает продолжительность жизни самок. Соответствующим образом повышенная активность мишени mTORC1 4E-BP1 в скелетной мускулатуре приводит к повышению окислительного метаболизма и защищает мышей от индуцированных диетой и возрастом метаболических нарушений.
В знаковом исследовании NIA’s Interventions Testing Program (ITP) было продемонстрировано, что терапия генетически гетерогенных мышей ингибитором mTORC рапамицином (в дозе 14 мг/кг пищи; 2,24 мг/кг массы тела/день), начатая в возрасте 9 или 20 месяцев, увеличивала продолжительность жизни обоих полов. Последующее наблюдение показало, что индуцированное рапамицином увеличение продолжительности жизни является дозо- и поло-зависимым. При указанном содержании рапамицина в корме самки мышей демонстрировали более выраженное увеличение продолжительности жизни, чем самцы, что коррелировало с более высокими уровнями рапамицина в крови самок, по сравнению с самцами. Терапия рапамицином индуцировала у самок и самцов совершенно разные изменения генной экспрессии, что свидетельствует о существовании полоспецифичных реакций на ингибирование mTORC. Более того, профили экспрессии метаболизирующих ксенобиотики ферментов в печени подвергшихся терапии рапамицином (14 мг/кг корма) мышей очень сильно отличались от профилей экспрессии 12-месячных мышей, содержащихся на низкокалорийной диете. В действительности низкокалорийная диета менее эффективно увеличивает продолжительность жизни при начале воздействия на поздних этапах жизни, тогда как терапия рапамицина оказывает свое действие на мышей даже при начале в среднем возрасте. Исключительно важен тот факт, что индуцируемое рапамицином увеличение продолжительности жизни наблюдается у мышей с разными генотипами.
Механизмы увеличения продолжительности жизни под действием рапамицина являются темой, горячо обсуждаемой в области биологии старения. Рапамицин обладает антинеопластическими свойствами, а рак является основной причиной смерти у большинства линий мышей, демонстрирующих опосредуемое рапамицином увеличение продолжительности жизни. В данном контексте правдоподобным объяснением увеличения продолжительности жизни мышей под действием рапамицина является способность препарата подавлять появление и/или агрессивность летальных опухолей. Однако некоторые исследователи продемонстрировали, что рапамицин помимо неоплазий также ингибирует возрастные фенотипы, что свидетельствует о большой вероятности того, что препарат оказывает более широкие антивозрастные эффекты. Напротив, согласно результатам недавнего очень детального исследования Neff et al., само по себе влияние рапамицина на возрастные фенотипы достаточно ограничено. В этом отношении были сделаны противоречащие наблюдения, касающиеся влияния терапии рапамицином на мышиные модели болезни Альцгеймера. Долгосрочная терапия рапамицином обеспечивала поведенческие улучшения у таких моделей и индуцировала опосредуемое аутофагией снижение уровней бета-амилоида и гиперфосфорилированного тау-протеина. В других исследованиях рапамицин, напротив, стимулировал продукцию бета-амилоида и вызывал усиление индуцированной бета-амилоидом клеточной гибели.
Рапамицин имеет серьезные побочные эффекты, которые могут ограничить возможности его долгосрочного применении в качестве антивозрастной терапии, в особенности это касается метаболической дисфункции, катаракты и атрофии семенников. Наиболее важен тот факт, что в силу иммуномодулирующих эффектов ингибиторов mTOR клиническое применение подобных рапамицину препаратов, таких как эверолимус/RAD001, ассоциировано с более высокой частотой инфекций у пациентов с такими заболеваниями, как рак и комплекс туберозного склероза. Результаты недавнего исследования, напротив, продемонстрировали, что краткосрочное применение эверолимуса/RAD001 здоровыми людьми преклонного возраста усиливало иммунную реакцию на вакцинацию против гриппа с умеренными побочными эффектами. Сниженная реакция на противогриппозную вакцинацию является важной клинической проблемой для пожилых людей. Эти данные свидетельствуют о том, что периодический или краткосрочный прием рапамицина или других ингибиторов mTOR может подавлять определенные функционально важные эффекты старения, такие как слабый ответ на иммунизацию, без отрицательных последствий, ассоциированных с хроническим применением таких препаратов. Результаты недавней работы на мышах подкрепляют эту гипотезу, подтверждая способность периодического приема рапамицина минимизировать проявления метаболической дисфункции у мышей, поддерживая хроническую супрессию mTOR в жировой ткани, но не в других тканях. Было бы очень интересно оценить эффекты такого периодического протокола на широкий спектр возрастных фенотипов и продолжительность жизни.
Часть 4
Метформин и другие бигуанидины
Метформин – антигликемический агент класса бигуанидов для перорального приема – является наиболее широко применяемым препаратом в терапии метаболического синдрома и сахарного диабета 2 типа. Механизм действия метформина не до конца ясен и он, наиболее вероятно, многофакторный. Есть данные, согласно которым он снижает содержание глюкозы в крови посредством ингибирования комплекса I дыхательной цепи в гепатоцитах, что приводит к снижению продукции АТФ и последующей активации киназ LKB1 и AMPK, подавляющей глюконеогенез в печени. Была установлена способность метформина активировать AMPK во многих других тканях, в том числе жировой ткани, скелетной мускулатуре, сердце, бета-клетках поджелудочной железы и гипоталамусе, что является потенциально положительным эффектом для пациентов с сахарным диабетом 2 типа. Однако метформин оказывает важное влияние независимо от LKB1 и AMPK, например посредством антагонизации действия глюкагона. Недавно был отскрыт еще один AMPK-зависимый механизм действия метформина. Результаты исследования Madiraju et al. показали, что метформин неконкурентно ингибирует фермент окислительно-восстановительного переносчика митохондриальной глицерофосфатдегидрогеназы, повышая окислительно-восстановительный статус цитозоля и снижая окислительно-восстановительный статус митохондрий. Это подавляет печеночный глюконеогенез через подавление конверсии лактата и глицерина в глюкозу. Хотя метформин в настоящее время одобрен в качестве терапии сахарного диабета 2 типа, большое количество литературных данных указывает на эффективность метформина в отношении других состояний, в особенности сердечно-сосудистых заболеваний и рака. В этом отношении недавнее исследование продемонстрировало, что метформин снижает онкогенез путем ингибирования митохондриального комплекса I в раковых клетках.
Активация AMPK обеспечивает долголетие дрозофил и нематод. Результаты целого ряда исследований свидетельствуют о том, что терапия метформином может воспроизводить некоторые эффекты низкокалорийной диеты. В данном контексте в нескольких исследованиях было проанализировано влияние метформина и других бигуанидов на продолжительность жизни и продемонстрированы отличающиеся результаты. Метформин и другие бигуаниды дозо-зависимо увеличивают продолжительность жизни C.elegans. Увеличение продолжительности жизни этих нематод опосредуется через ингибирование бактериального метаболизма фолата и метионина, что в свою очередь изменяет метаболизм метионина в организме червей, приводят к снижению уровней S-аденозилметионина и повышению уровней S-аденозилгомоцистеина. Однако метформин не увеличивает продолжительность жизни дрозофил. В действительности, несмотря на выраженную активацию AMPK, высокие дозы метформина даже уменьшают продолжительность жизни как самок, так и самцов дрозофил, возможно из-за нарушения гомеостаза кишечных жидкостей. Однако терапия метформином подавляет возрастные фенотипы в стволовых клетках средней кишки, а также оказывает положительное влияние на модель мушиную ожирения. Результаты недавнего исследования показали, что терапия метформином обеспечивает значительное увеличение средней и максимальной продолжительности жизни самок и самцов домовых сверчков.
Несколько исследований, посвященных изучения влияния метформина и других бигуанидов на продолжительность жизни, было проведено на грызунах. Их результаты варьировали в зависимости от генотипа, пола, а также дозы и продолжительности терапии. Хроническая терапия метформином (100 мг/кг в питьевой воде) увеличивала среднюю продолжительность жизни предрасположенных к раку трансгенных HER-2/neu, аутбредных SHR и инбредных 129/Sv самок мышей на 8% (p<0,05), 37,8% (p<0,01) и 4,4% (p<0,05) соответственно. Терапия метформином также увеличивала максимальную продолжительность жизни трансгенных HER-2/neu, аутбредных SHR самок мышей на 9% и 10,3% соответственно, тогда как максимальная продолжительность жизни инбредных 129/Sv самок мышей не изменялась. Напротив, терапия с использованием аналогичной дозы метформина уменьшала среднюю продолжительность жизни инбредных 129/Sv самцов мышей на 13,4%. В то же время терапия метформином (2 мг/мл в питьевой воде) трансгенной мышиной модели болезни Гентингтона увеличивала среднюю продолжительность жизни самцов на 20,1% (p=0,017), но не оказывала влияния на выживаемость самок. Также было показано, что начатая в 3-месячном возрасте терапия метформином (100 мг/кг в питьевой воде) обеспечивала тенденцию к увеличению продолжительности жизни самок аутбредных мышей SHR. Терапия метформином также отсрочивала формирование выявляемых опухолей при инициации в среднем, но не в преклонном возрасте. Неонатальная терапия метформином мышей 129/Sv (100 мг/кг в виде подкожных инъекций) обеспечивала увеличение средней продолжительности жизни самцов на 20% (p<0,001), а также немного увеличивала максимальную продолжительность жизни (на 3,5%). Однако при этом средняя и максимальная продолжительность жизни самок снижалась на 9,1% и 3,8% соответственно. В недавнем исследовании Martin-Montalvo et al. самцы мышей линии C57BL/6, получавшие 0,1% метформина в корме, продемонстрировали увеличение средней продолжительности жизни на 5,8% (p=0,02), тогда как в концентрации 1% метформин оказывал токсичное действие и уменьшил среднюю продолжительность жизни на 14,4%. В то же время добавление 0,1% метформина в корм самцов линии B6C3F1 обеспечивало увеличение продолжительности жизни только на 4,2% (p=0.064). Терапия другим бигуанидом, фенформином, (2 мг/мышь в 0,2 мл питьевой воды) значительно снижала частоту спонтанного формирования опухолей у самой мышей линии C3H/Sn и увеличивала их среднюю продолжительность жизни минимум на 21% (p<0.05), а максимальную продолжительность жизни – на 26%. В настоящее время консорциум ITP проводит оценку влияния метформина на продолжительность жизни мышей, результаты скоро должны появиться в доступе.
В экспериментах на крысах терапия буформином (5 мг/крысу в 1 мл питьевой воды) приводила к незначимому (7,3%) увеличению средней продолжительности жизни самок линии LIO, тогда как фенформин (5 мг/крысу в 1 мл питьевой воды) не оказывал никакого эффекта. Однако применение буформина и фенформина увеличивало максимальную продолжительность жизни самок линии на 5,5% и 98% соответственно. Терапия метформином (300 мг/кг/день) не увеличивала ни среднюю, ни максимальную продолжительность жизни самок крыс линии F344. Однако в той же публикации содержались данные, согласно которым в параллельной группе самцов линии F344, содержавшихся на низкокалорийной диете, также не наблюдалось увеличения продолжительности жизни, что делает результаты экспериментов с метформином недоказательными. Было высказано предположение, что терапия метформином воспроизводит ряд эффектов низкокалорийной диеты, в особенности посредством повышения активности AMPK, а также активации антиоксидантных реакций, что одновременно ведет к снижению выраженности накопления окислительных повреждений и хронического воспаления.
Несмотря на то, что влияние метформина на продолжительность жизни здоровых людей не было официально проанализировано ни в одном исследовании, рандомизированные клинические исследования продемонстрировали положительные эффекты препарата на состояние здоровья и выживаемость пациентов с избыточной массой тела/ожирением, страдающих сахарным диабетом 2 типа. Эти выводы были сделаны на основании снижения частоты заболеваний сердечно-сосудистой системы и рака, а также уменьшением общей смертности. Однако в комбинации с сульфонилмочевиной метформин повышал риск развития ассоциированной с диабетом смерти и смертности от всех причин в смешанной группе людей с нормальной массой тела, а также с избыточной массой тела/ожирением с диагнозом сахарный диабет 2 типа. В соответствии с этими наблюдениями, в недавнем исследовании Bannister et al. у получавших терапию метформином пациентам с сахарным диабетом 2 типа наблюдалось улучшение выживаемости по сравнению с группой контроля, в которую входили специально подобранные люди без сахарного диабета, тогда как у пациентов, прошедших терапию сульфонилмочевиной, наблюдалось снижение выживаемости.
Учитывая относительно перспективные результаты экспериментов на грызунах, свидетельства о том, что метформин может подавлять развитие рака и других возрастных патологий человека, а также сравнительно безобидный профиль безопасности этого препарата, существует большой интерес к официальному тестированию способности данного препарата откладывать возрастные болезни у человека. Управление по контролю за продуктами и лекарствами США (FDA) недавно одобрило проведение исследования «Воздействие метформина на старение» (Targeting Aging With Metformin, TAME), посвященного оценке метформина как препарата для замедления старения. В проекте TAME примет участие примерно 3 000 человек в возрасте 70-80 лет, уже имеющих одну, две или из следующих патологий: рак, болезни сердца или нарушения познавательной функции; или входящих в группу риска по развитию этих патологий. Исследование будет проводиться примерно в 15 центрах в США в течение 5-7 лет и на его проведение планируется потратить примерно 50 миллионов долларов США. Целью исследования является определение способности метформина предотвращать развитие возрастных заболеваний. Эта ключевая работа будет первым исследованием, в рамках которого будет проводиться клиническое тестирование потенциального антивозрастного препарата.
Часть 5
Ресвератрол и другие активирующие сиртуины соединения
Сиртуины составляют семейство НАД+-зависимых деацетилаз/АДФ-рибозилтрансфераз/деацилаз, вовлеченных в регулирование реакций на питательные вещества и другие аспекты клеточной биологии. Чрезмерная экспрессия Sir2 – наиболее важного члена семейства сиртуинов – увеличивает репликативную продолжительность жизни почкующихся дрожжей Saccharomyces cerevisiae через подавление накопления внехромосомных рДНК плазмид, приводящее к перемещению неповрежденного протеома в дочернюю клетку, что, в свою очередь, принудительно запускает сайленсинг субтеломерной ДНК и, возможно, другие механизмы. Некоторые, но не все, исследователи продемонстрировали, что гиперэкспрессия сиртуинов у червей и мух-дрозофил умеренно увеличивает продолжительность жизни этих организмов. Интересно, что Sir-2.1, являющийся гомологом Sir2, может увеличивать продолжительность жизни C.elegans независимо от активности деацетилазы. У млекопитающих наиболее близким гомологом Sir2 является SIRT1. Гиперэкспрессия этого белка в головном мозге (но не во всем организме) увеличивает продолжительность жизни, вероятно посредством активизации функции гипоталамуса в процессе старения. Глобальная гиперэкспрессия другого сиртуина, SIRT6, увеличивает продолжительность жизни исключительно самцов мышей, по крайней мере частично за счет предотвращения развития рака легких, являющегося основной причиной смерти самцов использованной в работе линии мышей. Гиперэкспрессия SIRT2 стабилизирует уровни регулирующего процесс митоза белка BubR1 у прогероидных (модель преждевременного старения) мышей линии BubR1H/H и увеличивает как медиану, так и максимальное значение продолжительности жизни самцов этой линии. Однако исследователи не располагают данными о потенциальных эффектах хронической гиперэкспрессии SIRT2 на животных дикого типа. Все больше новых научных данных свидетельствует в пользу того, что уровни НАД+ могут снижаться по мере старения, нарушая активность сиртуинов, и что способность гиперэкспрессии сиртуинов увеличивать продолжительность жизни частично противодействует этому эффекту посредством поддержания функционирования сиртуинов на фоне сокращения пула НАД+ в стареющих организмах.
Ресвератрол и некоторые другие полифенолы изначально идентифицированы как активаторы Sir2/SIRT1, увеличивающие среднюю и максимальную продолжительность жизни дрожжей. Следует отметить, что ресвератрол оказывает очень разнообразные функционально важные эффекты на множество клеточных мишеней. Воздействие ресвератрола на нематод и дрозофил (100 мкмоль для червей и 10-100 мкмоль для дрозофил) также увеличивало продолжительность жизни в зависимости от наличия функционального Sir-2.1 или dSir2 соответственно. Однако согласно результатам исследования Bass et al., терапия ресвератролом (1-1000 мкмоль) не оказывала значимых эффектов на продолжительность жизни дрозофил. В том же исследовании было показано, что терапия ресвератролом в дозе 100 мкмоль индуцировала только небольшое и спорадическое увеличение продолжительности жизни как нематод дикого типа, так и мутантных моделей sir-2.1. На основании этого можно предположить, что наблюдаемое увеличение продолжительности жизни под действием ресвератрола может быть независимым от Sir-2.1. Ресвератрол защищает нематод от окислительного стресса, индуцированных радиацией повреждений и токсичности амилоида, а также обеспечивает защиту дрозофил от радиационного облучения. Терапия ресвератролом увеличивает среднюю и максимальную продолжительность жизни медоносных пчел и короткоживущих рыб Nothobranchius furzeri и Nothobranchius guentheri.
Есть данные, согласно которым ресвератрол и другие активирующие сиртуины соединения аллостерически активируют Sir2/SIRT1. Однако другие исследователи установили, что эти соединения не способны усиливать активность SIRT1 в отношении нативных пептидов in vitro. В этом контексте было высказано предположение, что индуцированная ресвератролом повышенная активность SIRT1 зависит от присутствия ненативных флуорофоров, конъюгированных с пептидной последовательностью, изначально используемой для скрининга активаторов SIRT1. В то же время, согласно недавно полученным данным, ресвератрол и другие активирующие сиртуины соединения непосредственно связываются с SIRT1 и аллостерически усиливают его деацетилазную активность в отношении немеченых пептидных субстратов. Помимо этого продемонстрирована способность ресвератрола посредством ингибирования каталитической активности человеческого фермента tyrosyl transfer-RNA (tRNA) synthetase (TyrRS), стимулировать НАД+-зависимую активацию поли(АДФ-рибозо)полимеразы (PARP1), выполняющей важные роли в восстановлении повреждений и транскрипции ДНК.
Ресвератрол защищает мышей от ряда повреждающих эффектов диеты с высоким содержанием жиров/калорий, оказывая выраженное подавляющее действие на рост и развитие многих типов рака, а также откладывая или предотвращая развитие болезни Альцгеймера. Более того, ресвератрол защищает грызунов и человека от сахарного диабета 1 и 2 типа и заболеваний сердечно-сосудистой системы, а также оказывает противовоспалительную и противовирусную активность. Добавление в корм ресвератрола (в дозе 0,016–0,1% от общей массы корма или 25 мг/кг/день) увеличивало продолжительность жизни мышиных моделей ожирения, болезни Альцгеймера, болезни Гентингтона и бокового амиотрофическаго склероза. Терапия ресвератролом (2-8 мг/кг/день) увеличивала продолжительность жизни мышей, подвергшихся воздействию липополисахарида, и снижала индуцируемую катехоламином смертность крыс, страдающих ожирением (20 мг/кг/день). Более того, ресвератрол (10 мг/мл, внутрибрюшинная инъекция) увеличивал выживаемость мышиной модели индуцированного сепсисом поражения почек и восстанавливал почечную микроциркуляцию. Добавление ресвератрола в корм (18 мг/кг/день) также улучшало выживаемость крысиной модели гипертонии. Важен тот факт, что воздействие ресвератрола (100-1200 мг/кг/день в пище) не увеличивает продолжительность жизни мышей, употребляющих нормальных корм. Содержащие ресвератрол добавки индуцируют изменения генной экспрессии в некоторых тканях мышей, схожие с изменениями, ассоциированными с низкокалорийной диетой.
Прием добавки с ресвератролом (150 мг/день) в течение 30 дней вызывает у мужчин с ожирением метаболические изменения, в том числе снижение скорости метаболизма в покое и во время сна, внутрипеченочное содержание липидов, концентрацию глюкозы в крови, уровни маркеров воспаления и систолическое давление крови. В скелетной мускулатуре употреблявших ресвератрол людей регистрировались повышенная активность AMPK, увеличение уровней белков SIRT1 и PGC-1-альфа, а также улучшение митохондриального окисления жирных кислот. Напротив, прием в ресвератрола (75 мг/день) в течение 12 недель не страдающими ожирением женщинами в постклимактерическом периоде с нормальной толерантностью к глюкозе не вызывал регистрируемых изменений композиции тела, чувствительности к инсулину, скорости метаболизма в покое, уровней липидов в плазме и маркеров воспаления. Более того, употребление ресвератрола не оказывало эффекта на его предполагаемые молекулярные мишени, в том числе AMPK, SIRT1, NAMPT и PPARGC1A, ни в скелетной мускулатуре, ни в жировой ткани.
Недавно проведенное Cai et al. исследование продемонстрировало нелинейное дозо-зависимое защитное влияние на человека и мышей. На фоне богатой жирами диеты прием низких доз ресвератрола (~0,07 мг/кг/день) более эффективно уменьшал количество аденом и общую опухолевую нагрузку у мышей линии Apcmin, являющейся моделью кишечного канцерогенеза, чем прием высоких доз (14 мг/кг/день). Интересно, что самки мышей, получающие низкую дозу ресвератрола, демонстрировали значительно более выраженное повышение экспрессии и активации AMPK в слизистой оболочке кишечника, чем животные из группы, получавшей более высокую дозировку. В соответствии с этим образцы ткани толстого кишечника человека, подвергавшиеся воздействию низких диетических концентраций ресвератрола (0,01-0,1 мкмоль) ex vivo, продемонстрировали быструю активацию AMPK и повышенную активность аутофагии при низких концентрациях и менее выраженный эффект или полное его отсутствие при воздействии более высокими дозами (1-10 мкмоль). Этот необычный эффект может помочь в объяснении противоречивых данных о воздействии ресвератрола на человека. В будущем при планировании клинических исследований с использованием ресвератрола следует уделять особое внимание дозировке и уровням препарата в сыворотке крови, а также тщательной оценке эффектов, оказываемых ресвератролом на его предполагаемые молекулярные мишени.
Другие искусственно синтезированные активирующие сиртуины соединения также продемонстрировали способность увеличивать продолжительность жизни и продолжительность здоровой жизни мышей. Так, SRT1720 (100 мг/кг/день) увеличивал продолжительность жизни взрослых самцов мышей линии C57BL/6J, содержавшихся на нормальном рационе, на 8,8% (p=0,096) и на 21,7% (p=0,0193) – содержавшихся на богатом жирами рационе, без увеличения максимальной продолжительности жизни в обоих случаях. Терапия SRT1720 улучшала физиологические параметры животных, получавших богатый жирами корм, снижая выраженность жировой дегенерации печени, увеличивая чувствительность к инсулину, улучшая двигательную активность, а также индуцируя формирование профиля генной экспрессии, схожего с профилем, ассоциированным с употреблением нормального корма. Добавление в корм SRT1720 ингибировало экспрессию провоспалительных генов в печени и мышечной ткани мышей, получавших стандартный корм, и откладывало развитие возрастной болезни обмена веществ. Аналогичным образом добавление в корм SRT2104 (100 мг/кг) увеличивало как среднюю, так и максимальную продолжительность жизни получавших нормальный корм самцов мышей линии C57BL/6J на 9,7% (p<0,05) и 4,9% (p<0,001) соответственно и повышало чувствительность их тканей к инсулину, а также координацию движений с одновременным подавлением воспаления. Краткосрочная терапия SRT2104 обеспечивала сохранение костной и мышечной массы в экспериментальной модели атрофии. Эти данные свидетельствуют о том, что ресвератрол и другие активирующие сиртуины соединения могут оказывать положительное влияние на состояние здоровья, в особенности на фоне потребления богатой жирами пищи, а некоторые из этих соединений могут обеспечивать умеренное увеличение продолжительности жизни при потреблении нормальной пищи. Однако для более детальной оценки их влияния на долголетие самок и мышей других линий требуется проведение дальнейших исследований. В этом отношении в настоящее время существует большой интерес к оценке эффектов предшественников НАД+ в качестве препаратов для лечения болезни обмена веществ и потенциальных антивозрастных средств.
Часть 6
Другие потенциальные антивозрастные препараты
В последние десятилетия было идентифицировано достаточно много соединений, оказывающих положительное влияние на продолжительность здоровой жизни и долголетие. Однако в данной статье описывают только несколько ключевых малых молекул, обладающих положительными эффектами в отношении широкого спектра организмов, начиная от беспозвоночных моделей и заканчивая мышами (рисунок 2).
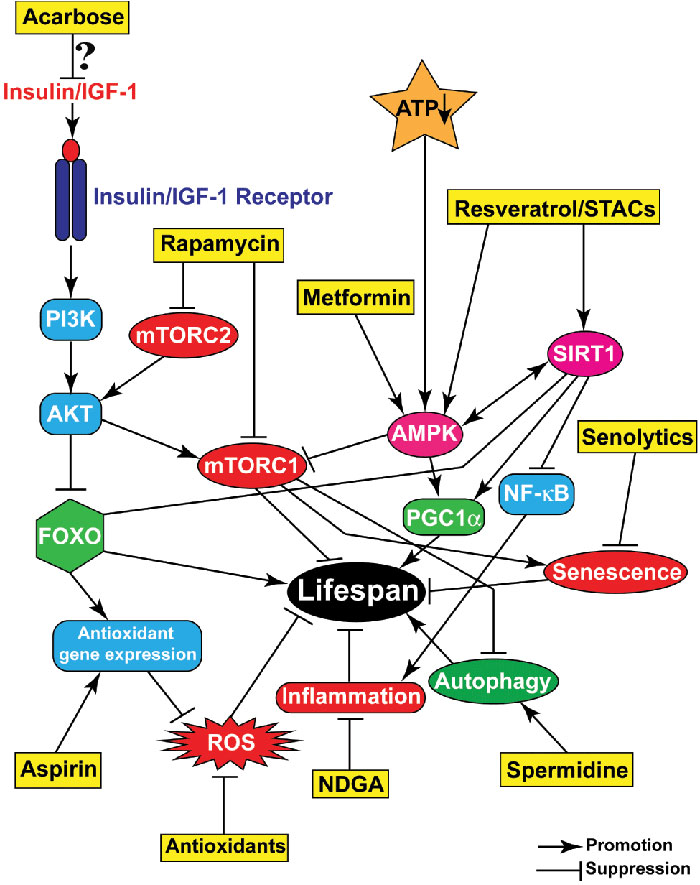 Рисунок 2. Фармакологические вмешательства, прицельно воздействующие на ассоциированные с возрастом сигнальные пути и процессы. Наиболее представительные соединения (желтые прямоугольники) воздействуют на различные процессы или сигнальные пути, вносящие вклад в старение и стимулируют или подавляют их активность/прогрессию, что обеспечивает улучшение состояния здоровья и увеличение продолжительности жизни.
Рисунок 2. Фармакологические вмешательства, прицельно воздействующие на ассоциированные с возрастом сигнальные пути и процессы. Наиболее представительные соединения (желтые прямоугольники) воздействуют на различные процессы или сигнальные пути, вносящие вклад в старение и стимулируют или подавляют их активность/прогрессию, что обеспечивает улучшение состояния здоровья и увеличение продолжительности жизни.
Относящийся к семейству полиаминов спермидин вовлечен в множество критичных клеточных процессов, в том числе поддержание стабильности ДНК, транскрипцию, трансляцию, апоптоз, пролиферацию и рост клеток. Было показано, что во многих органах уровни полиаминов снижаются с возрастом. Данные, полученные Pucciarelli et al., свидетельствуют о том, что поддержание высоких уровней спермидина в процессе старения может способствовать долголетию. Воздействие экзогенного спермидина увеличивало продолжительность жизни дрожжей, дрозофил, круглых червей и культивируемых мононуклеаров периферической крови человека. Спермидин также снижал возрастное угасание двигательной функции дрозофил. Более того, богатая полиамином диета снижала выраженность возрастной патологии и увеличивала продолжительность жизни самцов мышей линии Jcl:ICR. С другой стороны, блокирование усвоения экзогенного спермидина с помощью генетической манипуляции уменьшало продолжительность жизни дрожжей и мышей. Добавление спермидина в корм снижало выраженность возрастных окислительных повреждений в организме мышей и усиливало устойчивость дрожжей и дрозофил к стрессу. Положительные эффекты спермидина опосредованы преимущественно индукцией аутофагии, обеспечивающей контролируемую деградацию и переработку нефункциональных компонентов клетки. Нарушения аутофагии предотвращают положительное влияние спермидина.
Аспирин – производное салициловой кислоты – является прототипным ингибитором циклооксигеназы и нестероидным противовоспалительным агентом. Хроническое применений аспирина человеком снижает смертность от различных возрастных заболеваний, в том числе атеросклероза, сахарного диабета и разных типов рака. Применение аспирина человеком также ассоциировано с повышением выживаемости в очень преклонном возрасте. Недавнее исследование Ayyadevara et al. показало, что аспирин повышает экспрессию генов антиоксидантов (супероксиддисмутазы, каталаз и глутатион-S-трансфераз), что приводит к снижению уровней эндогенных активных форм кислорода и увеличению продолжительности жизни C.elegans. Результаты еще одного исследования показали, что терапия аспирином увеличивает продолжительность жизни домашних сверчков. Также полученные консорциумом ITP данные показали, что терапия аспирином (21 мг/кг в корме) обеспечивала увеличение средней продолжительности жизни самцов мышей, но не оказывала никакого эффекта на самок.
Нордигидрогваяретовая кислота (НДКГ), также известная как масопрокол, является природным дикатехолом, оказывающим антиоксидантное, антинеопластическое и противовоспалительное действие. Установлено, что она является мощным антагонистом провоспалительного цитокина – фактора некроза опухолей-альфа (TNF-alpha). Добавление в корм нордигидрогваяретовой кислоты откладывало угасание двигательной функции в мышиной модели бокового амиотрофическго склероза и значительно увеличивало продолжительности жизни животных. В исследовании консорциума ITP добавление этого соединения в корм в дозе 2500 мг/кг увеличивало продолжительность жизни самцов мышей линии UM-HET3. Однако данный эффект не распространялся на самок. Одним из возможных объяснений этого является тот факт, что продолжительность жизни самцов групп контроля в двух из трех исследовательских центров по какой-то причине была короче. Для того, чтобы полностью разобраться в этом вопросе, необходимо проведение дальнейших исследований.
Акарбоза является ингибитором альфа-глюкозидаз – кишечных ферментов, конвертирующих сложные углеводы в простые сахара для облегчения их всасывания. Терапия акарбозой нарушает переваривание углеводов и ингибирует нормальное повышение уровня глюкозы в крови после приема пищи. Исследователи консорциума ITP установили, что акарбоза (1000 мг/кг в корме) индуцировала значительное увеличение средней и максимальной продолжительности жизни обоих полов, однако этот эффект был значительно более выражен у самцов. Терапия акарбозой увеличивала среднюю продолжительность жизни самцов на 22% (p<0,0001), тогда как для самок – всего на 5% (p=0,01). Для максимальной продолжительности жизни эти показатели составили 11% (p<0,001) и 9% (p=0,001) соответственно. У получавших акарбозу мышей наблюдалось значительное повышение уровня фактора роста фибробластов-21 в сыворотке крови, а также умеренное снижение уровня инсулиноподобного фактора роста-1. Фактору роста фибробластов-21 принадлежат важные роли в регуляции уровней глюкозы, жиров, а также поддержании энергетического гомеостаза. Для трансгенных мышей с повышенной секрецией этого фактора характерно увеличение как средней, так и максимальной продолжительности жизни, возможно за счет подавления сигнального пути, опосредуемого инсулином/инсулинозависимым фактором роста-1.
17-альфа-эстрадиол является нефеминизирующим эстрогеном, обладающим сниженной способностью к связыванию с рецепторами эстрогена. Он ингибирует активность фермента 5-альфа-редуктазы, ответственного за конвертацию тестостерона в более мощный андроген дигидротестостерон, обладающий более высокой афинностью к андрогеновым рецепторам, чем тестостерон. 17-альфа-эстрадиол оказывает нейропротективное действие при ишемии головного мозга, болезни Паркинсона и заболеваниях сердечно-сосудистой системы. Недавно была установлена его способность снижать выраженность метаболических и воспалительных нарушений у старых мышей посредством уменьшения употребляемых калорий и изменений регистрирующих питательные вещества и воспалительных сигнальных путей в висцеральной белой жировой ткани без индукции феминизации. В исследованиях консорциума ITP применение 17- альфа-эстрадиола (4,8 мг/кг в корме) с 10-месячного возраста увеличивало медиану продолжительности жизни самцов на 12% без выраженного влияния на максимальную продолжительность жизни и продолжительность жизни самок. Аналогично случаю с нордигидрогваяретовой кислоты, это различие может быть обусловлено более короткой продолжительностью жизни самцов группы контроля и требует проведения дальнейших исследований.
Антагонисты бета-адренергических рецепторов связываются с бета-адренергическими рецепторами (бета-1, 2 и 3) и блокируют активность эндогенных катехоламинов эпинефрина и норэпинефрина. Повышенная активность бета-адренергических рецепторов может ускорить развитие возрастных патологий и увеличить смертность генетически модифицированных мышей. Также хроническое применение агонистов этих рецепторов ведет к повышению смертности и заболеваемости. У человека повышенная продукция бета-2-адренергических рецепторов, обусловленная специфичными генетическими вариантами, ассоциирована с уменьшением продолжительности жизни. С другой стороны, добавление в корм блокаторов бета-адренергических рецепторов метопролола (1,1 г/кг корма) и небиволола (0,27 г/кг корма) увеличивало медиану продолжительности жизни самцов мышей линии C3B6F1 на 10% (p=0,016) и 6,4% (p=0,023) соответственно, не оказывая влияния на употребление и утилизацию пищи. Однако максимальная продолжительность жизни при этом не изменялась. Также терапия метопрололом (мг/мл пищи) и небивололом (100 мкг/мл пищи) увеличивала медиану продолжительности жизни дрозофил на 23% (p≤0,0001) и 15% (p≤0,001) соответственно, не оказывая влияния на употребление пищи и подвижность. Аналогично блокаторам бета-адренергических рецепторов, антагонист блокаторов бета-1-адренергических рецепторов доксазозин, ингибирует связывание норэпинефрина с бета-1- адренергическими рецепторами на мембране гладкомышечных клеток сосудистого эпителия и увеличивает продолжительность жизни C.elegans на 15%. Учитывая то, что некоторые из этих агентов рутинно применяются в клинике в качестве гипотензивных препаратов и их профили безопасности хорошо описаны, эти препараты могут рассматриваться как потенциальные антивозрастные средства.
Антиоксиданты – соединения, обеспечивающие устойчивость к окислительному стрессу, – в ряде случаев также продемонстрировали способность увеличивать продолжительность жизни, в особенности низших организмов. Пищевые добавки с содержанием предшественника глутатиона N-ацетилцистеина увеличивали устойчивость к окислительному стрессу, тепловому стрессу и ультрафиолетовому излучению, а также значительно увеличивают как среднюю, так и максимальную продолжительность жизни нематод C.elegans и дрозофил. Более того, терапия EUK-134 и EUK-8 – синтетическими малыми молекулами, являющимися каталитическими миметиками супероксиддисмутазы и каталазы, – в одной из работ увеличивала продолжительность жизни C.elegans, тогда как несколько других групп не наблюдали подобных эффектов. Терапия разнополой группы мышей линии C57BL/6 еще одним миметиком супероксиддисмутазы карбоксифуллереном (10 мг/кг/день) снижала выраженность возрастного окислительного стресса и продукцию супероксида в митохондриях, а также умеренно увеличивала среднюю продолжительность жизни. Также пероральное введение раствора карбоксифуллерена (4 мг/кг/день) в оливковом масла самцам крыс линии Wistar обеспечивало увеличение медианы продолжительности жизни на 90% по сравнению с получавшими воду животными группы контроля. Помимо этого в ряде других исследований была продемонстрирована способность антиоксидантов увеличивать продолжительность жизни многих организмов.
Помимо этого существует большое количество публикаций, которые, напротив, не подтверждают идею, что содержащие антиоксиданты пищевые добавки в целом увеличивают продолжительность жизни здоровых животных и человека. Пищевые добавки с содержанием витамина Е (альфа-токоферол) или витамина С (аскорбиновая кислота) значительно уменьшают продолжительность жизни короткохвостых полевок. Аналогичным образом добавление в корм самцов мышей нутрицевтического состава, обогащенного антиоксидантами, не обеспечивало увеличения продолжительности жизни. Более того, в недавнем обзоре Bjelakovic et al. отмечено, что систематический и мета-анализ результатов большого количества клинических исследований, посвященных изучению влияния пищевых добавок, содержащих различные антиоксиданты (бате-каротин, витамин А, витамин С, витамин Е и селен), на человека, не выявило никаких общих полезных эффектов. Вместо этого в некоторых случаях применение этих агентов было ассоциировано с повышенной смертностью. Губительное действие антиоксидантных добавок может быть обусловлено неадекватной супрессией нормальных сигнальных функций, выполняемых активными формами кислорода в клетках, в том числе в критичных популяциях клеток, таких как стволовые клетки.
Часть 7
Сенолитические препараты
Избирательное уничтожение клеток, вступивших в фазу физиологического старения, с помощью недавно открытых препаратов-сенолитиков («растворителей старости», от лат. senesco – стареть и греч. lysis – растворение, распад), проявляется смягчением проявлений дряхления, улучшением сердечной функции и увеличением продолжительности здоровой жизни.
Физиологическое старение клеток заключается в необратимом прекращении клеточного роста, которого может индуцироваться многими стрессорами, в том числе серией пересевов, укорочением теломер, неадекватными митотическими стимулами и генотоксичными воздействиями. Считается, что физиологическому старению принадлежит важная роль в подавлении опухолевого роста у млекопитающих. Однако у вступивших в фазу физиологического старения клеток развивается измененный секреторный фенотип (senescence-associated secretory phenotype, SASP), для которого характерно высвобождение таких факторов, как протеазы, факторы роста, интерлейкины, хемокины и внеклеточные ремоделирующие белки. По мере старения такие клетки накапливаются в разных тканях и потенциально способствуют развитию патологических состояний, так как секретируемые ими факторы индуцируют развитие хронического воспаления, угасание функций клеток-предшественников и нарушение функций внеклеточного матрикса. Функциональное влияние вступивших в фазу физиологического старения клеток in vivo в течение многих лет оставалось горячо обсуждаемым вопросом биологии старения. Недавно были описаны генетические подходы к уничтожению этих клеток в организме мышей посредством активации индуцируемого препаратом «гена самоубийства». Уничтожение вступивших в фазу физиологического старения клеток в мышиной модели прогерии значительно откладывало развитие множества возрастных фенотипов, в том числе лордокифоза (аналог саркопении), катаракты, атрофии жировой ткани и нарушения функционирования мышц. Однако в целом это не сопровождалось значительным увеличением выживаемости этих животных, возможно из-за того, что ген самоубийства не экспрессировался в сердце и аорте, а сердечная недостаточность считается основной причиной смерти животных данной линии.
Недавнее знаковое исследование Baker et al. продемонстрировало, что уничтожение естественным образом вступивших в фазу физиологического старения клеток в организме не-прогероидных мышей препятствовало возрастному угасанию функциональности ряда органов, откладывало формирование летальных опухолей и увеличивало медиану продолжительности жизни мышей со смешанным и чистым C57BL/6 генотипами на 27% (p<0,001) и 24% (p<0,001) соответственно. Это исследование предоставило весьма убедительное доказательство того, что ассоциированное с возрастом накопление вступивших в фазу физиологического старения клеток способствует развитию возрастных патологий и уменьшает продолжительность жизни животных дикого типа.
В отличие от генетических, фармакологические подходы к уничтожению вступивших в фазу физиологического старения клеток связаны с серьезными техническими и концептуальными сложностями. Недавняя работа показала, что эти клетки демонстрируют повышенную экспрессию способствующих выживанию факторов, ответственных за их хорошо известную устойчивость к апоптозу. Интересно, что опосредуемый малыми интерферирующими РНК (миРНК) сайленсинг многих из этих факторов (эфрины, PI3K-delta, р21, BCL-xL и другие) избирательно уничтожает клетки, вступившие в фазу физиологического старения, не затрагивая делящиеся клетки, и клетки, находящиеся в фазе покоя. Эти миРНК получили название сенолитических. Воздействующие на эти же факторы малые молекулы (сенолитические препараты) также избирательно уничтожают такие клетки. Из 46 протестированных агентов этого класса наиболее эффективными оказались дазатиниб и кверцетин. Применяемый в терапии рака дазатениб является ингибитором множества тирозинкиназ. Кверцетин представляет собой природный флавонол, ингибирующий PI3K, другие киназы и серпины. Дазатиниб преимущественно уничтожал физиологически постаревшие преадипоциты, тогда как кверцетин был более эффективен в отношении эндотелиальных клеток человека и мезенхимальных стволовых клеток костного мозга мышей. Комбинация дазатиниба и кверцетина была эффективна в избирательном уничтожении вступивших в фазу физиологического старения человеческих клеток всех трех перечисленных типов. Комбинация препаратов также более эффективно уничтожала вступившие в фазу физиологического старения мышиных эмбриональных фибробластов по сравнению с каждым из препаратов по отдельности. Терапия хронологически состарившихся мышей дикого типа, мышей дикого типа, подвергшихся радиоактивному облучению, и прогероидных гипоморфных мышей линии Ercc1 комбинацией дазатиниба и кверцетина уменьшало количество клеток-мишеней. По окончании терапии у старых мышей дикого типа наблюдалось улучшение сердечной функции и реактивности сонной артерии, облученные мыши демонстрировали улучшение способности переносить физическую нагрузку, а прогероидные мутанты линии Ercc1 – более позднее проявление возрастных симптомов и патологий. В недавнем исследовании Chang et al. был идентифицирован ABT263 (навитоклакс – специфичный ингибитор антиапоптотических белков BCL-2 и BCL-xL), также являющийся мощным сенолитическим агентом. Применяемый в терапии многих типов рака ABT263 индуцировал апоптоз и избирательно уничтожал вступившие в фазу физиологического старения клетки, независимо от типа клеток и видовой принадлежности. В культуре вступившие в фазу физиологического старения фибробласты легких человека (IMR90), человеческие клетки почечного эпителия и мышиные эмбриональные фибробласты были более чувствительны к ABT263 чем их нормальные аналоги. Однако в другом исследовании было показано, что ABT263 не является сенолитиком широкого спектра действия, вместо этого они действуют на клетки определенных типов. Согласно результатам данного исследования, ABT263 оказывает сенолитическое действие на клетки пупочной вены человека (HUVECs), клетки линии IMR90, мышиные эмбриональные фибробласты, но не первичные преадипоциты человека.
Воздействие ABT263 на облученных или естественным образом состарившихся мышей не только уменьшало количество вступивших в фазу физиологического старения клеток, в том числе популяций гемопоэтических клеток костного мозга и мышечных стволовых клеток, но и подавляло экспрессию ряда SASP-факторов, а также омолаживало функции этих клеток при их старении. Эти данные, вместе с более ранними впечатляющими результатами, полученными на генетических моделях, свидетельствуют о том, что сенолитические препараты могут способствовать улучшению функций стареющих тканей. Однако применение некоторых сенотилитических препаратов ассоциировано токсичными побочными эффектами, такими как тромбоцитопения и нейтропения в случае ABT263, что является основным потенциальным препятствием для их клинического применения в качестве антивозрастных препаратов. Эти проявления токсичности можно несколько ослабить за счет прерывистого применения.
Наиболее важные результаты, касающиеся малых молекул, приведены на рисунке 2 в разделе «Другие потенциальные антивозрастные препараты».
Часть 8
Проблемы скрининга антивозрастных препаратов
Несколько препаратов продемонстрировали большие надежды в лабораторных экспериментах по увеличению продолжительности здоровой жизни и продолжительности жизни различных видов, в том числе мышей, что указывает на реальность эффективных фармакологических антивозрастных вмешательств. Однако проведение непредвзятого скрининга новых потенциальных геропротекторов на млекопитающих представляет собой практически невыполнимую задачу. Учитывая то, что некоторые оказывающие влияние на долголетие клеточные сигнальные пути сохранились в ходе эволюции, беспозвоночные модели могут оказаться достаточно полезными для проведения подобных скринингов. В то же время, некоторые из известных молекулярных факторов, оказывающих выраженное влияние на продолжительность жизни млекопитающих (например, фактор роста), достаточно сильно отличаются у беспозвоночных и млекопитающих. Поэтому скрининг малых молекул, основанный исключительно на использовании беспозвоночных моделей, не позволит выявить все соединения, оказывающие выраженное влияние на старение млекопитающих. Более того, многие ключевые физиологические параметры человека и других млекопитающих плохо моделируются на беспозвоночных, не имеющих таких специфичных тканей, как ткани сердца и почек, и сложных эндокринной, нервной и кровеносной систем, являющихся критичными мишенями в борьбе со старением и возрастными патологиями. Большинство беспозвоночных моделей старения обладают ограниченными регенеративными способностями и не в полной мере воспроизводят такие процессы, как обновление пула стволовых клеток, необходимые для механизмов восстановления тканевых повреждений, обеспечивающих поддержание тканевого гомеостаза у млекопитающих, необходимого для поддержания функционирования органов на протяжении многих лет и десятилетий.
Разработка новых короткоживущих позвоночных моделей старения может значительно облегчить проведение такого скрининга. В данном контексте привлекательной модельной системой является короткоживущая позвоночная рыба Nothobranchius furzeri. Недавно Harel et al. с помощью синтезированного de novo генома и технологии CRISPR/Cas9 описали для N.furzeri модель проявления генотипа в фенотипе (genotype-to-phenotype platform), открывающую возможности проведения интегративного скрининга на мутации генов и препараты, увеличивающие продолжительность жизни этого организма. Одним из основных ограничений возможностей применения N.furzeri является необходимость отдельного содержания, что значительно увеличивает финансовые затраты. Более того, возможно, что некоторые факторы, модулирующие старение рыб и других холоднокровных позвоночных, могут не совпадать с факторами, эффективными в отношении млекопитающих. Несмотря на то, что мыши позволяют хорошо воспроизводить многие аспекты старения и возрастных болезней человека, их использование для первичного скрининга/тестирования большого количества потенциальных антивозрастных соединений нецелесообразно из-за больших финансовых затрат. Использование прогероидных моделей, таких как гипоморфы Ercc1 или мутанты Lmna, для которых характерно ускоренное развитие патологий и короткая продолжительность жизни, позволит тестировать намного больше соединений, чем использование животных дикого типа. Однако вопрос о том, действительно ли эти животные страдают от старения как такового, в настоящее время горячо обсуждается. Возможно также, что тщательная оценка адекватных маркеров старения, например, повышения экспрессии р16 или изменения метилирования ДНК, позволит осуществлять на мышах первичную оценку антивозрастных эффектов большого количества соединений без проведения исследований, длительность которых соответствует продолжительности жизни мышей, с использованием множества когорт, получающих различные потенциальные антивозрастные соединения. В данном отношении группа Horvath разработала подход, позволяющий оценивать возраст большинства типов тканей и клеток на основании возрастных изменений уровней метилирования ДНК в зонах CpG, однако подобные методы пока не применялись к мышам.
Поиск антивозрастных соединений на современном этапе проводится с помощью двух основных подходов. Один из них является фенотипическим, то есть представляет собой скрининг соединений на клеточных или животных моделях, проводимый для выявления препаратов, оказывающих желаемые биологические эффекты, то есть увеличение продолжительности жизни. Несмотря на то, что этот подход продемонстрировал свою исключительную ценность во многих сферах биохимических исследований, идентификация модулирующих продолжительность жизни препаратов значительно более продолжительна, сложна и затратна, чем работа со многими другими фенотипами. Недостаточно используемой моделью для скрининга антивозрастных молекул являются пекарские дрожжи S.cerevisiae. У этих организмов описано две различных формы старения: репликативное и хронологическое (популяционное). В принципе, любая из них может использоваться для скрининга антивозрастных препаратов, хотя хронологическое старение более намного более пригодно для высокопроизводительного анализа. Дополнительный подход подразумевает прицельный скрининг модуляторов механизмов, с большой степенью вероятности модулирующих скорость старения. Однако такие подходы, по определению, лишь с малой степенью вероятности позволят идентифицировать новые клеточные факторы и сигнальные пути, вовлеченные в долголетие.
В преодолении этих сложностей мощным механизмом может оказаться применение для поиска антивозрастных препаратов холистического подхода, подразумевающего одновременно использовать эксперименты на беспозвоночных, клетках млекопитающих и мышах. В этом контексте авторы данной статьи, сотрудники Paul F. Glenn Center for Aging Research at the University of Michigan, проводят скрининг соединений на их способность увеличивать продолжительность здоровой жизни и продолжительность жизни дрозофил и нематод C.elegans, а также для повышения устойчивости фибробластов млекопитающих к стрессу, коррелирующей с долголетием млекопитающих. Эффективные во всех трех тестах соединения являются кандидатами на более глубокую механистическую оценку и дальнейшее тестирование на мышах (рисунок 3).
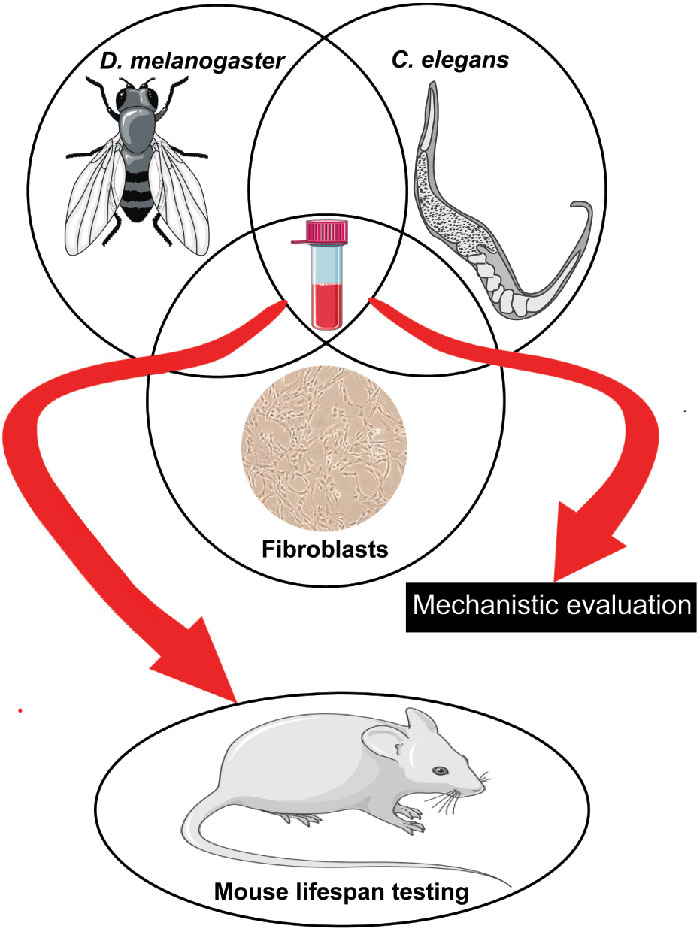 Рисунок 3. Препараты, показавшие увеличение продолжительности жизни и сохранение здоровья у дрозофил и нематод и повышение устойчивости к стрессу фибробластов млекопитающих, являются потенциальными кандидатами для дальнейшей углубленной оценки и тестирования на мышах.
Рисунок 3. Препараты, показавшие увеличение продолжительности жизни и сохранение здоровья у дрозофил и нематод и повышение устойчивости к стрессу фибробластов млекопитающих, являются потенциальными кандидатами для дальнейшей углубленной оценки и тестирования на мышах.
Еще одной схожей проблемой в изучении старения на сегодняшний день является отсутствие человекообразных (приматных) модельных систем с приемлемо короткой продолжительностью жизни для доклинического тестирования потенциальных антивозрастных препаратов. Наиболее часто в качестве такой модели используются макаки резус, продолжительность жизни которых составляет 30-40 лет. В отношении размера, доступности и других биологических параметров обыкновенные мартышки обладают перед макаками резус рядом преимуществ. В силу меньшего размера тела их содержание обходится дешевле. Более того, беременность мартышек протекает примерно 147 дней и приводит к появлению 2-3 детенышей. Некоторые особенности мартышек, в том числе профиль предрасположенности к заболеваниям, более схожи с особенностями человека, чем у макак. В Европе мартышки используются в качестве модели для тестирования безопасности и токсикологических параметров лекарственных препаратов. Так, в недавнем исследовании Tardif et al. описали на мартышках процедуру дозирования, фармакокинетику и изменения сигнальных путей для рапамицина. Однако их продолжительность жизни составляет около 17 лет, что меньше продолжительности жизни макак резус, но все еще мало применимо для изучения фармакологических вмешательств, предназначенных для увеличения продолжительности жизни. Создание новых моделей старения млекопитающих значительно облегчило бы изучение биологических процессов, лежащих в основе старения, и ускорило перенос фармакологических вмешательств из лаборатории в клинику.
Одной из рассматриваемых в данном отношении моделей являются собаки, разделяющие с человеком его окружение. Более того, старение и болезни собак достаточно хорошо изучены, их размеры тела и продолжительность жизни варьируют в очень широких пределах, что обусловлено огромным генетическим разнообразием. Собаки могут быть относительно недорогой модельной системой, в особенности учитывая желание некоторых владельцев протестировать на своих питомцах увеличивающие продолжительность жизни препараты, ранее валидированные в беспозвоночных моделях и грызунах. Мэтью Кэберлейн (Matthew Kaeberlein) и Дэниел Промислов (Daniel Promislow) из университета Вашингтона в Сиэтле начали пилотное исследование на 30 собаках, посвященное тестированию эффективности рапамицина в отношении улучшения общего состояния здоровья и увеличения продолжительности жизни крупных собак, обычно доживающих до 8-10 лет.
Проведение клинических исследований потенциальных антивозрастных препаратов связано с огромными сложностями. Очень маловероятно, что фармацевтические компании согласятся на проведение клинических исследований продолжительность в несколько десятков лет. Оценка краткосрочных суррогатных фенотипов, таких как молекулярные маркеры или ассоциированные с возрастом нарушения, такие как ослабленная реакция на вакцинацию, могут использоваться для первичной клинической оценки потенциальных антивозрастных соединений, проводимой в более приемлемых временных рамках.
Заключение
С древних времен люди мечтали о вмешательствах, замедляющих процесс старения и увеличивающих продолжительность жизни. Однако только совсем недавно биологические исследования старения достигли того уровня, на котором такие вмешательства уже выглядят вполне реальными. Результатом большого количества исследований на беспозвоночных моделях и грызунах стал постоянно растущий список молекул, потенциально способных увеличивать продолжительность жизни млекопитающих и способствовать сохранению ими хорошего состояния здоровья в старости. Учитывая тот факт, что между старением и заболеваемостью существует тесная взаимосвязь, такие препараты, в случае преодоления всех связанных с их тестированием и разработкой проблем, могут значительно улучшить состояние здоровья человека.
Ссылки на литературные источники см. в оригинале статьи.
Источники: Surinder Kumar, David B. Lombard
Finding Ponce de Leon’s Pill: Challenges in Screening for Anti-Aging Molecules
F1000Research, 2016
Перевод Евгении Рябцевой vechnayamolodost.ru
Читайте по теме: ГЕРОПРОТЕКТОРЫ
НОВОСТИ ГЕРОПРОТЕКТОРОВ